Лекция 4МГ.ppt
- Количество слайдов: 25
 Молекулярные механизмы репарации ДНК Лекция № 4 для студентов специальности «Микробиология» Лектор: Давыдова Ольга Константиновна, к. б. н. , доцент 1 2/6/2018
Молекулярные механизмы репарации ДНК Лекция № 4 для студентов специальности «Микробиология» Лектор: Давыдова Ольга Константиновна, к. б. н. , доцент 1 2/6/2018
 План лекции: • • Прямая репарация Эксцизионная репарация Репарация ошибок репликации ДНК Рекомбинантная (пострепликативная) репарация у бактерий • SOS-репарация
План лекции: • • Прямая репарация Эксцизионная репарация Репарация ошибок репликации ДНК Рекомбинантная (пострепликативная) репарация у бактерий • SOS-репарация
 Репарация генетических повреждений • — свойство живых организмов восстанавливать повреждения, возникшие в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы. • Репаративные механизмы, которые использует клетка для поддержания стабильности информации, заложенной в ДНК универсальны - функциональная, а иногда и структурная гомология элементов, образующих эти механизмы, прослеживается от бактерий до человека. Чем сложнее клетка, тем большее количество структурных и регуляторных генов и их продуктов участвуют в процессах репарации ДНК, хотя принципиальная схема конкретного процесса, как правило, остается неизменной. • К повреждающим событиям могут быть отнесены следующие: – 1) введение одноцепочечных разрывов; – 2) удаление основания, в результате чего гомолог остается неспаренным; – 3) превращение одного основания в другое, которое неправильно спарено с основанием-партнером; – 4) введение ковалентных связей между основаниями на одной цепи ДНК или между основаниями на противоположных цепях.
Репарация генетических повреждений • — свойство живых организмов восстанавливать повреждения, возникшие в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы. • Репаративные механизмы, которые использует клетка для поддержания стабильности информации, заложенной в ДНК универсальны - функциональная, а иногда и структурная гомология элементов, образующих эти механизмы, прослеживается от бактерий до человека. Чем сложнее клетка, тем большее количество структурных и регуляторных генов и их продуктов участвуют в процессах репарации ДНК, хотя принципиальная схема конкретного процесса, как правило, остается неизменной. • К повреждающим событиям могут быть отнесены следующие: – 1) введение одноцепочечных разрывов; – 2) удаление основания, в результате чего гомолог остается неспаренным; – 3) превращение одного основания в другое, которое неправильно спарено с основанием-партнером; – 4) введение ковалентных связей между основаниями на одной цепи ДНК или между основаниями на противоположных цепях.
 История изучения • • • Начало было положено работами А. Келнера (США), который в 1948 обнаружил явление фотореактивации (ФР) — уменьшение повреждения биологических объектов, вызываемого ультрафиолетовыми (УФ) лучами, при последующем воздействии ярким видимым светом (световая репарация). Сетлоу, К. Руперт (США) и др. вскоре установили, что ФР — фотохимический процесс, протекающий с участием специального фермента и приводящий к расщеплению димеров тимина, образовавшихся в ДНК при поглощении УФ-кванта. 1958 г. - был впервые выделен фермент, осуществляющий фотореактивацию, который сейчас называют фотолиазой. В 1963 г. она изучена подробнее. 1960 г. - голландские ученые Р. Бьюкерс и У. Берендс изучили химию процесса повреждения нуклеиновых кислот УФ-светом. Позднее при изучении генетического контроля чувствительности бактерий к УФ-свету и ионизирующим излучениям была обнаружена темновая репарация — свойство клеток ликвидировать повреждения в ДНК без участия видимого света. Механизм темновой репарации облученных УФ-светом бактериальных клеток был предсказан А. П. Говард-Фландерсом и экспериментально подтвержден в 1964 Ф. Ханавальтом и Д. Петиджоном (США). Было показано, что у бактерий после облучения происходит вырезание поврежденных участков ДНК с измененными нуклеотидами и ресинтез ДНК в образовавшихся пробелах.
История изучения • • • Начало было положено работами А. Келнера (США), который в 1948 обнаружил явление фотореактивации (ФР) — уменьшение повреждения биологических объектов, вызываемого ультрафиолетовыми (УФ) лучами, при последующем воздействии ярким видимым светом (световая репарация). Сетлоу, К. Руперт (США) и др. вскоре установили, что ФР — фотохимический процесс, протекающий с участием специального фермента и приводящий к расщеплению димеров тимина, образовавшихся в ДНК при поглощении УФ-кванта. 1958 г. - был впервые выделен фермент, осуществляющий фотореактивацию, который сейчас называют фотолиазой. В 1963 г. она изучена подробнее. 1960 г. - голландские ученые Р. Бьюкерс и У. Берендс изучили химию процесса повреждения нуклеиновых кислот УФ-светом. Позднее при изучении генетического контроля чувствительности бактерий к УФ-свету и ионизирующим излучениям была обнаружена темновая репарация — свойство клеток ликвидировать повреждения в ДНК без участия видимого света. Механизм темновой репарации облученных УФ-светом бактериальных клеток был предсказан А. П. Говард-Фландерсом и экспериментально подтвержден в 1964 Ф. Ханавальтом и Д. Петиджоном (США). Было показано, что у бактерий после облучения происходит вырезание поврежденных участков ДНК с измененными нуклеотидами и ресинтез ДНК в образовавшихся пробелах.
 Устройство систем репарации • В клетках имеются разнообразные "ремонтные бригады", которые следят за сохранностью информации, хранящейся на ДНК. Такие клеточные системы, исправляющие повреждения ДНК, называют системами репарации. • • Каждая из систем репарации включает следующие компоненты: фермент, "узнающий" химически измененные участки в цепи ДНК и осуществляющий разрыв цепи вблизи от повреждения, фермент, удаляющий поврежденный участок, фермент (ДНК-полимераза), синтезирующий соответствующий участок цепи ДНК взамен удалённого, Фермент (ДНК-лигаза), замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность. • • •
Устройство систем репарации • В клетках имеются разнообразные "ремонтные бригады", которые следят за сохранностью информации, хранящейся на ДНК. Такие клеточные системы, исправляющие повреждения ДНК, называют системами репарации. • • Каждая из систем репарации включает следующие компоненты: фермент, "узнающий" химически измененные участки в цепи ДНК и осуществляющий разрыв цепи вблизи от повреждения, фермент, удаляющий поврежденный участок, фермент (ДНК-полимераза), синтезирующий соответствующий участок цепи ДНК взамен удалённого, Фермент (ДНК-лигаза), замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность. • • •
 Прямая репарация • - наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов.
Прямая репарация • - наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов.
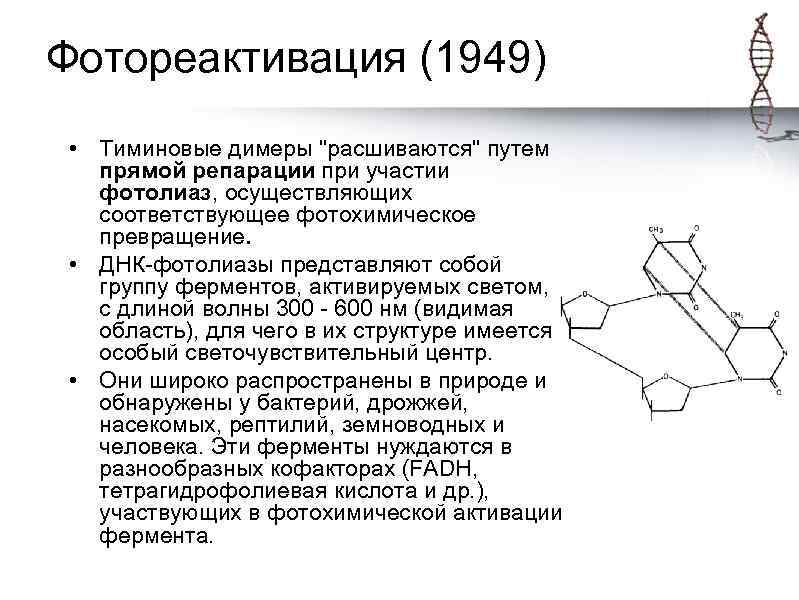 Фотореактивация (1949) • Тиминовые димеры "расшиваются" путем прямой репарации при участии фотолиаз, осуществляющих соответствующее фотохимическое превращение. • ДНК-фотолиазы представляют собой группу ферментов, активируемых светом, с длиной волны 300 - 600 нм (видимая область), для чего в их структуре имеется особый светочувствительный центр. • Они широко распространены в природе и обнаружены у бактерий, дрожжей, насекомых, рептилий, земноводных и человека. Эти ферменты нуждаются в разнообразных кофакторах (FADH, тетрагидрофолиевая кислота и др. ), участвующих в фотохимической активации фермента.
Фотореактивация (1949) • Тиминовые димеры "расшиваются" путем прямой репарации при участии фотолиаз, осуществляющих соответствующее фотохимическое превращение. • ДНК-фотолиазы представляют собой группу ферментов, активируемых светом, с длиной волны 300 - 600 нм (видимая область), для чего в их структуре имеется особый светочувствительный центр. • Они широко распространены в природе и обнаружены у бактерий, дрожжей, насекомых, рептилий, земноводных и человека. Эти ферменты нуждаются в разнообразных кофакторах (FADH, тетрагидрофолиевая кислота и др. ), участвующих в фотохимической активации фермента.
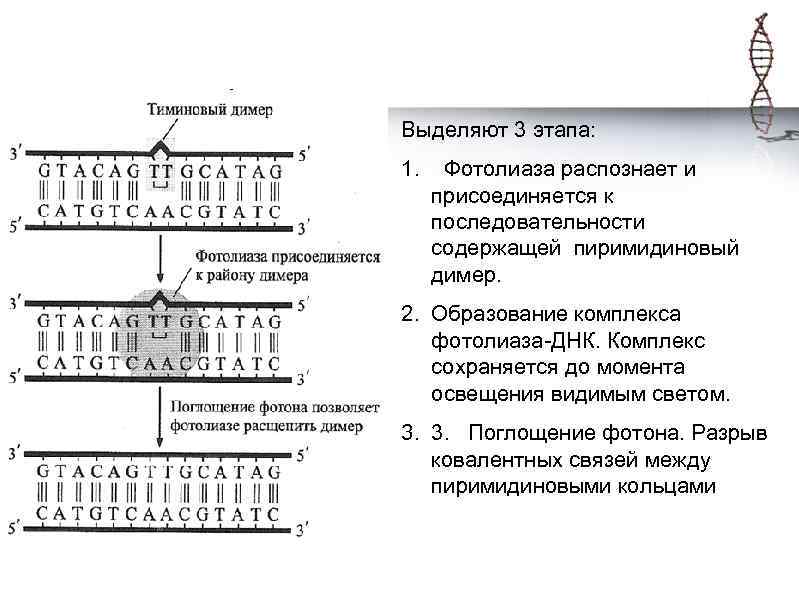 Выделяют 3 этапа: 1. Фотолиаза распознает и присоединяется к последовательности содержащей пиримидиновый димер. 2. Образование комплекса фотолиаза-ДНК. Комплекс сохраняется до момента освещения видимым светом. 3. 3. Поглощение фотона. Разрыв ковалентных связей между пиримидиновыми кольцами
Выделяют 3 этапа: 1. Фотолиаза распознает и присоединяется к последовательности содержащей пиримидиновый димер. 2. Образование комплекса фотолиаза-ДНК. Комплекс сохраняется до момента освещения видимым светом. 3. 3. Поглощение фотона. Разрыв ковалентных связей между пиримидиновыми кольцами
 Репарация алкилирующими агентами (дезалкилирование) • • • Важную роль в защите от алкилирующих факторов (например, диметилсульфата и N -этил-N-нитрозомочевины, N-метил-Nнитpo-N-нитрозогуанидина, или этилметансульфоната) играет фермент О 6 метилгуанин-ДНК-метилтрансфераза (или О 6 -алкилгуанинтрансферазf (AGT, фермент – самоубийца), которая снимает метильную группу с азотистого основания (O 6 -m. G) на один из собственных остатков цистеина У Е. coli существует подобная система репарации для О 4 -алкилтимина и фосфорных триэфиров. Подобные ферменты обнаружены и у многих других бактерий, а также у дрожжей Saccharomyces cerevisiae и плодовой мушки Drosophila melanogaster. Фермент, удаляющий остатки урацила путем гидролиза его N-гликозидной связи - урацил-ДНК-гликозилаза.
Репарация алкилирующими агентами (дезалкилирование) • • • Важную роль в защите от алкилирующих факторов (например, диметилсульфата и N -этил-N-нитрозомочевины, N-метил-Nнитpo-N-нитрозогуанидина, или этилметансульфоната) играет фермент О 6 метилгуанин-ДНК-метилтрансфераза (или О 6 -алкилгуанинтрансферазf (AGT, фермент – самоубийца), которая снимает метильную группу с азотистого основания (O 6 -m. G) на один из собственных остатков цистеина У Е. coli существует подобная система репарации для О 4 -алкилтимина и фосфорных триэфиров. Подобные ферменты обнаружены и у многих других бактерий, а также у дрожжей Saccharomyces cerevisiae и плодовой мушки Drosophila melanogaster. Фермент, удаляющий остатки урацила путем гидролиза его N-гликозидной связи - урацил-ДНК-гликозилаза.
 Репарация АР-сайтов • • • Голландский ученый Т. Линдал в 1979 году нашел, что при некоторых типах повреждений пуриновых оснований ковалентная связь между основанием и сахаром (гликозидная связь) может рваться. Тогда в молекуле ДНК на месте этих оснований образуется брешь, названная АР-сайтом. Термин приложим также к случаям, когда из ДНК выпадают пиримидиновые основания (термин АР-сайт, таким образом, объединяет все случаи выщепления оснований с образованием и апуриновых и апиримидиновых сайтов). АР-сайты могут репарироваться путем прямой вставки пуринов при участии ферментов, называемых ДНК-инсертазами (от англ. insert - вставлять). Например, ДНК-пурин-инсертаза, которая катализирует образование N-гликозидной связи между 1 -атомом дезоксирибозы апурин/апиримидинового сайта (АР-сайта), образовавшегося напротив пиримидина, и комплементарным ему основанием. Структура ДНК приобретает исходный неповрежденный вид. Однако только ограниченное число АР-сайтов может быть исправлено с помощью этого типа реакции.
Репарация АР-сайтов • • • Голландский ученый Т. Линдал в 1979 году нашел, что при некоторых типах повреждений пуриновых оснований ковалентная связь между основанием и сахаром (гликозидная связь) может рваться. Тогда в молекуле ДНК на месте этих оснований образуется брешь, названная АР-сайтом. Термин приложим также к случаям, когда из ДНК выпадают пиримидиновые основания (термин АР-сайт, таким образом, объединяет все случаи выщепления оснований с образованием и апуриновых и апиримидиновых сайтов). АР-сайты могут репарироваться путем прямой вставки пуринов при участии ферментов, называемых ДНК-инсертазами (от англ. insert - вставлять). Например, ДНК-пурин-инсертаза, которая катализирует образование N-гликозидной связи между 1 -атомом дезоксирибозы апурин/апиримидинового сайта (АР-сайта), образовавшегося напротив пиримидина, и комплементарным ему основанием. Структура ДНК приобретает исходный неповрежденный вид. Однако только ограниченное число АР-сайтов может быть исправлено с помощью этого типа реакции.
 Репарация однонитевых разрывов ДНК • Еще один тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых, например, ионизирующим излучением. При этом с помощью фермента ДНК полинуклеотидлигазы (от англ. ligase – соединять, связывать) происходит прямое воссоединение разорванных концов в молекуле ДНК. • У большинства организмов лигазы используют энергию АТФ, и лишь у эубактерий – энергию НАД(+). Интересно, что несмотря на различия в аминокислотных последовательностях и биохимических реакциях между этими двумя классами лигаз, структура аденилирующего домена у них совершенно одинакова. • Полинуклеотидлигаза является основным ферментом у E. coli, а высшие организмы производят несколько различных лигаз, имеющих специфические мишени и функции.
Репарация однонитевых разрывов ДНК • Еще один тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых, например, ионизирующим излучением. При этом с помощью фермента ДНК полинуклеотидлигазы (от англ. ligase – соединять, связывать) происходит прямое воссоединение разорванных концов в молекуле ДНК. • У большинства организмов лигазы используют энергию АТФ, и лишь у эубактерий – энергию НАД(+). Интересно, что несмотря на различия в аминокислотных последовательностях и биохимических реакциях между этими двумя классами лигаз, структура аденилирующего домена у них совершенно одинакова. • Полинуклеотидлигаза является основным ферментом у E. coli, а высшие организмы производят несколько различных лигаз, имеющих специфические мишени и функции.
 Эксцизионная репарация (1964) • • • Существуют более сложные реакции восстановления, напоминающие хирургические вмешательства в структуру ДНК, когда поврежденные участки вырезаются из цепи ДНК (отсюда происходит и термин "эксцизионная репарация", от excision – вырезание), а затем образовавшиеся бреши заполняются неповрежденным материалом. Для эксцизионной репарации необходима вторая (комплементарная) цепь ДНК. Все типы эксцизионной репарации имеют общие этапы: – – • Распознавание повреждения. Надрезание нити ДНК (сахарофосфатного остова). Эксцизия участка, содержащего повреждение. Репаративный синтез на неповрежденной матрице и лигирование. Три основных типа эксцизионной репарации получили свои названия в зависимости от того, какие именно повреждения будут исправляться. Эти типы репарации, несмотря на лежащий в их основе общий процесс вырезания участка ДНК с повреждением, принципиально различаются между собой. – Эксцизионная репарация оснований (BER). – Эксцизионная репарация нуклеотидов (NER). – Мисмэтч репарация(MMR).
Эксцизионная репарация (1964) • • • Существуют более сложные реакции восстановления, напоминающие хирургические вмешательства в структуру ДНК, когда поврежденные участки вырезаются из цепи ДНК (отсюда происходит и термин "эксцизионная репарация", от excision – вырезание), а затем образовавшиеся бреши заполняются неповрежденным материалом. Для эксцизионной репарации необходима вторая (комплементарная) цепь ДНК. Все типы эксцизионной репарации имеют общие этапы: – – • Распознавание повреждения. Надрезание нити ДНК (сахарофосфатного остова). Эксцизия участка, содержащего повреждение. Репаративный синтез на неповрежденной матрице и лигирование. Три основных типа эксцизионной репарации получили свои названия в зависимости от того, какие именно повреждения будут исправляться. Эти типы репарации, несмотря на лежащий в их основе общий процесс вырезания участка ДНК с повреждением, принципиально различаются между собой. – Эксцизионная репарация оснований (BER). – Эксцизионная репарация нуклеотидов (NER). – Мисмэтч репарация(MMR).
 Эксцизионная репарация оснований • Бракованное основание удаляется в одиночку или вместе с окружением - участками цепи в 2 -10 нуклеотидов. Так вырезаются модифицированные и поврежденные основания, апуриновые сайты и места с одноцепочечными разрывами.
Эксцизионная репарация оснований • Бракованное основание удаляется в одиночку или вместе с окружением - участками цепи в 2 -10 нуклеотидов. Так вырезаются модифицированные и поврежденные основания, апуриновые сайты и места с одноцепочечными разрывами.
 Ферменты BER • • • К настоящему времени описано много типов ферментов-гликозилаз, каждый из которых узнает разнообразные поврежденные основания (такие, как метилированные, окисленные, восстановленные, дезаминированные основания, связанные с формамидными группировками, и т. п. ). Гликозилазы присоединяются к ним, рвут гликозидные связи между модифицированным основанием и сахаром дезоксирибозой, за счет чего образуются АП-сайты. АП-сайт распознается теперь другим ферментом, АП-эндонуклеазой. Как только в нити ДНК возникает разрыв, в работу вступает еще один фермент - фосфодиэстераза: он отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент - ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному 3'ОН-концу. Чтобы соединить два свободных конца (3'ОН-конец вставленного нуклеотида и 5'-конец, ранее образовавшийся при разрыве нити ДНК АПэндонуклеазой), вступает в действие еще один фермент - полинуклеотидлигаза.
Ферменты BER • • • К настоящему времени описано много типов ферментов-гликозилаз, каждый из которых узнает разнообразные поврежденные основания (такие, как метилированные, окисленные, восстановленные, дезаминированные основания, связанные с формамидными группировками, и т. п. ). Гликозилазы присоединяются к ним, рвут гликозидные связи между модифицированным основанием и сахаром дезоксирибозой, за счет чего образуются АП-сайты. АП-сайт распознается теперь другим ферментом, АП-эндонуклеазой. Как только в нити ДНК возникает разрыв, в работу вступает еще один фермент - фосфодиэстераза: он отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь в одной цепи ДНК размером в один нуклеотид. Напротив бреши в противоположной нити ДНК расположен неповрежденный нуклеотид, и следующий фермент - ДНК полимераза I вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному 3'ОН-концу. Чтобы соединить два свободных конца (3'ОН-конец вставленного нуклеотида и 5'-конец, ранее образовавшийся при разрыве нити ДНК АПэндонуклеазой), вступает в действие еще один фермент - полинуклеотидлигаза.
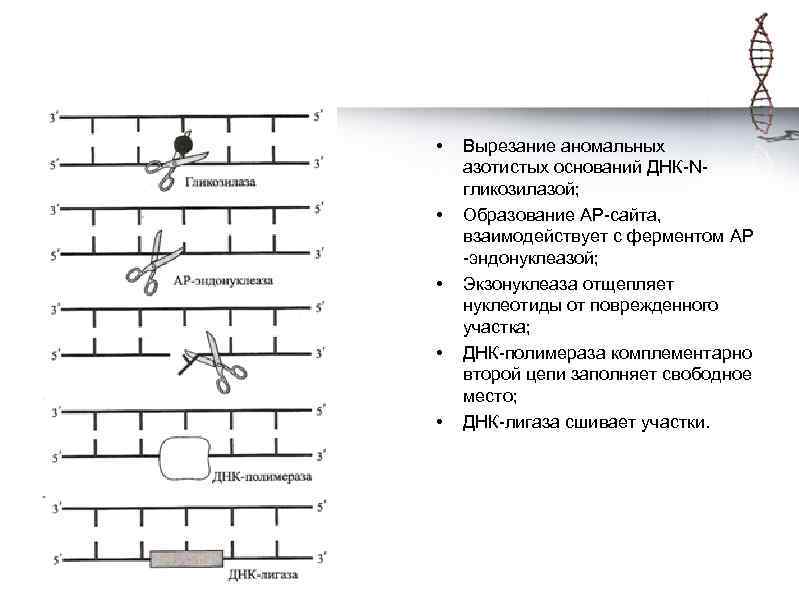 • • • Вырезание аномальных азотистых оснований ДНК-Nгликозилазой; Образование АР-сайта, взаимодействует с ферментом АР -эндонуклеазой; Экзонуклеаза отщепляет нуклеотиды от поврежденного участка; ДНК-полимераза комплементарно второй цепи заполняет свободное место; ДНК-лигаза сшивает участки.
• • • Вырезание аномальных азотистых оснований ДНК-Nгликозилазой; Образование АР-сайта, взаимодействует с ферментом АР -эндонуклеазой; Экзонуклеаза отщепляет нуклеотиды от поврежденного участка; ДНК-полимераза комплементарно второй цепи заполняет свободное место; ДНК-лигаза сшивает участки.
 Эксцизионная репарация нуклеотидов • Даже если ошибка в одном нуклеотиде, удаляется сразу множество нуклеотидов (около 30) в районе повреждения (например, возникновения пиримидиновых димеров или других объемных образований в ДНК, нарушающих структуру спирали).
Эксцизионная репарация нуклеотидов • Даже если ошибка в одном нуклеотиде, удаляется сразу множество нуклеотидов (около 30) в районе повреждения (например, возникновения пиримидиновых димеров или других объемных образований в ДНК, нарушающих структуру спирали).
 Ферменты NER • NER-репарацию в клетках E. coli выполняет мультиферментный комплекс, содержащий эндонуклеазы, кодируемые тремя генами: uvr. A, uvr. B и uvr. C (названия генов даны по первым буквам слов ultra violet repair). Комплекс получил название "эксинуклеаза". • Повреждение распознается и выщепляется эксинуклеазой (Uvr. ABC-эндонуклеазой). • ДНК раскручивается в месте повреждения. Разрез ДНК происходит с 3‘-стороны на 4 нуклеотида и на 8 с 5'-конца от повреждения. • Новая цепь ДНК достраивается по матрице неповрежденной цепи ДНК-полимеразой. • Лигаза сшивает вновь синтезированный конец цепи.
Ферменты NER • NER-репарацию в клетках E. coli выполняет мультиферментный комплекс, содержащий эндонуклеазы, кодируемые тремя генами: uvr. A, uvr. B и uvr. C (названия генов даны по первым буквам слов ultra violet repair). Комплекс получил название "эксинуклеаза". • Повреждение распознается и выщепляется эксинуклеазой (Uvr. ABC-эндонуклеазой). • ДНК раскручивается в месте повреждения. Разрез ДНК происходит с 3‘-стороны на 4 нуклеотида и на 8 с 5'-конца от повреждения. • Новая цепь ДНК достраивается по матрице неповрежденной цепи ДНК-полимеразой. • Лигаза сшивает вновь синтезированный конец цепи.
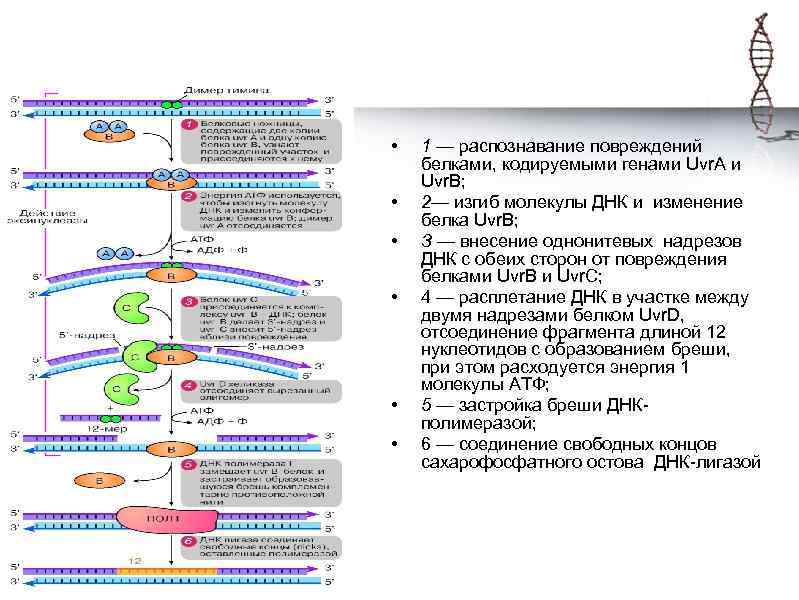 • • • 1 — распознавание повреждений белками, кодируемыми генами Uvr. A и Uvr. В; 2— изгиб молекулы ДНК и изменение белка Uvr. В; З — внесение однонитевых надрезов ДНК с обеих сторон от повреждения белками Uvr. В и Uvr. С; 4 — расплетание ДНК в участке между двумя надрезами белком Uvr. D, отсоединение фрагмента длиной 12 нуклеотидов с образованием бреши, при этом расходуется энергия 1 молекулы АТФ; 5 — застройка бреши ДНКполимеразой; 6 — соединение свободных концов сахарофосфатного остова ДНК-лигазой
• • • 1 — распознавание повреждений белками, кодируемыми генами Uvr. A и Uvr. В; 2— изгиб молекулы ДНК и изменение белка Uvr. В; З — внесение однонитевых надрезов ДНК с обеих сторон от повреждения белками Uvr. В и Uvr. С; 4 — расплетание ДНК в участке между двумя надрезами белком Uvr. D, отсоединение фрагмента длиной 12 нуклеотидов с образованием бреши, при этом расходуется энергия 1 молекулы АТФ; 5 — застройка бреши ДНКполимеразой; 6 — соединение свободных концов сахарофосфатного остова ДНК-лигазой
 Репарация ошибок репликации • • • ДНК полимеразы обладают следующим свойством: после подстановки очередного нуклеотида в растущую нить ДНК (полимеразный комплекс движется в направлении от 5'-конца синтезируемой нити к 3'-OH-концу) делать шаг назад (в направлении от 3' к 5') и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной нити ДНК. Этот процесс исправления ошибок спаривания, или коррекции, иногда не срабатывает, и тогда в ДНК по окончании репликации остаются невырезанными некоторые неправильные пары, остаются мисмэтчи. Ошибки спаривания азотистых оснований во время репликации ДНК происходят достаточно часто (у бактерий один раз на 10 тыс. нуклеотидов). Вскоре после окончания репликации специальные ферменты - метилазы присоединяют метильные группы к аденинам в последовательностях ГАТЦ. Пока они остаются неметилированными, клетки должны успеть отрепарировать мисмэтчи. Мисмэтч-репарация исправляет ошибочно встроенные неповрежденные основания за исключением C–C. Кроме того, эта система репарирует небольшие вставки в одну из цепей ДНК, образующиеся в результате ошибок репликации, длина которых не превышает четырех нуклеотидов. В мисмэтч репарации участвуют ферменты вовлеченные как в BER, так и в NER репарацию, так и специализированные ферменты.
Репарация ошибок репликации • • • ДНК полимеразы обладают следующим свойством: после подстановки очередного нуклеотида в растущую нить ДНК (полимеразный комплекс движется в направлении от 5'-конца синтезируемой нити к 3'-OH-концу) делать шаг назад (в направлении от 3' к 5') и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной нити ДНК. Этот процесс исправления ошибок спаривания, или коррекции, иногда не срабатывает, и тогда в ДНК по окончании репликации остаются невырезанными некоторые неправильные пары, остаются мисмэтчи. Ошибки спаривания азотистых оснований во время репликации ДНК происходят достаточно часто (у бактерий один раз на 10 тыс. нуклеотидов). Вскоре после окончания репликации специальные ферменты - метилазы присоединяют метильные группы к аденинам в последовательностях ГАТЦ. Пока они остаются неметилированными, клетки должны успеть отрепарировать мисмэтчи. Мисмэтч-репарация исправляет ошибочно встроенные неповрежденные основания за исключением C–C. Кроме того, эта система репарирует небольшие вставки в одну из цепей ДНК, образующиеся в результате ошибок репликации, длина которых не превышает четырех нуклеотидов. В мисмэтч репарации участвуют ферменты вовлеченные как в BER, так и в NER репарацию, так и специализированные ферменты.
 Ферменты мисмэтч-репарации • • • В кишечной палочке этот процесс идет под контролем продуктов четырех генов: Mut. H, Mut. L, Mut. S и Mut. U (Mut. U=Uvr. D=хеликаза II). Процесс начинается с того, что к некомплементарной паре мисмэтча присоединяется белок mut. S. Каждый из белков mut. H распознает участок ГАТЦ и обладает эндонуклеазной активностью, с помощью которой ДНК в этой последовательности может быть надрезана вблизи аденина в неметилированной нити. Надрезы могут быть внесены как в 5'-, так и в 3'-положение относительно аденина. Фрагмент ДНК протягивается через комплекс до тех пор, пока два участка ГАТЦ, расположенные по обе стороны от мисмэтча, удерживаемого белком mut. S, не окажутся захваченными молекулами белков mut. H. Иногда расстояние между участками ГАТЦ может превышать несколько тысяч нуклеотидов. Каждый из белков mut. H распознает участок ГАТЦ и разрывает дочернюю нить около неметилированных аденинов. Белок экзонуклеаза разрушит всю дочернюю нить ДНК до места неправильного спаривания и даже пройдет несколько дальше. Затем бреши должны быть застроены ДНК-полимеразой, а концы воссоединены с помощью лигаз. Разумеется, для высвобождения концов нитей после внесения первичных разрезов молекула ДНК должна быть расплетена (требуется белок хеликаза), нужны также источники энергии в виде АТФ, а для застройки брешей требуются дезоксирибонуклеотидтрифосфаты.
Ферменты мисмэтч-репарации • • • В кишечной палочке этот процесс идет под контролем продуктов четырех генов: Mut. H, Mut. L, Mut. S и Mut. U (Mut. U=Uvr. D=хеликаза II). Процесс начинается с того, что к некомплементарной паре мисмэтча присоединяется белок mut. S. Каждый из белков mut. H распознает участок ГАТЦ и обладает эндонуклеазной активностью, с помощью которой ДНК в этой последовательности может быть надрезана вблизи аденина в неметилированной нити. Надрезы могут быть внесены как в 5'-, так и в 3'-положение относительно аденина. Фрагмент ДНК протягивается через комплекс до тех пор, пока два участка ГАТЦ, расположенные по обе стороны от мисмэтча, удерживаемого белком mut. S, не окажутся захваченными молекулами белков mut. H. Иногда расстояние между участками ГАТЦ может превышать несколько тысяч нуклеотидов. Каждый из белков mut. H распознает участок ГАТЦ и разрывает дочернюю нить около неметилированных аденинов. Белок экзонуклеаза разрушит всю дочернюю нить ДНК до места неправильного спаривания и даже пройдет несколько дальше. Затем бреши должны быть застроены ДНК-полимеразой, а концы воссоединены с помощью лигаз. Разумеется, для высвобождения концов нитей после внесения первичных разрезов молекула ДНК должна быть расплетена (требуется белок хеликаза), нужны также источники энергии в виде АТФ, а для застройки брешей требуются дезоксирибонуклеотидтрифосфаты.
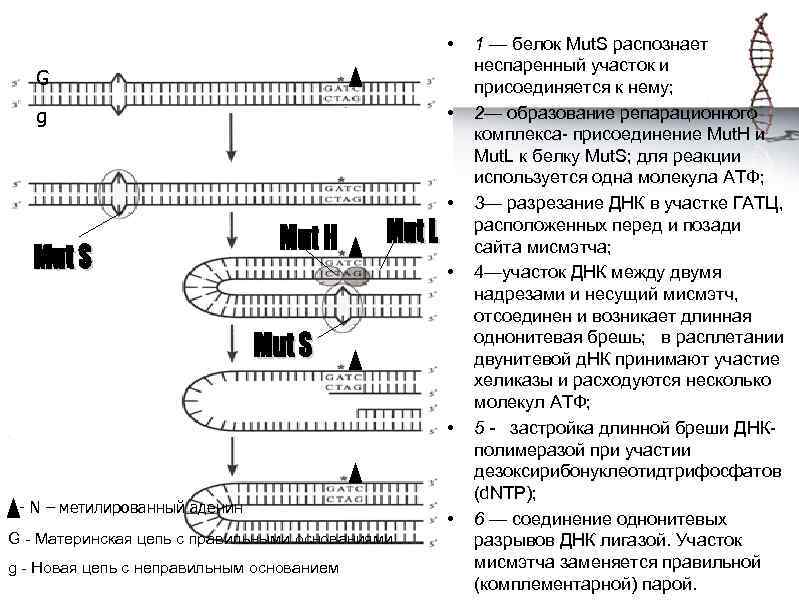 • G g • • - N – метилированный аденин G - Материнская цепь с правильными основаниями g - Новая цепь с неправильным основанием • 1 — белок Mut. S распознает неспаренный участок и присоединяется к нему; 2— образование репарационного комплекса- присоединение Mut. H и Mut. L к белку Mut. S; для реакции используется одна молекула АТФ; 3— разрезание ДНК в участке ГАТЦ, расположенных перед и позади сайта мисмэтча; 4—участок ДНК между двумя надрезами и несущий мисмэтч, отсоединен и возникает длинная однонитевая брешь; в расплетании двунитевой д. НК принимают участие хеликазы и расходуются несколько молекул АТФ; 5 - застройка длинной бреши ДНКполимеразой при участии дезоксирибонуклеотидтрифосфатов (d. NTP); 6 — соединение однонитевых разрывов ДНК лигазой. Участок мисмэтча заменяется правильной (комплементарной) парой.
• G g • • - N – метилированный аденин G - Материнская цепь с правильными основаниями g - Новая цепь с неправильным основанием • 1 — белок Mut. S распознает неспаренный участок и присоединяется к нему; 2— образование репарационного комплекса- присоединение Mut. H и Mut. L к белку Mut. S; для реакции используется одна молекула АТФ; 3— разрезание ДНК в участке ГАТЦ, расположенных перед и позади сайта мисмэтча; 4—участок ДНК между двумя надрезами и несущий мисмэтч, отсоединен и возникает длинная однонитевая брешь; в расплетании двунитевой д. НК принимают участие хеликазы и расходуются несколько молекул АТФ; 5 - застройка длинной бреши ДНКполимеразой при участии дезоксирибонуклеотидтрифосфатов (d. NTP); 6 — соединение однонитевых разрывов ДНК лигазой. Участок мисмэтча заменяется правильной (комплементарной) парой.
 Рекомбинантная репарация • • Существовать с молекулами ДНК, несущими бреши, клетка долго не может. Перед делением клетки в ней образуются две двунитевые молекулы ДНК. Если одна из них несет в какой-либо точке повреждение в одной нити и брешь в противоположной нити, то в другой двунитевой молекуле ДНК обе нити в данной точке будут нормальными. В этом случае может произойти обмен участками ДНК - рекомбинация - неповрежденный участок будет вырезан из нормальной молекулы ДНК и вставлен на место поврежденного участка в другой молекуле, благодаря чему поврежденный генетический материал будет заменен нормальным. Вслед за этим спец. ферменты (ДНК-полимеразы) заделают «бреши» (теперь они смогут это сделать, т. к. в обеих молекулах в данном месте повреждения будут отсутствовать), вновь синтезированные и старые нити будут соединены друг с другом, и исходная структура ДНК будет в результате этого полностью восстановлена.
Рекомбинантная репарация • • Существовать с молекулами ДНК, несущими бреши, клетка долго не может. Перед делением клетки в ней образуются две двунитевые молекулы ДНК. Если одна из них несет в какой-либо точке повреждение в одной нити и брешь в противоположной нити, то в другой двунитевой молекуле ДНК обе нити в данной точке будут нормальными. В этом случае может произойти обмен участками ДНК - рекомбинация - неповрежденный участок будет вырезан из нормальной молекулы ДНК и вставлен на место поврежденного участка в другой молекуле, благодаря чему поврежденный генетический материал будет заменен нормальным. Вслед за этим спец. ферменты (ДНК-полимеразы) заделают «бреши» (теперь они смогут это сделать, т. к. в обеих молекулах в данном месте повреждения будут отсутствовать), вновь синтезированные и старые нити будут соединены друг с другом, и исходная структура ДНК будет в результате этого полностью восстановлена.
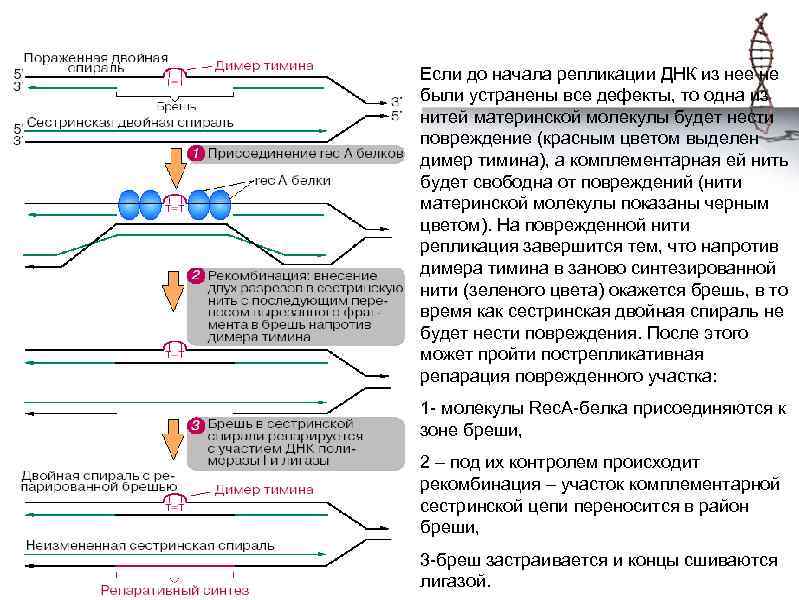 Если до начала репликации ДНК из нее не были устранены все дефекты, то одна из нитей материнской молекулы будет нести повреждение (красным цветом выделен димер тимина), а комплементарная ей нить будет свободна от повреждений (нити материнской молекулы показаны черным цветом). На поврежденной нити репликация завершится тем, что напротив димера тимина в заново синтезированной нити (зеленого цвета) окажется брешь, в то время как сестринская двойная спираль не будет нести повреждения. После этого может пройти пострепликативная репарация поврежденного участка: 1 - молекулы Rec. A-белка присоединяются к зоне бреши, 2 – под их контролем происходит рекомбинация – участок комплементарной сестринской цепи переносится в район бреши, 3 -бреш застраивается и концы сшиваются лигазой.
Если до начала репликации ДНК из нее не были устранены все дефекты, то одна из нитей материнской молекулы будет нести повреждение (красным цветом выделен димер тимина), а комплементарная ей нить будет свободна от повреждений (нити материнской молекулы показаны черным цветом). На поврежденной нити репликация завершится тем, что напротив димера тимина в заново синтезированной нити (зеленого цвета) окажется брешь, в то время как сестринская двойная спираль не будет нести повреждения. После этого может пройти пострепликативная репарация поврежденного участка: 1 - молекулы Rec. A-белка присоединяются к зоне бреши, 2 – под их контролем происходит рекомбинация – участок комплементарной сестринской цепи переносится в район бреши, 3 -бреш застраивается и концы сшиваются лигазой.
 SOS-репарация (1974) • Данный механизм занимает особое место среди клеточных репарирующих систем, ее еще называют "ошибочной" репарацией. У бактерии Е. coli ферменты этой системы синтезируются только в ответ на действие на клетку ДНК-повреждающих агентов, например УФ-излучения • Основная задача такой системы - модифицировать ДНК-полимеразу и поврежденный участок ДНК таким образом, чтобы не блокировалось действие ДНК-полимеразы. SOS-ответ представляет собой индуцируемую реакцию клетки на критическое состояние, приближающее ее к гибели. При наличии повреждений в клетке перед репликацией индуцируется синтез белков, которые присоединяются к ДНК-полимеразному комплексу и делают возможным строить дочернюю ДНК напротив дефектных звеньев матричной цепи. ДНК оказывается удвоенной, но с ошибкой. Сигналом к запуску служит накопление однонитевых разрывов, индуцирующих активность белка Rec. A, который специфически взаимодействует с белком Lex. A – репрессором для генов репарации. В результате работы репарационных систем происходит уменьшение одноцепочечных разрывов, белок Rec. A теряет активность и механизм SOS-репарации выключается. • •
SOS-репарация (1974) • Данный механизм занимает особое место среди клеточных репарирующих систем, ее еще называют "ошибочной" репарацией. У бактерии Е. coli ферменты этой системы синтезируются только в ответ на действие на клетку ДНК-повреждающих агентов, например УФ-излучения • Основная задача такой системы - модифицировать ДНК-полимеразу и поврежденный участок ДНК таким образом, чтобы не блокировалось действие ДНК-полимеразы. SOS-ответ представляет собой индуцируемую реакцию клетки на критическое состояние, приближающее ее к гибели. При наличии повреждений в клетке перед репликацией индуцируется синтез белков, которые присоединяются к ДНК-полимеразному комплексу и делают возможным строить дочернюю ДНК напротив дефектных звеньев матричной цепи. ДНК оказывается удвоенной, но с ошибкой. Сигналом к запуску служит накопление однонитевых разрывов, индуцирующих активность белка Rec. A, который специфически взаимодействует с белком Lex. A – репрессором для генов репарации. В результате работы репарационных систем происходит уменьшение одноцепочечных разрывов, белок Rec. A теряет активность и механизм SOS-репарации выключается. • •
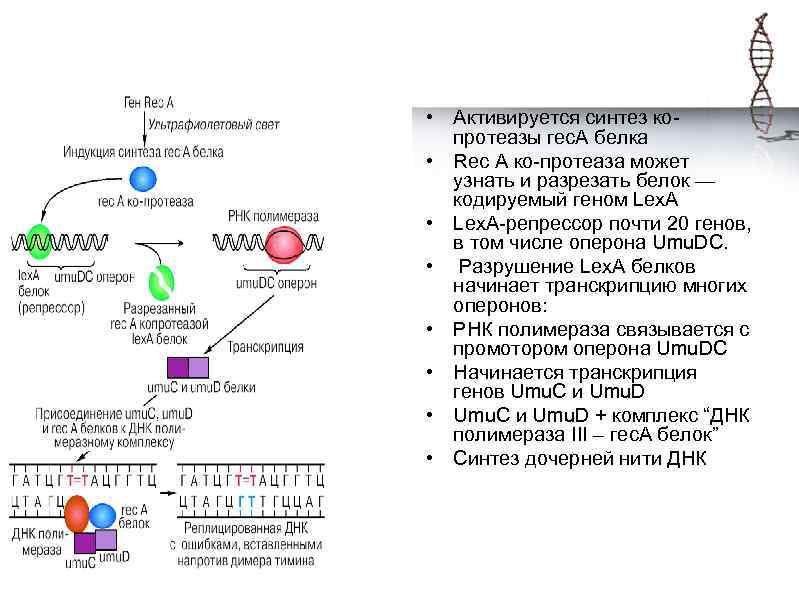 • Активируется синтез копротеазы гес. А белка • Rес А ко-протеаза может узнать и разрезать белок — кодируемый геном Lех. А • Lex. A-репрессор почти 20 генов, в том числе оперона Umu. DС. • Разрушение Lех. А белков начинает транскрипцию многих оперонов: • РНК полимераза связывается с промотором оперона Umu. DС • Начинается транскрипция генов Umu. С и Umu. D • Umu. С и Umu. D + комплекс “ДНК полимераза III – гес. А белок” • Cинтез дочерней нити ДНК
• Активируется синтез копротеазы гес. А белка • Rес А ко-протеаза может узнать и разрезать белок — кодируемый геном Lех. А • Lex. A-репрессор почти 20 генов, в том числе оперона Umu. DС. • Разрушение Lех. А белков начинает транскрипцию многих оперонов: • РНК полимераза связывается с промотором оперона Umu. DС • Начинается транскрипция генов Umu. С и Umu. D • Umu. С и Umu. D + комплекс “ДНК полимераза III – гес. А белок” • Cинтез дочерней нити ДНК


