клонирование_ноябрь 2012.ppt
- Количество слайдов: 59
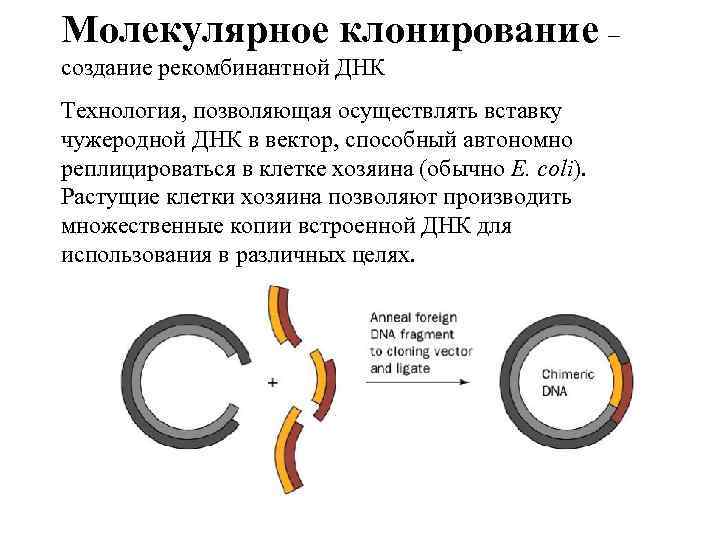
Молекулярное клонирование – создание рекомбинантной ДНК Технология, позволяющая осуществлять вставку чужеродной ДНК в вектор, способный автономно реплицироваться в клетке хозяина (обычно E. coli). Растущие клетки хозяина позволяют производить множественные копии встроенной ДНК для использования в различных целях.

Молекулярное клонирование в экологической микробиологии • Гены 16 S р. РНК – универсальный филогенетический маркер • Функциональные гены – несут информацию об определенной функции микроорганизмов (азотфиксация, метаногенез, сульфатредукция и др. )

Молекулярное клонирование в экспериментальной микробиологии • Гены устойчивости к металлам (сороперон, рсо-оперон и др. ) • Гены устойчивости к антибиотикам

Для процедуры молекулярного клонирования необходимо: • Фрагмент ДНК (ПЦР-продукт, геномная ДНК, к. ДНК) • Компетентные клетки (клетки хозяина – бактериальные клетки, дрожжи, клетки насекомых и др. ) • Вектор ДНК • Набор реагентов для встраивания чужеродной ДНК в вектор • Метод помещения модифицированной in vitro ДНК в клетки хозяина • Методы отбора и/или скрининга клеток, которые несут встроенный фрагмент ДНК

Эндонуклеазы рестрикции • Нуклеазы – ферменты, способные разрушать фосфодиэфирные связи между отдельными нуклеотидами в нуклеиновых кислотах • Лигазы – образуют фосфодиэфирные связи для соединения двух фрагментов ДНК с использованием АТФ в присутствии Mg 2+ • Киназы – переносят фосфатные группы от донорных молекул фосфорилаз • Фосфатазы – катализируют удаление 5‘фосфатных остатков

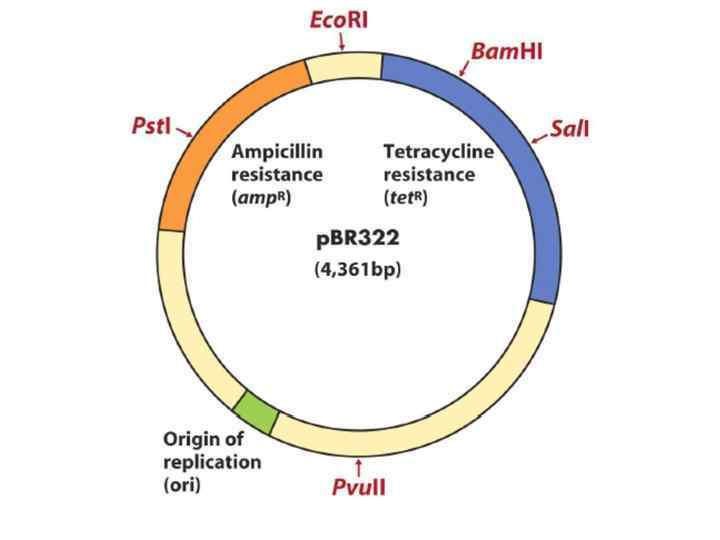
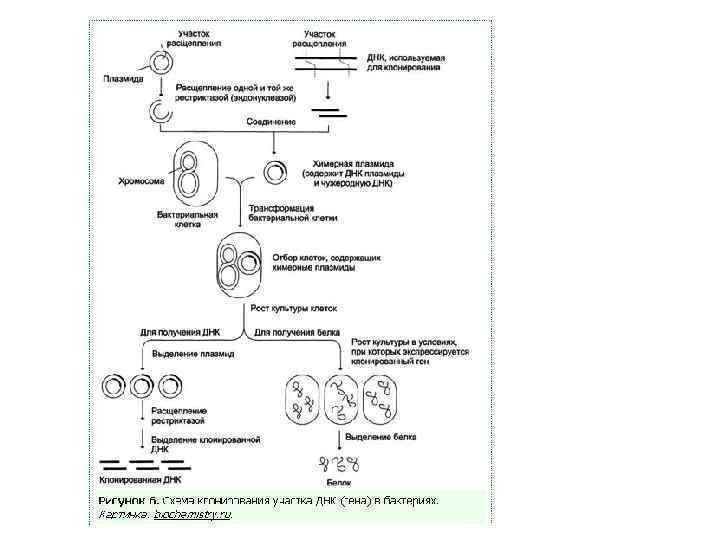
Вектор клонирования - это молекула ДНК, которая переносит экзогенную ДНК в клетку-хозяина, реплицируется внутри бактериальной клетки и образует множественные свои копии экзогенной ДНК. Особенности векторов клонирования 1. Кольцевая ДНК, способная автономно реплицироваться независимо от хромосомы клеткихозяина. 2. Сайт для встраивания экзогенной ДНК; большинство универсальных векторов содержат сайт, который может быть разрезан многими рестрикционными ферментами 3. Уникальные сайты рестрикции 4. Содержат один или более генов, некоторые из которых обеспечивают устойчивость к отдельным антибиотикам (ампициллин, тетрациклин). 5. Начало репликации (сайт ORI) – участок ДНК, который позволяет деление плазмиды внутри клетки -хозяина и определяет число копий на клетку
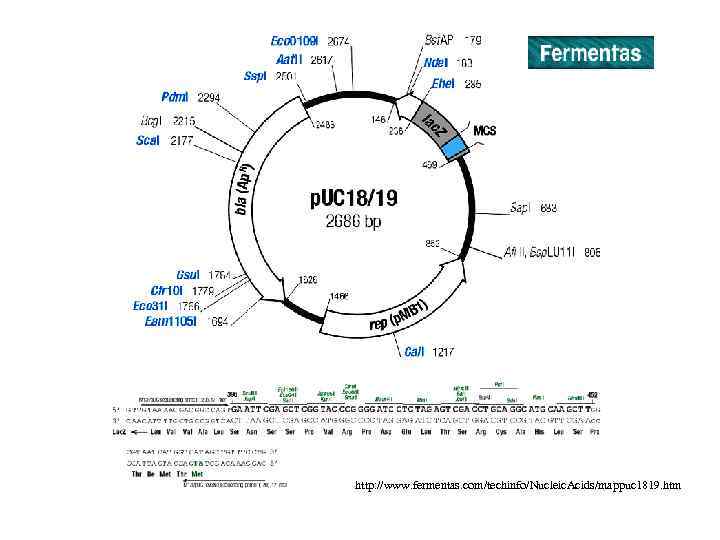
http: //www. fermentas. com/techinfo/Nucleic. Acids/mappuc 1819. htm

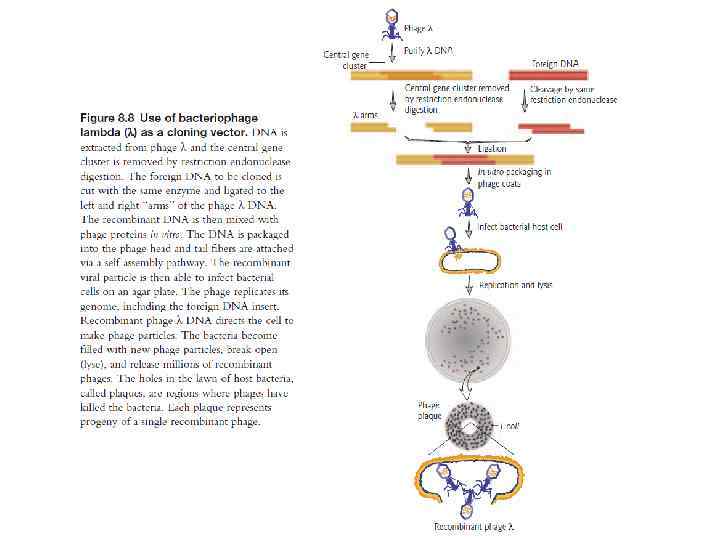
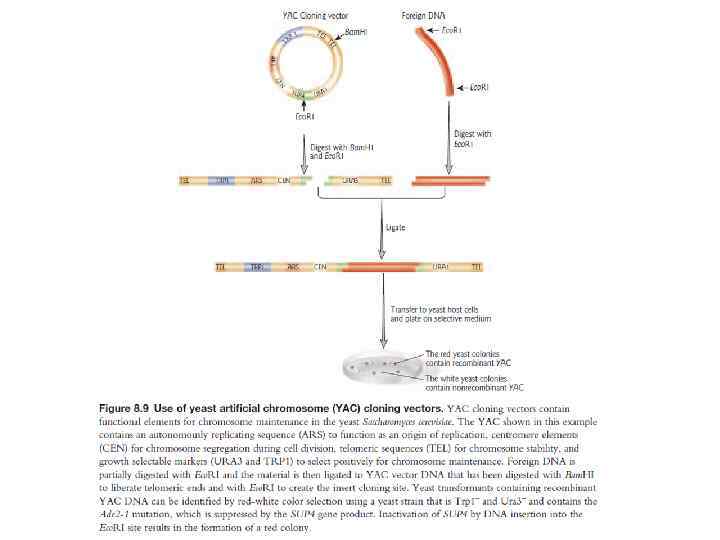
Типы векторов клонирования 1. Плазмида – внехромосомная кольцевая молекула ДНК, которая автономно реплицируется внутри бактериальной клетки; 100 -10000 bp или 0, 1 -10 kb 2. Фаг – производное бактериофага лямбда; линейная молекула ДНК, которая может быть реплицирована вместе с экзогенной ДНК без нарушения жизненного цикла клетки; 8 -20 kb 3. Космиды - внехромосомная кольцевая молекула ДНК, которая совмещает особенности плазмиды и фага; 35 -50 kb 4. Искуственные бактериальные хромосомы (BAC) – основаны на бактериальных мини-F плазмидах; 75 -300 kb 5. Искуственные хромосомы дрожжей (YAC) – искуственная хромосома, которая имеет теломеры, начало репликации, центромер дрожжей и селективные маркеры для идентификации дрожжевых клеток; 100 -1000 kb Желательные свойства плазмид • Маленький размер • Известная последовательность ДНК • Большое количество копий • Селективные маркеры • Большое число уникальных сайтов рестрикции

Стадии клонирования 1. Экстракция ДНК сообщества 2. Амплификация нужных фрагментов ДНК (АТ-достройка) 3. Экстракция из геля 4. Встраивание фрагмента в вектор (лигирование) 5. Перенос вектора в бактериальные клетки (трансформация) 6. Отбор трансформантов 7. ПЦР-анализ трансформантов 8. Рестрикция

Типичная процедура клонирования должна занять не более 2 -3 дней • День 1: Лигирование (4 -16 ч) и трансформация (не более 1 ч) • День 2: Перенос колоний на свежие чашки Петри • День 3: Анализ колоний с помощью ПЦР и рестрикционный анализ

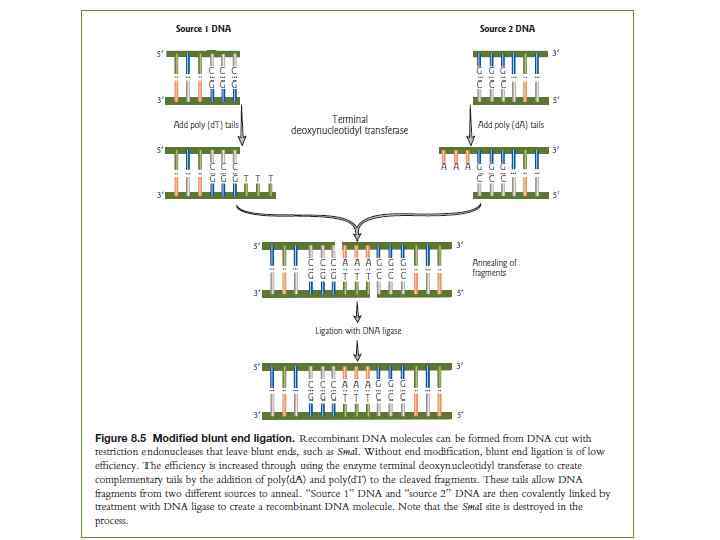
Встраивание амплифицированных фрагментов в вектор - Лигирование Реакция протекает в специальном буфере. Фермент лигаза «сшивает» концы встроенного фрагмента и вектора.

Липкие концы - Kомплементарные другу, выступающие однонитевые участки одного или разных двухцепочечных фрагментов ДНК, по липким концам фрагменты могут соединяться друг с другом с образованием гибридных молекул ДНК Тупые концы - концы цепей двухцепочечной молекулы ДНК, заканчивающиеся парой соединенных комплементарных оснований (т. е. один конец не "выступает" за другой - в отличие от "липких концов"

Трансформация – метод помещения модифицированной in vitro ДНК в клетку хозяина • Химическая трансформация - Обработка клеток хлоридом кальция - Тепловой шок • Электропорация - создание пор в бислойной липидной мембране под действием электрического поля

Электрическое поле «вдавливает» плазмидную ДНК в пору, при этом расширяя ее. Затем медленно (~ 100 сек. ) пора релаксирует к исходному состоянию
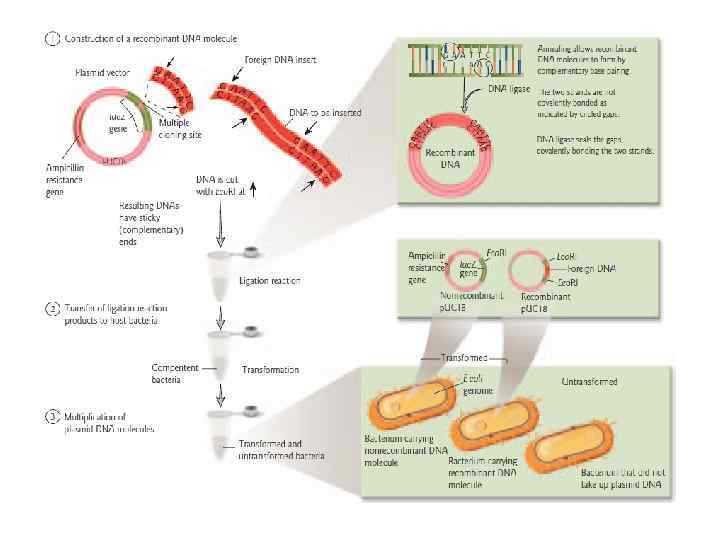

Метод отбора и/или скрининга клеток, которые получили вставку фрагмента ДНК Селекция – относится к применению условий, которые способствуют росту клеток или фагов, несущих вектор или вектор со вставкой. • Устойчивость к антибиотикам • Потребность в питательных веществах

Скрининг рекомбинантных клеток Все клетки способны к росту, но тест позволяет отобрать только клоны, получившие вектор со вставкой • Устойчивость/чувствительность к антибиотикам • Потребность в питательных веществах • Blue-white selection (β-галактозидаза) • Специфичность (гибридизация, антитела, ПЦР)
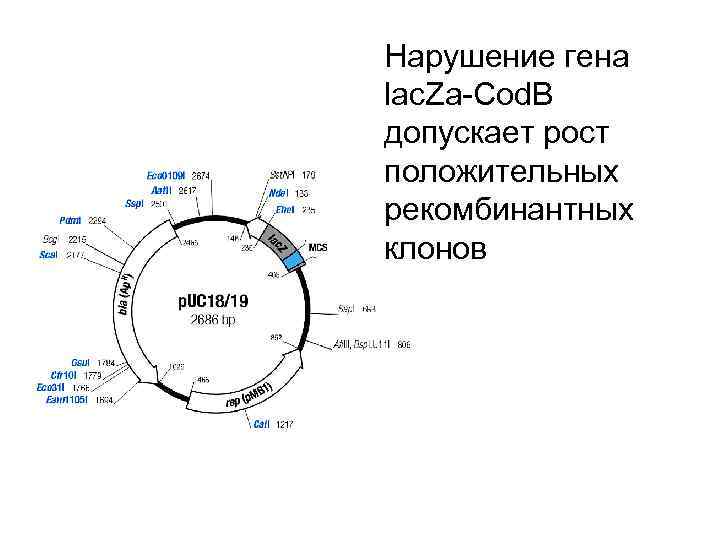
Нарушение гена lac. Za-Cod. B допускает рост положительных рекомбинантных клонов
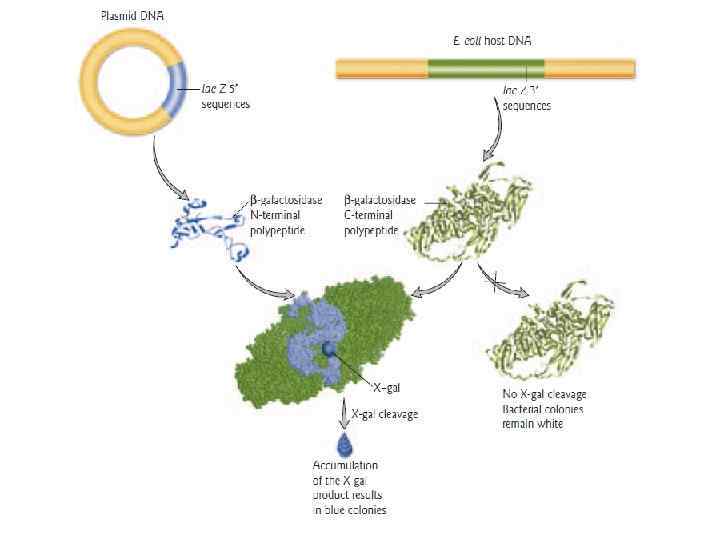
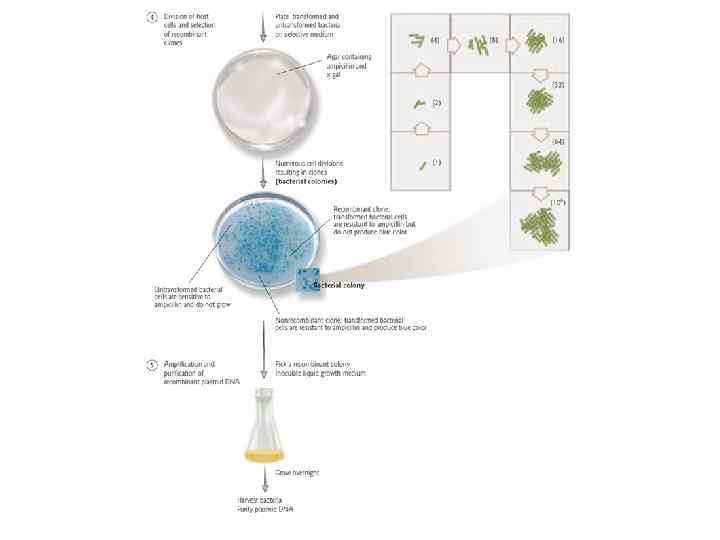

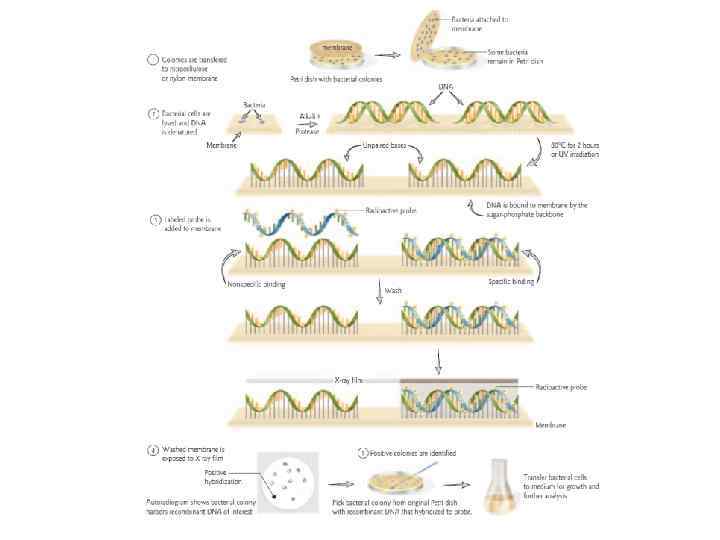
Дальнейшие манипуляции с ДНК: • • • Создание зондов Рестрикционный анализ Секвенирование Реинтродукция в организм Создание коллекций: библиотеки ДНК Дальнейшие молекулярные исследования: образование особых белков

Библиотека ДНК • Коллекция ДНК-клонов • Источник разнообразия генов • Возможно создание геномных библиотек или библиотек к. ДНК (ДНК, синтезированная из зрелой м. РНК в реакции, катализируемой обратной транскриптазой)
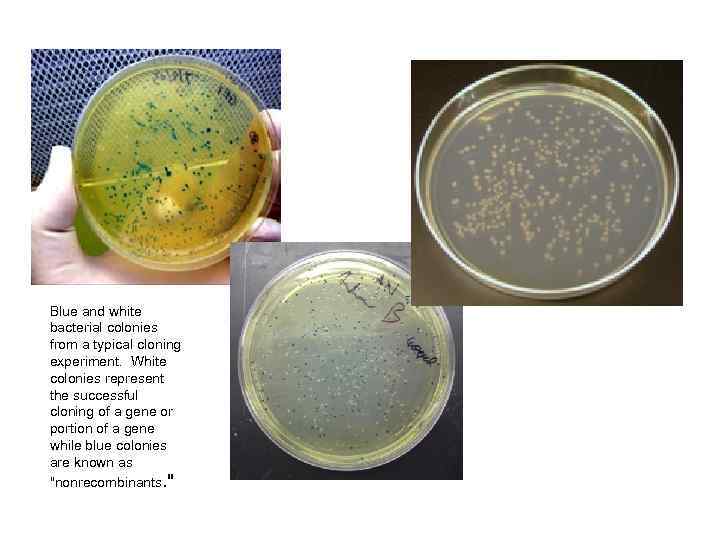
Blue and white bacterial colonies from a typical cloning experiment. White colonies represent the successful cloning of a gene or portion of a gene while blue colonies are known as "nonrecombinants. "

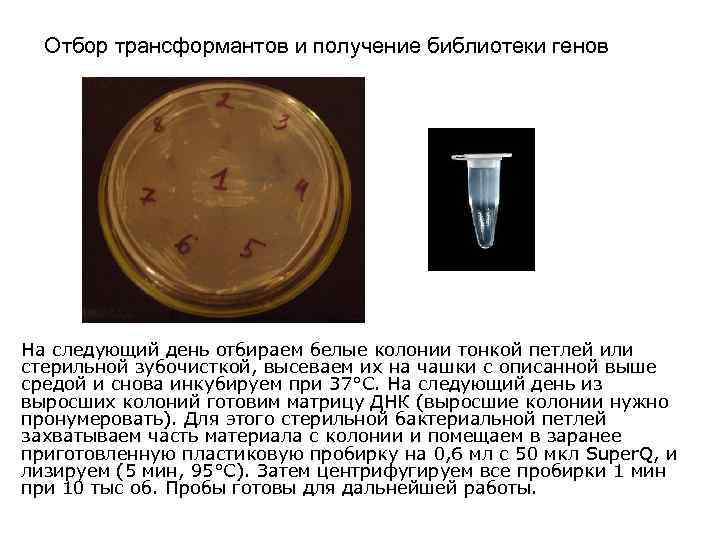
Отбор трансформантов и получение библиотеки генов На следующий день отбираем белые колонии тонкой петлей или стерильной зубочисткой, высеваем их на чашки с описанной выше средой и снова инкубируем при 37°С. На следующий день из выросших колоний готовим матрицу ДНК (выросшие колонии нужно пронумеровать). Для этого стерильной бактериальной петлей захватываем часть материала с колонии и помещаем в заранее приготовленную пластиковую пробирку на 0, 6 мл с 50 мкл Super. Q, и лизируем (5 мин, 95°С). Затем центрифугируем все пробирки 1 мин при 10 тыс об. Пробы готовы для дальнейшей работы.
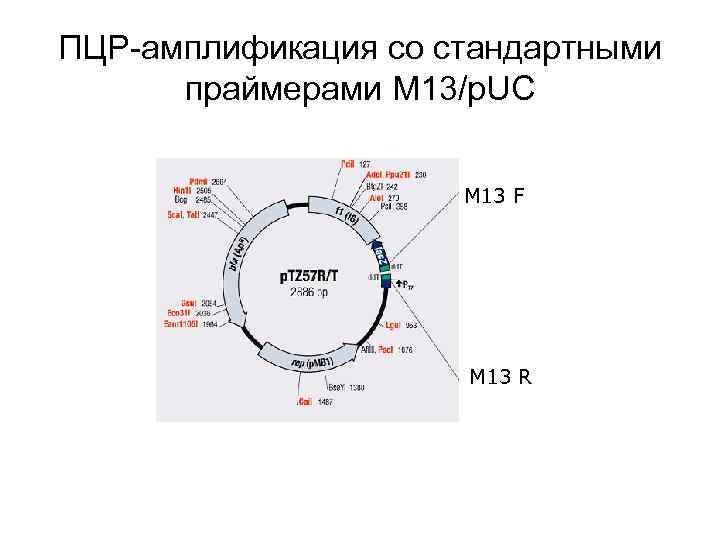
ПЦР-амплификация со стандартными праймерами M 13/p. UC M 13 F M 13 R
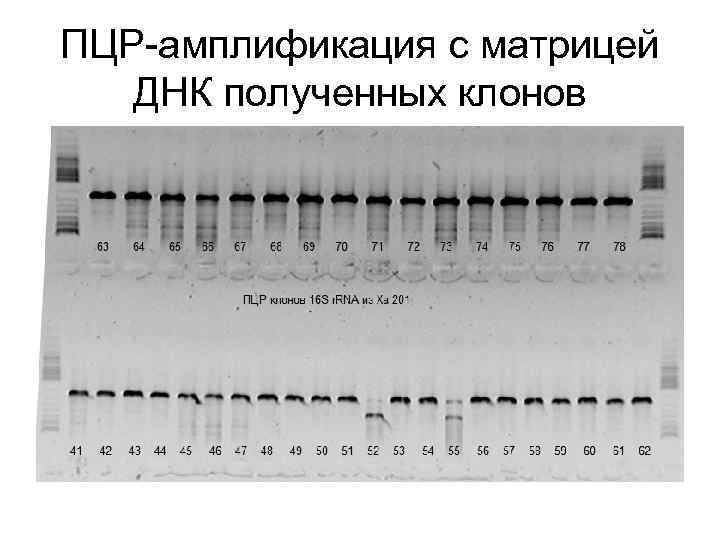
ПЦР-амплификация с матрицей ДНК полученных клонов

Рестрикционный анализ • наработанные фрагменты обрабатываются рестриктазами (# Rsa. I и Hin 6 I). Смесь содержит: 1/10 объема буфера для рестрикции (Buffer Y+/Tango. TM with BSA), 1/3 объема матрицы ДНК, 1/10 объема ферментов (Hin 6 I и Rsa. I), Super. Q Ферменты добавляем последними. Смесь готовим в 0, 6 мл пробирке. 2 ч при 37°С

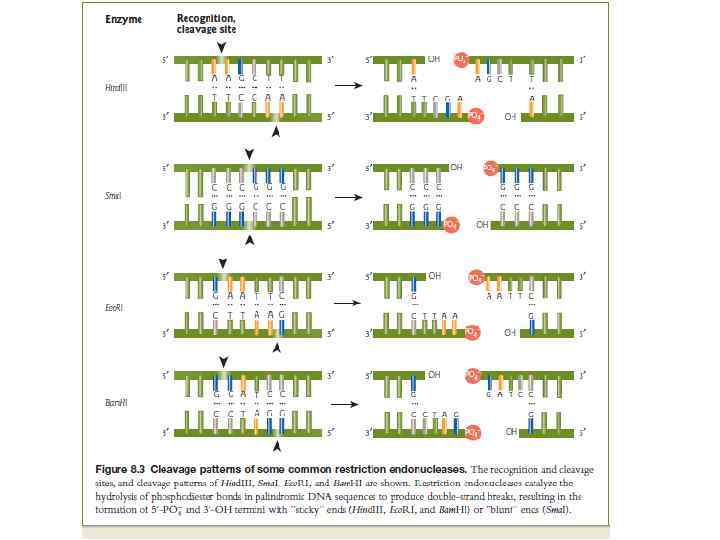
Эндонуклеазы рестрикции (или рестриктазы, лат. restrictio — ограничение) Это группа ферментов, катализирующих реакцию гидролиза нуклеиновых кислот. Каждая рестриктаза узнаёт определённый участок ДНК длиной от четырёх пар нуклеотидов и расщепляет нуклеотидную цепь внутри участка узнавания или вне его.
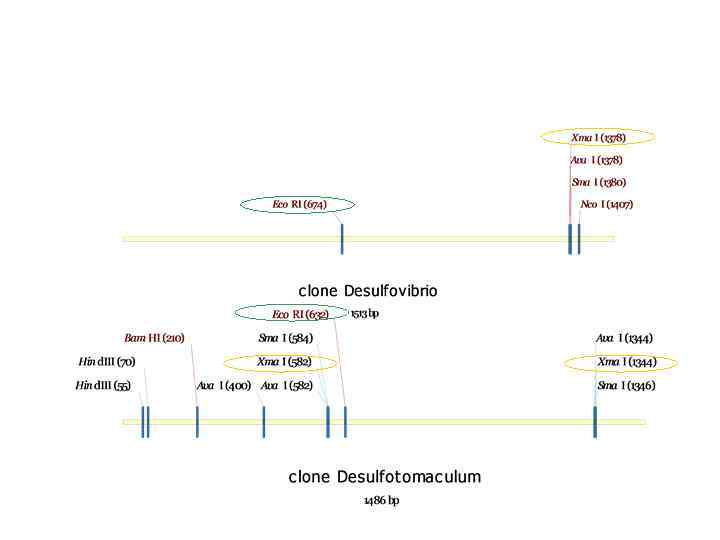
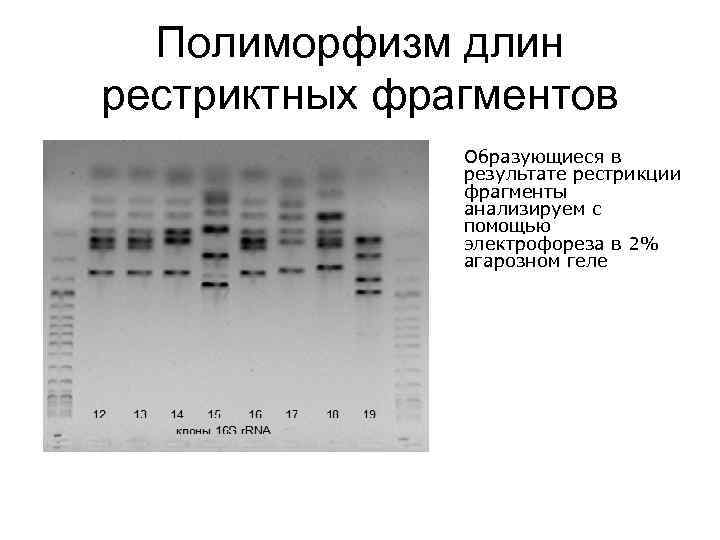
Полиморфизм длин рестриктных фрагментов Образующиеся в результате рестрикции фрагменты анализируем с помощью электрофореза в 2% агарозном геле
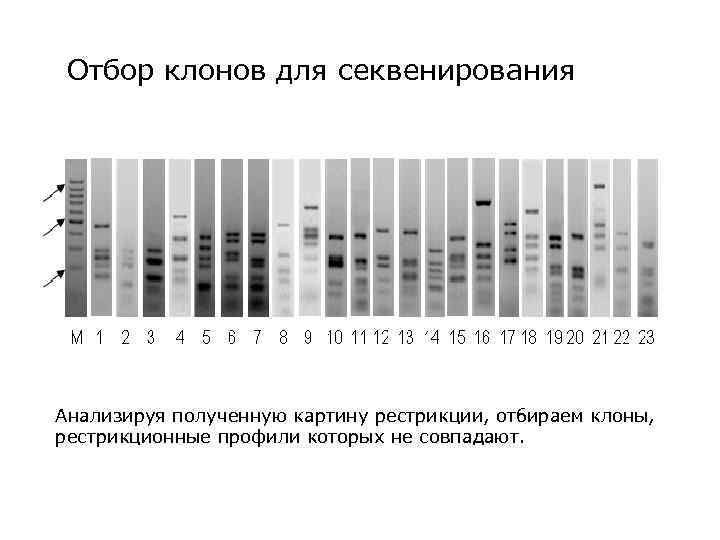
Отбор клонов для секвенирования Анализируя полученную картину рестрикции, отбираем клоны, рестрикционные профили которых не совпадают.

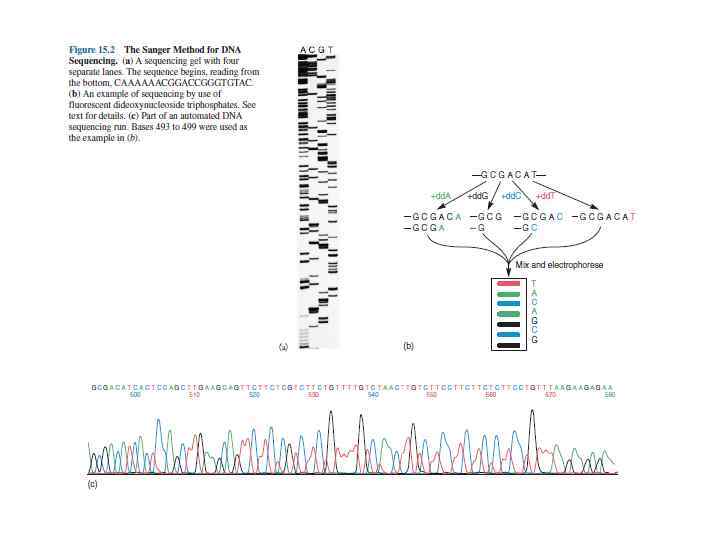
Секвенирование – определение нуклеотидной последовательности • Дезоксинуклеотидный метод, или метод «обрыва цепи» , был разработан Ф. Сенгером в 1977 году и в настоящее время широко используется для определения нуклеотидной последовательности ДНК. • При дидезоксисеквенировании происходит гибридизация синтетического олигонуклеотида длиной 17— 20 звеньев со специфическим участком одной из цепей секвенируемого участка. Этот олигонуклеотид является, поставляющим 3'гидроксильную группу для инициации синтеза цепи, комплементарной матрице.
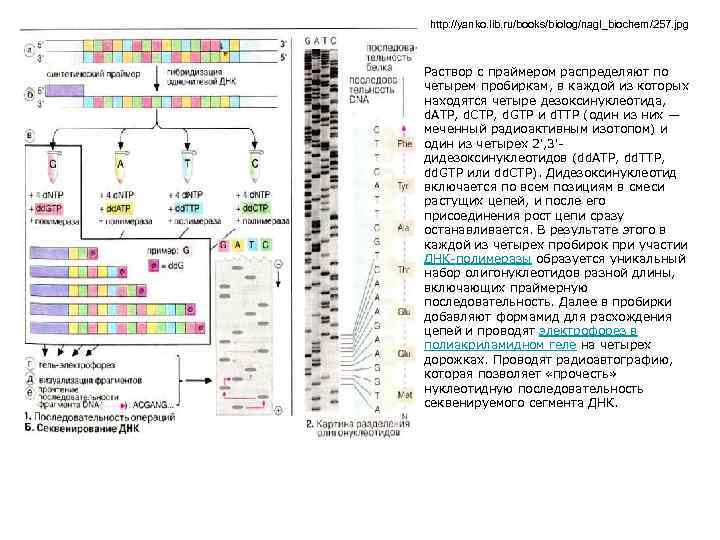
http: //yanko. lib. ru/books/biolog/nagl_biochem/257. jpg Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, d. ATP, d. CTP, d. GTP и d. TTP (один из них — меченный радиоактивным изотопом) и один из четырех 2', 3'дидезоксинуклеотидов (dd. ATP, dd. TTP, dd. GTP или dd. CTP). Дидезоксинуклеотид включается по всем позициям в смеси растущих цепей, и после его присоединения рост цепи сразу останавливается. В результате этого в каждой из четырех пробирок при участии ДНК-полимеразы образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. Далее в пробирки добавляют формамид для расхождения цепей и проводят электрофорез в полиакриламидном геле на четырех дорожках. Проводят радиоавтографию, которая позволяет «прочесть» нуклеотидную последовательность секвенируемого сегмента ДНК.

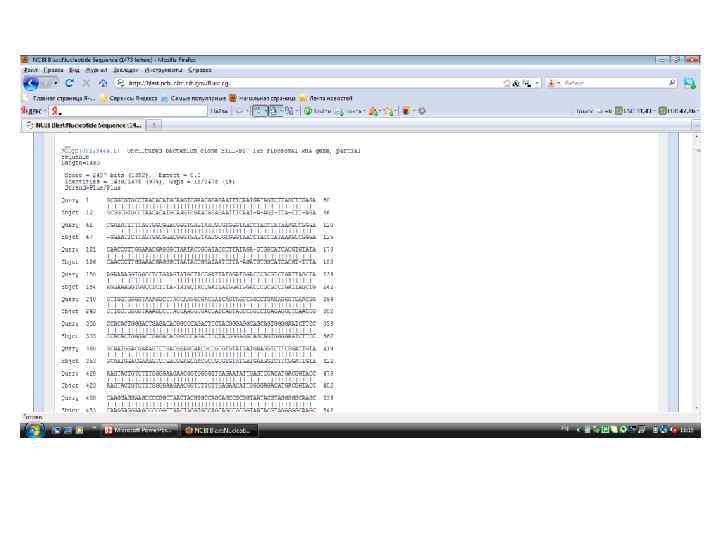
В результате получается линейное символьное описание, которое сжато резюмирует структуру молекулы ДНК. • GCGGCGTGCCTAACACATGCAAGTCGAACGGAGAATTTCAATGATAGTCTTAGCTT GAGACGAAATTTTTAGTGGCGGACGGGTGAGTAACGCGTGGGTAACCTACCCATAA AGCCGGGACAACCCTTGGAAACGAGGGCTAATACCGGATACCCTTATAGAGTGGC ATCACGTGTATAAGAAAAGGTGGCCTCTGAAGTATGCTACCGATTATGGACC CGCGTCTGATTAGCTAGTTGGTGGGGTAAAGGCCTACCAAGGCGACGATCAGTAG CCGGCCTGAGAGGGTGAACGGCCACACTGGGACTGAGACACGGCCCAGACTCCT ACGGGAGGCAGCAGTGGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAAC GCCGCGTGTATGATGAAGGTCTTCGGATTGTAAAGTACTGTCTTTGGGGAAGAACG GTGGGGTTGAGAATATTGAGTCCACATGACGGTACCCAAGGAGGAAGCCCCGGCT AACTACGTGCCAGCAGCCGCGGTAATACGTAGGGGGCAAGCGTTGTCCGGAATTA TTGGGCGTAAAGGGCGCGTAGGCGGATGCTTAAGTCCGGTGTGAAAGATCAGGGC TCAACCCTGAGAGTGCATCGGAAACTGGGTATCTTGAGGACAGGAGAGGAAAGTG GAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGA AGGCGACTTTCTGGACTGTAACTGACGCTGAGGCGCGAAAGCGTGGGGAGCAAAC AGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGAGTGCTAGGTGTAGAGG GTATCGACCCCTTCTGTGCCGCAGTTAACACAATAAGCACTCCGCCTGGGGAGTAC GGCCGCAAGGTTGAAACTCAAAGGAATTGACGGGGGCCCGCACAAGCGGTGGAG CATGTGGTTTAATTCGACGCAACGCGAAGAACCTTACCAGGGCTTGACATCCTCTG AACTTCCTAGAAATAGGGAGGTGCCCTTCGGGGAGCAGAGAGACAGGTGGTGCAT GGTTGTCGTCAGCTCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCGCAA CCCCTGTATTTAGTTGCTAACAAGTAAAGGTGAGCACTCTAGACTGCCGGTG ATAAACCGGAGGAAGGTGGGGATGACGTCAAATCATCATGCCCCTTATGTCTTGGG CTACACACGTGCTACAATGGCCGGTACAGACGGAAGCCGCGAGGTGAAGC AAATCCGAGAAAGCCGGTCTCAGTTCGGATTGCAGGCTGCAACTCGCCTGCATGAA GTCGGAATCGCTAGTAATCGCAGGTCAGCATACTGCGGTGAATACGTTCCCGGGC CTTGTACACACCGCCCGTCACACCACGAAAGTCTGCAACACCCGAAGCCGGTGAG GTAACCCGTAAGGGAGCTAGCCGTCGAAGGTGGGGC

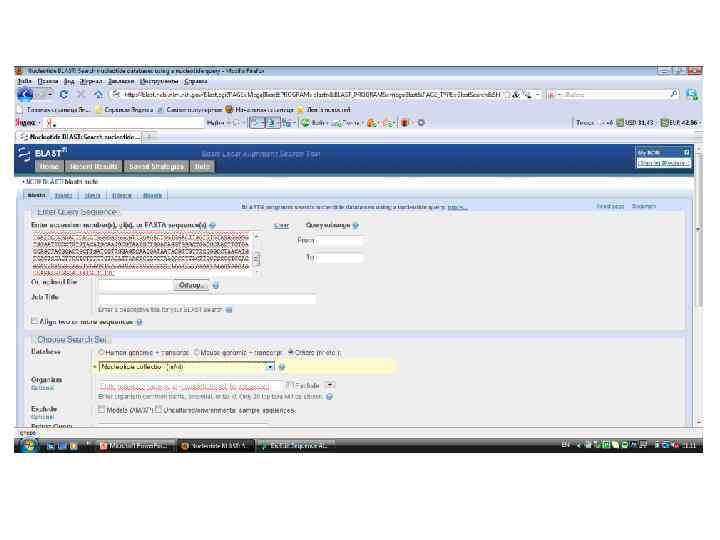
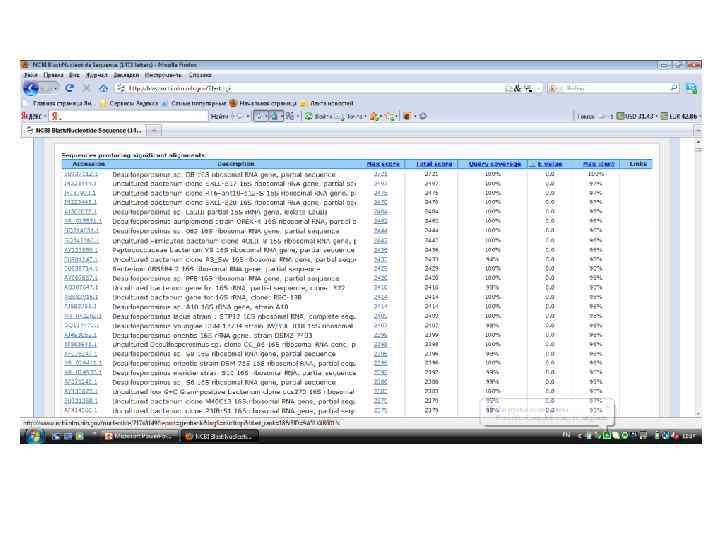
Основные программы для анализа сиквенсов • Bio. Edit - биологический редактор выравнивания и обработки последовательностей, написанный для Windows 95/98/NT/2000/XP • BLAST - семейство компьютерных программ, служащих для поиска гомологов белков или нуклеиновых кислот, для которых известна первичная структура (последовательность) или её фрагмент. Используя BLAST, можно сравнить имеющуюся последовательность с последовательностями из базы данных и найти последовательности предполагаемых гомологов.
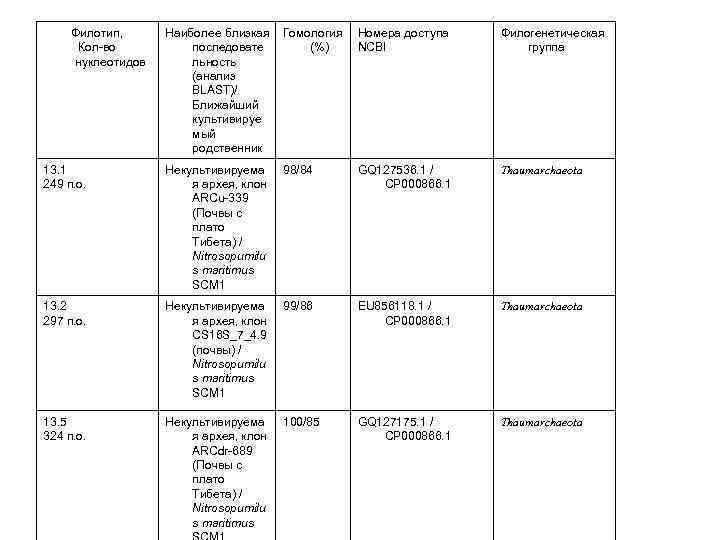
Филотип, Кол-во нуклеотидов Наиболее близкая Гомология Номера доступа последовате (%) NCBI льность (анализ BLAST)/ Ближайший культивируе мый родственник Филогенетическая группа 13. 1 249 п. о. Некультивируема я архея, клон ARCu-339 (Почвы с плато Тибета) / Nitrosopumilu s maritimus SCM 1 98/84 GQ 127536. 1 / CP 000866. 1 Thaumarchaeota 13. 2 297 п. о. Некультивируема я архея, клон CS 16 S_7_4. 9 (почвы) / Nitrosopumilu s maritimus SCM 1 99/86 EU 856118. 1 / CP 000866. 1 Thaumarchaeota 13. 5 324 п. о. Некультивируема я архея, клон ARCdr-689 (Почвы с плато Тибета) / Nitrosopumilu s maritimus 100/85 GQ 127175. 1 / CP 000866. 1 Thaumarchaeota

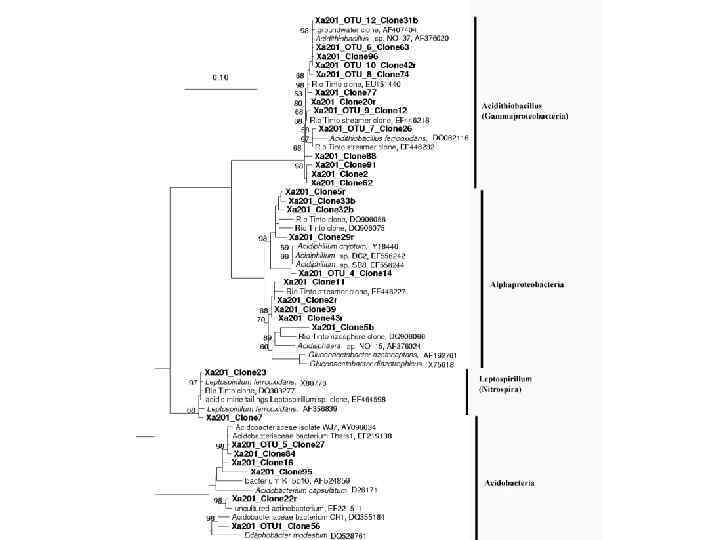
Результат филогенетического анализа генов 16 S р. РНК из пробы микробноводорослевого сообщества
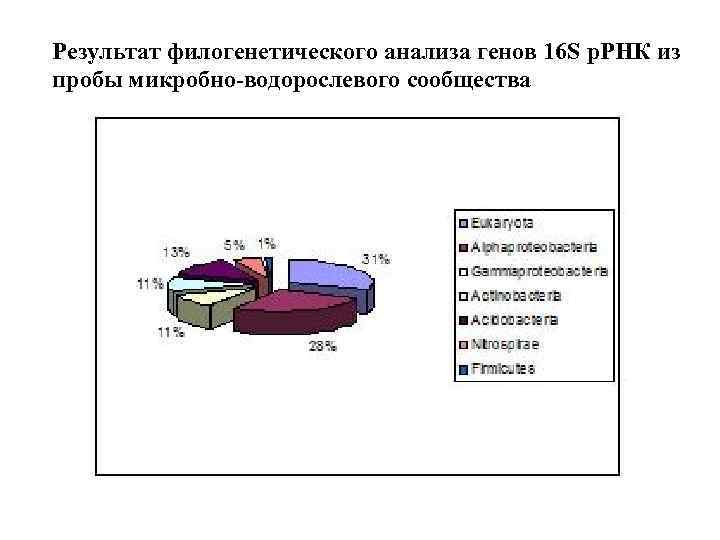
Результат филогенетического анализа генов 16 S р. РНК из пробы микробно-водорослевого сообщества
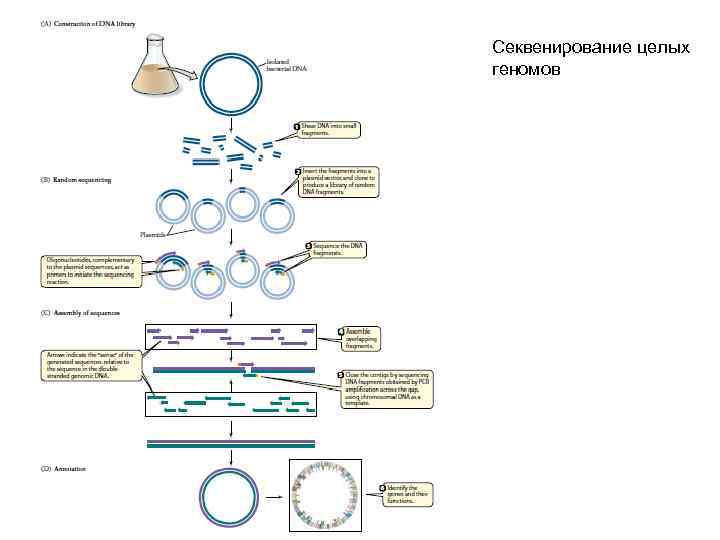
Секвенирование целых геномов

Вариант 1. 1. Для выделения чистых культур микроорганизмов используется метод: а) Метод Виноградского б) Метод Коха в) Метод Бейеринка Вариант 2. 1. Доля культивируемых микроорганизмов от их общего числа в природе составляет: а) ~1% б) ~ 5% в) ~ 10% г) ~ 50%

Вариант 1. 2. Выберите из предложенных вариантов флуоресцентные красители: а) Метиленовый синий б) Акридиновый оранжевый в) Основной красный г) DAPI Вариант 2. 2. Для прямого подсчета живых клеток используется следующий вид микроскопии: а) Люминесцентная б) Электронная в) Фазово-контрастная

Вариант 1. 3. Какие селективные условия нужно создать для получения накопительной культуры анаэробных фотосинтезирующих бактерий, относящихся к прототрофам? Вариант 2. 3. Какие селективные условия нужно создать для получения накопительной культуры аэробных азотфиксирующих бактерий, относящихся к ауксотрофам?

Вариант 1. 4. Перечислите группы микроорганизмов в колонке Виноградского в порядке уменьшения концентрации кислорода. Вариант 2. 4. Перечислите группы микроорганизмов в колонке Виноградского в порядке уменьшения концентрации сероводорода.
клонирование_ноябрь 2012.ppt