Tema_9_Sortuvannya_i_transport_bilkiv.ppt
- Количество слайдов: 29

Молекулярні механізми, які визначають локалізацію та руйнування білків

1. Сортування та модифікація білків. 2. Механізми контролю якості білків. Убіквітин-залежна система протеолізу в регульованій деградації білків. 3. Розщеплення білків в протеасомах і лізосомах
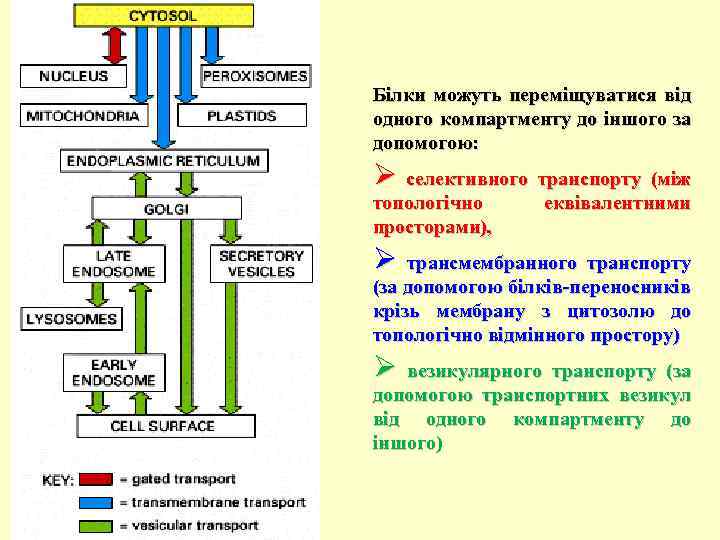
Білки можуть переміщуватися від одного компартменту до іншого за допомогою: Ø селективного транспорту (між топологічно просторами), еквівалентними Ø трансмембранного транспорту (за допомогою білків-переносників крізь мембрану з цитозолю до топологічно відмінного простору) Ø везикулярного транспорту (за допомогою транспортних везикул від одного компартменту до іншого)
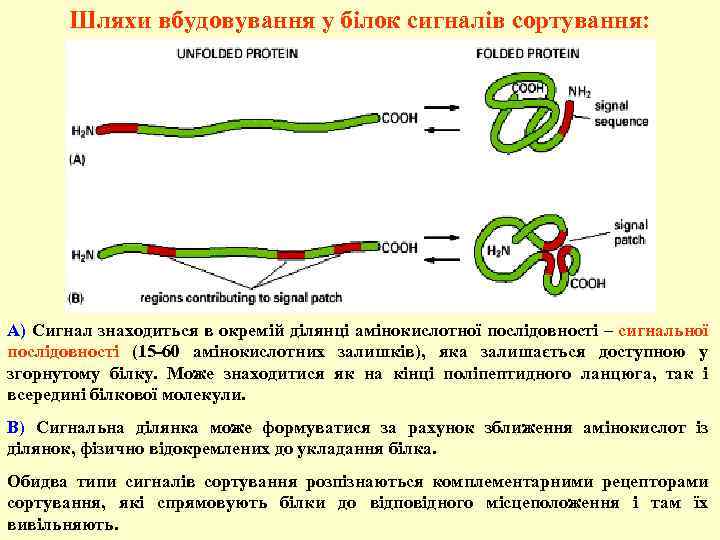
Шляхи вбудовування у білок сигналів сортування: А) Сигнал знаходиться в окремій ділянці амінокислотної послідовності – сигнальної послідовності (15 -60 амінокислотних залишків), яка залишається доступною у згорнутому білку. Може знаходитися як на кінці поліпептидного ланцюга, так і всередині білкової молекули. В) Сигнальна ділянка може формуватися за рахунок зближення амінокислот із ділянок, фізично відокремлених до укладання білка. Обидва типи сигналів сортування розпізнаються комплементарними рецепторами сортування, які спрямовують білки до відповідного місцеположення і там їх вивільняють.

Деякі типові сигнальні послідовності Функція сигналу Приклад сигнальної послідовності +H N-Met-Ser-Phe-Val-Ser-Leu-Leu-Val-GlyІмпорт в ЕР 3 Ile-Leu-Phe-Trp-Ala- Thr-Glu-Ala-Glu-Gln-Leu-Thr-Lys-Cys-Glu-Val-Phe-Gln. Утримання в люмені ЕР -Lys-Asp-Glu-Leu-COOІмпорт у мітохондрію Lys-Pro- +H 3 N-Met-Leu-Ser-Leu-Arg-Gln-Ser-Ile-Arg-Phe- Ala-Thr-Arg-Thr-Leu-Cys-Ser-Arg-Tyr-LeuІмпорт в ядро -Pro-Lys-Lys-Arg-Lys-Val- Імпорт у пероксисоми -Ser-Lys-Leu- Позитивно заряджені амінокислоти позначені червоним, негативно заряджені - червоним зеленим. Послідовність гідрофобних амінокислот позначена голубим. +H 3 N вказує на зеленим голубим аміно-кінець послідовності; COO- вказує на карбоксильний кінець послідовності.
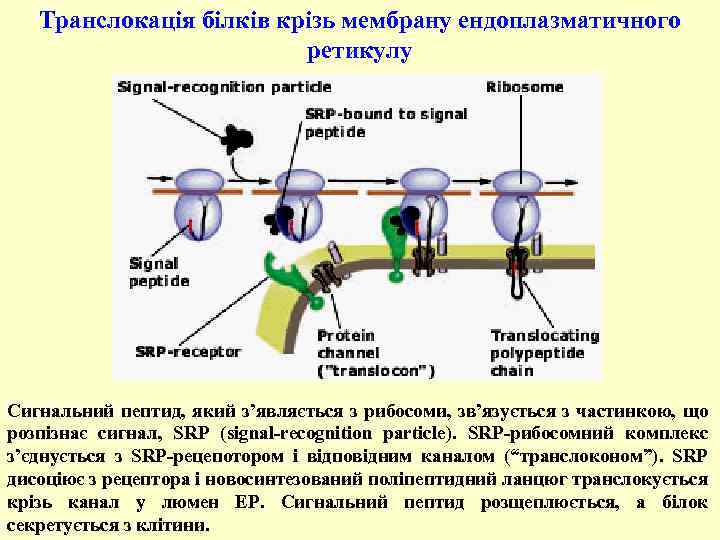
Транслокація білків крізь мембрану ендоплазматичного ретикулу Сигнальний пептид, який з’являється з рибосоми, зв’язується з частинкою, що розпізнає сигнал, SRP (signal-recognition particle). SRP-рибосомний комплекс з’єднується з SRP-рецепотором і відповідним каналом (“транслоконом”). SRP дисоціює з рецептора і новосинтезований поліпептидний ланцюг транслокується крізь канал у люмен ЕР. Сигнальний пептид розщеплюється, а білок секретується з клітини.
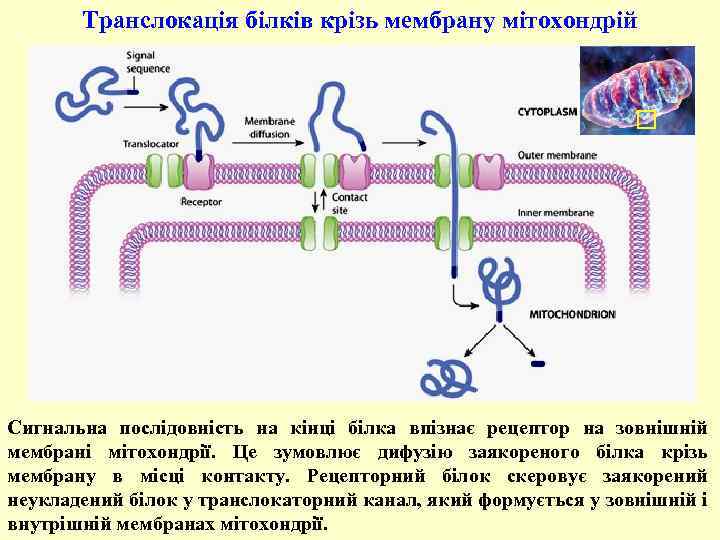
Транслокація білків крізь мембрану мітохондрій Сигнальна послідовність на кінці білка впізнає рецептор на зовнішній мембрані мітохондрії. Це зумовлює дифузію заякореного білка крізь мембрану в місці контакту. Рецепторний білок скеровує заякорений неукладений білок у транслокаторний канал, який формується у зовнішній і внутрішній мембранах мітохондрії.
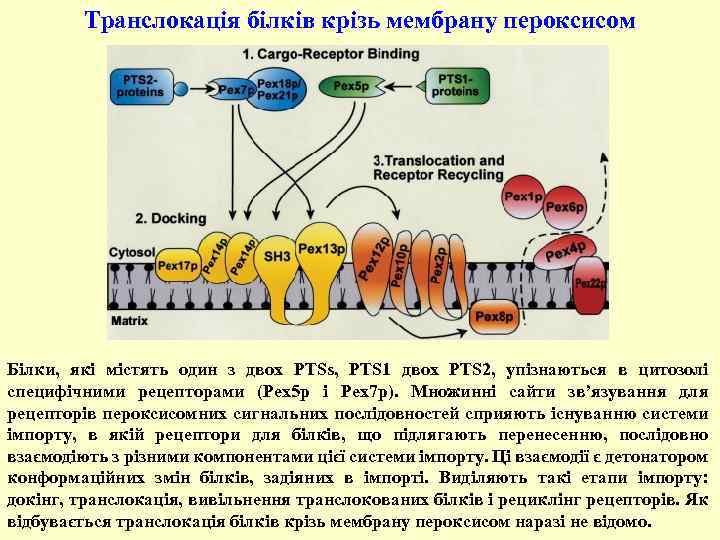
Транслокація білків крізь мембрану пероксисом Білки, які містять один з двох PTSs, PTS 1 двох PTS 2, упізнаються в цитозолі специфічними рецепторами (Pex 5 p і Pex 7 p). Множинні сайти зв’язування для рецепторів пероксисомних сигнальних послідовностей сприяють існуванню системи імпорту, в якій рецептори для білків, що підлягають перенесенню, послідовно взаємодіють з різними компонентами цієї системи імпорту. Ці взаємодії є детонатором конформаційних змін білків, задіяних в імпорті. Виділяють такі етапи імпорту: докінг, транслокація, вивільнення транслокованих білків і рециклінг рецепторів. Як відбувається транслокація білків крізь мембрану пероксисом наразі не відомо.
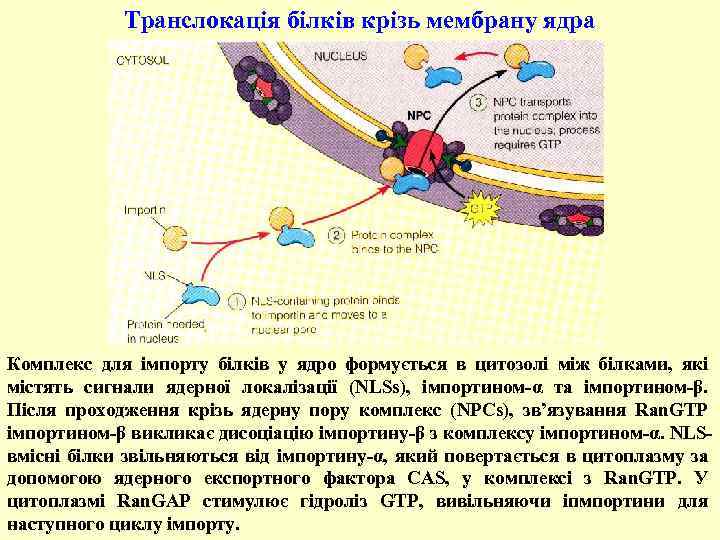
Транслокація білків крізь мембрану ядра Комплекс для імпорту білків у ядро формується в цитозолі між білками, які містять сигнали ядерної локалізації (NLSs), імпортином-α та імпортином-β. Після проходження крізь ядерну пору комплекс (NPCs), зв’язування Ran. GTP імпортином-β викликає дисоціацію імпортину-β з комплексу імпортином-α. NLSвмісні білки звільняються від імпортину-α, який повертається в цитоплазму за допомогою ядерного експортного фактора CAS, у комплексі з Ran. GTP. У цитоплазмі Ran. GAP стимулює гідроліз GTP, вивільняючи іпмпортини для наступного циклу імпорту.
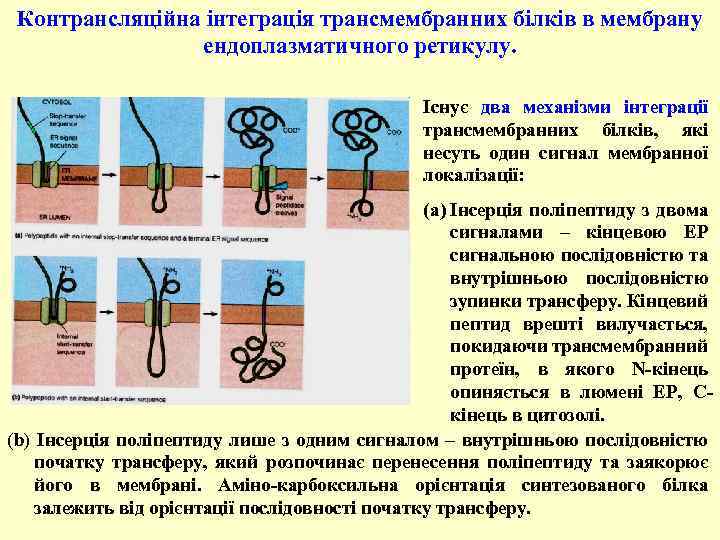
Контрансляційна інтеграція трансмембранних білків в мембрану ендоплазматичного ретикулу. Існує два механізми інтеграції трансмембранних білків, які несуть один сигнал мембранної локалізації: (a) Інсерція поліпептиду з двома сигналами – кінцевою ЕР сигнальною послідовністю та внутрішньою послідовністю зупинки трансферу. Кінцевий пептид врешті вилучається, покидаючи трансмембранний протеїн, в якого N-кінець опиняється в люмені ЕР, Cкінець в цитозолі. (b) Інсерція поліпептиду лише з одним сигналом – внутрішньою послідовністю початку трансферу, який розпочинає перенесення поліпептиду та заякорює його в мембрані. Аміно-карбоксильна орієнтація синтезованого білка залежить від орієнтації послідовності початку трансферу.
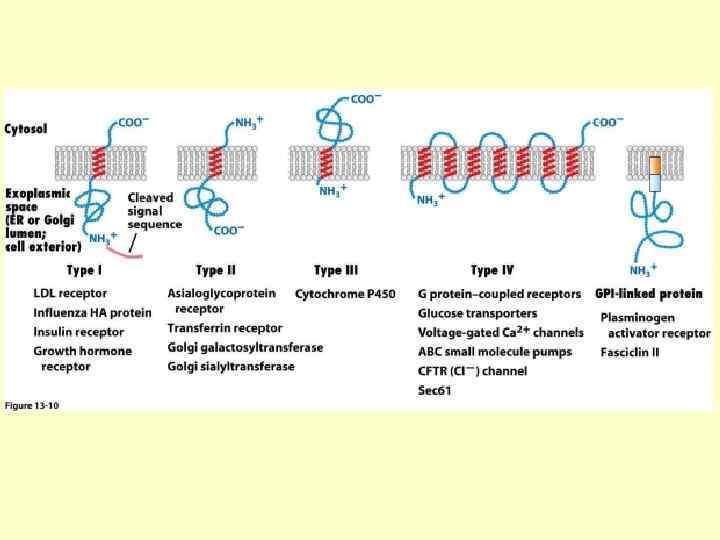
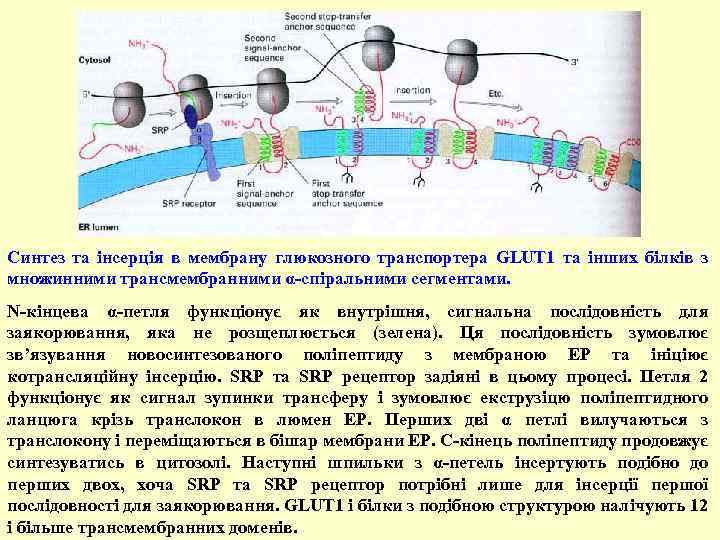
Синтез та інсерція в мембрану глюкозного транспортера GLUT 1 та інших білків з множинними трансмембранними α-спіральними сегментами. N-кінцева α-петля функціонує як внутрішня, сигнальна послідовність для заякорювання, яка не розщеплюється (зелена). Ця послідовність зумовлює зв’язування новосинтезованого поліпептиду з мембраною ЕР та ініціює котрансляційну інсерцію. SRP та SRP рецептор задіяні в цьому процесі. Петля 2 функціонує як сигнал зупинки трансферу і зумовлює екструзіцю поліпептидного ланцюга крізь транслокон в люмен ЕР. Перших дві α петлі вилучаються з транслокону і переміщаються в бішар мембрани ЕР. C-кінець поліпептиду продовжує синтезуватись в цитозолі. Наступні шпильки з α-петель інсертують подібно до перших двох, хоча SRP та SRP рецептор потрібні лише для інсерції першої послідовності для заякорювання. GLUT 1 і білки з подібною структурою налічують 12 і більше трансмембранних доменів.
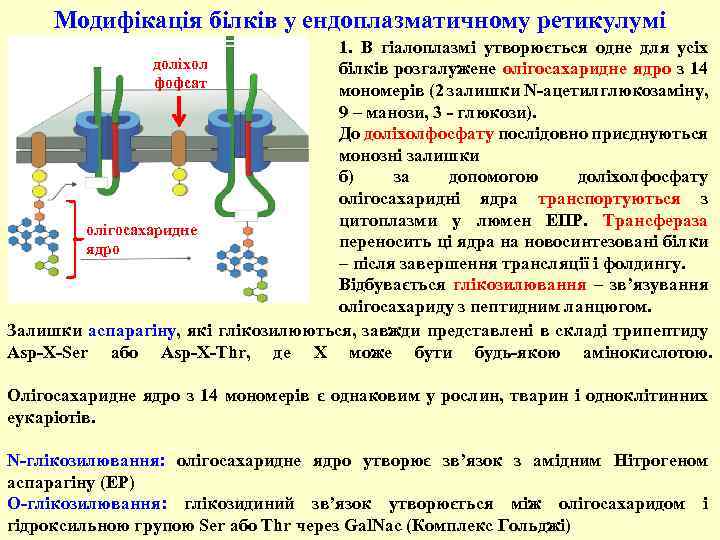
Модифікація білків у ендоплазматичному ретикулумі 1. В гіалоплазмі утворюється одне для усіх доліхол білків розгалужене олігосахаридне ядро з 14 фофсат мономерів (2 залишки N-ацетилглюкозаміну, 9 – манози, 3 - глюкози). До доліхолфосфату послідовно приєднуються монозні залишки б) за допомогою доліхолфосфату олігосахаридні ядра транспортуються з цитоплазми у люмен ЕПР. Трансфераза олігосахаридне переносить ці ядра на новосинтезовані білки ядро – після завершення трансляції і фолдингу. Відбувається глікозилювання – зв’язування олігосахариду з пептидним ланцюгом. Залишки аспарагіну, які глікозилюються, завжди представлені в складі трипептиду Аsp-X-Ser або Аsp-X-Thr, де X може бути будь-якою амінокислотою. Олігосахаридне ядро з 14 мономерів є однаковим у рослин, тварин і одноклітинних еукаріотів. N-глікозилювання: олігосахаридне ядро утворює зв’язок з амідним Нітрогеном аспарагіну (ЕР) O-глікозилювання: глікозидиний зв’язок утворюється між олігосахаридом і гідроксильною групою Ser або Thr через Gal. Nac (Комплекс Гольджі)
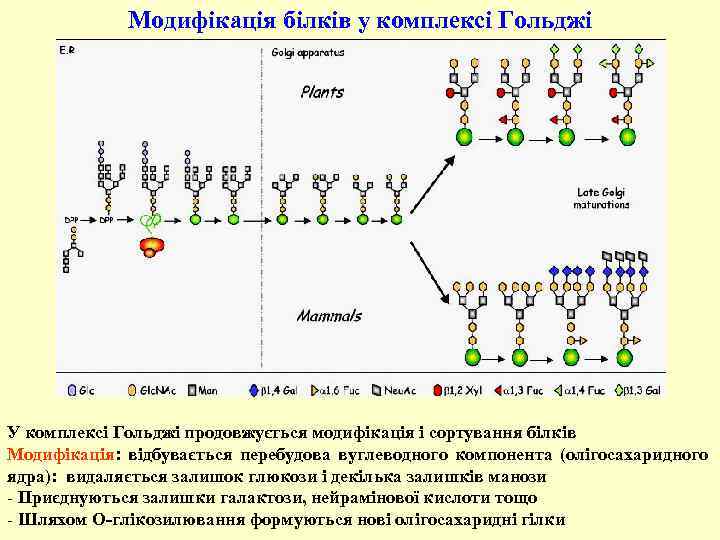
Модифікація білків у комплексі Гольджі У комплексі Гольджі продовжується модифікація і сортування білків Модифікація: відбувається перебудова вуглеводного компонента (олігосахаридного ядра): видаляється залишок глюкози і декілька залишків манози - Приєднуються залишки галактози, нейрамінової кислоти тощо - Шляхом О-глікозилювання формуються нові олігосахаридні гілки
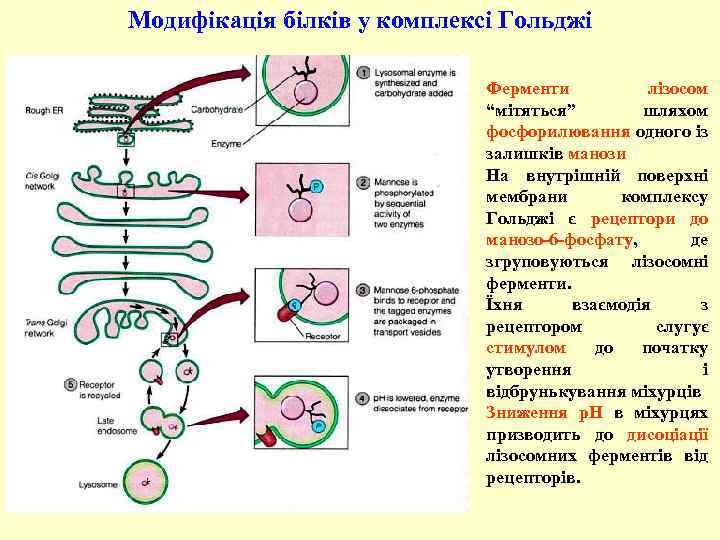
Модифікація білків у комплексі Гольджі Ферменти лізосом “мітяться” шляхом фосфорилювання одного із залишків манози На внутрішній поверхні мембрани комплексу Гольджі є рецептори до манозо-6 -фосфату, де згруповуються лізосомні ферменти. Їхня взаємодія з рецептором слугує стимулом до початку утворення і відбрунькування міхурців Зниження р. Н в міхурцях призводить до дисоціації лізосомних ферментів від рецепторів.
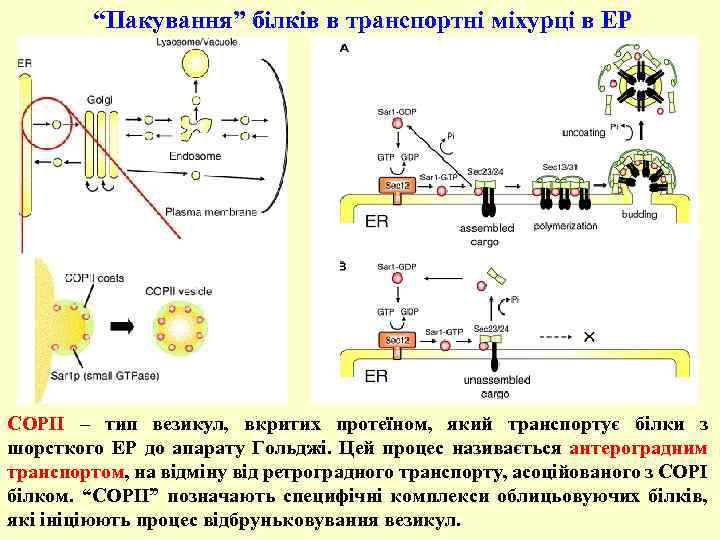
“Пакування” білків в транспортні міхурці в ЕР COPII – тип везикул, вкритих протеїном, який транспортує білки з шорсткого ЕР до апарату Гольджі. Цей процес називається антероградним транспортом, на відміну від ретроградного транспорту, асоційованого з COPI білком. “COPII” позначають специфічні комплекси облицьовуючих білків, які ініціюють процес відбруньковування везикул.
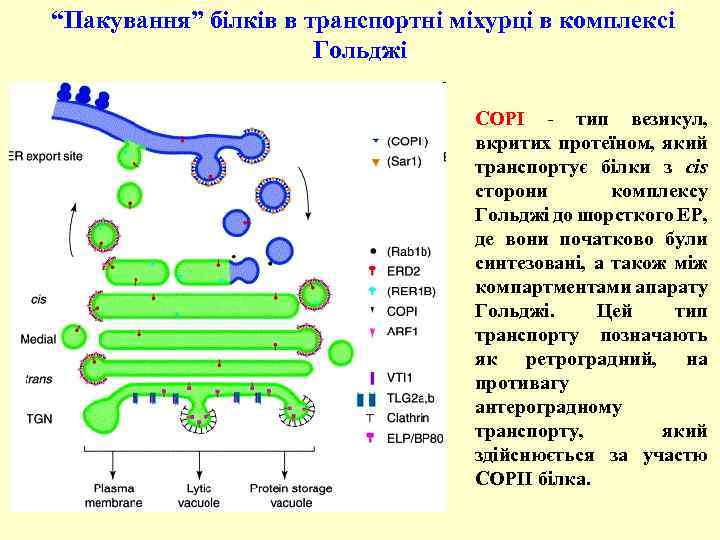
“Пакування” білків в транспортні міхурці в комплексі Гольджі COPI - тип везикул, вкритих протеїном, який транспортує білки з cis сторони комплексу Гольджі до шорсткого ЕР, де вони початково були синтезовані, а також між компартментами апарату Гольджі. Цей тип транспорту позначають як ретроградний, на противагу антероградному транспорту, який здійснюється за участю COPII білка.
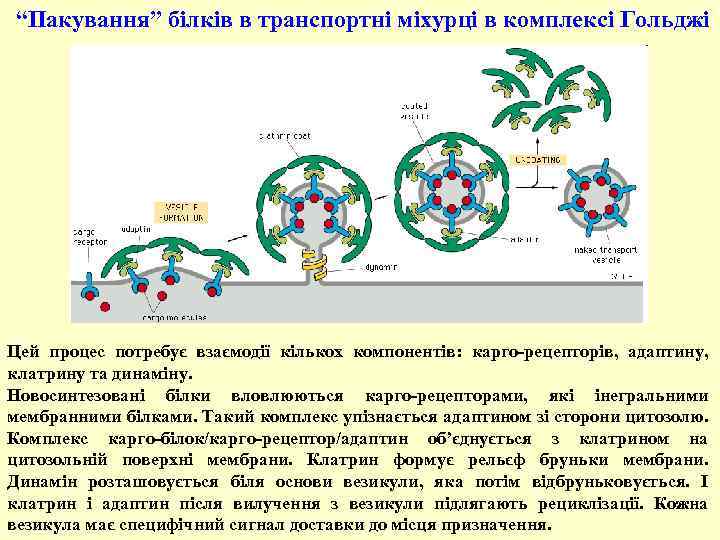
“Пакування” білків в транспортні міхурці в комплексі Гольджі Цей процес потребує взаємодії кількох компонентів: карго-рецепторів, адаптину, клатрину та динаміну. Новосинтезовані білки вловлюються карго-рецепторами, які інегральними мембранними білками. Такий комплекс упізнається адаптином зі сторони цитозолю. Комплекс карго-білок/карго-рецептор/адаптин об’єднується з клатрином на цитозольній поверхні мембрани. Клатрин формує рельєф бруньки мембрани. Динамін розташовується біля основи везикули, яка потім відбруньковується. І клатрин і адаптин після вилучення з везикули підлягають рециклізації. Кожна везикула має специфічний сигнал доставки до місця призначення.
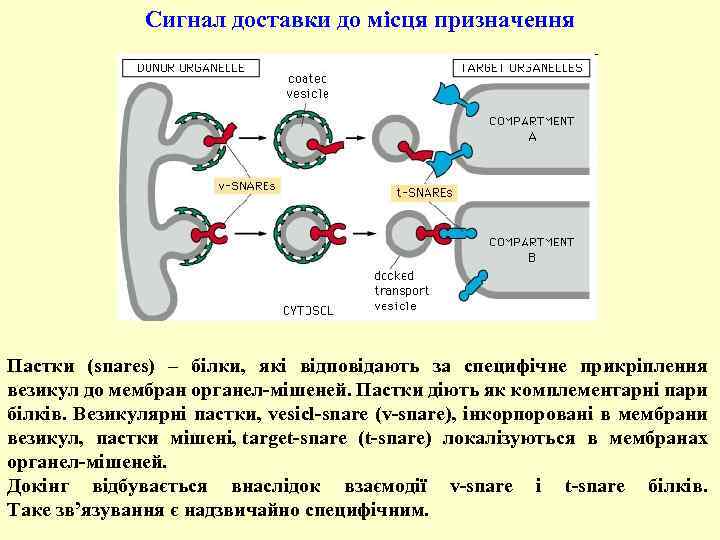
Сигнал доставки до місця призначення Пастки (snares) – білки, які відповідають за специфічне прикріплення везикул до мембран органел-мішеней. Пастки діють як комплементарні пари білків. Везикулярні пастки, vesicl-snare (v-snare), інкорпоровані в мембрани везикул, пастки мішені, target-snare (t-snare) локалізуються в мембранах органел-мішеней. Докінг відбувається внаслідок взаємодії v-snare і t-snare білків. Таке зв’язування є надзвичайно специфічним.
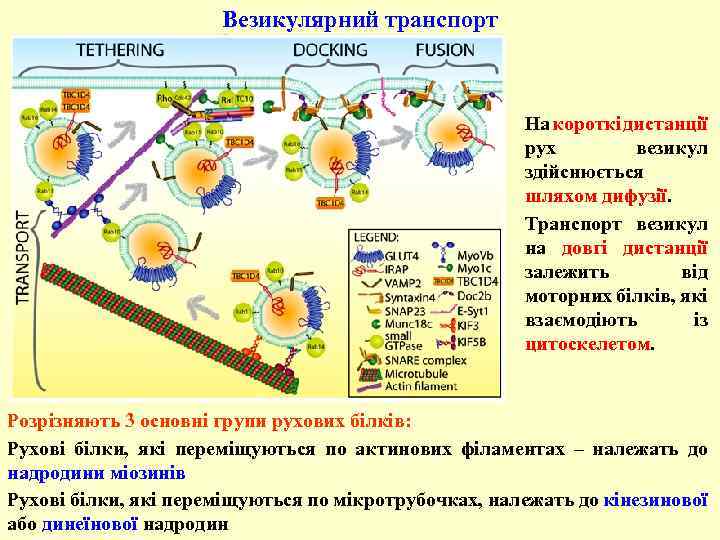
Везикулярний транспорт На короткі дистанції рух везикул здійснюється шляхом дифузії. Транспорт везикул на довгі дистанції залежить від моторних білків, які взаємодіють із цитоскелетом. Розрізняють 3 основні групи рухових білків: Рухові білки, які переміщуються по актинових філаментах – належать до надродини міозинів Рухові білки, які переміщуються по мікротрубочках, належать до кінезинової або динеїнової надродин
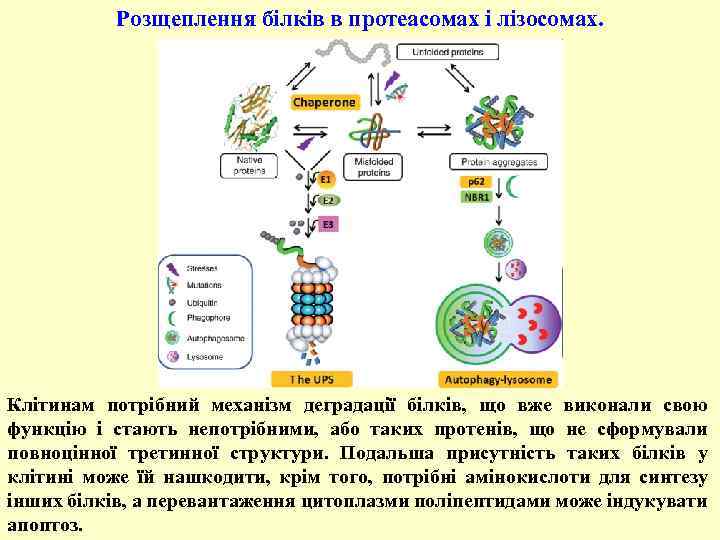
Розщеплення білків в протеасомах і лізосомах. Клітинам потрібний механізм деградації білків, що вже виконали свою функцію і стають непотрібними, або таких протенів, що не сформували повноцінної третинної структури. Подальша присутність таких білків у клітині може їй нашкодити, крім того, потрібні амінокислоти для синтезу інших білків, а перевантаження цитоплазми поліпептидами може індукувати апоптоз.
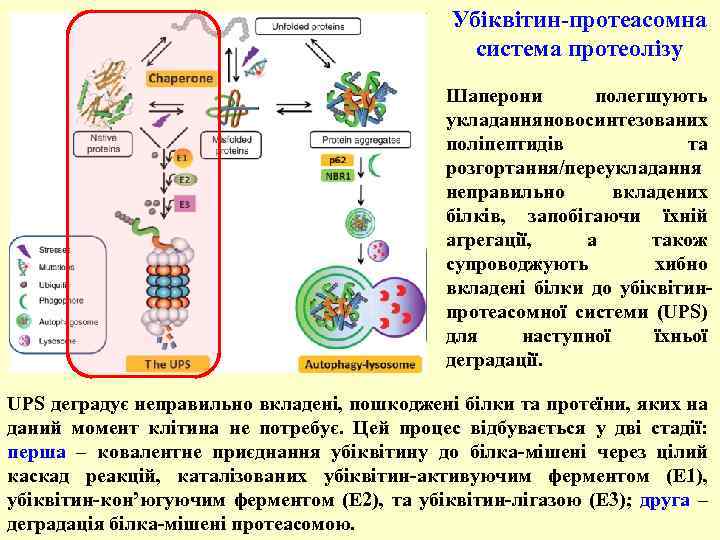
Убіквітин-протеасомна система протеолізу Шаперони полегшують укладання овосинтезованих н поліпептидів та розгортання/переукладання неправильно вкладених білків, запобігаючи їхній агрегації, а також супроводжують хибно вкладені білки до убіквітинпротеасомної системи (UPS) для наступної їхньої деградації. UPS деградує неправильно вкладені, пошкоджені білки та протеїни, яких на даний момент клітина не потребує. Цей процес відбувається у дві стадії: перша – ковалентне приєднання убіквітину до білка-мішені через цілий каскад реакцій, каталізованих убіквітин-активуючим ферментом (E 1), убіквітин-кон’югуючим ферментом (E 2), та убіквітин-лігазою (E 3); друга – деградація білка-мішені протеасомою.

Механізми контролю якості білків. Убіквітин-залежна система протеолізу в регульованій деградації білків. В еукаріотів розпад білків з нетривалим часом життя є убіквітин-залежним Убіквітин (від англ. ubiquitous - «присутній всюди» ) - висококонсервативний малий регуляторний білок, що у великій кількості присутній у всіх клітинах еукаріотів. Цей білок здатний формувати ковалентні зв'язки з іншими білками, де полімерізується з утворенням ізопептидних зв'язків у вигляді груп з кількох молекул убіківтину. Цей процес називається убіквітинуванням, і є формою посттрансляційної модифікації білків. Головною ціллю убіквітинювання є направлення білків до протеасоми для деградації, хоча крім того, убіквітинювання контролює функцію та внутріклітинну локалізацію багатьох білків.
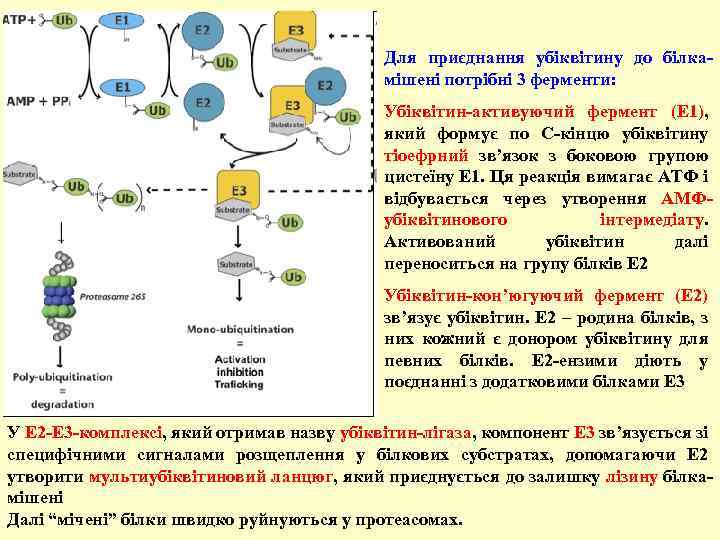
Для приєднання убіквітину до білкамішені потрібні 3 ферменти: Убіквітин-активуючий фермент (Е 1), який формує по С-кінцю убіквітину тіоефрний зв’язок з боковою групою цистеїну Е 1. Ця реакція вимагає АТФ і відбувається через утворення АМФубіквітинового інтермедіату. Активований убіквітин далі переноситься на групу білків Е 2 Убіквітин-кон’югуючий фермент (Е 2) зв’язує убіквітин. Е 2 – родина білків, з них кожний є донором убіквітину для певних білків. Е 2 -ензими діють у поєднанні з додатковими білками Е 3 У Е 2 -Е 3 -комплексі, який отримав назву убіквітин-лігаза, компонент Е 3 зв’язується зі специфічними сигналами розщеплення у білкових субстратах, допомагаючи Е 2 утворити мультиубіквітиновий ланцюг, який приєднується до залишку лізину білкамішені Далі “мічені” білки швидко руйнуються у протеасомах.
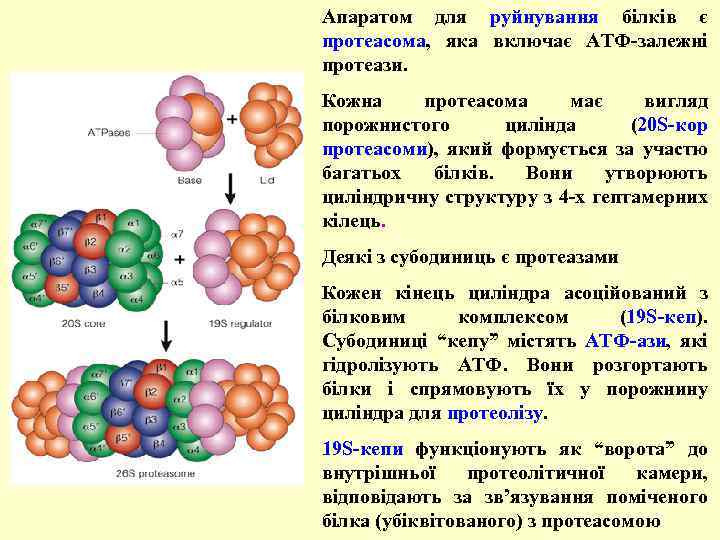
Апаратом для руйнування білків є протеасома, яка включає АТФ-залежні протеази. Кожна протеасома має вигляд порожнистого цилінда (20 S-кор протеасоми), який формується за участю багатьох білків. Вони утворюють циліндричну структуру з 4 -х гептамерних кілець. Деякі з субодиниць є протеазами Кожен кінець циліндра асоційований з білковим комплексом (19 S-кеп). Субодиниці “кепу” містять АТФ-ази, які гідролізують АТФ. Вони розгортають білки і спрямовують їх у порожнину циліндра для протеолізу. 19 S-кепи функціонують як “ворота” до внутрішньої протеолітичної камери, відповідають за зв’язування поміченого білка (убіквітованого) з протеасомою

Убіквітин-залежний протеоліз є лише в еукаріотів, хоча протеасоми є і в прокаріотів і у архей, але в них кепуюча субодиниця відразу впізнає субстрат, таким чином число субстратів є сильно обмеженим. При убіквітинуванні число субстратів значно більше, внаслідок наявності великої кількості ферментів і можливості їх комбінування. Другою перевагою убіквітинування є те, що воно оборотне. Для напрямлення білка у протеасому недостатньо одного залишку убіквітину, поки синтезується поліубіквітиновий ланцюг клітина має час «подумати» . Таким чином забезпечується гнучкість системи протеолізу.
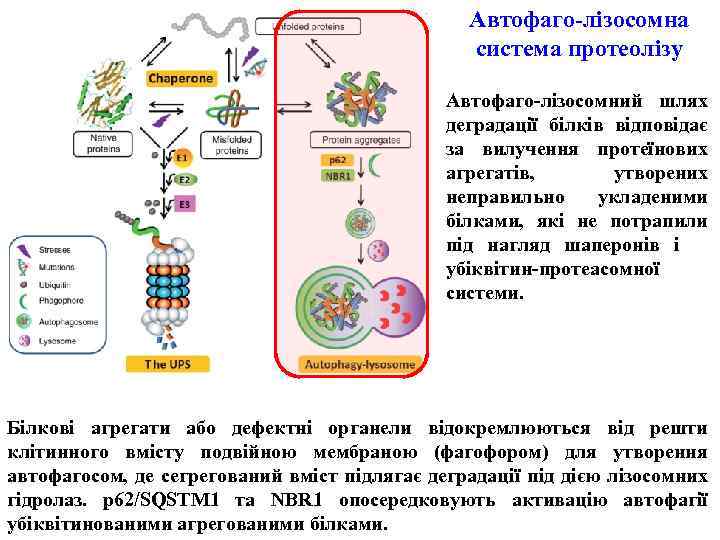
Автофаго-лізосомна система протеолізу Автофаго-лізосомний шлях деградації білків відповідає за вилучення протеїнових агрегатів, утворених неправильно укладеними білками, які не потрапили під нагляд шаперонів і убіквітин-протеасомної системи. Білкові агрегати або дефектні органели відокремлюються від решти клітинного вмісту подвійною мембраною (фагофором) для утворення автофагосом, де сегрегований вміст підлягає деградації під дією лізосомних гідролаз. p 62/SQSTM 1 та NBR 1 опосередковують активацію автофагії убіквітинованими агрегованими білками.
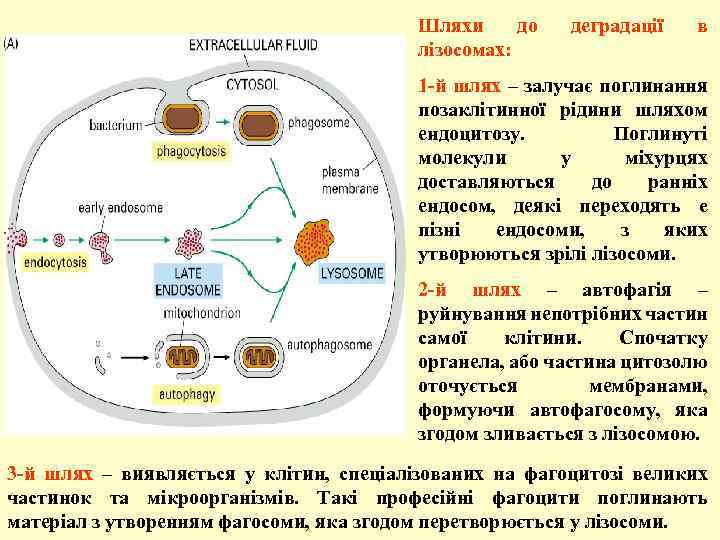
Шляхи до лізосомах: деградації в 1 -й шлях – залучає поглинання позаклітинної рідини шляхом ендоцитозу. Поглинуті молекули у міхурцях доставляються до ранніх ендосом, деякі переходять e пізні ендосоми, з яких утворюються зрілі лізосоми. 2 -й шлях – автофагія – руйнування непотрібних частин самої клітини. Спочатку органела, або частина цитозолю оточується мембранами, формуючи автофагосому, яка згодом зливається з лізосомою. 3 -й шлях – виявляється у клітин, спеціалізованих на фагоцитозі великих частинок та мікроорганізмів. Такі професійні фагоцити поглинають матеріал з утворенням фагосоми, яка згодом перетворюється у лізосоми.
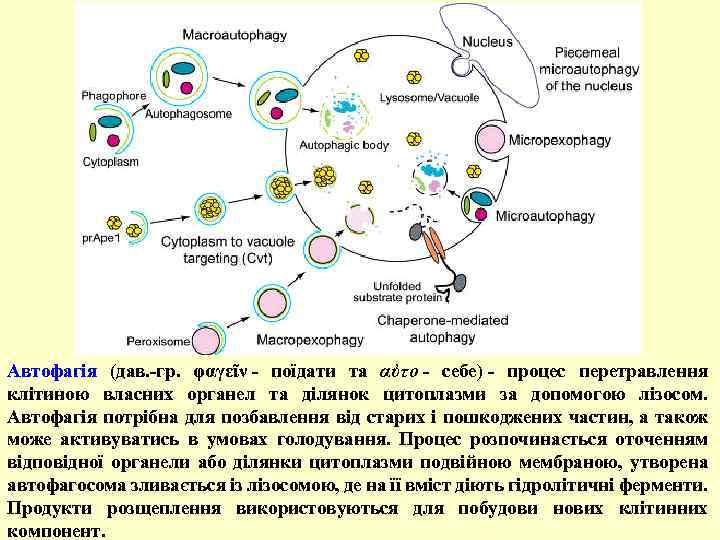
Автофагія (дав. -гр. φαγεῖν - поїдати та αὐτο - себе) - процес перетравлення клітиною власних органел та ділянок цитоплазми за допомогою лізосом. Автофагія потрібна для позбавлення від старих і пошкоджених частин, а також може активуватись в умовах голодування. Процес розпочинається оточенням відповідної органели або ділянки цитоплазми подвійною мембраною, утворена автофагосома зливається із лізосомою, де на її вміст діють гідролітичні ферменти. Продукти розщеплення використовуються для побудови нових клітинних компонент.
Tema_9_Sortuvannya_i_transport_bilkiv.ppt