2. Изомерия.ppt
- Количество слайдов: 42

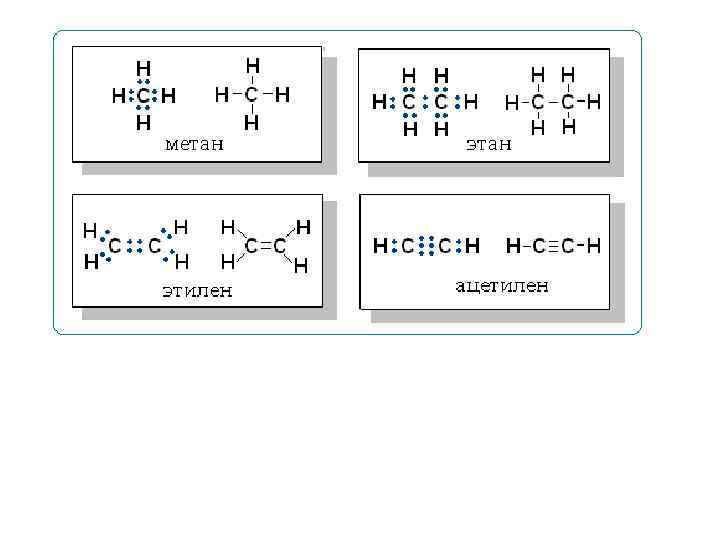

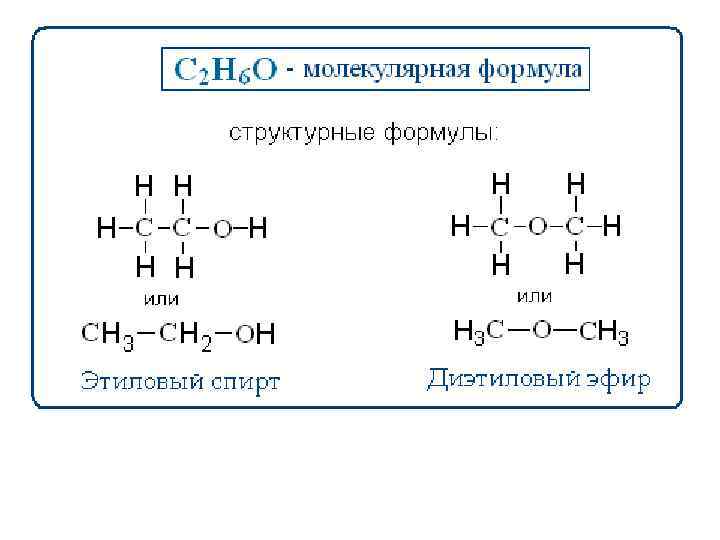
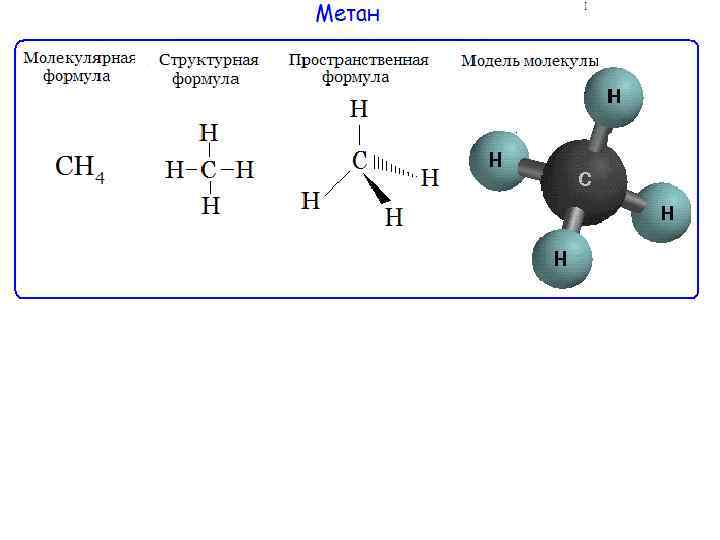
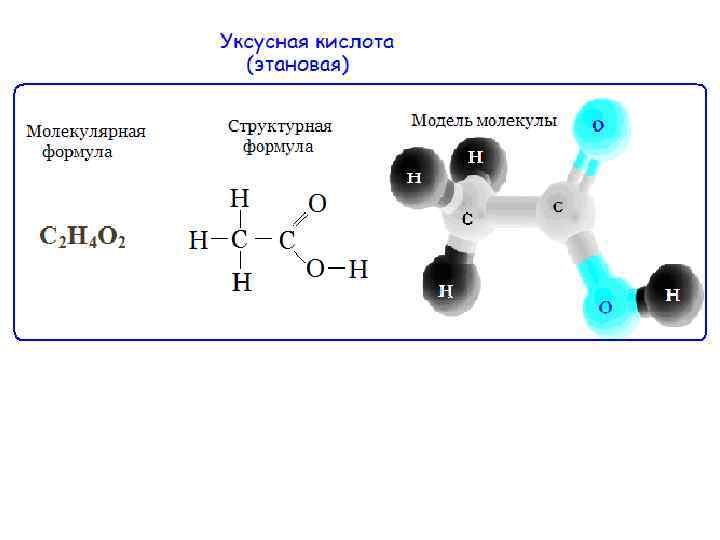
Молекулярная, или брутто-формула, показывает, какие атомы и в каком количестве входят в состав молекулы, например С 6 Н 6 СН 4 О С 2 Н 3 Сl. O Молекулярная формула не отражает строения молекулы Структурная формула должна отражать: природу атомов, которые входят в состав молекулы, их количество и последовательность соединения их между собой, а также тип связи между атомами.
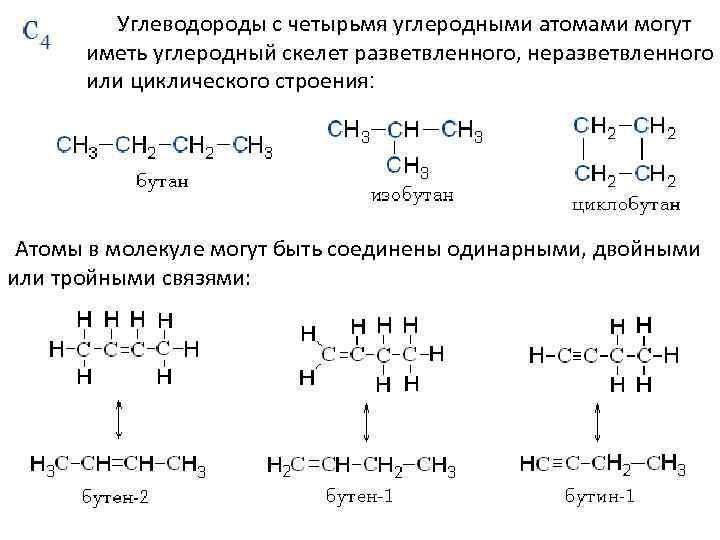
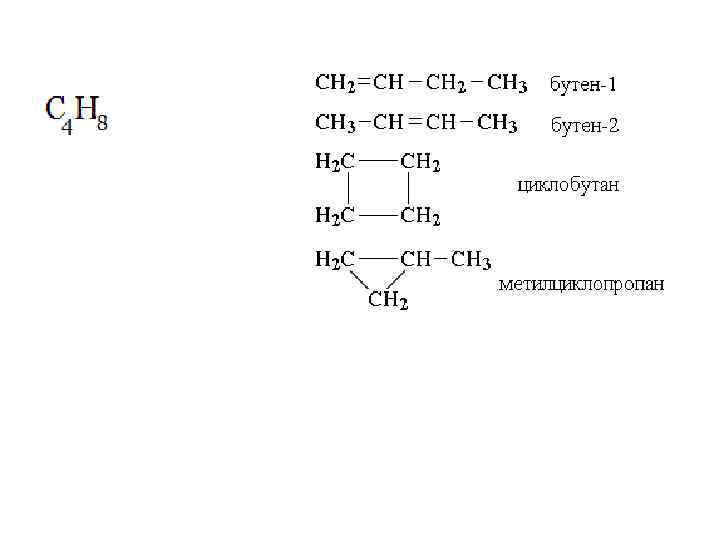
Углеводороды с четырьмя углеродными атомами могут иметь углеродный скелет разветвленного, неразветвленного или циклического строения: Атомы в молекуле могут быть соединены одинарными, двойными или тройными связями:
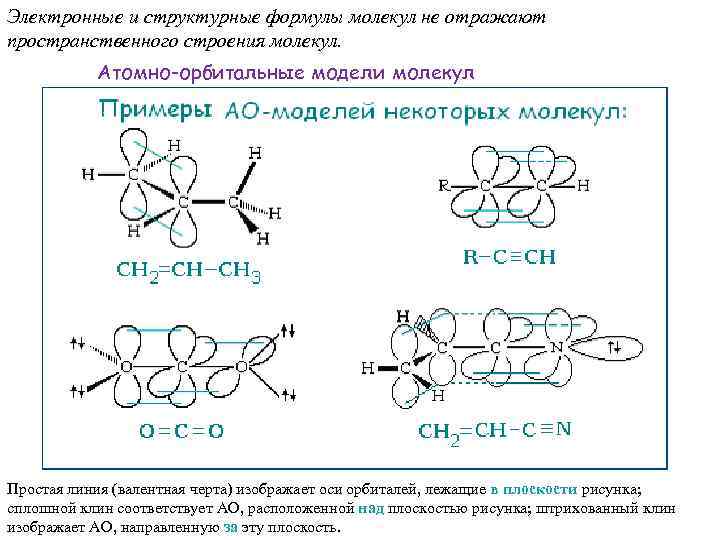
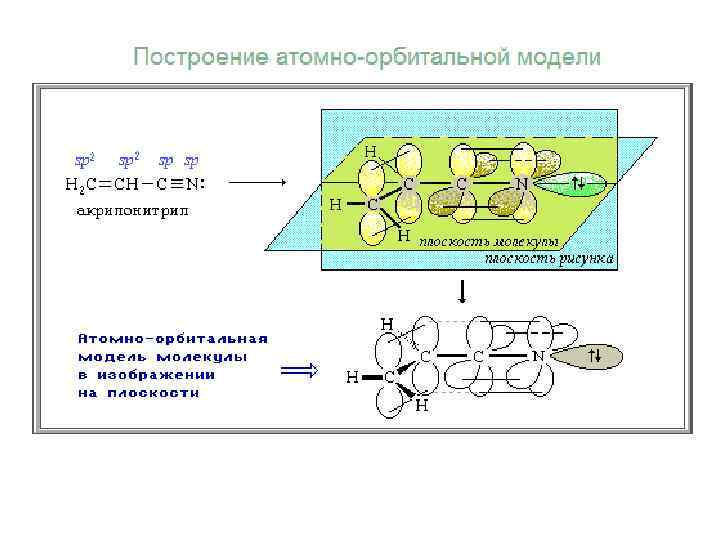
Электронные и структурные формулы молекул не отражают пространственного строения молекул. Атомно-орбитальные модели молекул Простая линия (валентная черта) изображает оси орбиталей, лежащие в плоскости рисунка; сплошной клин соответствует АО, расположенной над плоскостью рисунка; штрихованный клин изображает АО, направленную за эту плоскость.

Суть этого процесса заключается в разрыве химических связей в исходных веществах и образовании новых связей в продуктах реакции. Органические реакции записывают не в виде уравнений, а в виде схем реакций, в которых внимание уделяется не столько стехиометрическому соотношению реагентов, сколько условиям реакции. В этих схемах исходные продукты (реагенты) отделяются от продуктов реакции стрелкой, над которой обозначают условия реакции и катализаторы, а под стрелкой со знаком „минус” – соединения, которые образуются во время реакции


Классификация реакций по конечному результату

Реакции разложения: В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ: Расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов (реакции разложения при высокой температуре называют пиролизом) Молекула низкомолекулярного соединения отщепляется от двух соседних С- атомов (увеличение кратности связи) или от других атомов с образованием цикла
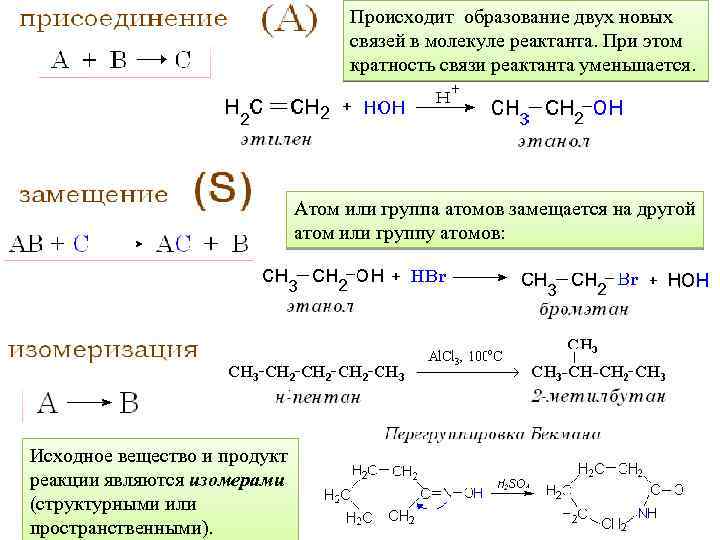
Происходит образование двух новых связей в молекуле реактанта. При этом кратность связи реактанта уменьшается. Атом или группа атомов замещается на другой атом или группу атомов: Исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
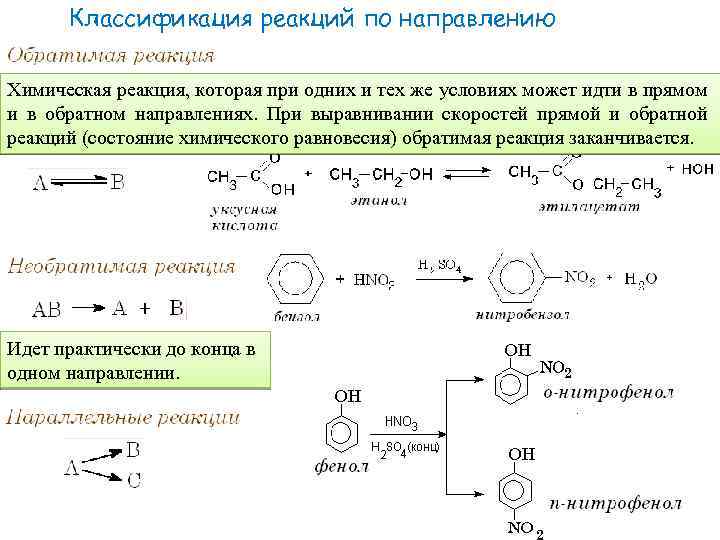
Классификация реакций по направлению Химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях. При выравнивании скоростей прямой и обратной реакций (состояние химического равновесия) обратимая реакция заканчивается. Идет практически до конца в одном направлении.

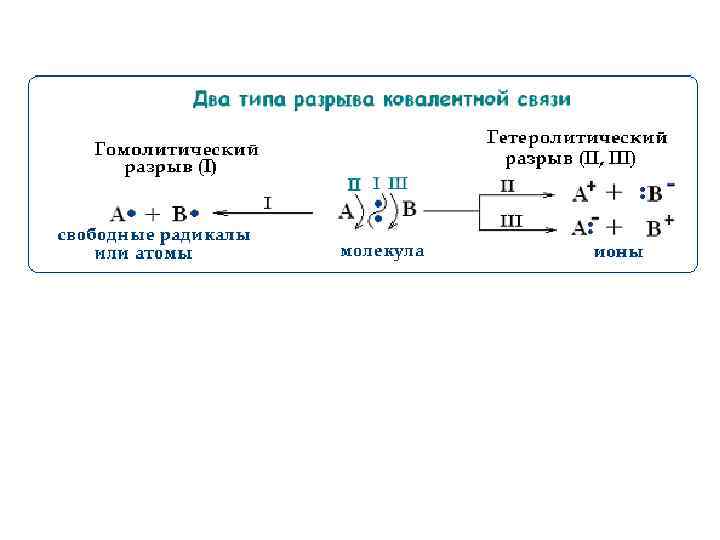

Гомолитические реакции Общая схема реакции:

Условия проведения радикальных реакций: • повышенная температура (часто реакцию проводят в газовой фазе), • действие света или радиоактивного излучения, • неполярные растворители, • присутствие соединений - источников свободных радикалов (инициаторов) Реакции с участием свободных радикалов характерны для соединений с неполярными и слабополярными связями. Такие связи (например, C–C, C–H, Cl–Cl, O–O и т. п. ) склонны к гомолитическому разрыву
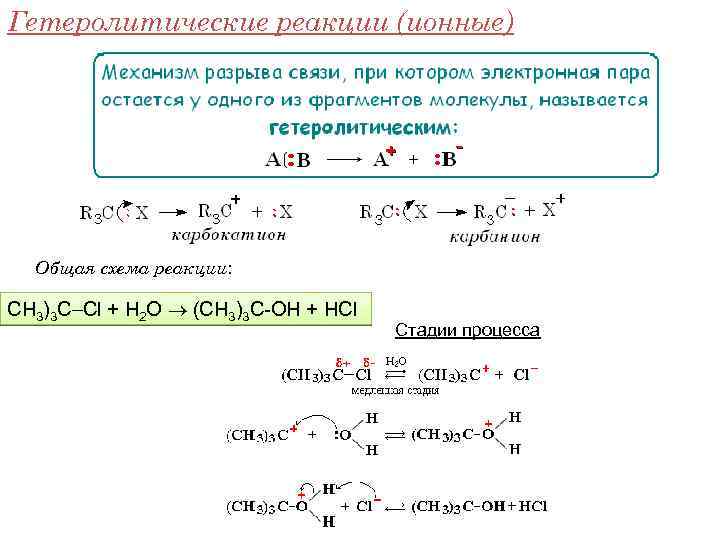
Гетеролитические реакции (ионные) Общая схема реакции: CH 3)3 C Cl + H 2 O (CH 3)3 C-OH + HCl Стадии процесса

Условия проведения ионных реакций: • невысокая температура; • полярные растворители, способные к сольватации образующихся ионов. Такие реакции характерны для соединений с полярными связями (C-O, C-N, C-Cl) и связями с высокой поляризуемостью (C=C, C=C-C=C, C=O и т. п. ). Чем полярнее связь, тем легче она разрывается по йонному механизму!!!

Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.

Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.

Молекулярная формула: Структурные формулы:
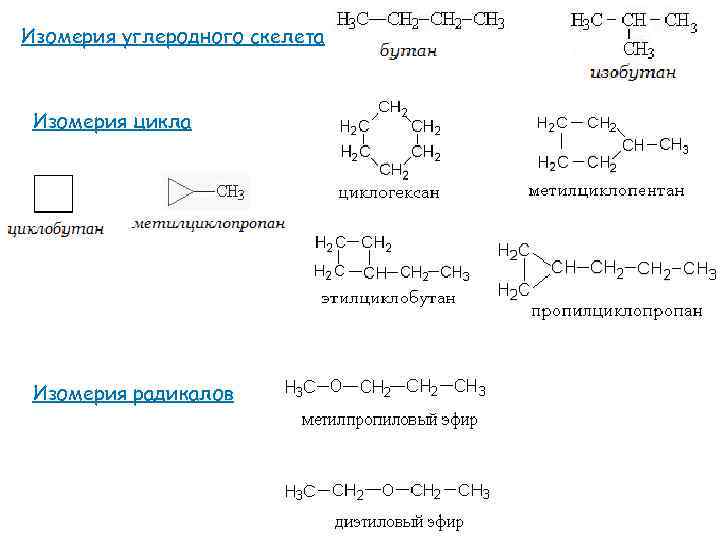
Изомерия углеродного скелета Изомерия цикла Изомерия радикалов

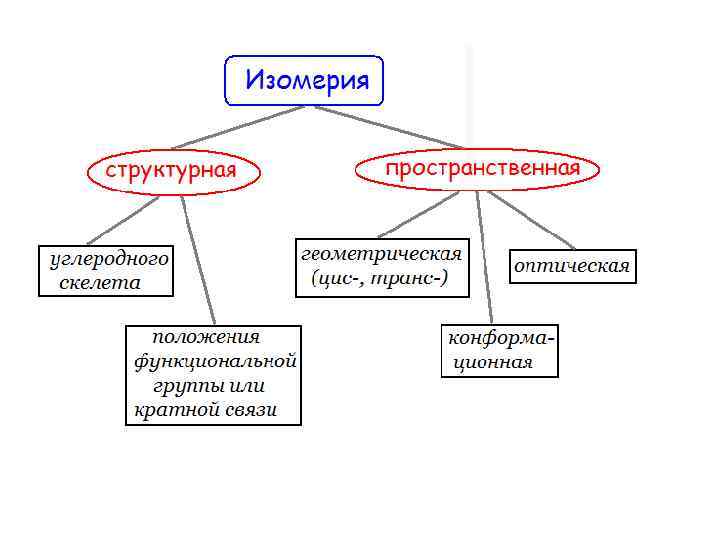
Изомерия места (позиционная)
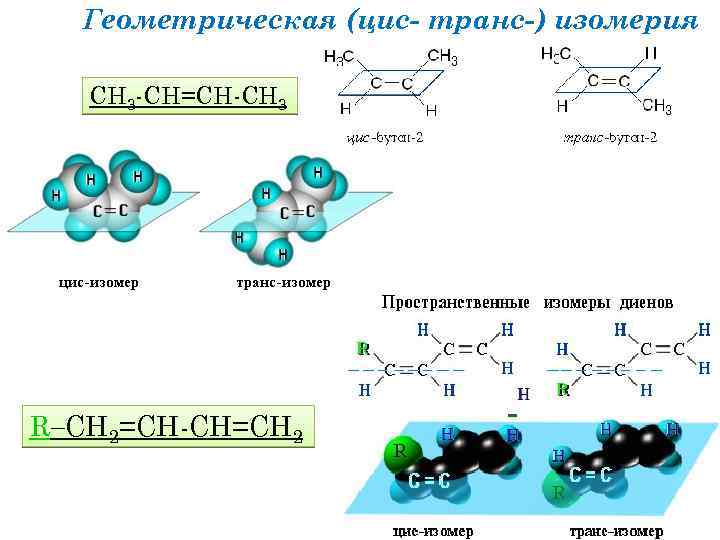
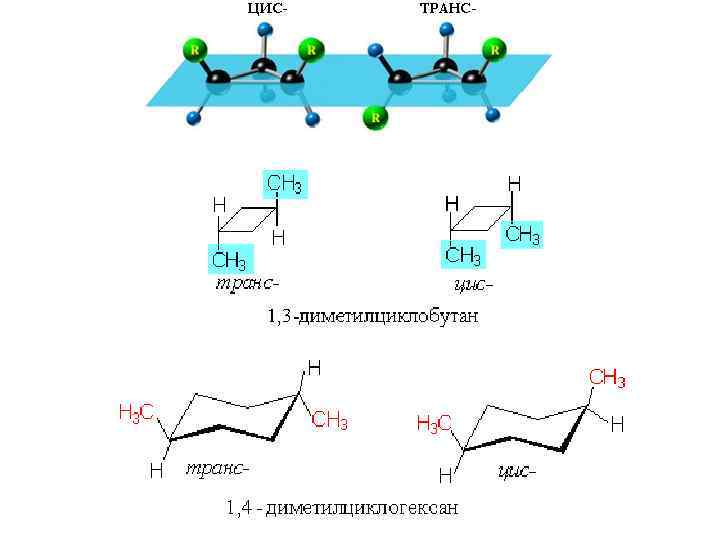
Геометрическая (цис- транс-) изомерия СН 3 -СН=СН-СН 3 R СН 2=СН-СН=СН 2
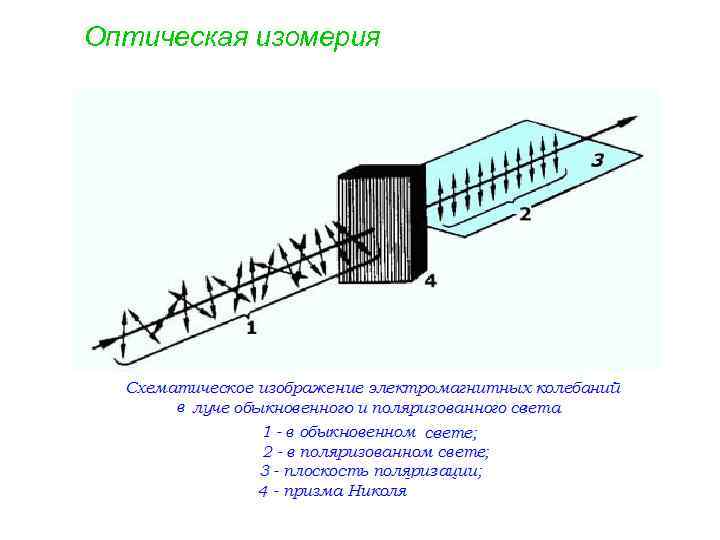
Оптическая изомерия
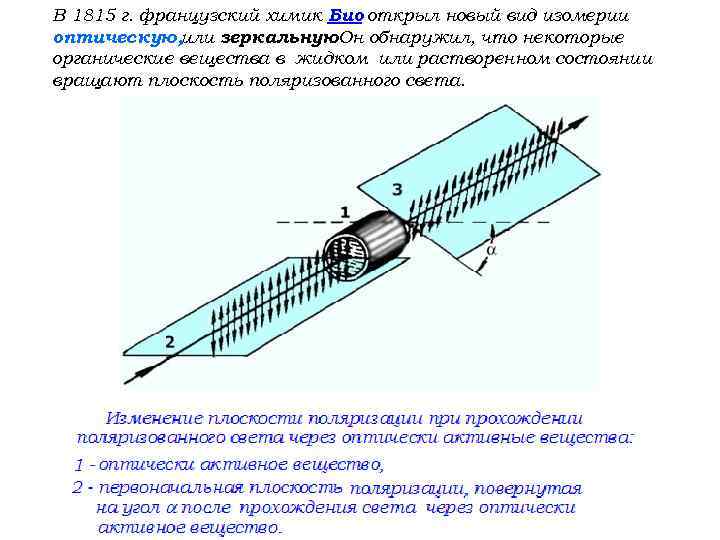
В 1815 г. французский химик Био открыл новый вид изомерии оптическую, или зеркальную. Он обнаружил, что некоторые. органические вещества в жидком или растворенном состоянии вращают плоскость поляризованного света.

Соединения, которые изменяют (вращают) плоскость поляризации, называют оптически активными они существуют в виде двух оптических изомеров. , и Один из них вращает плоскость поляризации вправо, а другой - на тот же угол, но влево. Для обозначения этих вращений используют знаки (+) и (-), которые ставят перед формулой оптического изомера. Все оптически активные вещества содержат в своих молекулах хотя бы один асимметрический атом углерода (в формулах этот атом обозначается звездочкой), т. е. углерод, который связан с четырьмя различными атомами или группами атомов
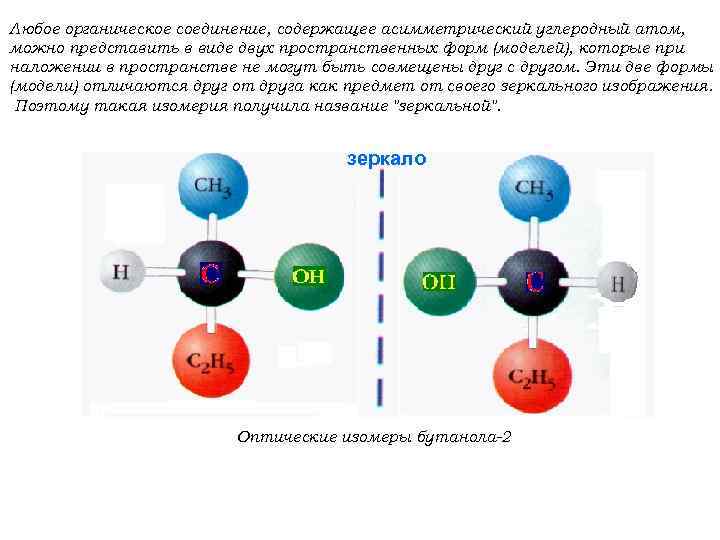
Любое органическое соединение, содержащее асимметрический углеродный атом, можно представить в виде двух пространственных форм (моделей), которые при наложении в пространстве не могут быть совмещены друг с другом. Эти две формы (модели) отличаются друг от друга как предмет от своего зеркального изображения. Поэтому такая изомерия получила название "зеркальной". зеркало Оптические изомеры бутанола-2
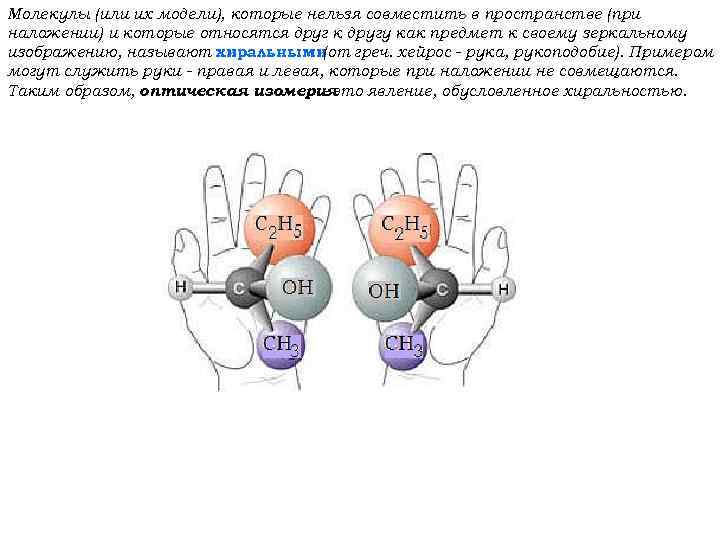
Молекулы (или их модели), которые нельзя совместить в пространстве (при наложении) и которые относятся друг к другу как предмет к своему зеркальному изображению, называют хиральными (от греч. хейрос - рука, рукоподобие). Примером могут служить руки - правая и левая, которые при наложении не совмещаются. Таким образом, оптическая изомерия - это явление, обусловленное хиральностью.
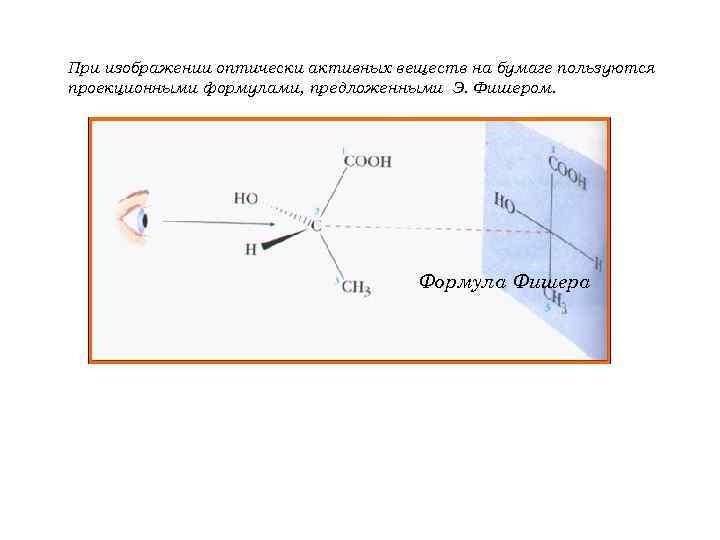
При изображении оптически активных веществ на бумаге пользуются проекционными формулами, предложенными Э. Фишером. Формула Фишера
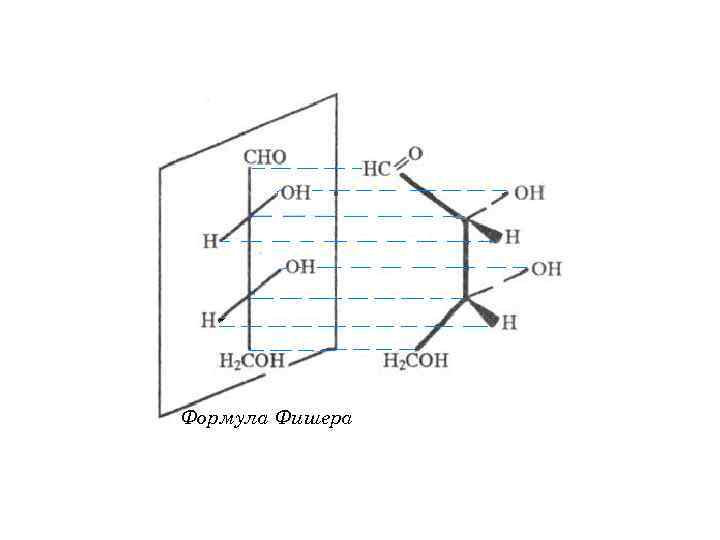
Формула Фишера
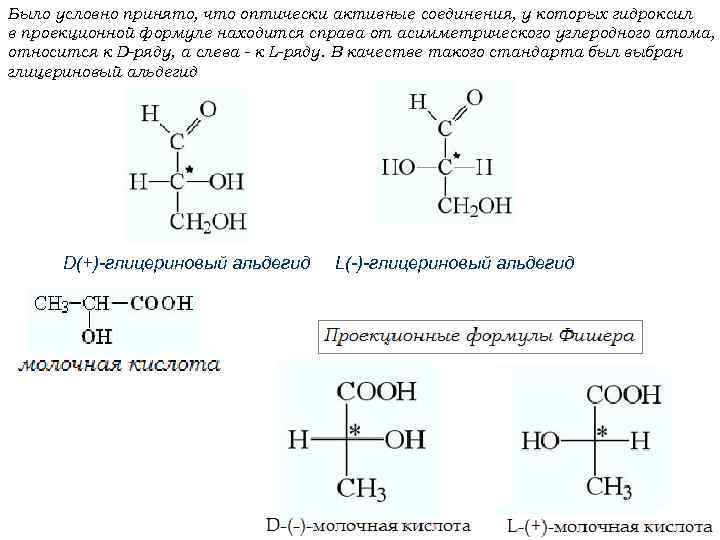
Было условно принято, что оптически активные соединения, у которых гидроксил в проекционной формуле находится справа от асимметрического углеродного атома, относится к D-ряду, а слева - к L-ряду. В качестве такого стандарта был выбран глицериновый альдегид D(+)-глицериновый альдегид L(-)-глицериновый альдегид
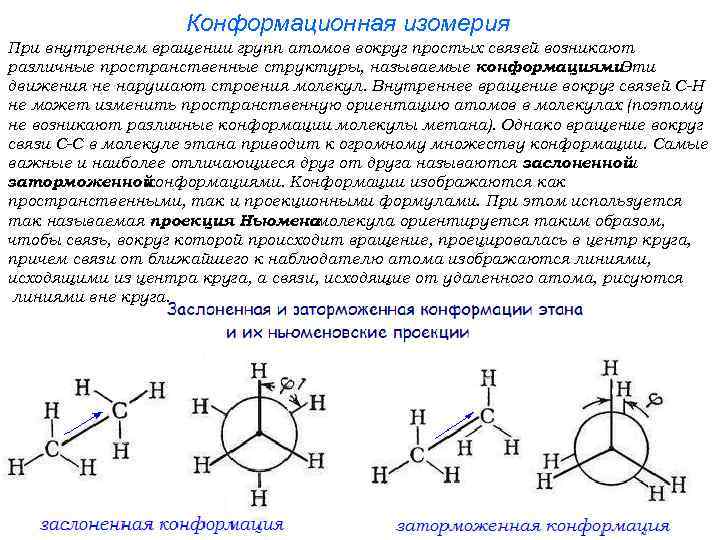
Конформационная изомерия При внутреннем вращении групп атомов вокруг простых связей возникают различные пространственные структуры, называемые конформациями. Эти движения не нарушают строения молекул. Внутреннее вращение вокруг связей С-Н не может изменить пространственную ориентацию атомов в молекулах (поэтому не возникают различные конформации молекулы метана). Однако вращение вокруг связи С-С в молекуле этана приводит к огромному множеству конформации. Самые важные и наиболее отличающиеся друг от друга называются заслоненной и заторможенной конформациями. Конформации изображаются как пространственными, так и проекционными формулами. При этом используется так называемая проекция Ньюмена : молекула ориентируется таким образом, чтобы связь, вокруг которой происходит вращение, проецировалась в центр круга, причем связи от ближайшего к наблюдателю атома изображаются линиями, исходящими из центра круга, а связи, исходящие от удаленного атома, рисуются линиями вне круга.
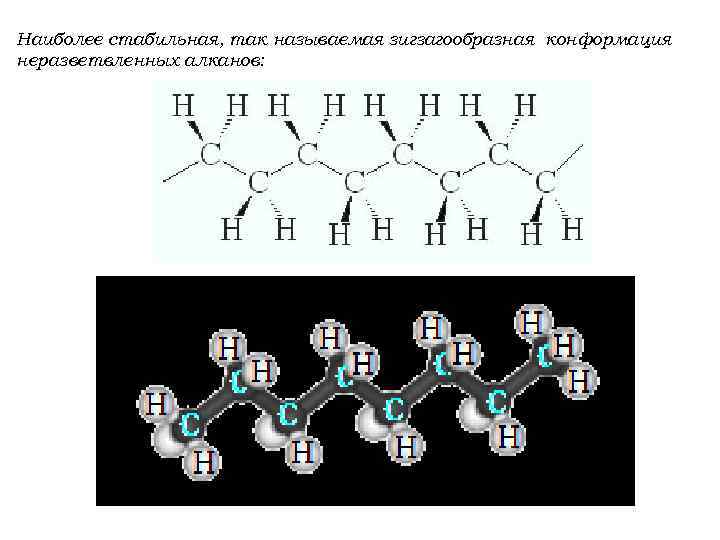
Наиболее стабильная, так называемая зигзагообразная конформация неразветвленных алканов:

2. Изомерия.ppt