02_Lektsia_Osnovy_BKh_Belki_2011.ppt
- Количество слайдов: 72

Молекулярная иерархия Неорганические предшественники Метаболиты Строительные блоки (мономеры) Макромолекулы Надмолекулярные комплексы Органеллы Клетка 1

Молекулярная иерархия 2

БЕЛКИ 3

Функции белков • служат катализаторами разнообразных биохимических реакций (ферменты) • осуществляют транспорт веществ внутри клеток и между ними • регулируют проницаемость клеточных мембран • являются строительным материалом клеточных структур • участвуют в осуществлении двигательных функций • обеспечивают защиту от инфекций и токсинов • регулируют синтез генетического материала • сигнальная функция 4 (рецепторы и гормоны)
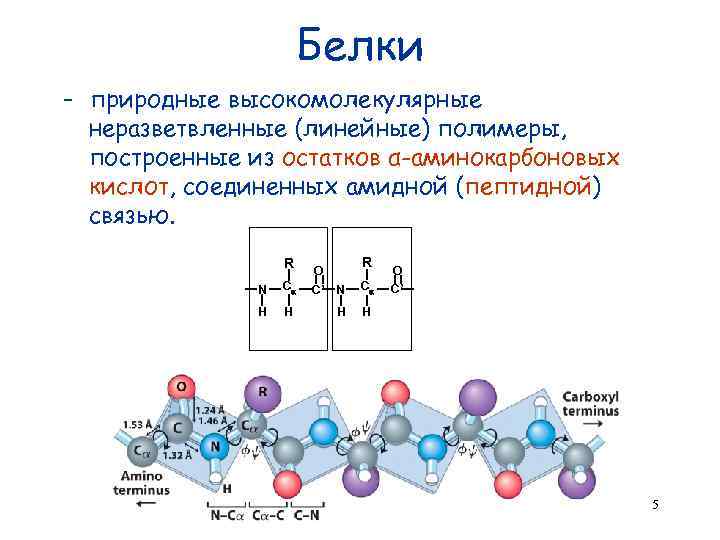
Белки - природные высокомолекулярные неразветвленные (линейные) полимеры, построенные из остатков α-аминокарбоновых кислот, соединенных амидной (пептидной) связью. R N C H H R O C’ N C H O H C’ 5
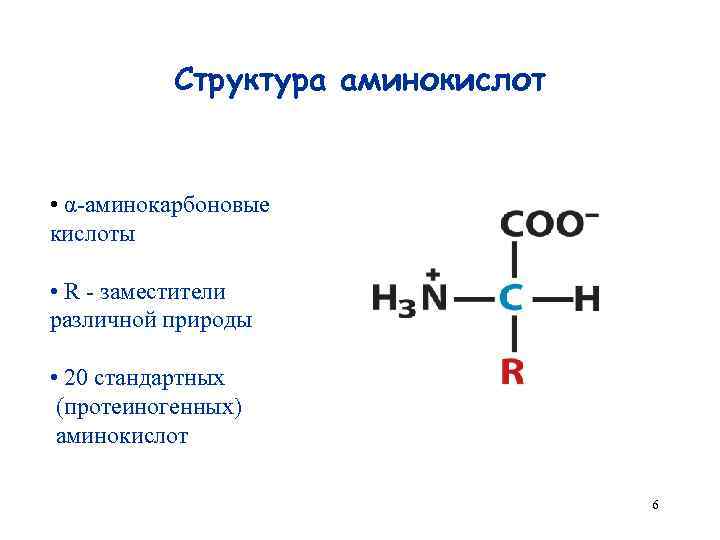
Структура аминокислот • α-аминокарбоновые кислоты • R - заместители различной природы • 20 стандартных (протеиногенных) аминокислот 6
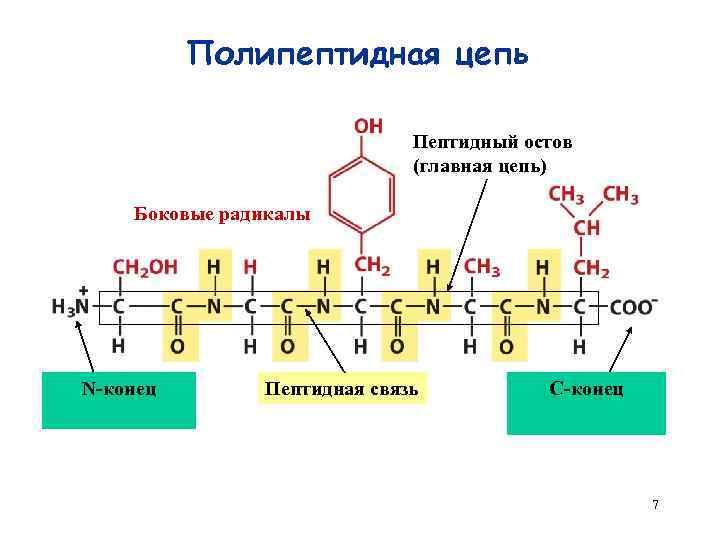
Полипептидная цепь Пептидный остов (главная цепь) Боковые радикалы N-конец Пептидная связь C-конец 7

АМИНОКИСЛОТНЫЕ ОСТАТКИ 8

Внимание! * Трех- и однобуквенные обозначения 20 -ти аминокислот, а также их структурные формулы (см. распечатку) понадобятся для выполнения домашнего задания! 11

Стандартные аминокислоты (20 а. к. ) Неполярные алифатические R-группы Глицин (Gly, G) Аланин (Ala, A) Пролин (Pro, P) Валин (Val, V) Лейцин (Leu, L) Изолейцин (Ile, I)** 12 Метионин (Met, M)

Стандартные аминокислоты (20 а. к. ) Полярные незаряженные R-группы Серин (Ser, S) Треонин (Thr, T)** Цистеин (Cys, C) Аспарагин (Asn, N) Глутамин (Gln, Q) 13

Стандартные аминокислоты (20 а. к. ) Ароматические R-группы Фенилаланин (Phe, F) Тирозин (Tyr, Y) Триптофан (Trp, W) 14

Стандартные аминокислоты (20 а. к. ) Положительно заряженные R-группы Имидазольно е кольцо р. Ка 6 Гуанидиновая группа р. Ка 13 -Аминогруппа р. Ка 10, 5 Лизин (Lys, K) Аргинин (Arg, R) Гистидин (His, H) 15

Стандартные аминокислоты (20 а. к. ) Отрицательно заряженные R-группы Аспарагиновая кислота (Asp, D) Глутаминовая кислота (Glu, E) p. Ka 3, 65 p. Ka 4, 32 16

Классификация аминокислот 1. По химической структуре 2. По отношению к воде (гидрофильные и гидрофобные) 3. По кислотно-основным свойствам: Кислые а. к. Asp, Glu (2) Основные а. к. Lys, Arg, His (3) Нейтральные а. к. (15) 4. По пищевой ценности: Заменимые а. к. (10) (синтезируются в организме) Незаменимые а. к. (10) (должны поступать извне) Val, Leu, Ile, Thr, Met, Phe, Trp, Lys, Arg, His 17

Нестандартные аминокислоты γ-Карбоксиглутамат 4 -Гидроксипролин 5 -Гидроксилизин 6 -N-Метиллизин Десмозин Селеноцистеин (кодон UGA) 18

Кислотно-основные свойства аминокислот Нейтральная Цвиттерионная форма • Проявляют амфотерные свойства; • В водных растворах при р. Н 7 полностью диссоциированы существуют в виде биполярных ионов (цвиттер-ионов); • Ионизация а. к. зависит от р. Н раствора – для каждой а. к. имеется значение р. Нi (изоэлектрическая точка), при котором а. к. нейтральна: Нейтральные а. к. р. Нi 5, 0 - 6, 3 Кислые а. к. р. Нi 2, 8 - 3, 2 Основные а. к. р. Нi = 7, 6 - 10, 8 19
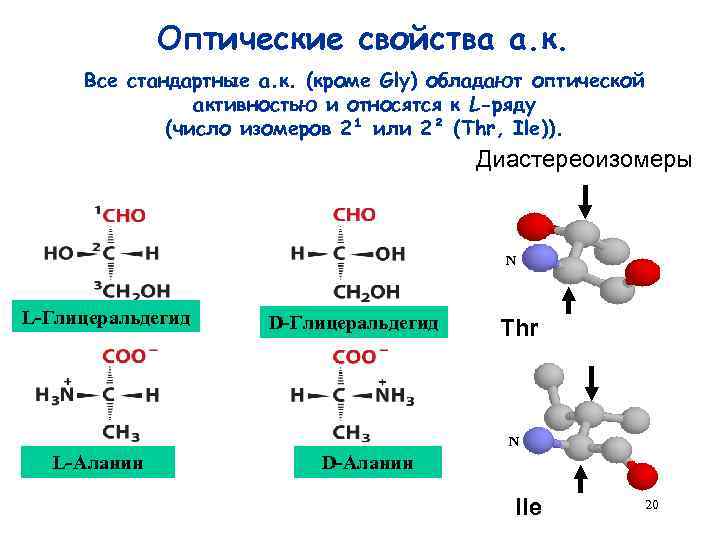
Оптические свойства а. к. Все стандартные а. к. (кроме Gly) обладают оптической активностью и относятся к L-ряду (число изомеров 2¹ или 2² (Thr, Ile)). Диастереоизомеры N L-Глицеральдегид D-Глицеральдегид Thr N L-Аланин D-Аланин Ile 20

Особенности Cys Цистеин Цистин Cys 2 Цистеин В составе белка остатки Cys подвергаются самопроизвольному окислению с образованием дисульфидных мостиков, которые ковалентно связывают участки полипептидных цепей. 21
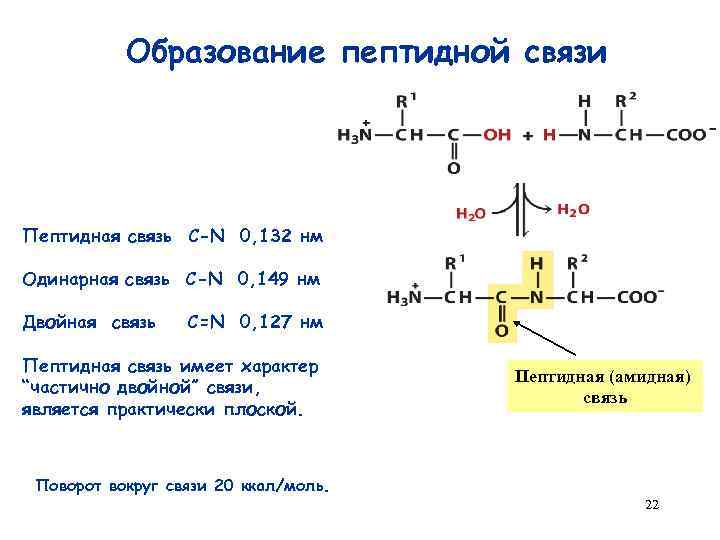
Образование пептидной связи Пептидная связь C-N 0, 132 нм Одинарная связь C-N 0, 149 нм Двойная связь С=N 0, 127 нм Пептидная связь имеет характер “частично двойной” связи, является практически плоской. Пептидная (амидная) связь Поворот вокруг связи 20 ккал/моль. 22

Пептидная связь – не двойная и не одинарная, а полуторная! 23

Пептидная связь - свойства Жесткость Планарность транс-Конфигурация 24
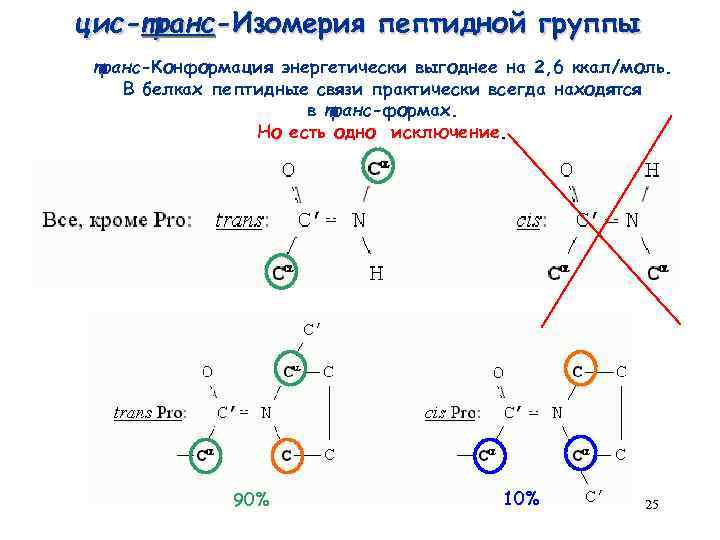
цис-транс-Изомерия пептидной группы транс-Конформация энергетически выгоднее на 2, 6 ккал/моль. В белках пептидные связи практически всегда находятся в транс-формах. Но есть одно исключение. 90% 10% 25

Уровни организации белковых структур 26
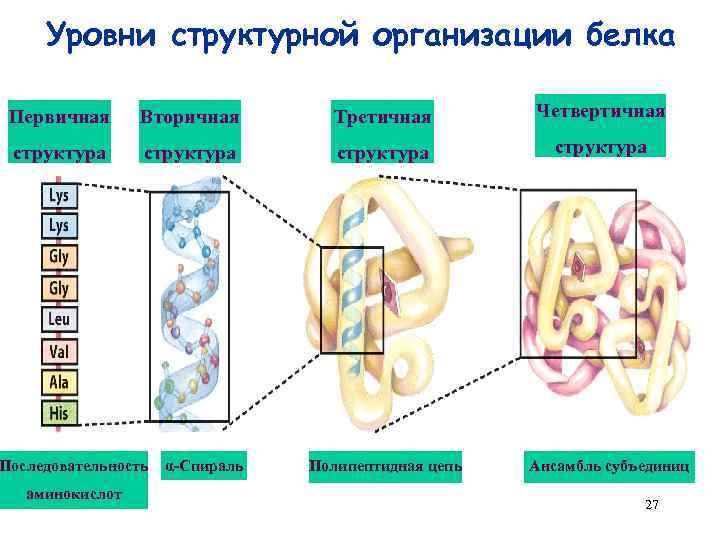
Уровни структурной организации белка Первичная Вторичная Третичная Четвертичная структура Последовательность аминокислот α-Спираль Полипептидная цепь Ансамбль субъединиц 27

Иерархия белковых структур первичная вторичная третичная четвертичная • • • Последовательность аминокислот α-спирали, β-слои, петли Мотивы Домены Многодоменный белок Белок, состоящий из нескольких полипептидных цепей (субъединиц) Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных, более или менее протяженных ее участках. 28

Вторичная структура белка– упорядоченные структуры полипептидных цепей, стабилизированные водородными связями между пептидными СО- и NH-группами. Типы вторичных структур: • α-спираль (α-helical) • β-складчатая структура (β-pleated sheet) • β-изгиб (β-turn) • неупорядоченный клубок (random coil) Первичная структура регулярные Вторичная структура 29
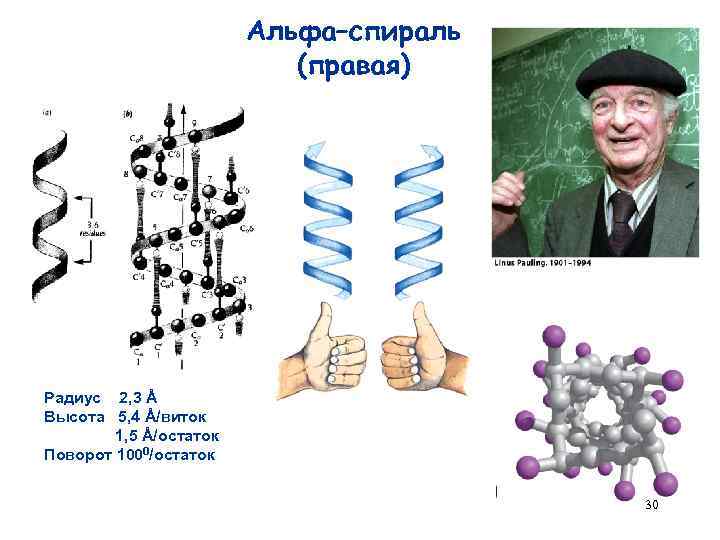
Альфа–спираль (правая) Радиус 2, 3 Å Высота 5, 4 Å/виток 1, 5 Å/остаток Поворот 1000/остаток 30

α-Спираль Характеристики α-спирали: • 18 а. к. образуют 5 витков N-конец спирали • 1 виток – 3, 6 а. к. , h = 0, 54 нм • каждая а. к. образует водородную связь СО---NH c четвертой по порядку следования по цепи а. к. 0, 54 нм 3, 6 а. к. на 1 виток C-конец Стабилизируют α-спираль: Ala, Val, Leu, Phe, Trp, Met, His, Gln Дестабилизируют α-спираль: Gly, Glu, Asp, Ile, Lys, Arg, Tyr, Asn, Ser, Cys Pro обычно расположен на повороте α -спирали 31

β-Складчатая структура β-Складчатый лист - ассоциат вытянутых зигзагообразных пептидных цепей, стабилизированный межцепочечными водородными СО---NH-связями 32

β-Складчатая структура Параллельная структура Вид сбоку Антипараллельная структура Вид сбоку 33

β-Изгибы 34

Сверхвторичная структура белка - наличие ансамблей взаимодействующих между собой вторичных структур. α-Спиральные белки, сходные по форме, но разные по функциям (мотив – « 4 -х-спиральный пучок» ) 35

МОТИВ «ГРЕЧЕСКИЙ КЛЮЧ» 36

Ретинол-связывающий белок (β-цилиндр, или β-бочонок) Мотив 37

Мотивы укладки цепи в домене -кристаллина, в β-домене белка – катаболического активатора (САР) и в белке оболочки сателлитного вируса некроза табака. β-сэндвич 38

-Cтруктура в форме “шестилопастного пропеллера” в нейраминидазе Суперцилиндр, сложенный из β-сэндвичей 39

-Призмы (или β-спирали) Ацилтрансфераза Пиктатлиаза С Это белки, сложенные из чисто параллельной β-структуры, что встречается редко! 40

Обложка номера журнала “Nature”, посвященного белковым мотивам Мотивы укладки белковой цепи и орнаменты на индейских и греческих вазах: два решения задачи окружения объема несамопресекающейся линией. 41

Третичная структура белка Полипептидная цепь, содержащая определенное число участков вторичной структуры, обычно свертывается в относительно компактную систему, в которой элементы вторичной структуры взаимодействуют между собой и с участками неупорядоченной структуры. • Для многих белков третичная структура эквивалентна пространственной структуре белка. • Каждый белок обладают своей уникальной пространственной структурой. 42

Связи, стабилизирующие конформацию белковой молекулы Ø Ø Ø Ван-дер-Ваальсовы взаимодействия Водородные связи Гидрофобные взаимодействия Электростатические (ионные) взаимодействия Дисульфидные связи 43

Миоглобин В миоглобине спирали организованы в два перпендикулярных слоя по три -спирали в каждом. 44

Глобулярные и фибриллярные белки Белки образуют при свертывании: • Компактные структуры сферической формы (глобулы) глобулярные белки • Достаточно вытянутое волокно - фибриллярные белки 45

Глобулярные домены в -кристаллине Классификация типов глобулярных белковых структур ( «чистые» β-белки, «чистые» -белки и «смешанные» /β и +β белки) относится к малым белкам, а также к отдельным доменам 46 (т. е. к компактным субглобулам, из которых сложены большие белки).

Что такое домен? • • Домен – это часть полипептидной цепи (или вся цепочка) , которая сворачивается независимо в стабильную третичную структуру [C. Brenden & John Tooze] Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации [Степанов В. М. ] 47

α+β β (↑↑) α/β β (↑↓) α 48
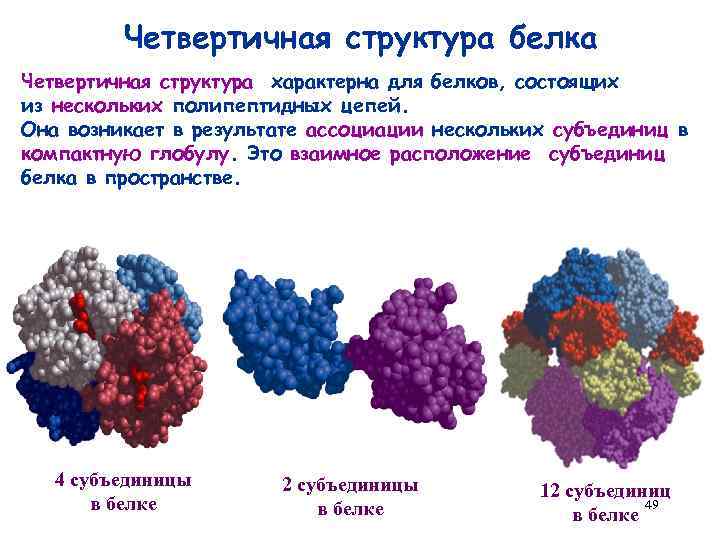
Четвертичная структура белка Четвертичная структура характерна для белков, состоящих из нескольких полипептидных цепей. Она возникает в результате ассоциации нескольких субъединиц в компактную глобулу. Это взаимное расположение субъединиц белка в пространстве. 4 субъединицы в белке 2 субъединицы в белке 12 субъединиц 49 в белке

Гемоглобин – белок с четвертичной структурой 50

Вирус табачной мозаики 2310 шт. Литовский национальный 51 пирог «Шакотис»
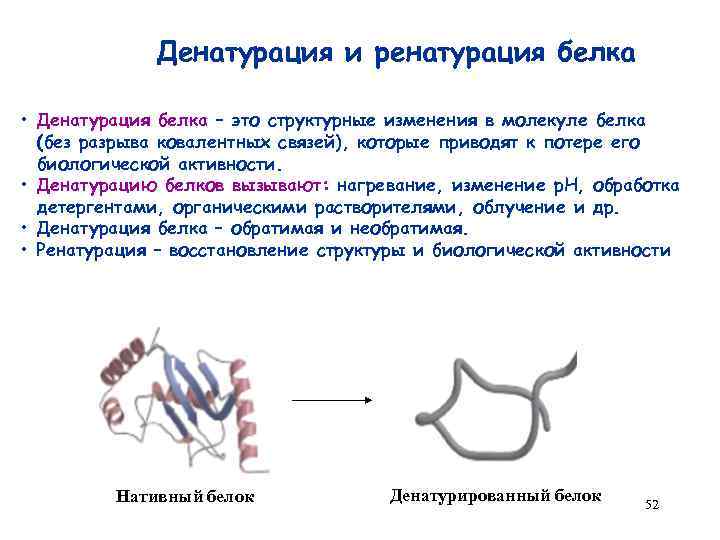
Денатурация и ренатурация белка • Денатурация белка – это структурные изменения в молекуле белка (без разрыва ковалентных связей), которые приводят к потере его биологической активности. • Денатурацию белков вызывают: нагревание, изменение р. Н, обработка детергентами, органическими растворителями, облучение и др. • Денатурация белка – обратимая и необратимая. • Ренатурация – восстановление структуры и биологической активности Нативный белок Денатурированный белок 52

Относительные размеры белков Инсулин Цитохром с Рибонуклеаза Лизоцим Миоглобин Гемоглобин Иммуноглобулин Глутамин-синтетаза 53

СТРУКТУРА БЕЛКОВОЙ ГЛОБУЛЫ 1. Не менее половины гидрофобных остатков спрятано внутрь. 2. 20 -30% аминокислотных остатков входит в гидрофобное ядро. 3. Не менее 90% водородных связей должны быть насыщены Свободные NH и СО Альфа и бета области Гидрофобное ядро 59

Фибриллярные белки 60
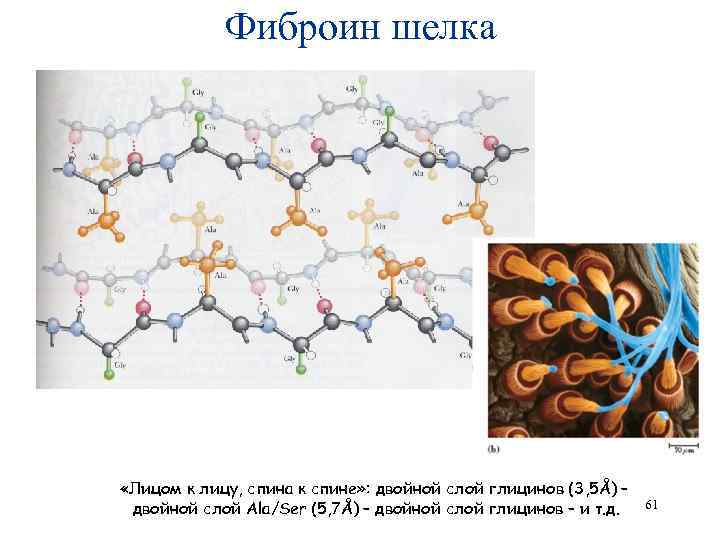
Фиброин шелка «Лицом к лицу, спина к спине» : двойной слой глицинов (3, 5Å) – двойной слой Ala/Ser (5, 7Å) – двойной слой глицинов – и т. д. 61
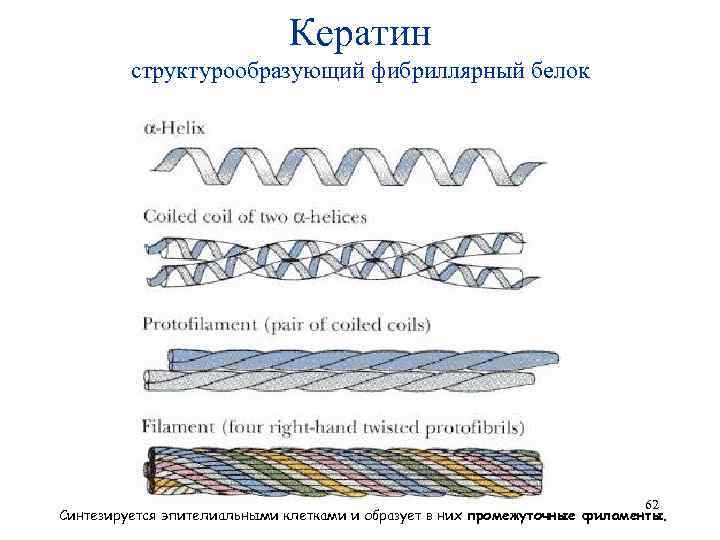
Кератин структурообразующий фибриллярный белок 62 Синтезируется эпителиальными клетками и образует в них промежуточные филаменты.

ра- ти- Ке- ны 63
![Коллаген - белок соединительной ткани [Gly-Xaa-Yaa]338 Xaa = Pro; Yaa = Hyp молекула тропоколлагена Коллаген - белок соединительной ткани [Gly-Xaa-Yaa]338 Xaa = Pro; Yaa = Hyp молекула тропоколлагена](https://present5.com/presentation/109360294_98556034/image-57.jpg)
Коллаген - белок соединительной ткани [Gly-Xaa-Yaa]338 Xaa = Pro; Yaa = Hyp молекула тропоколлагена имеет форму стержня длиной 3000Å и диаметром 15Å; 3 АКО/виток; расстояние между АКО 0, 29 нм. Три левые спирали закручены в правую суперспираль. 64

Компоненты цитоскелета 65

Белки микротрубочек 66

Кинезин взаимодействует с тубулином микротрубочек 67

Перемещение кинезина по микротрубочке 68

Ферменты Enzymes 69
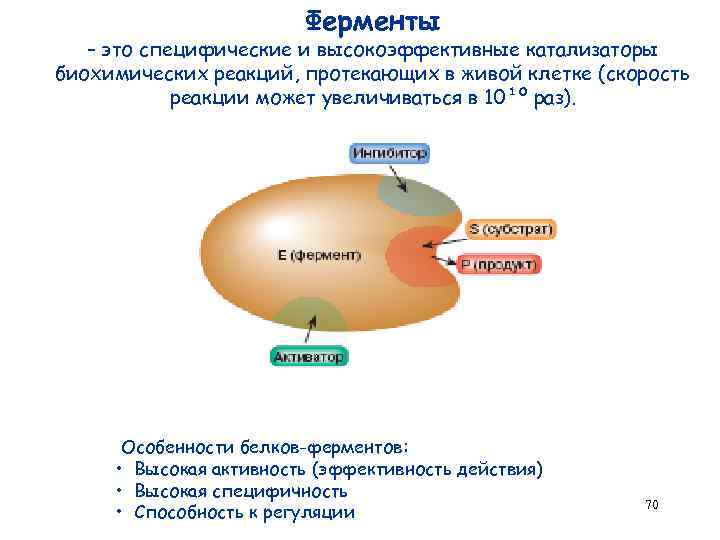
Ферменты – это специфические и высокоэффективные катализаторы биохимических реакций, протекающих в живой клетке (скорость реакции может увеличиваться в 10¹º раз). Особенности белков-ферментов: • Высокая активность (эффективность действия) • Высокая специфичность • Способность к регуляции 70

В живой клетке множество разнообразных соединений, но реакции между ними не беспорядочны, а образуют строго определенные метаболические пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма. 71

18 -ый верблюд 72

73
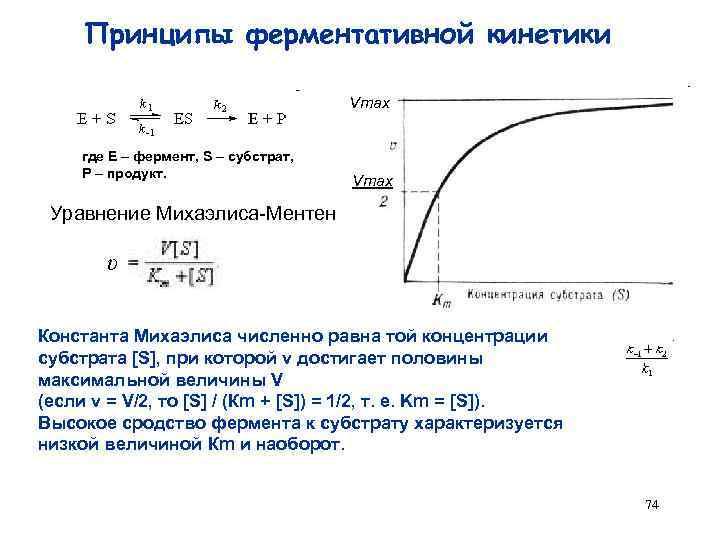
Принципы ферментативной кинетики Vmax где Е – фермент, S – субстрат, Р – продукт. Vmax Уравнение Михаэлиса-Ментен υ Константа Михаэлиса численно равна той концентрации субстрата [S], при которой ν достигает половины максимальной величины V (если v = V/2, то [S] / (Кm + [S]) = 1/2, т. е. Km = [S]). Высокое сродство фермента к субстрату характеризуется низкой величиной Кm и наоборот. 74

Графики Лайнуивера-Берка Конкурентное ингибирование Неконкурентное ингибирование 75

Взаимодействие фермент-субстрат 76

Активный центр ферментов Активный центр фермента может состоять: • только из а. к. остатков белка – лактатдегидрогеназа (а), • содержать ионы металлов – алкогольдегидрогеназа (б), • ионы металлов в составе сложных органических молекул – гем (в, г) 77

Международная классификация ферментов • • • КФ 1 (EC 1): ОКСИДОРЕДУКТАЗЫ, катализирующие окисление или ОКСИДОРЕДУКТАЗЫ восстановление. Примеры: каталаза, алкогольдегидрогеназа КФ 2 (EC 2): ТРАНСФЕРАЗЫ, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. КФ 3 (EC 3): ГИДРОЛАЗЫ, катализирующие гидролиз химических связей. Примеры: эстеразы, пепсин, трипсин, амилаза, липазы КФ 4 (EC 4): ЛИАЗЫ, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. КФ 5 (EC 5): ИЗОМЕРАЗЫ, катализирующие структурные или геометрические изменения в молекуле субстрата. КФ 6 (EC 6): ЛИГАЗЫ, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Примеры: ДНК-полимераза 78

79
02_Lektsia_Osnovy_BKh_Belki_2011.ppt