lektsii_po_molekulyarnoy_fizike.ppt
- Количество слайдов: 63
 Молекулярная физика и термодинамика В изучении свойств вещества существует два подхода. Молекулярная физика использует статистический подход, основывающийся на молекулярно-кинетической теории, в соответствии с которой все тела состоят из огромного числа атомов и молекул, находящихся в непрерывном хаотическом (тепловом) движении. Атомы и молекулы взаимодействуют между собой, притягиваясь на больших расстояниях и отталкиваясь на маленьких расстояниях. Термодинамический подход изучает свойства веществ в целом, не привлекая сведений об их строении. Он устанавливает связи между макроскопическими эспериментально определяемыми параметрами состояния (температура, давление, внутренняя энергия и т. д. ), базируясь на нескольких фундаментальных законах, называемых началами термодинамики. Обе теории взаимно дополняют друга.
Молекулярная физика и термодинамика В изучении свойств вещества существует два подхода. Молекулярная физика использует статистический подход, основывающийся на молекулярно-кинетической теории, в соответствии с которой все тела состоят из огромного числа атомов и молекул, находящихся в непрерывном хаотическом (тепловом) движении. Атомы и молекулы взаимодействуют между собой, притягиваясь на больших расстояниях и отталкиваясь на маленьких расстояниях. Термодинамический подход изучает свойства веществ в целом, не привлекая сведений об их строении. Он устанавливает связи между макроскопическими эспериментально определяемыми параметрами состояния (температура, давление, внутренняя энергия и т. д. ), базируясь на нескольких фундаментальных законах, называемых началами термодинамики. Обе теории взаимно дополняют друга.
 Молекулярная физика • Молекулярно-кинетическая теория. • Масса атомов и молекул определяется в атомных единицах массы (а. е. м. ) (1/12 массы изотопа углерода С 12). Макроскопическая масса различных веществ измеряется в молях и киломолях. 1 моль (1 киломоль) – количество вещества, масса которого численно равна массе его атома или молекулы, выраженной в граммах (килограммах). Для кислорода, масса молекулы которого равна 32 а. е. м. , 1 моль равен 32 г , а– 1 киломоль - 32 кг. В одном моле вещества содержится количество атомов или молекул, равное числу Авогадро. • Температура • При соприкосновении двух нагретых тел в результате теплового движения атомов и молекул происходит передача энергии от более нагретого к менее нагретому телу до тех пор, пока не наступает тепловое равновесие. Характеристикой степени нагретости тел служит температура Т, которая определяется следующим соотношением
Молекулярная физика • Молекулярно-кинетическая теория. • Масса атомов и молекул определяется в атомных единицах массы (а. е. м. ) (1/12 массы изотопа углерода С 12). Макроскопическая масса различных веществ измеряется в молях и киломолях. 1 моль (1 киломоль) – количество вещества, масса которого численно равна массе его атома или молекулы, выраженной в граммах (килограммах). Для кислорода, масса молекулы которого равна 32 а. е. м. , 1 моль равен 32 г , а– 1 киломоль - 32 кг. В одном моле вещества содержится количество атомов или молекул, равное числу Авогадро. • Температура • При соприкосновении двух нагретых тел в результате теплового движения атомов и молекул происходит передача энергии от более нагретого к менее нагретому телу до тех пор, пока не наступает тепловое равновесие. Характеристикой степени нагретости тел служит температура Т, которая определяется следующим соотношением
 Молекулярная физика • , • где - кинетическая энергия поступательного движения молекулы массой m 0, Дж/К - постоянная Больцмана, - средняя квадратичная скорость молекулы. Измерять температуру в джоулях неудобно, в связи с малой величиной кинетической энергии молекулы и сложностью ее определения. Поэтому принято измерять температуру в градусах абсолютной шкалы температуры – кельвинах, ноль которой соответствует прекращению теплового движения. Наряду со шкалой Кельвина используется шкала Цельсия, где за 0° принимается точка замерзания воды, а за 100° – точка ее кипения. Абсолютная температура замерзания воды 273, 15° К, поэтому для перевода градусов Цельсия в градусы Кельвина пользуются соотношением • . • Давление. • При столкновении со стенками сосуда молекулы газа оказывают на них давление, передавая им определенный импульс. Изменение им-пульса определяет величину действующей на стенку силы.
Молекулярная физика • , • где - кинетическая энергия поступательного движения молекулы массой m 0, Дж/К - постоянная Больцмана, - средняя квадратичная скорость молекулы. Измерять температуру в джоулях неудобно, в связи с малой величиной кинетической энергии молекулы и сложностью ее определения. Поэтому принято измерять температуру в градусах абсолютной шкалы температуры – кельвинах, ноль которой соответствует прекращению теплового движения. Наряду со шкалой Кельвина используется шкала Цельсия, где за 0° принимается точка замерзания воды, а за 100° – точка ее кипения. Абсолютная температура замерзания воды 273, 15° К, поэтому для перевода градусов Цельсия в градусы Кельвина пользуются соотношением • . • Давление. • При столкновении со стенками сосуда молекулы газа оказывают на них давление, передавая им определенный импульс. Изменение им-пульса определяет величину действующей на стенку силы.
 Молекулярная физика Давлением p называется сила действующая на единицу площади поверхности сосуда • В системе СИ давление измеряется в паскалях: . Наряду с этим используется внесистемная единица давления - атмосфера, определяемая как сила в 1 к. Г, действующая на площади в 1 см 2. 1 атм =1, 05· 105 Па. Основное уравнение молекулярно-кинетической теории. Идеальный – газ, взаимодействием между молекулами которого можно пренебречь (за исключением момента их соударения). Молекулы идеального газа являются материальными точками, не имеющими объема. При каждом ударе о стенку сосуда она передает ему импульс, равный . После удара молекула долетит до верхней стенки сосуда на высоте , отразится и вновь ударит дно сосуда через время . В единицу времени дно сосуда получает импульс
Молекулярная физика Давлением p называется сила действующая на единицу площади поверхности сосуда • В системе СИ давление измеряется в паскалях: . Наряду с этим используется внесистемная единица давления - атмосфера, определяемая как сила в 1 к. Г, действующая на площади в 1 см 2. 1 атм =1, 05· 105 Па. Основное уравнение молекулярно-кинетической теории. Идеальный – газ, взаимодействием между молекулами которого можно пренебречь (за исключением момента их соударения). Молекулы идеального газа являются материальными точками, не имеющими объема. При каждом ударе о стенку сосуда она передает ему импульс, равный . После удара молекула долетит до верхней стенки сосуда на высоте , отразится и вновь ударит дно сосуда через время . В единицу времени дно сосуда получает импульс
 Молекулярная физика • , который равен силе , действующей на дно со стороны одной молекулы. Т. к. движение молекул хаотично, то все направления равноценны и . Тогда на дно и любую стенку сосуда со стороны N молекул действует сила откуда , а , где - число молекул в единице объема. Полученное соотношение называется основным уравнением молекулярно- кинетической теории. Если преобразовать уравнение , то получим уравнение Клапейрона-Менделеева , где - число молей. R – универсальная газовая постоянная.
Молекулярная физика • , который равен силе , действующей на дно со стороны одной молекулы. Т. к. движение молекул хаотично, то все направления равноценны и . Тогда на дно и любую стенку сосуда со стороны N молекул действует сила откуда , а , где - число молекул в единице объема. Полученное соотношение называется основным уравнением молекулярно- кинетической теории. Если преобразовать уравнение , то получим уравнение Клапейрона-Менделеева , где - число молей. R – универсальная газовая постоянная.
 Молекулярная физика Идеальный газ во внешнем поле. • Рассмотрим идеальный газ, находящийся в тепловом равновесии (Т=const) во внешнем потенциальном поле U. Под действием сил поля давление газа не будет постоянным, а будет изменяться от точки к точке. Пусть поле направлено вдоль оси z. Рассмотрим две площадки площадью S, расположенные перпендикулярно оси z на расстоянии dz друг от друга. Пусть на нижней площадке давление будет p, а на верхней p+dp . Разность давлений, умноженная на площадь dp. S должна равняться суммарной силе, действующей на все молекулы слоя. • Используя соотношения и , получим: и . • А для давления (применяя основное уравнение молекулярнокинетической теории) будем иметь , • где m 0 – масса молекулы газа, M – его молярная масса.
Молекулярная физика Идеальный газ во внешнем поле. • Рассмотрим идеальный газ, находящийся в тепловом равновесии (Т=const) во внешнем потенциальном поле U. Под действием сил поля давление газа не будет постоянным, а будет изменяться от точки к точке. Пусть поле направлено вдоль оси z. Рассмотрим две площадки площадью S, расположенные перпендикулярно оси z на расстоянии dz друг от друга. Пусть на нижней площадке давление будет p, а на верхней p+dp . Разность давлений, умноженная на площадь dp. S должна равняться суммарной силе, действующей на все молекулы слоя. • Используя соотношения и , получим: и . • А для давления (применяя основное уравнение молекулярнокинетической теории) будем иметь , • где m 0 – масса молекулы газа, M – его молярная масса.
 Молекулярная физика Распределение молекул по скоростям. Распределение Максвелла. В связи с тем, что в макроскопических объемах газа содержится астрономическое число молекул, бессмысленно говорить об определении точного значения скорости каждой из них. С одной стороны, это сложно осуществить технически, а с другой стороны, молекулы, постоянно сталкиваясь, меняют величину и направление скорости. При таком большом количестве частиц можно говорить лишь о вероятности того, что определенная часть молекул имеет скорости лежащие в некотором интервале от до . Решением подобных задач занимается статистическая физика. Введем понятие вероятности. Вероятностью называется относительная частота выпадения того или иного события. Игральная кость при падении оказывается одной гранью вверх. Вероятность выпадения, например, числа 3 равна числу выпадения тройки, отнесенному к общему числу бросаний
Молекулярная физика Распределение молекул по скоростям. Распределение Максвелла. В связи с тем, что в макроскопических объемах газа содержится астрономическое число молекул, бессмысленно говорить об определении точного значения скорости каждой из них. С одной стороны, это сложно осуществить технически, а с другой стороны, молекулы, постоянно сталкиваясь, меняют величину и направление скорости. При таком большом количестве частиц можно говорить лишь о вероятности того, что определенная часть молекул имеет скорости лежащие в некотором интервале от до . Решением подобных задач занимается статистическая физика. Введем понятие вероятности. Вероятностью называется относительная частота выпадения того или иного события. Игральная кость при падении оказывается одной гранью вверх. Вероятность выпадения, например, числа 3 равна числу выпадения тройки, отнесенному к общему числу бросаний
 Молекулярная физика • Сумма выпадения всех возможных 6 чисел равна . • Из общего числа молекул N d. N имеют скорости, лежащие в интервале от v до v + dv. Вероятность d. P того, что молекулы имеют скорости, лежащие в этих пределах равна , где во второй части равенства вероятность выражена через величину интервала скоростей, а функция называется функцией распределения по скоростям. Будем искать . Для этого рассмотрим идеальный газ в состоянии теплового равновесия в однородном гравитационном поле и будем следить только за z компонентой их скоростей . Пусть число молекул в единице объема со скоростями, лежащими в интервале от до - Рассмотрим бесконечно тонкий слой газа dz площадью S толщиной на высоте z. В его объеме Sdz содержится молекул, где n(z) - плотность газа на высоте z. Через некоторое время молекулы этого слоя при тепловом движении сместится на другую высоту z’ и изменит свою толщину от
Молекулярная физика • Сумма выпадения всех возможных 6 чисел равна . • Из общего числа молекул N d. N имеют скорости, лежащие в интервале от v до v + dv. Вероятность d. P того, что молекулы имеют скорости, лежащие в этих пределах равна , где во второй части равенства вероятность выражена через величину интервала скоростей, а функция называется функцией распределения по скоростям. Будем искать . Для этого рассмотрим идеальный газ в состоянии теплового равновесия в однородном гравитационном поле и будем следить только за z компонентой их скоростей . Пусть число молекул в единице объема со скоростями, лежащими в интервале от до - Рассмотрим бесконечно тонкий слой газа dz площадью S толщиной на высоте z. В его объеме Sdz содержится молекул, где n(z) - плотность газа на высоте z. Через некоторое время молекулы этого слоя при тепловом движении сместится на другую высоту z’ и изменит свою толщину от
 Молекулярная физика dz до dz’ , а скорости под действием сил поля изменятся и перейдут в интервал от до , и их число можно представить в виде . Поскольку число молекул осталось неизменным, то В поле силы тяжести горизонтальные составляющие скорости не меняются, и закон сохранения энергии примет вид: Дифференцируя при постоянных z и z’, получим , . Используя эти два соотношения будем иметь: Из закона сохранения энергии следует: . Откуда и
Молекулярная физика dz до dz’ , а скорости под действием сил поля изменятся и перейдут в интервал от до , и их число можно представить в виде . Поскольку число молекул осталось неизменным, то В поле силы тяжести горизонтальные составляющие скорости не меняются, и закон сохранения энергии примет вид: Дифференцируя при постоянных z и z’, получим , . Используя эти два соотношения будем иметь: Из закона сохранения энергии следует: . Откуда и
 Молекулярная физика Если проинтегрировать по , то Константа определяется из соотношения: Функция распределения примет вид
Молекулярная физика Если проинтегрировать по , то Константа определяется из соотношения: Функция распределения примет вид
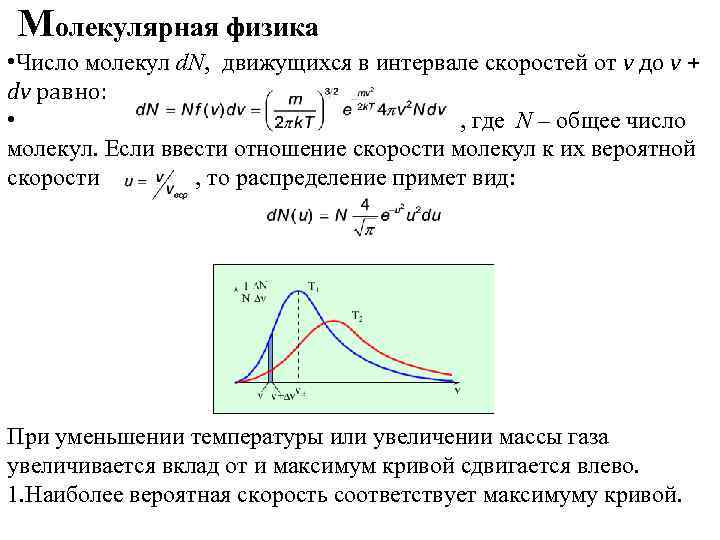 Молекулярная физика • Число молекул d. N, движущихся в интервале скоростей от v до v + dv равно: • , где N – общее число молекул. Если ввести отношение скорости молекул к их вероятной скорости , то распределение примет вид: При уменьшении температуры или увеличении массы газа увеличивается вклад от и максимум кривой сдвигается влево. 1. Наиболее вероятная скорость соответствует максимуму кривой.
Молекулярная физика • Число молекул d. N, движущихся в интервале скоростей от v до v + dv равно: • , где N – общее число молекул. Если ввести отношение скорости молекул к их вероятной скорости , то распределение примет вид: При уменьшении температуры или увеличении массы газа увеличивается вклад от и максимум кривой сдвигается влево. 1. Наиболее вероятная скорость соответствует максимуму кривой.
 Молекулярная физика , где - масса молекулы, M – молярная масса. 2. Средняя скорость молекул 3. Среднеквадратичная скорость молекул Пример. Средняя скорость движения молекул кислорода. м/с % 0 -0, 5 Распределение молекул по скоростям Экспериментальное подтверждение распределения Максвелла получено в опытах Штерна и Ламмерта. 8, 1 0, 51, 5 70, 7 1, 5 -2 16, 6 2 -3 4, 6 >3 0, 04
Молекулярная физика , где - масса молекулы, M – молярная масса. 2. Средняя скорость молекул 3. Среднеквадратичная скорость молекул Пример. Средняя скорость движения молекул кислорода. м/с % 0 -0, 5 Распределение молекул по скоростям Экспериментальное подтверждение распределения Максвелла получено в опытах Штерна и Ламмерта. 8, 1 0, 51, 5 70, 7 1, 5 -2 16, 6 2 -3 4, 6 >3 0, 04
 Молекулярная физика Средняя длина свободного пробега молекул. Процесс столкновения молекул сложнее, чем упругое соударение, - это процесс их взаимодействия. Он задается формой кривой потенциальной энергии U(r) взаимодействия молекул, которая имеет следующий вид. Если поместить одну молекулу в начало координат, а другую направить к ней вдоль оси r из бесконечности, то сначала под действием сил притяжения молекула движется к началу координат с ускорением. После прохождения точки r 0 силы притяжения сменяются силами отталкивания, которые тормозят ее движение до остановки на расстоянии d от другой молекулы. Это расстояние называют эффективным диаметром молекулы. С ростом температуры Т d уменьшается. Средняя длина свободного пробега молекул l определяется как отношение расстояния, проходимого молекулой за единицу времени - к числу столкновений молекул в единицу времени n
Молекулярная физика Средняя длина свободного пробега молекул. Процесс столкновения молекул сложнее, чем упругое соударение, - это процесс их взаимодействия. Он задается формой кривой потенциальной энергии U(r) взаимодействия молекул, которая имеет следующий вид. Если поместить одну молекулу в начало координат, а другую направить к ней вдоль оси r из бесконечности, то сначала под действием сил притяжения молекула движется к началу координат с ускорением. После прохождения точки r 0 силы притяжения сменяются силами отталкивания, которые тормозят ее движение до остановки на расстоянии d от другой молекулы. Это расстояние называют эффективным диаметром молекулы. С ростом температуры Т d уменьшается. Средняя длина свободного пробега молекул l определяется как отношение расстояния, проходимого молекулой за единицу времени - к числу столкновений молекул в единицу времени n
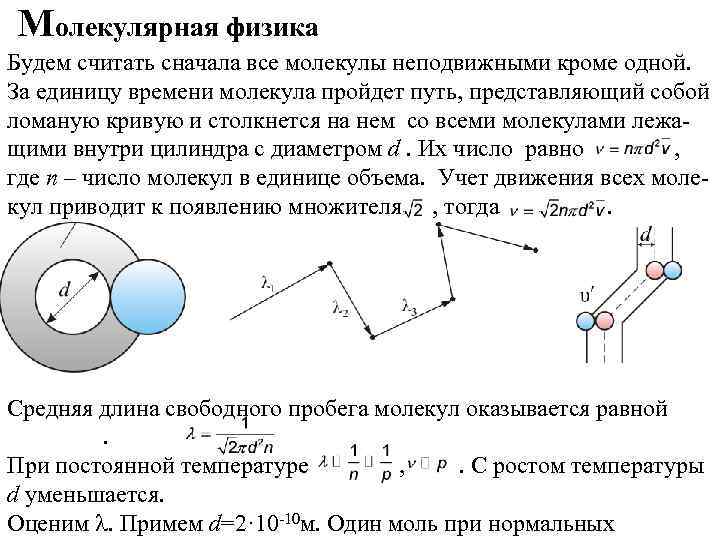 Молекулярная физика Будем считать сначала все молекулы неподвижными кроме одной. За единицу времени молекула пройдет путь, представляющий собой ломаную кривую и столкнется на нем со всеми молекулами лежащими внутри цилиндра с диаметром d. Их число равно , где n – число молекул в единице объема. Учет движения всех молекул приводит к появлению множителя , тогда . Средняя длина свободного пробега молекул оказывается равной . При постоянной температуре , . С ростом температуры d уменьшается. Оценим l. Примем d=2· 10 -10 м. Один моль при нормальных
Молекулярная физика Будем считать сначала все молекулы неподвижными кроме одной. За единицу времени молекула пройдет путь, представляющий собой ломаную кривую и столкнется на нем со всеми молекулами лежащими внутри цилиндра с диаметром d. Их число равно , где n – число молекул в единице объема. Учет движения всех молекул приводит к появлению множителя , тогда . Средняя длина свободного пробега молекул оказывается равной . При постоянной температуре , . С ростом температуры d уменьшается. Оценим l. Примем d=2· 10 -10 м. Один моль при нормальных
 Молекулярная физика •
Молекулярная физика •
 Молекулярная физика • При тепловом движении молекул будут происходить их столкновения и процесс выравнивания концентраций, сопровождающийся переносом каждого из газов в направлении убывания концентрации. Экспериментально установлено, что поток молекул i-го вида через поверхность S перпендикулярно оси z , где D – коэффициент диффузии. Знак минус означает, что поток направлен в сторону, противоположную . Умножив обе части уравнения на массу молекулы mi 0, получим , где Mi – переносимая масса i-го газа - его плотность. Определим D с помощью молекулярно-кинетической теории, считая, что , а их эффективные диаметры d 1 ≈d 2 ≈ d, . Через площадку S перпендикулярно оси z в единицу времени при тепловом движении в положительном направлении оси z переместится N’молекул газа, а в противоположном направлении N” молекул. Таким образом через площадку S пролетит N= N’- N” молекул газа. В силу отсутствия в пространстве выделенных
Молекулярная физика • При тепловом движении молекул будут происходить их столкновения и процесс выравнивания концентраций, сопровождающийся переносом каждого из газов в направлении убывания концентрации. Экспериментально установлено, что поток молекул i-го вида через поверхность S перпендикулярно оси z , где D – коэффициент диффузии. Знак минус означает, что поток направлен в сторону, противоположную . Умножив обе части уравнения на массу молекулы mi 0, получим , где Mi – переносимая масса i-го газа - его плотность. Определим D с помощью молекулярно-кинетической теории, считая, что , а их эффективные диаметры d 1 ≈d 2 ≈ d, . Через площадку S перпендикулярно оси z в единицу времени при тепловом движении в положительном направлении оси z переместится N’молекул газа, а в противоположном направлении N” молекул. Таким образом через площадку S пролетит N= N’- N” молекул газа. В силу отсутствия в пространстве выделенных
 Молекулярная физика направлений вдоль каждой оси координат будет двигаться 1/3 всех молекул, в том числе 1/6 молекул в положительном направлении оси z и 1/6 молекул в отрицательном направлении. Тогда , где n’ и n” – число молекул в единице объема снизу и сверху от S, а S - объем газа? перемещающийся за одну секунду. Через площадку S пролетят молекулы, испытывающие соударение на расстоянии z-l и z+l, поэтому , а • Подставляя в выражение для N, получим: , а коэффициент диффузии . Отсюда следует, что . • Вязкость газов. Экспериментально установлено, что сила трения между двумя слоями газа или жидкости равна . В соответствии со вторым законом Ньютона в единицу времени от слоя к слою
Молекулярная физика направлений вдоль каждой оси координат будет двигаться 1/3 всех молекул, в том числе 1/6 молекул в положительном направлении оси z и 1/6 молекул в отрицательном направлении. Тогда , где n’ и n” – число молекул в единице объема снизу и сверху от S, а S - объем газа? перемещающийся за одну секунду. Через площадку S пролетят молекулы, испытывающие соударение на расстоянии z-l и z+l, поэтому , а • Подставляя в выражение для N, получим: , а коэффициент диффузии . Отсюда следует, что . • Вязкость газов. Экспериментально установлено, что сила трения между двумя слоями газа или жидкости равна . В соответствии со вторым законом Ньютона в единицу времени от слоя к слою
 Молекулярная физика •
Молекулярная физика •
 Термодинамика • В термодинамике рассматриваются термодинамические системы (далее система) – совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. При этом не учитывается атомно-молекулярное строение тел и вещества. Состояние системы характеризуется параметрами состояния (давление, температура, объем и т. д. ). Если все параметры состояния имеют определенные, не изменяющиеся со временем значения, то такое состояние является равновесным. Если хотя бы один параметр не имеет определенного значения, то состояние называется неравновесным. Переход системы из одного состояния в другое называется термодинамическим процессом. Равновесный – процесс, на каждом этапе которого система находится в равновесном состоянии. Очевидно, это возможно только при бесконечно медленном течении процесса, что практически сложно реализовать. Внутренняя энергия идеального газа – суммарная кинетическая энергия всех молекул рассматриваемой массы (объема). Кинетическая энергия молекулы
Термодинамика • В термодинамике рассматриваются термодинамические системы (далее система) – совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. При этом не учитывается атомно-молекулярное строение тел и вещества. Состояние системы характеризуется параметрами состояния (давление, температура, объем и т. д. ). Если все параметры состояния имеют определенные, не изменяющиеся со временем значения, то такое состояние является равновесным. Если хотя бы один параметр не имеет определенного значения, то состояние называется неравновесным. Переход системы из одного состояния в другое называется термодинамическим процессом. Равновесный – процесс, на каждом этапе которого система находится в равновесном состоянии. Очевидно, это возможно только при бесконечно медленном течении процесса, что практически сложно реализовать. Внутренняя энергия идеального газа – суммарная кинетическая энергия всех молекул рассматриваемой массы (объема). Кинетическая энергия молекулы
 Термодинамика требует уточнения - у многоатомных молекул необходимо учитывать кинетическую энергию не только поступательного, но и вращательного движений. Это можно сделать, введя число степеней свободы молекулы – число независимых координат, определяющих ее положение в пространстве. Положение в пространстве одноатомной молекулы, рассматриваемой как материальная точка, определяется тремя независимыми координатами, поэтому число ее степеней свободы i=3 и соответствует поступательному движению по трем осям координат (x, y, z). • Положение двухатомной молекулы (двух материальных точек на неизменном расстоянии друг от друга) определяется 6 координатами. Расстояние между атомами выражается через координаты следующим образом: • Из этого соотношения одну координату можно выразить через другие 5 координат. Поэтому независимыми будут только 5 координат и число степеней свободы двухатомной молекулы будет равно 5.
Термодинамика требует уточнения - у многоатомных молекул необходимо учитывать кинетическую энергию не только поступательного, но и вращательного движений. Это можно сделать, введя число степеней свободы молекулы – число независимых координат, определяющих ее положение в пространстве. Положение в пространстве одноатомной молекулы, рассматриваемой как материальная точка, определяется тремя независимыми координатами, поэтому число ее степеней свободы i=3 и соответствует поступательному движению по трем осям координат (x, y, z). • Положение двухатомной молекулы (двух материальных точек на неизменном расстоянии друг от друга) определяется 6 координатами. Расстояние между атомами выражается через координаты следующим образом: • Из этого соотношения одну координату можно выразить через другие 5 координат. Поэтому независимыми будут только 5 координат и число степеней свободы двухатомной молекулы будет равно 5.
 Термодинамика Это соответствует трем степеням свободы поступательного движения молекулы как целого и двум степеням свободы вращательного движения (относительно двух взаимно-пер-пендикулярных осей) i=5=3 поступ+2 вращ. В случае упругой связи между молекулами число степеней свободы будет 6. • Положение трехатомной молекулы (трех материальных точек на неизменном расстоянии друг от друга) задается 9 координатами. Соединив три точки прямыми, получим треугольник, длину каждой из сторон которого можно выразить соответствующим уравнением. Три полученных уравнения позволяют выразить три координаты через остальные 6, поэтому независимых координат будет 6, и число степеней свободы равно 6. Шесть степеней свободы складываются из трех степеней свободы поступательного движения молекулы как целого и трех степеней свободы вращательного движения (относительно трех взаимно-перпендикулярных осей) • i=6=3 поступ+3 вращ.
Термодинамика Это соответствует трем степеням свободы поступательного движения молекулы как целого и двум степеням свободы вращательного движения (относительно двух взаимно-пер-пендикулярных осей) i=5=3 поступ+2 вращ. В случае упругой связи между молекулами число степеней свободы будет 6. • Положение трехатомной молекулы (трех материальных точек на неизменном расстоянии друг от друга) задается 9 координатами. Соединив три точки прямыми, получим треугольник, длину каждой из сторон которого можно выразить соответствующим уравнением. Три полученных уравнения позволяют выразить три координаты через остальные 6, поэтому независимых координат будет 6, и число степеней свободы равно 6. Шесть степеней свободы складываются из трех степеней свободы поступательного движения молекулы как целого и трех степеней свободы вращательного движения (относительно трех взаимно-перпендикулярных осей) • i=6=3 поступ+3 вращ.
 Термодинамика • В многоатомных молекулах возможно колебательное движение атомов. При этом среднее значение кинетической энергии равно среднему значению потенциальной энергии, поэтому на каждое колебательное движение должно приходиться 2 степени свободы и общее число степеней свободы молекулы равно i=3 поступ+iвращ +2 iколеб. Колебательные степени свободы проявляются при больших температурах. В соответствии с законом о равнораспределении кинетической энергии молекул на каждую степень свободы приходится в среднем одинаковая кинетическая энергия, равная ½ k. T, где k – постоянная Больцмана, Т – абсолютная температура. • С учетом числа степеней свободы молекул внутренняя энергия идеального газа равна , где n число • молей, i - число степеней свободы, k – постоянная Больцмана, NA- число Авогадро, R – универсальная газовая постоянная. Изменение внутренней энергии равно
Термодинамика • В многоатомных молекулах возможно колебательное движение атомов. При этом среднее значение кинетической энергии равно среднему значению потенциальной энергии, поэтому на каждое колебательное движение должно приходиться 2 степени свободы и общее число степеней свободы молекулы равно i=3 поступ+iвращ +2 iколеб. Колебательные степени свободы проявляются при больших температурах. В соответствии с законом о равнораспределении кинетической энергии молекул на каждую степень свободы приходится в среднем одинаковая кинетическая энергия, равная ½ k. T, где k – постоянная Больцмана, Т – абсолютная температура. • С учетом числа степеней свободы молекул внутренняя энергия идеального газа равна , где n число • молей, i - число степеней свободы, k – постоянная Больцмана, NA- число Авогадро, R – универсальная газовая постоянная. Изменение внутренней энергии равно
 Термодинамика • Работа в термодинамике. • Термодинамика бурно развивалась в эпоху развития паровых двигателей, одним из основных элементов которых был цилиндр с поршнем. Поэтому определение механической работы было адаптировано к этому элементу: , где F – сила, - перемещение, p –давление, S – площадь поршня, d. V- изменение объема. При расширении газа d. V>0 работа положительна, а при сжатии d. V<0 работа отрицательна и ее совершают над газом, если d. V=0, то работа равна нулю. Работа на конечном участке равна . • Первое начало термодинамики • Если система не получает извне энергии, то работа при расширении производится за счет ее внутренней энергии. Изменение внутренней энергии не обязательно совпадает с произведенной работой и может происходить путем перехода от других тел. Получаемую при этом энергию называют количеством тепла Q. Q>0, если
Термодинамика • Работа в термодинамике. • Термодинамика бурно развивалась в эпоху развития паровых двигателей, одним из основных элементов которых был цилиндр с поршнем. Поэтому определение механической работы было адаптировано к этому элементу: , где F – сила, - перемещение, p –давление, S – площадь поршня, d. V- изменение объема. При расширении газа d. V>0 работа положительна, а при сжатии d. V<0 работа отрицательна и ее совершают над газом, если d. V=0, то работа равна нулю. Работа на конечном участке равна . • Первое начало термодинамики • Если система не получает извне энергии, то работа при расширении производится за счет ее внутренней энергии. Изменение внутренней энергии не обязательно совпадает с произведенной работой и может происходить путем перехода от других тел. Получаемую при этом энергию называют количеством тепла Q. Q>0, если
 Термодинамика система получает тепло и Q<0, если она его отдает. Закон сохранения энергии в этом случае принимает вид . Этот результат можно переписать в виде: Количество полученного системой тепла идет на изменение ее внутренней энергии и совершении работы. Это соотношение называют первым началом термодинамики. Следует отметить, что количество тепла и работа зависят не только от начального и конечного состояний системы, но и от пути, по которому это изменение происходило, поэтому d. Q и d. A не являются полными дифференциалами. Внутренняя энергия напротив является функцией или параметром состояния системы, и ее изменение зависит только от начального и конечного состояний. Теплоемкость тела (идеального газа) – количество тепла, необходимое для его нагревания или охлаждения на 1 К.
Термодинамика система получает тепло и Q<0, если она его отдает. Закон сохранения энергии в этом случае принимает вид . Этот результат можно переписать в виде: Количество полученного системой тепла идет на изменение ее внутренней энергии и совершении работы. Это соотношение называют первым началом термодинамики. Следует отметить, что количество тепла и работа зависят не только от начального и конечного состояний системы, но и от пути, по которому это изменение происходило, поэтому d. Q и d. A не являются полными дифференциалами. Внутренняя энергия напротив является функцией или параметром состояния системы, и ее изменение зависит только от начального и конечного состояний. Теплоемкость тела (идеального газа) – количество тепла, необходимое для его нагревания или охлаждения на 1 К.
 Термодинамика Различают молярную (для одного моля газа) и удельную (для одного кг вещества тела или газа) теплоемкости. При нагревании газа при постоянном объеме работа не совершается, поэтому все получаемое тепло идет на изменение его внутренней энергии. Если процесс нагревания идет при постоянном давлении, то первое начало термодинамики запишется в виде: , где учтено что при постоянном давлении p дифференцирование уравнения состояния идеального газа дает . Для молярной теплоемкости при постоянном давлении получим: . В таблице представлены значения и для различных газов.
Термодинамика Различают молярную (для одного моля газа) и удельную (для одного кг вещества тела или газа) теплоемкости. При нагревании газа при постоянном объеме работа не совершается, поэтому все получаемое тепло идет на изменение его внутренней энергии. Если процесс нагревания идет при постоянном давлении, то первое начало термодинамики запишется в виде: , где учтено что при постоянном давлении p дифференцирование уравнения состояния идеального газа дает . Для молярной теплоемкости при постоянном давлении получим: . В таблице представлены значения и для различных газов.
 Термодинамика В классической физике теплоемкость от температуры не зависят, од -нако экспериментальные данные показывают, что теплоемкость с ростом температуры увеличивается. Зависимость теплоемкости от температуры удалось объяснить только в квантовой механике, где энергия вращательного и колебательного движений молекулы может принимать только дискретные значения и изменяется не непрерывно, а скачками. Энергия поступательного движения может меняться практически непрерывно. Расстояния между вращательными уровнями энергии много меньше, чем между колебательными уровнями. Поэтому при повышении температуры сначала «включаются» степени свободы вращательного движения и лишь при значительной температуре колебательные степени свободы.
Термодинамика В классической физике теплоемкость от температуры не зависят, од -нако экспериментальные данные показывают, что теплоемкость с ростом температуры увеличивается. Зависимость теплоемкости от температуры удалось объяснить только в квантовой механике, где энергия вращательного и колебательного движений молекулы может принимать только дискретные значения и изменяется не непрерывно, а скачками. Энергия поступательного движения может меняться практически непрерывно. Расстояния между вращательными уровнями энергии много меньше, чем между колебательными уровнями. Поэтому при повышении температуры сначала «включаются» степени свободы вращательного движения и лишь при значительной температуре колебательные степени свободы.
 Термодинамика Применение первого начала термодинамики для изопроцессов. 1. Изобарный процесс (p=const). Из уравнения состояния и При постоянном давлении первое начало термодинамики имеет вид: , где количество тепла , приращение внутренней энергии , работа . 2. Изохорный процесс (V=const). Из уравнения состояния и . В изохорном процессе работа А=0. Поэтому получаемое системой количество тепла идет на изменение ее внутренней энергии . 3. Изотермический процесс (Т=const). В изотермическом процессе , внутренняя энергия системы не меняется DU=0 и получаемое количество тепла идет на
Термодинамика Применение первого начала термодинамики для изопроцессов. 1. Изобарный процесс (p=const). Из уравнения состояния и При постоянном давлении первое начало термодинамики имеет вид: , где количество тепла , приращение внутренней энергии , работа . 2. Изохорный процесс (V=const). Из уравнения состояния и . В изохорном процессе работа А=0. Поэтому получаемое системой количество тепла идет на изменение ее внутренней энергии . 3. Изотермический процесс (Т=const). В изотермическом процессе , внутренняя энергия системы не меняется DU=0 и получаемое количество тепла идет на
 Термодинамика совершение системой работы. 4. Адиабатический процесс (Q=0). В адиабатическом процессе отсутствует теплообмен с внешней средой, а работа может совершаться системой за счет уменьшения ее внутренней энергии . Получим уравнение адиабатического процесса. Запишем дифференциал уравнения состояния идеального газа и уравнение первого начала термодинамики . Разделив первое уравнение на второе, получим , откуда , и Это есть уравнение адиабаты или уравнение Пуассона, где - показатель адиабаты ( ). График адиабатического процесса в координатах p и V идет круче графика изотермического процесса.
Термодинамика совершение системой работы. 4. Адиабатический процесс (Q=0). В адиабатическом процессе отсутствует теплообмен с внешней средой, а работа может совершаться системой за счет уменьшения ее внутренней энергии . Получим уравнение адиабатического процесса. Запишем дифференциал уравнения состояния идеального газа и уравнение первого начала термодинамики . Разделив первое уравнение на второе, получим , откуда , и Это есть уравнение адиабаты или уравнение Пуассона, где - показатель адиабаты ( ). График адиабатического процесса в координатах p и V идет круче графика изотермического процесса.
 Термодинамика координатах p и V идет круче графика изотермического процесса. Выразив давление из уравнения состояния , и подставив в уравнение адиабаты, получим . Выразив аналогичным образом объем , для уравнения адиабаты в координатах p и T, получим
Термодинамика координатах p и V идет круче графика изотермического процесса. Выразив давление из уравнения состояния , и подставив в уравнение адиабаты, получим . Выразив аналогичным образом объем , для уравнения адиабаты в координатах p и T, получим
 Термодинамика Работа в адиабатическом процессе Получим выражение для работы в адиабатическом процессе. Из уравнения адиабатического процесса , найдем , и Круговые процессы (циклы) Обратимый – процесс, способный протекать как в прямом, так и в обратном направлении. В противном случае – процесс необратимый. Пример – движение тела, брошенного под углом к горизонту возможно и в обратном направлении. Расширение газа в вакуум – пример необратимого процесса. Круговой процесс или цикл – процесс, периодически повторящийся во времени, при котором система или тепловая машина проходит через одни и те же начальные и конечные состояния. Работа,
Термодинамика Работа в адиабатическом процессе Получим выражение для работы в адиабатическом процессе. Из уравнения адиабатического процесса , найдем , и Круговые процессы (циклы) Обратимый – процесс, способный протекать как в прямом, так и в обратном направлении. В противном случае – процесс необратимый. Пример – движение тела, брошенного под углом к горизонту возможно и в обратном направлении. Расширение газа в вакуум – пример необратимого процесса. Круговой процесс или цикл – процесс, периодически повторящийся во времени, при котором система или тепловая машина проходит через одни и те же начальные и конечные состояния. Работа,
 Термодинамика Коэффициент полезного действия тепловой машины. Всякий двигатель или тепловая машина – система, совершающая цикл. Для получения отличной от нуля работы за цикл, необходимо, чтобы давление, а, следовательно, и температура в процессе расширения было больше, чем при сжатии, поэтому на участке 1 -2 в систему необходимо подводить количество тепла Q 1, а на участке 2 -1 отбирать количество тепла Q 2. Работа за цикл равна Коэффициент полезного действия тепловой машины Холодильная машина забирает на участке 2 -1 тепло от менее нагретого тела и передает его более нагретому телу за счет работы, совершаемой над системой
Термодинамика Коэффициент полезного действия тепловой машины. Всякий двигатель или тепловая машина – система, совершающая цикл. Для получения отличной от нуля работы за цикл, необходимо, чтобы давление, а, следовательно, и температура в процессе расширения было больше, чем при сжатии, поэтому на участке 1 -2 в систему необходимо подводить количество тепла Q 1, а на участке 2 -1 отбирать количество тепла Q 2. Работа за цикл равна Коэффициент полезного действия тепловой машины Холодильная машина забирает на участке 2 -1 тепло от менее нагретого тела и передает его более нагретому телу за счет работы, совершаемой над системой
 Термодинамика Формулировка первого начала термодинамика Невозможен периодически действующий двигатель, который совершал бы работу, большую, чем получаемая извне энергия (вечный двигатель 1 рода) Формулировка второго начала термодинамика Невозможны процессы, которые полностью превращали бы отбираемое от некоторого тела тепло в работу (вечный двигатель 2 рода). Цикл Карно Можно показать, что обратимый цикл, совершаемый системой, вступающей в теплообмен с двумя тепловыми резервуарами бесконечно большой теплоемкости, может состоять только из двух изотерм и двух адиабат. Коэффициент полезного действия тепловой машины, работающей по циклу Карно.
Термодинамика Формулировка первого начала термодинамика Невозможен периодически действующий двигатель, который совершал бы работу, большую, чем получаемая извне энергия (вечный двигатель 1 рода) Формулировка второго начала термодинамика Невозможны процессы, которые полностью превращали бы отбираемое от некоторого тела тепло в работу (вечный двигатель 2 рода). Цикл Карно Можно показать, что обратимый цикл, совершаемый системой, вступающей в теплообмен с двумя тепловыми резервуарами бесконечно большой теплоемкости, может состоять только из двух изотерм и двух адиабат. Коэффициент полезного действия тепловой машины, работающей по циклу Карно.
 Термодинамика На участке 1 -2 (изотерма T 1) система получает от нагревателя количество тепла а на участке 3 -4 (изотерма T 2) система отдает холодильнику количество тепла .
Термодинамика На участке 1 -2 (изотерма T 1) система получает от нагревателя количество тепла а на участке 3 -4 (изотерма T 2) система отдает холодильнику количество тепла .
 Термодинамика Коэффициент полезного действия равен . Запишем уравнение адиабатического процесса в координатах T и V для участков цикла Карно 2 -1 и 3 -4 . Разделив первое уравнение на второе, получим: . Тогда .
Термодинамика Коэффициент полезного действия равен . Запишем уравнение адиабатического процесса в координатах T и V для участков цикла Карно 2 -1 и 3 -4 . Разделив первое уравнение на второе, получим: . Тогда .
 Термодинамика Приведенное количество тепла. Неравенство Клаузиуса. Можно показать, что к. п. д. необратимой тепловой машины меньше, чем у обратимой . Преобразуем это соотношение: , и . Если учитывать знаки у и - положительный у , означающий поступление тепла в систему и отрицательный у , означающий, что система отдает тепло, то можно получить, неравенство Клаузиуса. Отношение называют приведенным количеством тепла.
Термодинамика Приведенное количество тепла. Неравенство Клаузиуса. Можно показать, что к. п. д. необратимой тепловой машины меньше, чем у обратимой . Преобразуем это соотношение: , и . Если учитывать знаки у и - положительный у , означающий поступление тепла в систему и отрицательный у , означающий, что система отдает тепло, то можно получить, неравенство Клаузиуса. Отношение называют приведенным количеством тепла.
 Термодинамика • Если система в ходе цикла вступает в теплообмен с двумя, а с N тепловыми резервуарами, причем от тела с температурой Тi получает (отдает) количество тепла DQi, (которое может быть как положительным, так и отрицательным), то должно выполняться следующе условие В реальных условиях процесс передачи или получения тепла происходит с изменяющейся температурой (при получении небольшой порции тепла температура системы незначительно повышается, и следующая порция тепла передается при большей температуре). Поэтому суммирование следует заменить интегрированием по всем элементам кругового процесса • Энтропия • Выделим на произвольном обратимом цикле две точки и опустим
Термодинамика • Если система в ходе цикла вступает в теплообмен с двумя, а с N тепловыми резервуарами, причем от тела с температурой Тi получает (отдает) количество тепла DQi, (которое может быть как положительным, так и отрицательным), то должно выполняться следующе условие В реальных условиях процесс передачи или получения тепла происходит с изменяющейся температурой (при получении небольшой порции тепла температура системы незначительно повышается, и следующая порция тепла передается при большей температуре). Поэтому суммирование следует заменить интегрированием по всем элементам кругового процесса • Энтропия • Выделим на произвольном обратимом цикле две точки и опустим
 Термодинамика суммирование по i. Эти точки делят цикл на 2 части I и II. Сумма приведенных количеств тепла, взятая по всему циклу равна нулю , откуда и . Процесс обратный передаче системой тепла есть процесс получения тепла, поэтому и суммирование не зависит от пути, по которому совершается обратимый процесс из состояния 1 в состояние 2. Следовательно,
Термодинамика суммирование по i. Эти точки делят цикл на 2 части I и II. Сумма приведенных количеств тепла, взятая по всему циклу равна нулю , откуда и . Процесс обратный передаче системой тепла есть процесс получения тепла, поэтому и суммирование не зависит от пути, по которому совершается обратимый процесс из состояния 1 в состояние 2. Следовательно,
 Термодинамика есть приращение некоторой функции состояния, которая называется энтропией. Более строго энтропия определяется следующим соотношением Энтропия обладает свойством аддитивности: , где энтропия системы, - энтропия частей системы. Выясним, как меняется энтропия при необратимом процессе. Пусть одна из частей рассмотренного цикла 1 -2 будет необратимой, а часть 2 -1 по-прежнему обратимой, тогда . Разобьем эту сумму на 2 слагаемых:
Термодинамика есть приращение некоторой функции состояния, которая называется энтропией. Более строго энтропия определяется следующим соотношением Энтропия обладает свойством аддитивности: , где энтропия системы, - энтропия частей системы. Выясним, как меняется энтропия при необратимом процессе. Пусть одна из частей рассмотренного цикла 1 -2 будет необратимой, а часть 2 -1 по-прежнему обратимой, тогда . Разобьем эту сумму на 2 слагаемых:
 Термодинамика Вторая сумма равна изменению энтропии, поэтому , откуда . Если объединить этот результат с выражением для обратимого цикла, получим: , где знак равенства берется для обратимого перехода 1 -2, а неравенства для необратимого. Для изолированной системы, у которой нет теплообмена с внешней средой,
Термодинамика Вторая сумма равна изменению энтропии, поэтому , откуда . Если объединить этот результат с выражением для обратимого цикла, получим: , где знак равенства берется для обратимого перехода 1 -2, а неравенства для необратимого. Для изолированной системы, у которой нет теплообмена с внешней средой,
 Термодинамика Таким образом, энтропия изолированной системы может только возрастать в случае необратимого процесса и оставаться постоянной для обратимого. Это есть формулировка второго начала термодинамики. Процесс, проходящий без теплообмена с внешней средой – адиабатический и он идет при постоянной энтропии. Цикл Карно на диаграмме T, S представляет прямоугольник. Здесь S 1 - энтропия в начальном состоянии, S 2 - энтропия в конечном состоянии, T 1 – температура нагревателя, T 2 – температура холодильника.
Термодинамика Таким образом, энтропия изолированной системы может только возрастать в случае необратимого процесса и оставаться постоянной для обратимого. Это есть формулировка второго начала термодинамики. Процесс, проходящий без теплообмена с внешней средой – адиабатический и он идет при постоянной энтропии. Цикл Карно на диаграмме T, S представляет прямоугольник. Здесь S 1 - энтропия в начальном состоянии, S 2 - энтропия в конечном состоянии, T 1 – температура нагревателя, T 2 – температура холодильника.
 Термодинамика За цикл тепловая машина получит количество тепла Q=Q 1+Q 2, где Q 2 - количество тепла, отдаваемого в холодильник, имеет отрицательный знак, поэтому Q – работа за цикл. Для коэффициента полезного действия получим: Найдем энтропию одного моля идеального газа где - постоянная. В силу аддитивности энтропия n молей газа равна . Определим энтропию в переменных p и V, для чего выразим температуру из уравнения cостояния идеального газа
Термодинамика За цикл тепловая машина получит количество тепла Q=Q 1+Q 2, где Q 2 - количество тепла, отдаваемого в холодильник, имеет отрицательный знак, поэтому Q – работа за цикл. Для коэффициента полезного действия получим: Найдем энтропию одного моля идеального газа где - постоянная. В силу аддитивности энтропия n молей газа равна . Определим энтропию в переменных p и V, для чего выразим температуру из уравнения cостояния идеального газа
 Термодинамика и подставим ее уравнение для : где - новая постоянная. Аналогичным образом для энтропии в переменных p и T получим Статистический смысл энтропии. Больцман установил, что энтропия имеет следующий статистический смысл , где k – постоянная Больцмана, W – термодинамическая вероятность состояния системы – число способов реализации данного состояния системы. Рассмотрим различные способы распределения 4 молекул газа по правой и левой частям сосуда. Результаты распределения представлены в таблице.
Термодинамика и подставим ее уравнение для : где - новая постоянная. Аналогичным образом для энтропии в переменных p и T получим Статистический смысл энтропии. Больцман установил, что энтропия имеет следующий статистический смысл , где k – постоянная Больцмана, W – термодинамическая вероятность состояния системы – число способов реализации данного состояния системы. Рассмотрим различные способы распределения 4 молекул газа по правой и левой частям сосуда. Результаты распределения представлены в таблице.
 Термодинамика Способы реализации Состояние Число молекул слева 0 состояния Число молекул справа способов Номе ра молекул данного слева справа состояния (W) 1, 2, 4 1, 2, 3 3, 4 2, 4 1, 4 2, 3 1, 4 1, 3 1, 2 4 1, 2, 4 3 1, 3, 4 2 2, 3, 4 0 3 1, 2, 3 4 1, 3, 4 1 2 2, 4 3 2, 3, 4 1, 3 2 1, 2, 3, 4 1, 2 2 - 4 3 реализации ра молекул 1 1 4 Номе Число 1 1, 2, 3, 4 - Всего способов 1 4 6 4 1 W=24 =16 Для одного моля кислорода при комнатной температуре термодинамическая вероятность состояния системы представляет собой астрономическое число
Термодинамика Способы реализации Состояние Число молекул слева 0 состояния Число молекул справа способов Номе ра молекул данного слева справа состояния (W) 1, 2, 4 1, 2, 3 3, 4 2, 4 1, 4 2, 3 1, 4 1, 3 1, 2 4 1, 2, 4 3 1, 3, 4 2 2, 3, 4 0 3 1, 2, 3 4 1, 3, 4 1 2 2, 4 3 2, 3, 4 1, 3 2 1, 2, 3, 4 1, 2 2 - 4 3 реализации ра молекул 1 1 4 Номе Число 1 1, 2, 3, 4 - Всего способов 1 4 6 4 1 W=24 =16 Для одного моля кислорода при комнатной температуре термодинамическая вероятность состояния системы представляет собой астрономическое число
 Реальные газы Поведение реальных газов довольно хорошо описывается уравнением состояния идеального газа лишь при не слишком больших давлениях и достаточно высоких температурах. При увеличении давления газа и уменьшением температуры наблюдается отклонение от уравнения состояния идеального газа. В таблице представлены значения произведения для 1 л азота при нормальных условиях. При давлении 1000 атмосфер отклонение составляет 100%. С ростом давления увеличивается плотность газа, расстояние между
Реальные газы Поведение реальных газов довольно хорошо описывается уравнением состояния идеального газа лишь при не слишком больших давлениях и достаточно высоких температурах. При увеличении давления газа и уменьшением температуры наблюдается отклонение от уравнения состояния идеального газа. В таблице представлены значения произведения для 1 л азота при нормальных условиях. При давлении 1000 атмосфер отклонение составляет 100%. С ростом давления увеличивается плотность газа, расстояние между
 Реальные газы молекулами уменьшается, поэтому объем молекул и взаимодействие между ними на расстоянии начинают играть существенную роль. Запишем уравнение состояния для одного моля идеального газа в следующем виде Учет объема молекул приводит к тому, что газ можно сжать только до некоторого объема b. Этот объем не является суммарным объемом всех молекул, поскольку их невозможно расположить так, чтобы между ними не осталось свободного места.
Реальные газы молекулами уменьшается, поэтому объем молекул и взаимодействие между ними на расстоянии начинают играть существенную роль. Запишем уравнение состояния для одного моля идеального газа в следующем виде Учет объема молекул приводит к тому, что газ можно сжать только до некоторого объема b. Этот объем не является суммарным объемом всех молекул, поскольку их невозможно расположить так, чтобы между ними не осталось свободного места.
 Реальные газы Из рисунка видно, что для двух изображенных на нем молекул недоступным является объем , где d – эффективный диаметр молекулы, V – ее объем. В расчете на одну молекулу недоступным является учетверенный объем молекулы, поэтому , где V 0 – суммарный объем всех молекул одного моля газа и . Притяжение молекул происходит в пределах радиуса действия молекулярных сил r 0. Если представить слой молекул толщиной r 0, находящийся у стенки сосуда, то он будет притягиваться соседним слоем и «оттягивать» первый слой от стенки, уменьшая давление. Можно показать, что учет сил межмолекулярного взаимодействия приведет к уменьшению давления на стенку на величину , тогда
Реальные газы Из рисунка видно, что для двух изображенных на нем молекул недоступным является объем , где d – эффективный диаметр молекулы, V – ее объем. В расчете на одну молекулу недоступным является учетверенный объем молекулы, поэтому , где V 0 – суммарный объем всех молекул одного моля газа и . Притяжение молекул происходит в пределах радиуса действия молекулярных сил r 0. Если представить слой молекул толщиной r 0, находящийся у стенки сосуда, то он будет притягиваться соседним слоем и «оттягивать» первый слой от стенки, уменьшая давление. Можно показать, что учет сил межмолекулярного взаимодействия приведет к уменьшению давления на стенку на величину , тогда
 Реальные газы Преобразуя последнее уравнение, получим уравнение Ван-дер Ваальса , где a и b – постоянные Ван-дер Ваальса с размерностью . Запишем это уравнение для произвольной массы газа, используя соотношение : , где , . При уменьшении плотности газа уравнение Ван-дер Ваальса переходит в уравнение состояния идеального газа. Раскрыв скобки в уравнении Ван-дер Ваальса и умножив его на V 2, получим Это уравнение третьей степени относительно V, с вещественными коэффициентами и свободным членом, имеет три решения:
Реальные газы Преобразуя последнее уравнение, получим уравнение Ван-дер Ваальса , где a и b – постоянные Ван-дер Ваальса с размерностью . Запишем это уравнение для произвольной массы газа, используя соотношение : , где , . При уменьшении плотности газа уравнение Ван-дер Ваальса переходит в уравнение состояния идеального газа. Раскрыв скобки в уравнении Ван-дер Ваальса и умножив его на V 2, получим Это уравнение третьей степени относительно V, с вещественными коэффициентами и свободным членом, имеет три решения:
 Реальные газы . В зависимости от величины коэффициентов либо все три решения будут вещественными, либо одно будет вещественным, а два других комплексными. Объем является вещественным, поэтому комплексные решения физического смысла не имеют. Теоретические изотермы Ван-дер-Ваальса представлены графике, где трем вещественным решениям соответствуют точки 1, 2, 3. Различие между этими решениями с ростом температуры уменьшается и при определенной температуре, называемой критической три решения сливаются в одно. При температурах выше критической уравнение имеет только одно решение.
Реальные газы . В зависимости от величины коэффициентов либо все три решения будут вещественными, либо одно будет вещественным, а два других комплексными. Объем является вещественным, поэтому комплексные решения физического смысла не имеют. Теоретические изотермы Ван-дер-Ваальса представлены графике, где трем вещественным решениям соответствуют точки 1, 2, 3. Различие между этими решениями с ростом температуры уменьшается и при определенной температуре, называемой критической три решения сливаются в одно. При температурах выше критической уравнение имеет только одно решение.
 Реальные газы Рис. а
Реальные газы Рис. а
 Реальные газы Точка К на критической изотерме является точкой перегиба и соответствует критическим величинам давления и объема. В этой точке первая и вторая производные и обращаются в ноль. Дифференцируя , получим: Решая эту систему уравнений, найдем: . Для критической точки можно написать следующее соотношение , которое показывает расхождение с уравнением состояния идеального газа на 62, 5%.
Реальные газы Точка К на критической изотерме является точкой перегиба и соответствует критическим величинам давления и объема. В этой точке первая и вторая производные и обращаются в ноль. Дифференцируя , получим: Решая эту систему уравнений, найдем: . Для критической точки можно написать следующее соотношение , которое показывает расхождение с уравнением состояния идеального газа на 62, 5%.
 Реальные газы Экспериметальные изотермы Ван-дер Ваальса. На изотермах ниже критической имеется участок 2 -4, на котором давление растет с увеличением объема. Такие состояния в природе существовать не могут. Существование заведомо нереализуемого участка означает, что вещество не может все время оставаться в однородном виде; в некоторый момент должно наступить скачкообразное изменение состояния и расслоение вещества на две фазы. Фазой в термодинамике называют часть системы однородной по физическим свойствам. Изотерма при этом должна иметь вид ломаной линии с горизонтальным изобарным участком, что и наблюдается на экспериментальных изотермах. Горизонтальная часть изотермы 1 -5 соответствует двухфазному состоянию вещества. Начиная с точки, при уменьшении объема вещество начинает переходить в жидкую фазу. Этот переход заканчивается в точке 1. При дальней-шем уменьшении объема изотерма описывает сжатие жидкости. На участке 1 -5 жидкая и газообразная фазы находятся в равновесии, а газ называют насыщенным паром. На рисунке б точки
Реальные газы Экспериметальные изотермы Ван-дер Ваальса. На изотермах ниже критической имеется участок 2 -4, на котором давление растет с увеличением объема. Такие состояния в природе существовать не могут. Существование заведомо нереализуемого участка означает, что вещество не может все время оставаться в однородном виде; в некоторый момент должно наступить скачкообразное изменение состояния и расслоение вещества на две фазы. Фазой в термодинамике называют часть системы однородной по физическим свойствам. Изотерма при этом должна иметь вид ломаной линии с горизонтальным изобарным участком, что и наблюдается на экспериментальных изотермах. Горизонтальная часть изотермы 1 -5 соответствует двухфазному состоянию вещества. Начиная с точки, при уменьшении объема вещество начинает переходить в жидкую фазу. Этот переход заканчивается в точке 1. При дальней-шем уменьшении объема изотерма описывает сжатие жидкости. На участке 1 -5 жидкая и газообразная фазы находятся в равновесии, а газ называют насыщенным паром. На рисунке б точки
 Реальные газы Рис. б изотерм соединены кривой. Она ограничивает слева до критической изотермы область жидкого состояния вещества. Между кривой и критической изотермой справа находится область газообразного (ненасыщенный пар) состояния, а внутри кривой заключена область двухфазного состояния вещества (жидкость + газ). Область выше критической изотермы соответствует газообразному состоянию, которое нельзя изотермически перевести в двухфазное состояние
Реальные газы Рис. б изотерм соединены кривой. Она ограничивает слева до критической изотермы область жидкого состояния вещества. Между кривой и критической изотермой справа находится область газообразного (ненасыщенный пар) состояния, а внутри кривой заключена область двухфазного состояния вещества (жидкость + газ). Область выше критической изотермы соответствует газообразному состоянию, которое нельзя изотермически перевести в двухфазное состояние
 Реальные газы жидкость –пар. Участки изотерм 1 -2 и 4 -5 (рис. а) описывают метастабильные (неустойчивые) со-стояния, из которых система достаточно быстро переходит в устойчивое состояние. Состояния на участке 1 -2 называют перегретой жидкостью, а на участке 4 -5 переохлажденным паром. В таблице приведены критические температуры для нескольких газов и температура их сжижения. Внутренняя энергия реального газа включает в себя не только кинетическую энергию движения молекул, но и потенциальную энергию их взаимодействия (притяжения) на расстоянии. Действие
Реальные газы жидкость –пар. Участки изотерм 1 -2 и 4 -5 (рис. а) описывают метастабильные (неустойчивые) со-стояния, из которых система достаточно быстро переходит в устойчивое состояние. Состояния на участке 1 -2 называют перегретой жидкостью, а на участке 4 -5 переохлажденным паром. В таблице приведены критические температуры для нескольких газов и температура их сжижения. Внутренняя энергия реального газа включает в себя не только кинетическую энергию движения молекул, но и потенциальную энергию их взаимодействия (притяжения) на расстоянии. Действие
 Реальные газы этих сил приводит к уменьшению давления на величину . При расширении реального газа должна быть совершена работа против межмолекулярных сил, равная приращению потенциальной энергии молекул Интегрирование этого равенства дает следующее выражение для потенциальной энергии . При возрастании объема до бесконечности газ должен становиться идеальным и потенциальная энергия его молекул должна стремиться к нулю. Поэтому постоянную интегрирования нужно положить равной нулю. Тогда внутренняя энергия одного моля реального газа равна .
Реальные газы этих сил приводит к уменьшению давления на величину . При расширении реального газа должна быть совершена работа против межмолекулярных сил, равная приращению потенциальной энергии молекул Интегрирование этого равенства дает следующее выражение для потенциальной энергии . При возрастании объема до бесконечности газ должен становиться идеальным и потенциальная энергия его молекул должна стремиться к нулю. Поэтому постоянную интегрирования нужно положить равной нулю. Тогда внутренняя энергия одного моля реального газа равна .
 Жидкости Жидкое состояние вещества занимает промежуточное положение между газами и твердыми телами. Жидкости, как и твердые тела имеют определенный объем, и вместе с тем подобно газу, принимают форму того сосуда, в котором находятся. Кристаллическое состояние характеризуется упорядоченным размещением атомов или молекул (дальний порядок), а в газах их расположение хаотично. Рентгенографические исследования жидкостей показывают, что в расположении их молекул наблюдается ближний порядок. Это означает, что по отношению к любой молекуле положение ближайших к ней соседей является упорядоченным. Однако по мере удаления от этой молекулы порядок в расположении частиц довольно быстро полностью исчезает. Молекула большую часть времени совершает колебания вблизи некоторого положения равновесия, а затем скачком меняет его и начинает колебаться относительно этого нового положения. Силы притяжения между молекулами жидкости действуют в пределах расстояния r 0, называемого радиусом молекулярного
Жидкости Жидкое состояние вещества занимает промежуточное положение между газами и твердыми телами. Жидкости, как и твердые тела имеют определенный объем, и вместе с тем подобно газу, принимают форму того сосуда, в котором находятся. Кристаллическое состояние характеризуется упорядоченным размещением атомов или молекул (дальний порядок), а в газах их расположение хаотично. Рентгенографические исследования жидкостей показывают, что в расположении их молекул наблюдается ближний порядок. Это означает, что по отношению к любой молекуле положение ближайших к ней соседей является упорядоченным. Однако по мере удаления от этой молекулы порядок в расположении частиц довольно быстро полностью исчезает. Молекула большую часть времени совершает колебания вблизи некоторого положения равновесия, а затем скачком меняет его и начинает колебаться относительно этого нового положения. Силы притяжения между молекулами жидкости действуют в пределах расстояния r 0, называемого радиусом молекулярного
 Жидкости • действия и составляющего несколько эффективных диаметров молекулы. Результирующая сила, действующая на молекулу внутри жидкости в пределахr 0 со стороны ее соседей равна нулю, а на поверхности жидкости не равна нулю и направлена вниз (концентрация молекул насыщенного пара значительно меньше концентрации молекул жидкости). Чтобы попасть на поверхность молекула должна совершить работу против этой силы за счет кинетической энергией теплового движения. В результате ее потенциальная энергия молекулярного взаимодействия увеличивается (становится менее отрицательной) и молекулы поверхностного слоя обладают большей энергией по сравнению с энерги ей молекул внутри жидкости. Эта энергия пропорциональна площади слоя и называется поверхностной энергией. , где S – площадь поверхности, s - коэффициент поверхностного натяжения.
Жидкости • действия и составляющего несколько эффективных диаметров молекулы. Результирующая сила, действующая на молекулу внутри жидкости в пределахr 0 со стороны ее соседей равна нулю, а на поверхности жидкости не равна нулю и направлена вниз (концентрация молекул насыщенного пара значительно меньше концентрации молекул жидкости). Чтобы попасть на поверхность молекула должна совершить работу против этой силы за счет кинетической энергией теплового движения. В результате ее потенциальная энергия молекулярного взаимодействия увеличивается (становится менее отрицательной) и молекулы поверхностного слоя обладают большей энергией по сравнению с энерги ей молекул внутри жидкости. Эта энергия пропорциональна площади слоя и называется поверхностной энергией. , где S – площадь поверхности, s - коэффициент поверхностного натяжения.
 Жидкости • В равновесном состоянии жидкость стремится занять положение с наименьшей поверхностной энергией, т. е. с наименьшей площадью поверхности. При данном объеме минимальной площадью обладает поверхность сферы. Именно такую форму принимают маленькие капельки ртути, однако, большие капли за счет действия силы тяжести имеют вид сплюснутой сферы. В невесомости любой объем жидкости принимает сферическую форму. Таким образом, поверхность жидкости стремится умень-шиться, что приводит к появлению сил поверхностного натяжения. Рассмотрим пленку жидкости, натянутую на плоскую проволочную рамку, одна из сторон которой, длиной l перемещается. Благодаря стремлению поверхности уменьшиться на подвижную сторону рам-
Жидкости • В равновесном состоянии жидкость стремится занять положение с наименьшей поверхностной энергией, т. е. с наименьшей площадью поверхности. При данном объеме минимальной площадью обладает поверхность сферы. Именно такую форму принимают маленькие капельки ртути, однако, большие капли за счет действия силы тяжести имеют вид сплюснутой сферы. В невесомости любой объем жидкости принимает сферическую форму. Таким образом, поверхность жидкости стремится умень-шиться, что приводит к появлению сил поверхностного натяжения. Рассмотрим пленку жидкости, натянутую на плоскую проволочную рамку, одна из сторон которой, длиной l перемещается. Благодаря стремлению поверхности уменьшиться на подвижную сторону рам-
 Жидкости ки будет действовать сила, которую можно измерить. Она равна . Поверхностная энергия растет с увеличением площади пленки. Поэтому знак минус означает, что сила направлена внутрь поверхности пленки. Таким образом, коэффициент поверхностного натяжения можно определить через поверхностную энергию или через силу поверхностного натяжения, и он измеряется в Дж/м 2 или в Н/м. В таблице приведены коэффициенты поверхностного натяжения s нескольких веществ.
Жидкости ки будет действовать сила, которую можно измерить. Она равна . Поверхностная энергия растет с увеличением площади пленки. Поэтому знак минус означает, что сила направлена внутрь поверхности пленки. Таким образом, коэффициент поверхностного натяжения можно определить через поверхностную энергию или через силу поверхностного натяжения, и он измеряется в Дж/м 2 или в Н/м. В таблице приведены коэффициенты поверхностного натяжения s нескольких веществ.
 Жидкости Вещество s ( Н/м) Ртуть 0, 490 Вода 0, 073 Бензол 0, 029 Спирт 0, 023 Эфир 0, 020 Добавление на поверхность жидкости поверхностно-активных веществ (ПАВ) приводит к уменьшению коэффициента поверхностного натяжения. Молекулы ПАВ, смешиваясь с молекулами жидкости, уменьшают силы межмолекулярного взаимодействия. С ростом температуры различие в плотности жидкости и ее насыщенного пара снижается, что приводит к уменьшению коэффициента поверхностного натяжения, а при критической температуре он обращается в ноль.
Жидкости Вещество s ( Н/м) Ртуть 0, 490 Вода 0, 073 Бензол 0, 029 Спирт 0, 023 Эфир 0, 020 Добавление на поверхность жидкости поверхностно-активных веществ (ПАВ) приводит к уменьшению коэффициента поверхностного натяжения. Молекулы ПАВ, смешиваясь с молекулами жидкости, уменьшают силы межмолекулярного взаимодействия. С ростом температуры различие в плотности жидкости и ее насыщенного пара снижается, что приводит к уменьшению коэффициента поверхностного натяжения, а при критической температуре он обращается в ноль.
 Жидкости Явления на границе жидкости и твердого тела. Смачивание Рассмотрим каплю жидкости на поверхности твердого тела. Поверхности и жидкости и твердого тела стремятся уменьшиться и принимают форму, соответствующую минимуму потенциальной энергии. Обозначим коэффициент поверхностного натяжения на границе твердое тело – газ sтг, на границе твердое тело – жидкость sтж и на границе жидкость – газ sжг. Капля находится в равновесном состоянии, если действующая на нее результирующая сила по горизонтали - вдоль поверхности твердого тела равна нулю (соответствующая вертикальная составляющая уравновешивается силой тяжести). Тогда силы, действующие на элемент контура капли удовлетворяют уравнению
Жидкости Явления на границе жидкости и твердого тела. Смачивание Рассмотрим каплю жидкости на поверхности твердого тела. Поверхности и жидкости и твердого тела стремятся уменьшиться и принимают форму, соответствующую минимуму потенциальной энергии. Обозначим коэффициент поверхностного натяжения на границе твердое тело – газ sтг, на границе твердое тело – жидкость sтж и на границе жидкость – газ sжг. Капля находится в равновесном состоянии, если действующая на нее результирующая сила по горизонтали - вдоль поверхности твердого тела равна нулю (соответствующая вертикальная составляющая уравновешивается силой тяжести). Тогда силы, действующие на элемент контура капли удовлетворяют уравнению
 Жидкости , где q - краевой угол (между касательными к поверхности твердого тела и жидкости). • Если это условие не выполняется, то , что возможно в двух случаях: 1. Сила, действующая на границе твердое тело – газ заставляет каплю жидкости растекаться по поверхности твердого тела (q=0), и наблюдается полное смачивание. При 0< q < p/2 говорят о неполном смачивании. 2. • Сила, действующая на границе твердое тело – жидкость заставляет каплю жидкости касаться поверхности твердого тела только в одной точке (q =p) и наблюдается полное несмачивание. При p/2< q < p говорят о неполном несмачивании.
Жидкости , где q - краевой угол (между касательными к поверхности твердого тела и жидкости). • Если это условие не выполняется, то , что возможно в двух случаях: 1. Сила, действующая на границе твердое тело – газ заставляет каплю жидкости растекаться по поверхности твердого тела (q=0), и наблюдается полное смачивание. При 0< q < p/2 говорят о неполном смачивании. 2. • Сила, действующая на границе твердое тело – жидкость заставляет каплю жидкости касаться поверхности твердого тела только в одной точке (q =p) и наблюдается полное несмачивание. При p/2< q < p говорят о неполном несмачивании.
 Жидкости Давление под изогнутой поверхностью жидкости. Если поверхность жидкости не плоская, то тенденция к ее сокращению приводит к созданию дополнительного давления по отношению к давлению под плоской поверхностью ( см. рисунок). Для выпуклой поверхности оно положительно, а для вогнутой – отрицательно (поверхностный слой стремится сократиться, растягивая жидкость. Для определения добавочного давления Dp под изогнутой поверхностью рассмотрим сферическую каплю жидкости, рассеченную на две части в диаметральной плоскости. Обе половинки сферы притягиваются друг к другу силами поверхностного натяжения , откуда для дополнительного давления получим: , • где R – радиус кривизны поверхности.
Жидкости Давление под изогнутой поверхностью жидкости. Если поверхность жидкости не плоская, то тенденция к ее сокращению приводит к созданию дополнительного давления по отношению к давлению под плоской поверхностью ( см. рисунок). Для выпуклой поверхности оно положительно, а для вогнутой – отрицательно (поверхностный слой стремится сократиться, растягивая жидкость. Для определения добавочного давления Dp под изогнутой поверхностью рассмотрим сферическую каплю жидкости, рассеченную на две части в диаметральной плоскости. Обе половинки сферы притягиваются друг к другу силами поверхностного натяжения , откуда для дополнительного давления получим: , • где R – радиус кривизны поверхности.
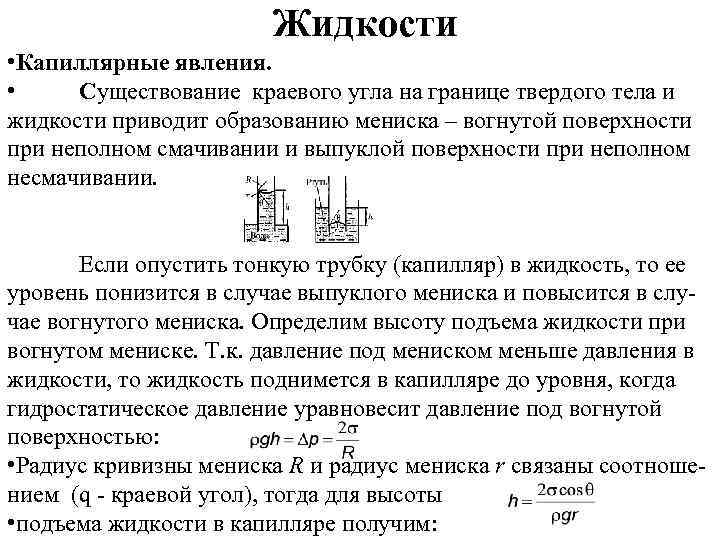 Жидкости • Капиллярные явления. • Существование краевого угла на границе твердого тела и жидкости приводит образованию мениска – вогнутой поверхности при неполном смачивании и выпуклой поверхности при неполном несмачивании. Если опустить тонкую трубку (капилляр) в жидкость, то ее уровень понизится в случае выпуклого мениска и повысится в случае вогнутого мениска. Определим высоту подъема жидкости при вогнутом мениске. Т. к. давление под мениском меньше давления в жидкости, то жидкость поднимется в капилляре до уровня, когда гидростатическое давление уравновесит давление под вогнутой поверхностью: • Радиус кривизны мениска R и радиус мениска r связаны соотношением (q - краевой угол), тогда для высоты • подъема жидкости в капилляре получим:
Жидкости • Капиллярные явления. • Существование краевого угла на границе твердого тела и жидкости приводит образованию мениска – вогнутой поверхности при неполном смачивании и выпуклой поверхности при неполном несмачивании. Если опустить тонкую трубку (капилляр) в жидкость, то ее уровень понизится в случае выпуклого мениска и повысится в случае вогнутого мениска. Определим высоту подъема жидкости при вогнутом мениске. Т. к. давление под мениском меньше давления в жидкости, то жидкость поднимется в капилляре до уровня, когда гидростатическое давление уравновесит давление под вогнутой поверхностью: • Радиус кривизны мениска R и радиус мениска r связаны соотношением (q - краевой угол), тогда для высоты • подъема жидкости в капилляре получим:


