 Молекулярная физика и термодинамика
Молекулярная физика и термодинамика
 Методы изучения систем частиц: • динамический • термодинамический • статистический
Методы изучения систем частиц: • динамический • термодинамический • статистический
 Динамический метод Записываются уравнения движения для каждой частицы, входящей в систему и решается система уравнений 1 м 3 газа ~ 1026 частиц ~ 1026 уравнений 1 см 3 металла ~ 1030 электронов ~ 1030 уравнений Этот метод непригоден для описания систем, состоящих из большого числа частиц
Динамический метод Записываются уравнения движения для каждой частицы, входящей в систему и решается система уравнений 1 м 3 газа ~ 1026 частиц ~ 1026 уравнений 1 см 3 металла ~ 1030 электронов ~ 1030 уравнений Этот метод непригоден для описания систем, состоящих из большого числа частиц
 Статистический метод Состоит в том, что с помощью теории вероятностей вычисляют средние значения физических величин, характеризующие поведение всей системы частиц, и устанавливаются связи между ними. Статистические закономерности носят вероятностный характер
Статистический метод Состоит в том, что с помощью теории вероятностей вычисляют средние значения физических величин, характеризующие поведение всей системы частиц, и устанавливаются связи между ними. Статистические закономерности носят вероятностный характер
 Термодинамический метод Не рассматривается внутреннее строение изучаемой системы. Система рассматривается как единое целое. Изучаются законы превращения энергии из одного вида в другой и количественно описываются эти превращения.
Термодинамический метод Не рассматривается внутреннее строение изучаемой системы. Система рассматривается как единое целое. Изучаются законы превращения энергии из одного вида в другой и количественно описываются эти превращения.
 Термодинамическое описание коллектива частиц Термодинамическая система – Внешние тела (внешняя среда)Термодинамические параметры (параметры состояния)- обычно – объём, давление, температура. Объём V, [V] = м 3 Давление [P] = Па где d. Fn - модуль нормальной силы, действующей на малый участок поверхности площадью d. S
Термодинамическое описание коллектива частиц Термодинамическая система – Внешние тела (внешняя среда)Термодинамические параметры (параметры состояния)- обычно – объём, давление, температура. Объём V, [V] = м 3 Давление [P] = Па где d. Fn - модуль нормальной силы, действующей на малый участок поверхности площадью d. S
 Температура Термодинамическое равновесие. Абсолютная (термодинамическая) температура-
Температура Термодинамическое равновесие. Абсолютная (термодинамическая) температура-
 Молекулярная физика Идеальный газ -
Молекулярная физика Идеальный газ -
 Количество вещества Число, равное количеству частиц в 1 моле, называется числом Авогадро, то есть NA = 6, 0221367· 1023 моль– 1. N – число частиц в системе. Молярная масса - Концентрация частиц -
Количество вещества Число, равное количеству частиц в 1 моле, называется числом Авогадро, то есть NA = 6, 0221367· 1023 моль– 1. N – число частиц в системе. Молярная масса - Концентрация частиц -
 Основное уравнение молекулярнокинетической теории идеального газа
Основное уравнение молекулярнокинетической теории идеального газа
 Температура есть мера средней кинетической энергии поступательного движения молекул: где k =1, 38· 10 -23 Дж/К – постоянная Больцмана -уравнение Менделеева - Клапейрона -уравнение состояния идеального газа
Температура есть мера средней кинетической энергии поступательного движения молекул: где k =1, 38· 10 -23 Дж/К – постоянная Больцмана -уравнение Менделеева - Клапейрона -уравнение состояния идеального газа
 Газовые законы
Газовые законы
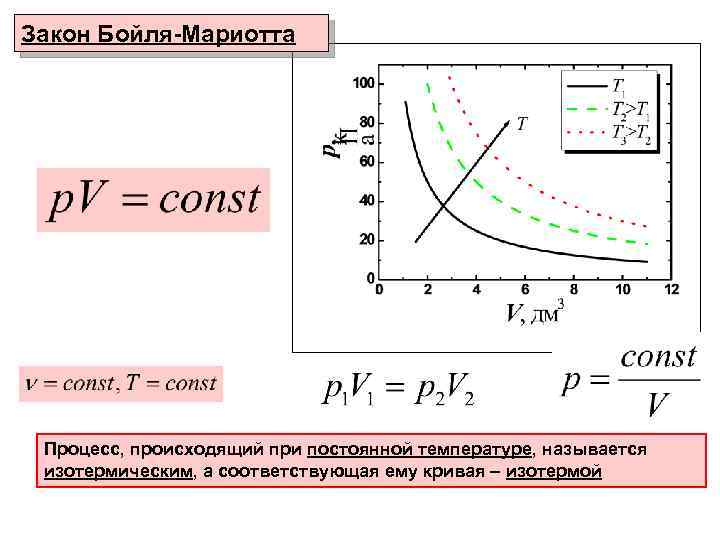 Закон Бойля-Мариотта Процесс, происходящий при постоянной температуре, называется изотермическим, а соответствующая ему кривая – изотермой
Закон Бойля-Мариотта Процесс, происходящий при постоянной температуре, называется изотермическим, а соответствующая ему кривая – изотермой
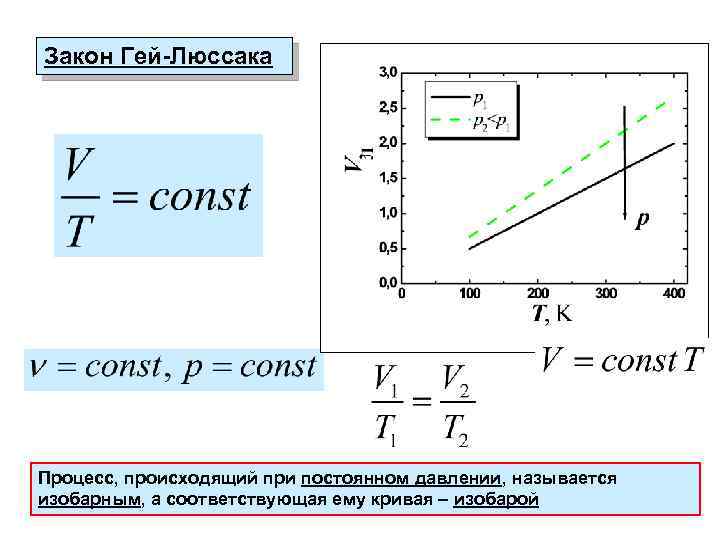 Закон Гей-Люссака Процесс, происходящий при постоянном давлении, называется изобарным, а соответствующая ему кривая – изобарой
Закон Гей-Люссака Процесс, происходящий при постоянном давлении, называется изобарным, а соответствующая ему кривая – изобарой
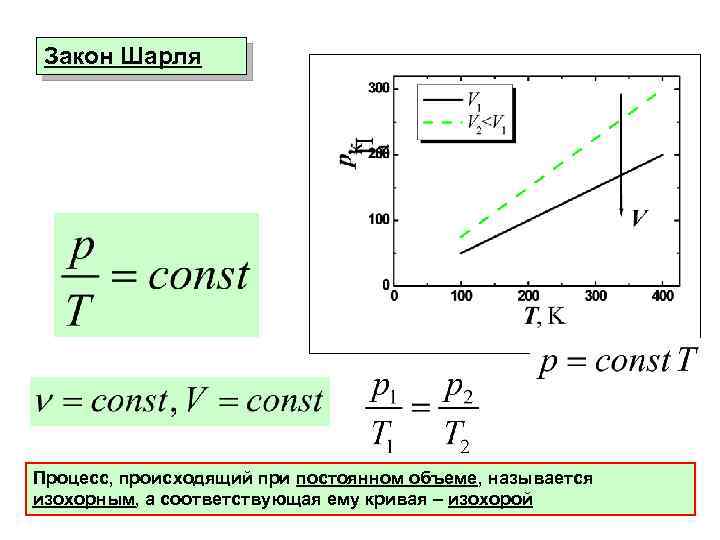 Закон Шарля Процесс, происходящий при постоянном объеме, называется изохорным, а соответствующая ему кривая – изохорой
Закон Шарля Процесс, происходящий при постоянном объеме, называется изохорным, а соответствующая ему кривая – изохорой
 Закон Авогадро: Один моль любого газа при нормальных условиях (давление p = 1 атм = 1, 013· 105 Па, температура t = 0 о. С или T = 273 К) занимает объем 22, 4 л.
Закон Авогадро: Один моль любого газа при нормальных условиях (давление p = 1 атм = 1, 013· 105 Па, температура t = 0 о. С или T = 273 К) занимает объем 22, 4 л.
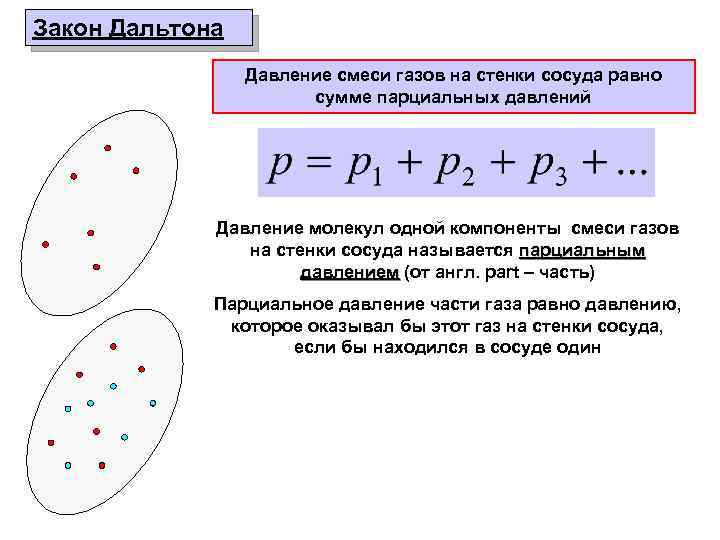 Закон Дальтона Давление смеси газов на стенки сосуда равно сумме парциальных давлений Давление молекул одной компоненты смеси газов на стенки сосуда называется парциальным давлением (от англ. part – часть) Парциальное давление части газа равно давлению, которое оказывал бы этот газ на стенки сосуда, если бы находился в сосуде один
Закон Дальтона Давление смеси газов на стенки сосуда равно сумме парциальных давлений Давление молекул одной компоненты смеси газов на стенки сосуда называется парциальным давлением (от англ. part – часть) Парциальное давление части газа равно давлению, которое оказывал бы этот газ на стенки сосуда, если бы находился в сосуде один