2ДЕ_МКТ и термодинамика готовый.ppt
- Количество слайдов: 52
 МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА (2 дидактическая единица)
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА (2 дидактическая единица)
 Распределения Максвелла и 7 Больцмана Молекулярная 8 Средняя энергия молекул (статистическая) 2 Второе начало термодинамики. физика и 9 термодинамика Энтропия. Циклы I начало термодинамики. Работа 10 при изопроцессах
Распределения Максвелла и 7 Больцмана Молекулярная 8 Средняя энергия молекул (статистическая) 2 Второе начало термодинамики. физика и 9 термодинамика Энтропия. Циклы I начало термодинамики. Работа 10 при изопроцессах
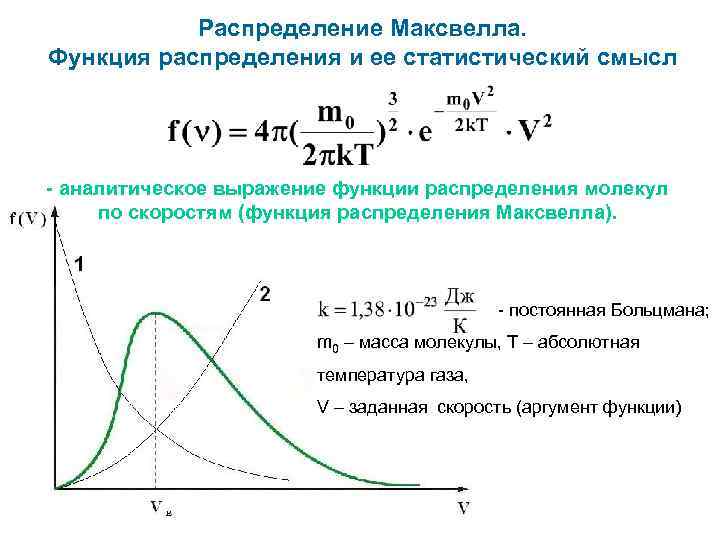 Распределение Максвелла. Функция распределения и ее статистический смысл - аналитическое выражение функции распределения молекул по скоростям (функция распределения Максвелла). - постоянная Больцмана; m 0 – масса молекулы, Т – абсолютная температура газа, V – заданная скорость (аргумент функции)
Распределение Максвелла. Функция распределения и ее статистический смысл - аналитическое выражение функции распределения молекул по скоростям (функция распределения Максвелла). - постоянная Больцмана; m 0 – масса молекулы, Т – абсолютная температура газа, V – заданная скорость (аргумент функции)
 d. Nv – число молекул со скоростями от V до V + d. V; N – общее число молекул газа в данном объеме. - относительное число молекул, скорости которых лежат в интервале от V до V + d. V (вероятность того, что скорость данной молекулы лежит в данном интервале) Поделим полученную вероятность на ширину интервала d. V: - относительное число молекул в единичном интервале скоростей - плотность вероятности того, что молекула обладает скоростью V (функция распределения Максвелла)
d. Nv – число молекул со скоростями от V до V + d. V; N – общее число молекул газа в данном объеме. - относительное число молекул, скорости которых лежат в интервале от V до V + d. V (вероятность того, что скорость данной молекулы лежит в данном интервале) Поделим полученную вероятность на ширину интервала d. V: - относительное число молекул в единичном интервале скоростей - плотность вероятности того, что молекула обладает скоростью V (функция распределения Максвелла)
 Основное свойство : - условие нормировки функции распределения Интеграл определяет вероятность того, что скорость молекулы попадает в интервал скоростей от 0 до. Площадь под кривой остается постоянной и равной 1, что следует из условия нормировки функции распределения Максвелла.
Основное свойство : - условие нормировки функции распределения Интеграл определяет вероятность того, что скорость молекулы попадает в интервал скоростей от 0 до. Площадь под кривой остается постоянной и равной 1, что следует из условия нормировки функции распределения Максвелла.

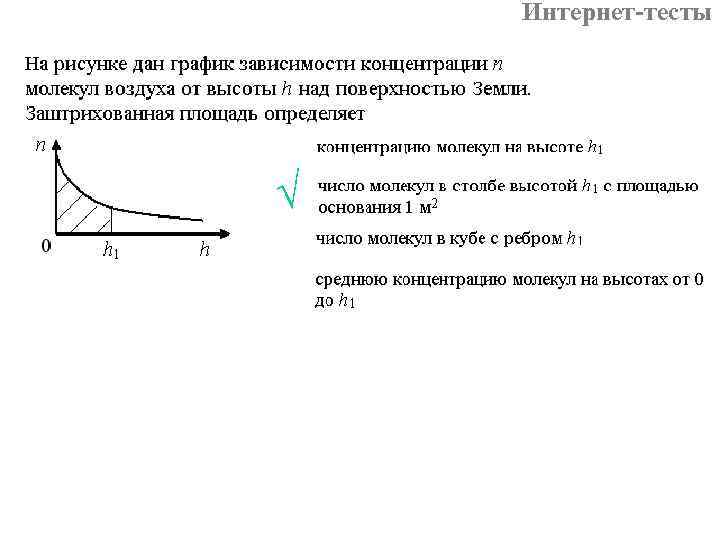
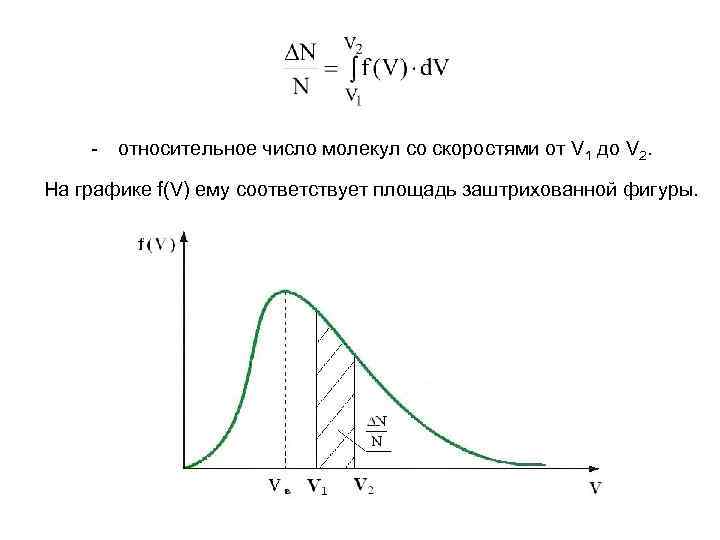 - относительное число молекул со скоростями от V 1 до V 2. На графике f(V) ему соответствует площадь заштрихованной фигуры.
- относительное число молекул со скоростями от V 1 до V 2. На графике f(V) ему соответствует площадь заштрихованной фигуры.
 Интернет-тесты
Интернет-тесты
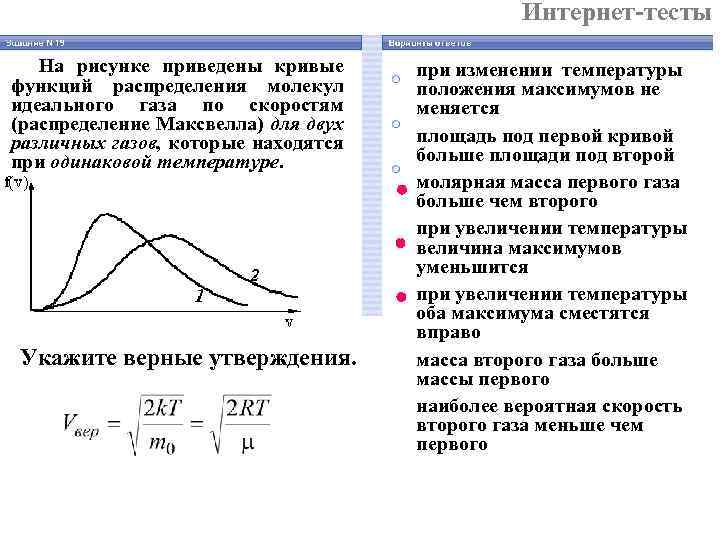 Интернет-тесты На рисунке приведены кривые при изменении температуры функций распределения молекул положения максимумов не идеального газа по скоростям меняется (распределение Максвелла) для двух различных газов, которые находятся площадь под первой кривой при одинаковой температуре. больше площади под второй молярная масса первого газа больше чем второго при увеличении температуры величина максимумов уменьшится при увеличении температуры оба максимума сместятся вправо Укажите верные утверждения. масса второго газа больше массы первого наиболее вероятная скорость второго газа меньше чем первого
Интернет-тесты На рисунке приведены кривые при изменении температуры функций распределения молекул положения максимумов не идеального газа по скоростям меняется (распределение Максвелла) для двух различных газов, которые находятся площадь под первой кривой при одинаковой температуре. больше площади под второй молярная масса первого газа больше чем второго при увеличении температуры величина максимумов уменьшится при увеличении температуры оба максимума сместятся вправо Укажите верные утверждения. масса второго газа больше массы первого наиболее вероятная скорость второго газа меньше чем первого
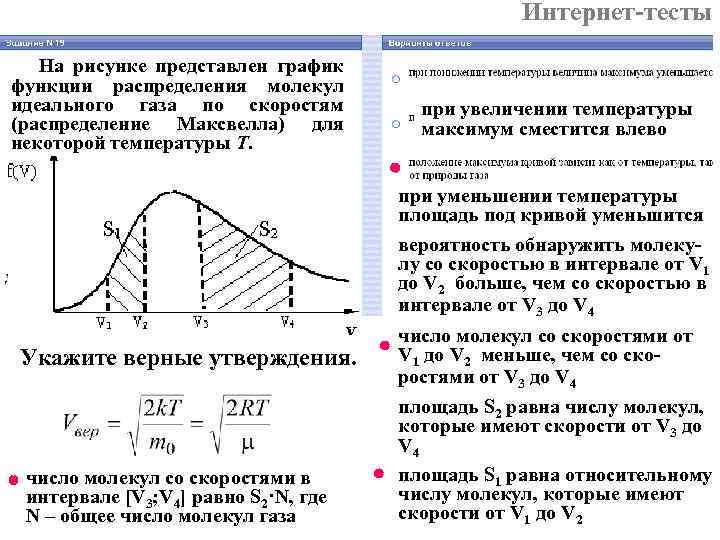 Интернет-тесты На рисунке представлен график функции распределения молекул идеального газа по скоростям при увеличении температуры (распределение Максвелла) для максимум сместится влево некоторой температуры Т. при уменьшении температуры площадь под кривой уменьшится вероятность обнаружить молеку- лу со скоростью в интервале от V 1 до V 2 больше, чем со скоростью в интервале от V 3 до V 4 число молекул со скоростями от Укажите верные утверждения. V 1 до V 2 меньше, чем со ско- ростями от V 3 до V 4 площадь S 2 равна числу молекул, которые имеют скорости от V 3 до V 4 число молекул со скоростями в площадь S 1 равна относительному интервале [V 3; V 4] равно S 2·N, где числу молекул, которые имеют N – общее число молекул газа скорости от V 1 до V 2
Интернет-тесты На рисунке представлен график функции распределения молекул идеального газа по скоростям при увеличении температуры (распределение Максвелла) для максимум сместится влево некоторой температуры Т. при уменьшении температуры площадь под кривой уменьшится вероятность обнаружить молеку- лу со скоростью в интервале от V 1 до V 2 больше, чем со скоростью в интервале от V 3 до V 4 число молекул со скоростями от Укажите верные утверждения. V 1 до V 2 меньше, чем со ско- ростями от V 3 до V 4 площадь S 2 равна числу молекул, которые имеют скорости от V 3 до V 4 число молекул со скоростями в площадь S 1 равна относительному интервале [V 3; V 4] равно S 2·N, где числу молекул, которые имеют N – общее число молекул газа скорости от V 1 до V 2
 Интернет-тесты
Интернет-тесты
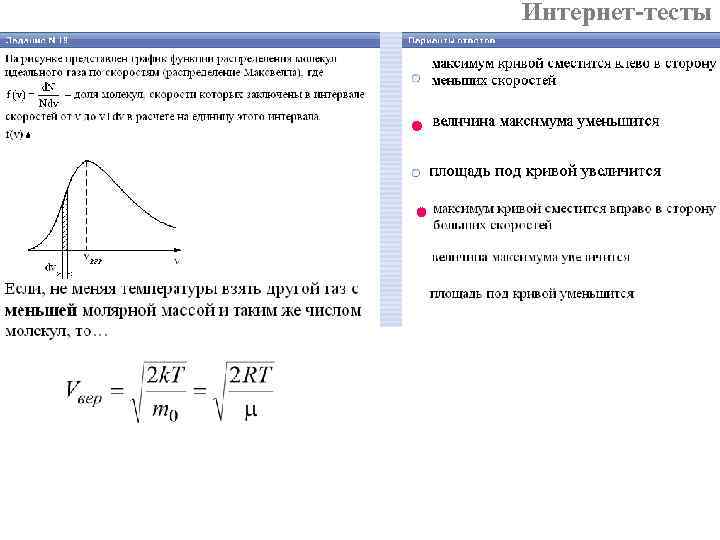 Интернет-тесты
Интернет-тесты
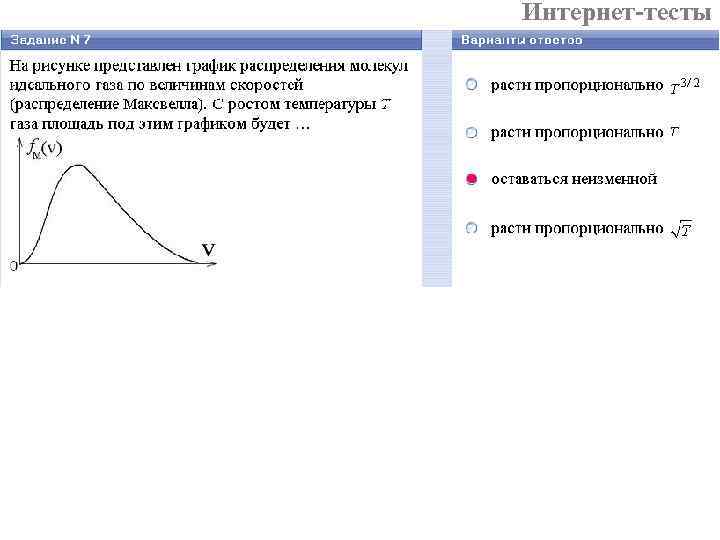 Интернет-тесты
Интернет-тесты
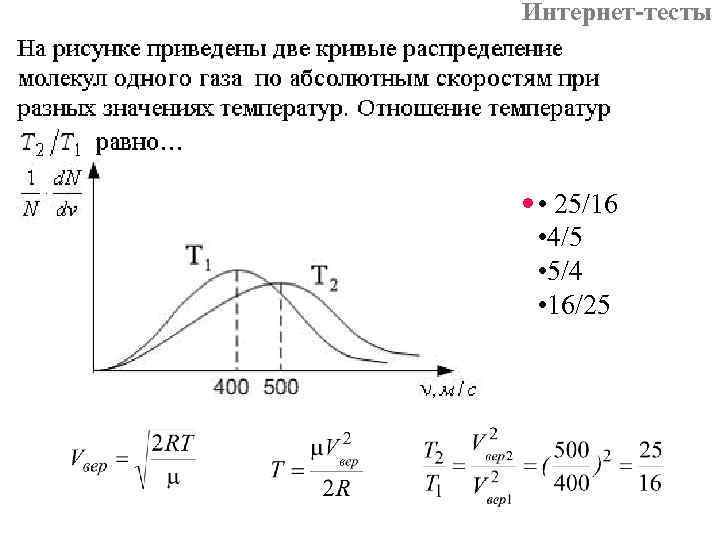 Интернет-тесты • 25/16 • 4/5 • 5/4 • 16/25
Интернет-тесты • 25/16 • 4/5 • 5/4 • 16/25
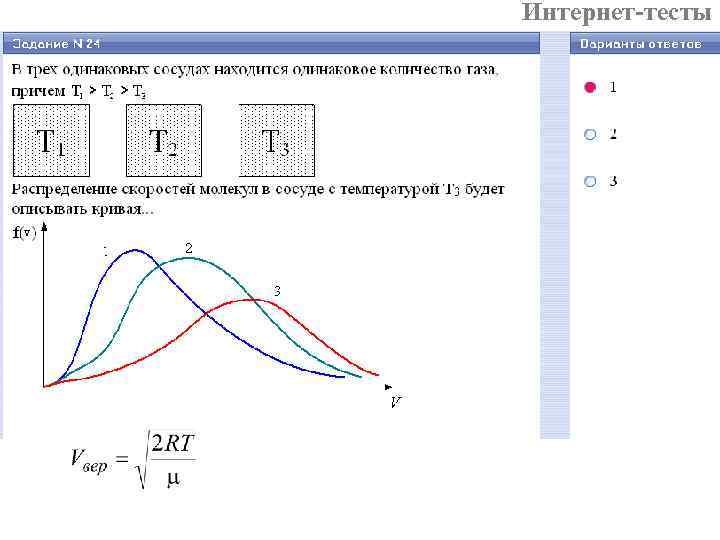 Интернет-тесты
Интернет-тесты
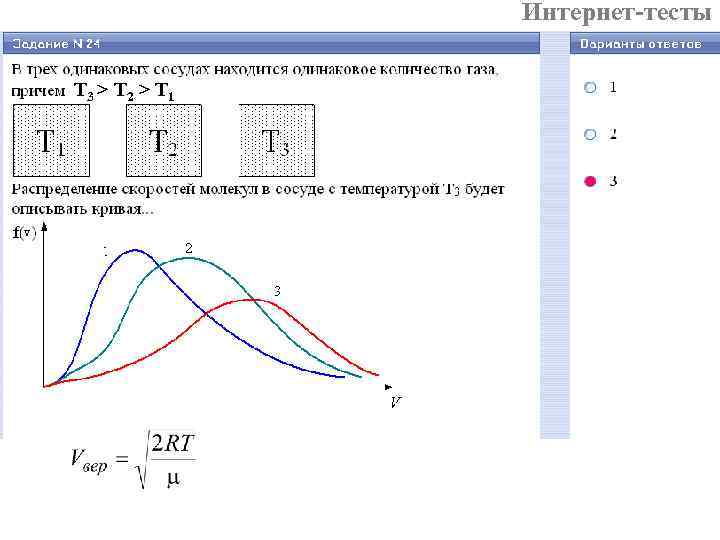 Интернет-тесты T 3 > T 2 > T 1
Интернет-тесты T 3 > T 2 > T 1
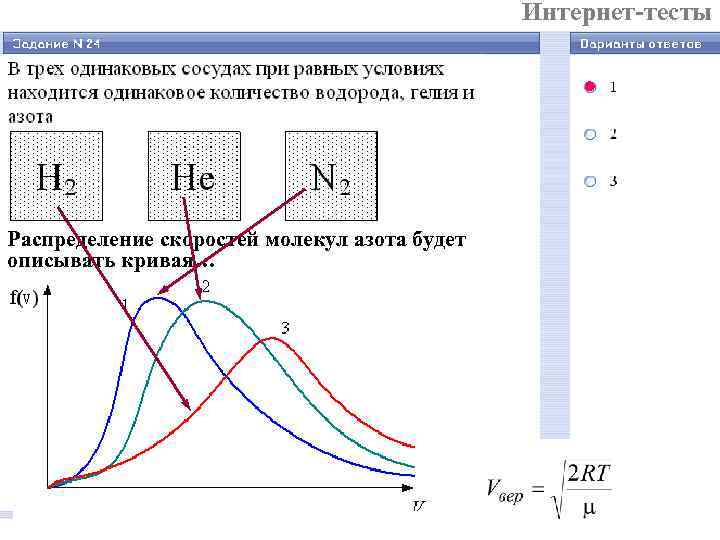 Интернет-тесты Распределение скоростей молекул азота будет описывать кривая…
Интернет-тесты Распределение скоростей молекул азота будет описывать кривая…
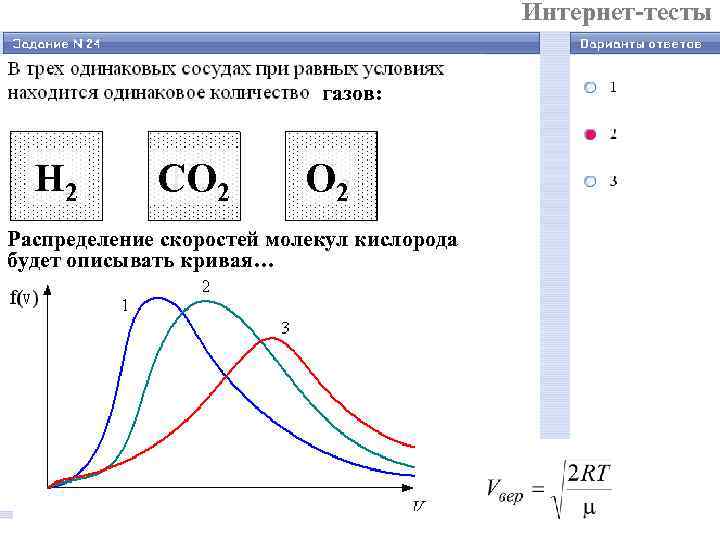 Интернет-тесты газов: Н 2 СО 2 Распределение скоростей молекул кислорода будет описывать кривая…
Интернет-тесты газов: Н 2 СО 2 Распределение скоростей молекул кислорода будет описывать кривая…
 Интернет-тесты √
Интернет-тесты √
 8. Средняя энергия молекул Необходимо знать: - степени свободы молекул (поступательные, вращательные, колебательные) - число степеней свободы одно-, двух-, и многоатомных молекул - закон о равномерном распределении энергии по степеням свободы - теплоемкость газов
8. Средняя энергия молекул Необходимо знать: - степени свободы молекул (поступательные, вращательные, колебательные) - число степеней свободы одно-, двух-, и многоатомных молекул - закон о равномерном распределении энергии по степеням свободы - теплоемкость газов
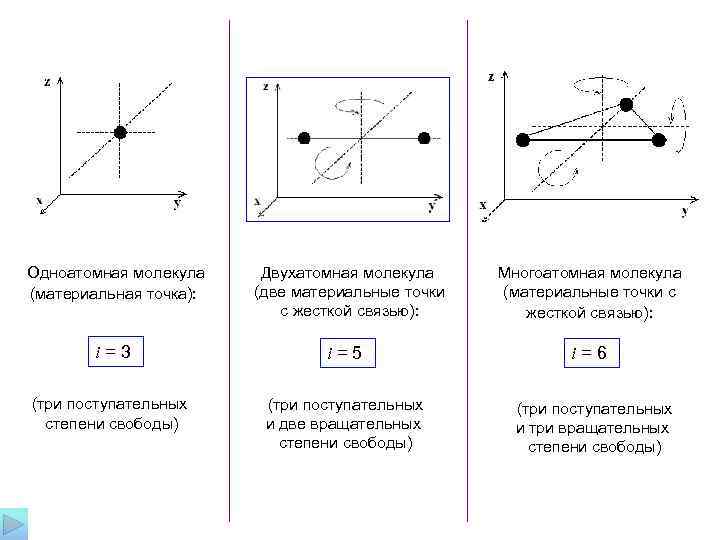 Одноатомная молекула Двухатомная молекула Многоатомная молекула (материальная точка): (две материальные точки (материальные точки с с жесткой связью): i=3 i=5 i=6 (три поступательных степени свободы) и две вращательных и три вращательных степени свободы)
Одноатомная молекула Двухатомная молекула Многоатомная молекула (материальная точка): (две материальные точки (материальные точки с с жесткой связью): i=3 i=5 i=6 (три поступательных степени свободы) и две вращательных и три вращательных степени свободы)
 Теорема о равномерном распределении энергии по степеням свободы (Больцман): на каждую поступательную и вращательную степень свободы приходится энергия, равная (k. T)/2, а на каждую колебательную степень свободы – энергия, равная k. Т. Средняя кинетическая энергия одной молекулы:
Теорема о равномерном распределении энергии по степеням свободы (Больцман): на каждую поступательную и вращательную степень свободы приходится энергия, равная (k. T)/2, а на каждую колебательную степень свободы – энергия, равная k. Т. Средняя кинетическая энергия одной молекулы:
 Интернет-тесты
Интернет-тесты
 Интернет-тесты 2/5 3/5 iвр= 2 2/13 i =5 3/6
Интернет-тесты 2/5 3/5 iвр= 2 2/13 i =5 3/6
 Интернет-тесты 9 1 2 3 =7 iпост= 3 iвр+2 iколеб=4 iколеб=1 iвр= 2
Интернет-тесты 9 1 2 3 =7 iпост= 3 iвр+2 iколеб=4 iколеб=1 iвр= 2
 Интернет-тесты
Интернет-тесты
 Интернет-тесты
Интернет-тесты
 9. Второе начало термодинамики. Энтропия. Циклы Необходимо знать: - энтропия - характер изменения энтропии в различных процессах - цикл Карно в координатах (T, S)
9. Второе начало термодинамики. Энтропия. Циклы Необходимо знать: - энтропия - характер изменения энтропии в различных процессах - цикл Карно в координатах (T, S)
 Термодинамическое определение энтропии: Энтропия – это функция состояния термодинамической системы, изменение которой при переходе системы из некоторого состояния 1 в состояние 2 равно сумме приведенных количеств тепла, сообщенных системе при любом обратимом переходе из состояния 1 в состояние 2. Изменение энтропии: - элементарное приращение энтропии в обратимом процессе равно элементарному количеству тепла, получаемому системой извне, отнесенному к температуре, при которой это тепло получается (приведенному количеству тепла).
Термодинамическое определение энтропии: Энтропия – это функция состояния термодинамической системы, изменение которой при переходе системы из некоторого состояния 1 в состояние 2 равно сумме приведенных количеств тепла, сообщенных системе при любом обратимом переходе из состояния 1 в состояние 2. Изменение энтропии: - элементарное приращение энтропии в обратимом процессе равно элементарному количеству тепла, получаемому системой извне, отнесенному к температуре, при которой это тепло получается (приведенному количеству тепла).
 Свойства энтропии 1. Энтропия – величина аддитивная. 2. Если термодинамическая система является адиабатически изолированной, т. е. не обменивается теплом с окружающей средой, то S 2 – S 1 ≥ 0 Энтропийная формулировка второго начала термодинамики (закон возрастания энтропии): энтропия изолированной системы может либо увеличиваться, если в системе протекают необратимые процессы, либо оставаться постоянной, если в системе протекают обратимые процессы. Убывать энтропия изолированной системы не может. Если система обменивается теплом с внешней средой, то ее энтропия может вести себя любым образом. Поскольку реальные термодинамические процессы, протекающие в природе, необратимы, то в реальных процессах энтропия адиабатически изолированной системы неизбежно будет возрастать. 3. Если неизолированная термодинамическая система совершает цикл, то изменение энтропии как функции состояния равно нулю. При этом на отдельных участках цикла энтропия возрастает, а на других убывает.
Свойства энтропии 1. Энтропия – величина аддитивная. 2. Если термодинамическая система является адиабатически изолированной, т. е. не обменивается теплом с окружающей средой, то S 2 – S 1 ≥ 0 Энтропийная формулировка второго начала термодинамики (закон возрастания энтропии): энтропия изолированной системы может либо увеличиваться, если в системе протекают необратимые процессы, либо оставаться постоянной, если в системе протекают обратимые процессы. Убывать энтропия изолированной системы не может. Если система обменивается теплом с внешней средой, то ее энтропия может вести себя любым образом. Поскольку реальные термодинамические процессы, протекающие в природе, необратимы, то в реальных процессах энтропия адиабатически изолированной системы неизбежно будет возрастать. 3. Если неизолированная термодинамическая система совершает цикл, то изменение энтропии как функции состояния равно нулю. При этом на отдельных участках цикла энтропия возрастает, а на других убывает.
 Интернет-тесты S = const - адиабата T↑ V↓ T↓ V↑
Интернет-тесты S = const - адиабата T↑ V↓ T↓ V↑
 Интернет-тесты обратимого >0
Интернет-тесты обратимого >0
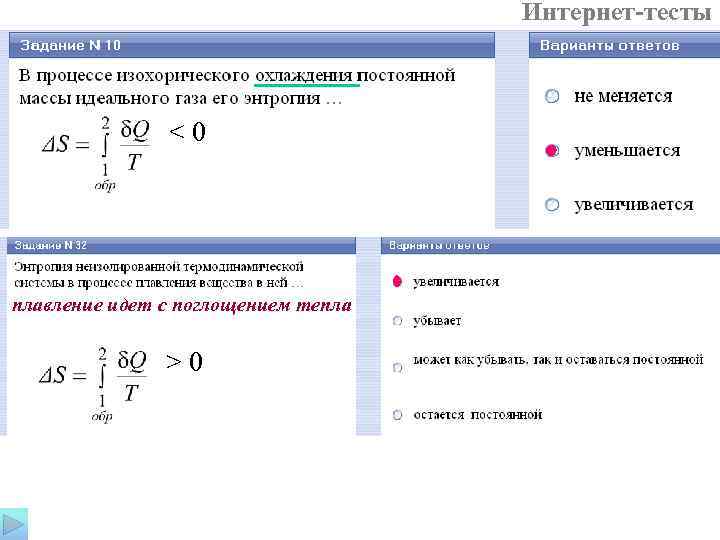 Интернет-тесты <0 плавление идет с поглощением тепла >0
Интернет-тесты <0 плавление идет с поглощением тепла >0
 Интернет-тесты 0 <0 0 < >0
Интернет-тесты 0 <0 0 < >0
 Интернет-тесты
Интернет-тесты
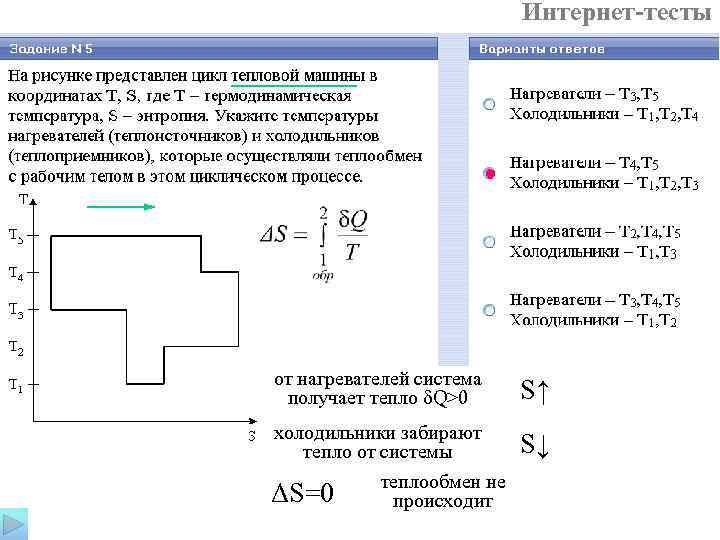 Интернет-тесты от нагревателей система получает тепло δQ>0 S↑ холодильники забирают тепло от системы S↓ теплообмен не ΔS=0 происходит
Интернет-тесты от нагревателей система получает тепло δQ>0 S↑ холодильники забирают тепло от системы S↓ теплообмен не ΔS=0 происходит
 Интернет-тесты
Интернет-тесты
 Интернет-тесты S=const V↓ T↑
Интернет-тесты S=const V↓ T↑
 Интернет-тесты Теплота подводится к системе на ΔQ>0 ΔS>0
Интернет-тесты Теплота подводится к системе на ΔQ>0 ΔS>0
 Интернет-тесты 0 |ΔT 23|=| ΔT 41|
Интернет-тесты 0 |ΔT 23|=| ΔT 41|
 Интернет-тесты 1 2 - 1 2 1 2
Интернет-тесты 1 2 - 1 2 1 2
 9. I начало термодинамики. Работа при изопроцессах Необходимо знать: - I начало термодинамики - изопроцессы (изотермический, изобарный, изохорный, адиабатный) - работа при изопроцессах
9. I начало термодинамики. Работа при изопроцессах Необходимо знать: - I начало термодинамики - изопроцессы (изотермический, изобарный, изохорный, адиабатный) - работа при изопроцессах
 Первое начало термодинамики: количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами): Q > 0 - система получает тепло; Q < 0 – отдает; А>0 – система совершает работу над внешними телами, А<0 – над системой совершают работу внешние тела.
Первое начало термодинамики: количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами): Q > 0 - система получает тепло; Q < 0 – отдает; А>0 – система совершает работу над внешними телами, А<0 – над системой совершают работу внешние тела.
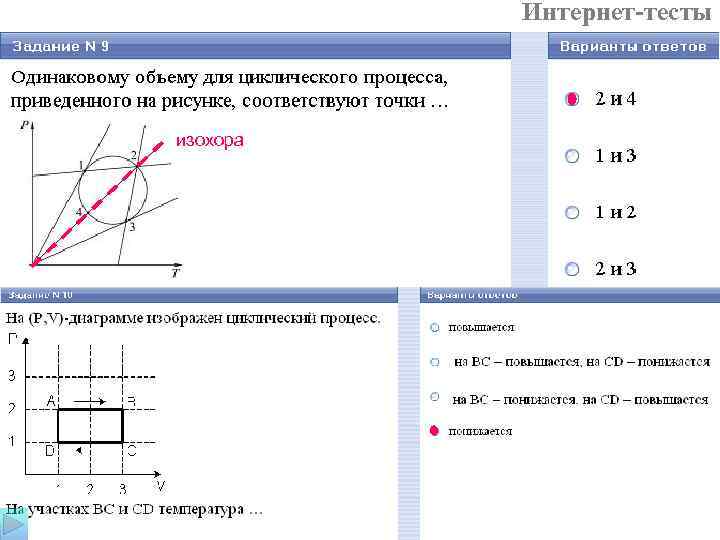 Интернет-тесты изохора
Интернет-тесты изохора
 Интернет-тесты
Интернет-тесты
 Интернет-тесты работа за цикл работа при охлаждении 300 200
Интернет-тесты работа за цикл работа при охлаждении 300 200
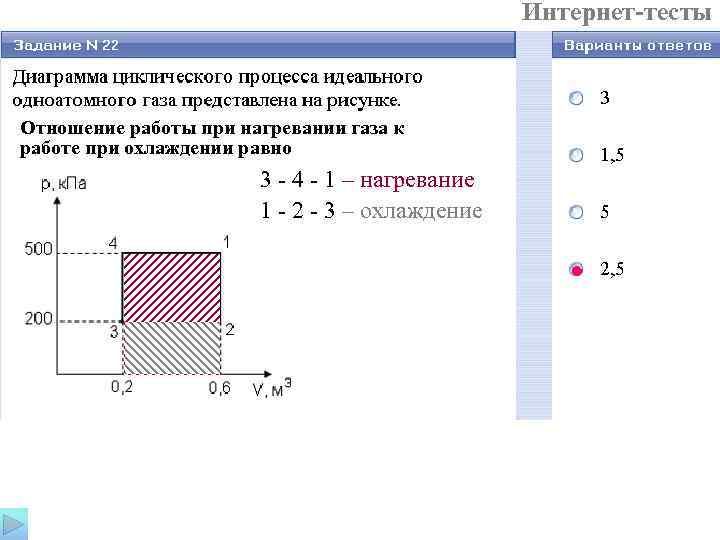 Интернет-тесты Отношение работы при нагревании газа к работе при охлаждении равно 3 - 4 - 1 – нагревание 1 - 2 - 3 – охлаждение
Интернет-тесты Отношение работы при нагревании газа к работе при охлаждении равно 3 - 4 - 1 – нагревание 1 - 2 - 3 – охлаждение
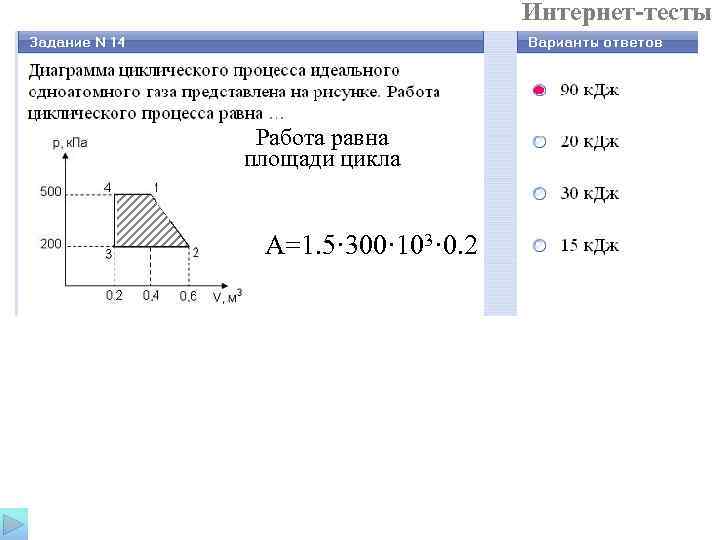 Интернет-тесты Работа равна площади цикла A=1. 5· 300· 103· 0. 2
Интернет-тесты Работа равна площади цикла A=1. 5· 300· 103· 0. 2
 Интернет-тесты
Интернет-тесты
 Интернет-тесты
Интернет-тесты
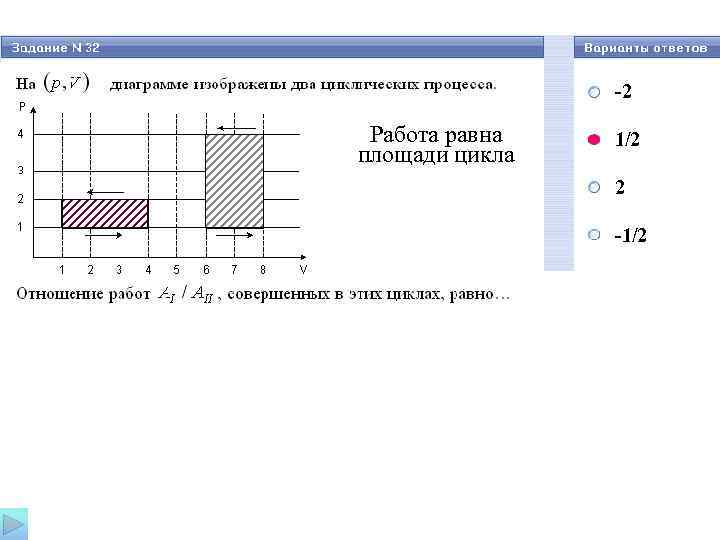 -2 Работа равна 1/2 площади цикла 2 -1/2
-2 Работа равна 1/2 площади цикла 2 -1/2
 Интернет-тесты Молярные теплоемкости гелия в процессах 1 -2 и 1 -3 равны С 1 и С 2 соответственно. 5/3 3/5 7/5 5/7 Тогда С 1/ С 2 составляет… He i=3
Интернет-тесты Молярные теплоемкости гелия в процессах 1 -2 и 1 -3 равны С 1 и С 2 соответственно. 5/3 3/5 7/5 5/7 Тогда С 1/ С 2 составляет… He i=3


