25- Твердые тела.ppt
- Количество слайдов: 123
 Молекулярная физика 25
Молекулярная физика 25
 1. Твердые тела. Монои поликристаллы. 2. Типы кристаллических твердых тел. 3. Дефекты в кристаллах. 4. Теплоемкость твердых тел. 5. Испарение, сублимация, плавление и кристаллизация. Аморфные тела.
1. Твердые тела. Монои поликристаллы. 2. Типы кристаллических твердых тел. 3. Дефекты в кристаллах. 4. Теплоемкость твердых тел. 5. Испарение, сублимация, плавление и кристаллизация. Аморфные тела.
 1. 2. 3. 4. 5. 6. 7. Кристаллические тела. Кристаллические решетки Основные понятия кристаллографии Симметрия твердых тел Теплоемкость твердых тел Классическая теория теплоемкостей твердых тел. Элементы квантовой теории теплоемкости (качественно).
1. 2. 3. 4. 5. 6. 7. Кристаллические тела. Кристаллические решетки Основные понятия кристаллографии Симметрия твердых тел Теплоемкость твердых тел Классическая теория теплоемкостей твердых тел. Элементы квантовой теории теплоемкости (качественно).
 Аморфные и кристаллические тела • По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические тела.
Аморфные и кристаллические тела • По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические тела.
 Изотропность • Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д. ) от направления. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
Изотропность • Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д. ) от направления. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
 Ионные кристаллы • В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы Na. Cl (рис. ). Такие кристаллы называются ионными. Кристаллическая решетка поваренной соли.
Ионные кристаллы • В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы Na. Cl (рис. ). Такие кристаллы называются ионными. Кристаллическая решетка поваренной соли.
 Элементарная ячейка • В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Элементарная ячейка • В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
 230 различных пространственных кристаллических структур • Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно. • Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
230 различных пространственных кристаллических структур • Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно. • Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
 Монокристаллы и поликристаллы • Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
Монокристаллы и поликристаллы • Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
 Монокристаллы и поликристаллы • В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Монокристаллы и поликристаллы • В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
 Полиморфизм • Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60– 100 тысяч атмосфер и температурах 1500– 2000 К.
Полиморфизм • Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60– 100 тысяч атмосфер и температурах 1500– 2000 К.
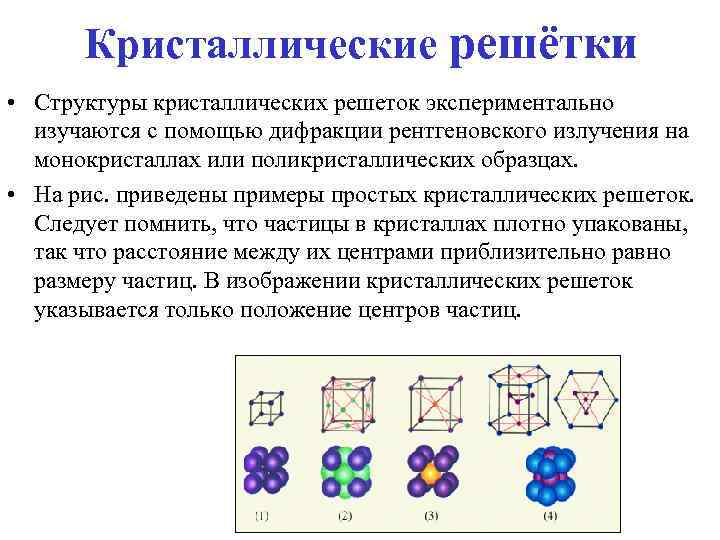 Кристаллические решётки • Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах. • На рис. приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
Кристаллические решётки • Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах. • На рис. приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
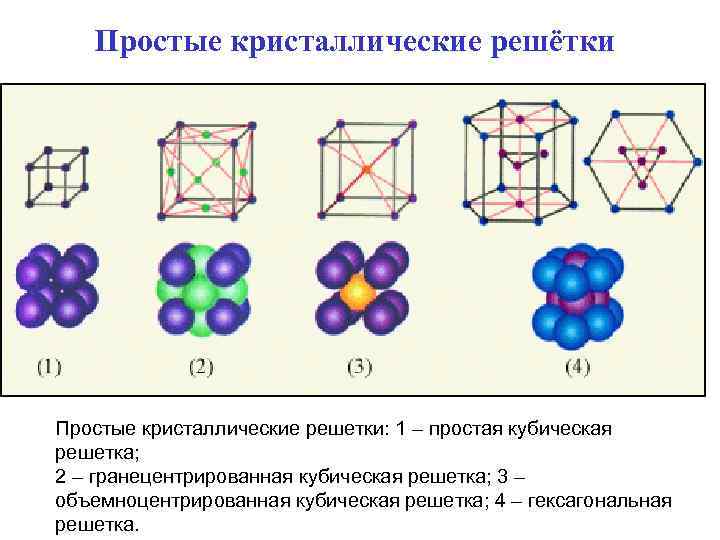 Простые кристаллические решётки Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка.
Простые кристаллические решётки Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка.
 Кубическая решётка • В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
Кубическая решётка • В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
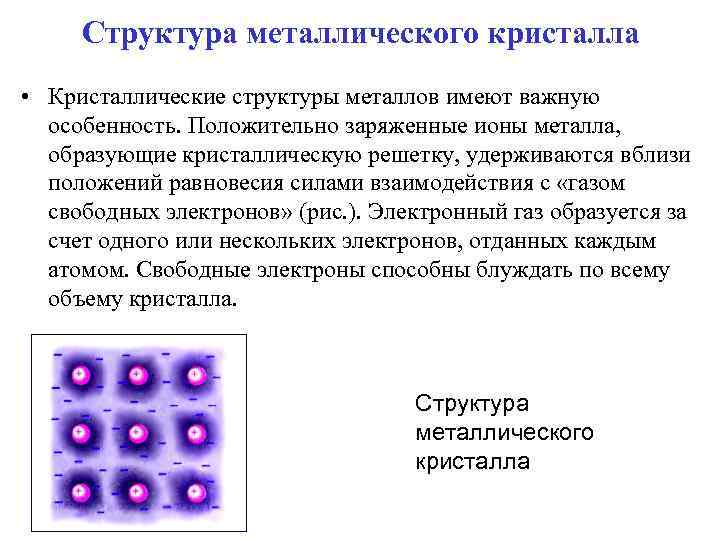 Структура металлического кристалла • Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. ). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла. Структура металлического кристалла
Структура металлического кристалла • Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. ). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла. Структура металлического кристалла
 Твердые тела. Моно- и поликристаллы. • Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая, как по казали рентгенографические исследования немецкого физика теоретика М. Лауэ (1879— 1960), является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — точки, относительно которых частицы совершают колебания, называются узлами кристаллической решетки.
Твердые тела. Моно- и поликристаллы. • Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая, как по казали рентгенографические исследования немецкого физика теоретика М. Лауэ (1879— 1960), является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — точки, относительно которых частицы совершают колебания, называются узлами кристаллической решетки.
 Твердые тела • Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. • Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного вида может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл.
Твердые тела • Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. • Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного вида может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл.
 Твердые тела • Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д. ) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
Твердые тела • Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д. ) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
 Анизотропность • Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от на правления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. ), т. е. плотность расположения частиц кристаллической решетки по разным направлениям не одинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы
Анизотропность • Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от на правления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. ), т. е. плотность расположения частиц кристаллической решетки по разным направлениям не одинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы
 Типы кристаллических твердых тел • Существует два признака для классификации кристаллов: • 1) кристаллографический; • 2) физический (природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними). • Кристаллографический признак кристаллов. • В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
Типы кристаллических твердых тел • Существует два признака для классификации кристаллов: • 1) кристаллографический; • 2) физический (природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними). • Кристаллографический признак кристаллов. • В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
 • Кристаллическая решетка может обладать различными видами симметрии. Симметрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853— 1919), присущи 230 комбинаций элементов симметрии, или 230 различных пространственных групп.
• Кристаллическая решетка может обладать различными видами симметрии. Симметрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853— 1919), присущи 230 комбинаций элементов симметрии, или 230 различных пространственных групп.
 • С переносной симметрией в трехмерном пространстве связывают понятие трехмерной периодической структуры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристаллографом О. Бравэ (1811 — 1863). Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл.
• С переносной симметрией в трехмерном пространстве связывают понятие трехмерной периодической структуры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристаллографом О. Бравэ (1811 — 1863). Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл.
 • Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами между ребрами (табл. ). Величины а, b и с и называются параметрами элементарной ячейки и однозначно ее определяют. •
• Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами между ребрами (табл. ). Величины а, b и с и называются параметрами элементарной ячейки и однозначно ее определяют. •
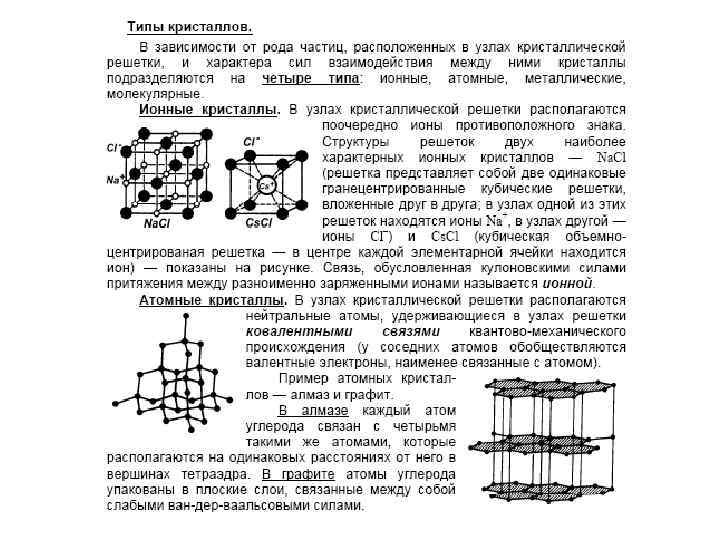
 Физический признак кристаллов • Физический признак кристаллов. • В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: • ионные, • атомные, • металлические, • молекулярные.
Физический признак кристаллов • Физический признак кристаллов. • В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: • ионные, • атомные, • металлические, • молекулярные.
 Ионные кристаллы • В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (Na. Cl, Cs. Cl, KBr и т. д. ), а также оксидов различных элементов (Mg. O, Ca. O и т. д. ). Структуры решеток двух наиболее характерных ионных кристаллов — Na. Cl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na + , в узлах другой — ионы Cl) и Cs. Cl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки находится ион) — показаны на рис.
Ионные кристаллы • В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (Na. Cl, Cs. Cl, KBr и т. д. ), а также оксидов различных элементов (Mg. O, Ca. O и т. д. ). Структуры решеток двух наиболее характерных ионных кристаллов — Na. Cl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na + , в узлах другой — ионы Cl) и Cs. Cl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки находится ион) — показаны на рис.
 • Силы взаимодействия между ионами являются в основном электростатическими (кулоновскими). Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называется ионной (или гетерополярной). В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собой как бы одну гигантскую молекулу.
• Силы взаимодействия между ионами являются в основном электростатическими (кулоновскими). Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называется ионной (или гетерополярной). В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собой как бы одну гигантскую молекулу.
 Атомные кристаллы • Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями квантово механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются алмаз и графит (два различных состояния углерода), некоторые неорганические соединения (Zn. S, Be. O и т. д. ), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. , где каждый атом углерода окружен четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдров.
Атомные кристаллы • Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями квантово механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются алмаз и графит (два различных состояния углерода), некоторые неорганические соединения (Zn. S, Be. O и т. д. ), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. , где каждый атом углерода окружен четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдров.
 • Валентные связи осуществляются парами электронов, движущихся по орбитам, охватывающим оба атома, и носят направленный характер: ковалентные силы направлены от центрального атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдвигать отдельные участки кристалла, поэтому алмаз является прочным соединением.
• Валентные связи осуществляются парами электронов, движущихся по орбитам, охватывающим оба атома, и носят направленный характер: ковалентные силы направлены от центрального атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдвигать отдельные участки кристалла, поэтому алмаз является прочным соединением.
 Металлические кристаллы • Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаотически, подобно молекулам газа, движутся «свободные» электроны, наличие которых обеспечивает хорошую электропроводность металлов. Так как металлическая связь не имеет направленного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию высокого порядка. Действительно, большинство металлов имеют кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрированную (Сu Ag, Pt, Au) решетки. Чаще всего металлы встречаются в виде поли кристаллов.
Металлические кристаллы • Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаотически, подобно молекулам газа, движутся «свободные» электроны, наличие которых обеспечивает хорошую электропроводность металлов. Так как металлическая связь не имеет направленного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию высокого порядка. Действительно, большинство металлов имеют кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрированную (Сu Ag, Pt, Au) решетки. Чаще всего металлы встречаются в виде поли кристаллов.
 Молекулярные кристаллы • Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван дер ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д. ), инертные газы (Ne, Аr, Кr, Хе) и газы С 02, N 2 в твердом состоянии, лед, а также кристаллы брома Вr 2, йода I 2. Ван дер ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
Молекулярные кристаллы • Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван дер ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д. ), инертные газы (Ne, Аr, Кr, Хе) и газы С 02, N 2 в твердом состоянии, лед, а также кристаллы брома Вr 2, йода I 2. Ван дер ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
 • В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером этому служит графит (гексагональная решетка). Решетка графита (рис. ) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника. Плоские слои связаны друг с другом ван дер ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным» , коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя.
• В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером этому служит графит (гексагональная решетка). Решетка графита (рис. ) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника. Плоские слои связаны друг с другом ван дер ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным» , коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя.
 • Таким образом, в данном случае осуществляется три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван дер ваальсова — между слоями. Этим объясняется мягкость графита, так как его слои могут скользить друг относительно друга. • Различие в строении кристаллических решеток двух разновидностей углерода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т. д.
• Таким образом, в данном случае осуществляется три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван дер ваальсова — между слоями. Этим объясняется мягкость графита, так как его слои могут скользить друг относительно друга. • Различие в строении кристаллических решеток двух разновидностей углерода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т. д.
 • Расположение атомов в кристаллах характеризуется также координационным числом — числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. ). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата.
• Расположение атомов в кристаллах характеризуется также координационным числом — числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. ). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата.
 • Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6. Т. е. чем плотнее упаковка, тем больше координационное число. • Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. справа.
• Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6. Т. е. чем плотнее упаковка, тем больше координационное число. • Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. справа.
 • Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их серыми кружками (рис. ). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. соответственно зелеными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В — если над зелеными кружками, слоем С — если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС. . . , в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
• Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их серыми кружками (рис. ). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. соответственно зелеными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В — если над зелеными кружками, слоем С — если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС. . . , в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
 • Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ. . . —гексагональная плотноупакованная структура (рис. );
• Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ. . . —гексагональная плотноупакованная структура (рис. );
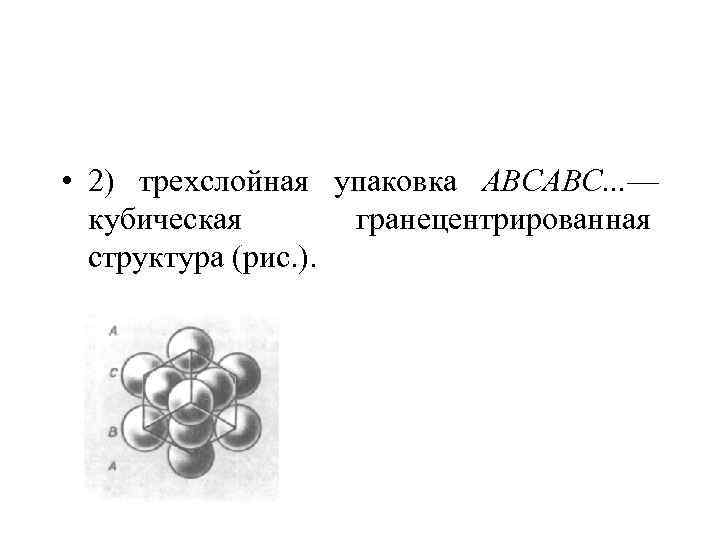 • 2) трехслойная упаковка АВСАВС. . . — кубическая гранецентрированная структура (рис. ).
• 2) трехслойная упаковка АВСАВС. . . — кубическая гранецентрированная структура (рис. ).
 • В обеих решетках координационное число равно 12 и плотность упаковки одинакова — атомы занимают 74 % общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. ) равно 4. • Кроме двух и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАС. . . — шестислойная упаковка. Существует модификация карбида Si. C с периодом повторяемости 6, 15 и 243 слоя.
• В обеих решетках координационное число равно 12 и плотность упаковки одинакова — атомы занимают 74 % общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. ) равно 4. • Кроме двух и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАС. . . — шестислойная упаковка. Существует модификация карбида Si. C с периодом повторяемости 6, 15 и 243 слоя.
 • Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. • На рис. приведено модельное • изображение кристалла поваренной соли. • Крупные ионы хлора (r= 181 пм) образуют • плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (r= 98 пм). Каждый ион Na окружен шестью ионами С 1, и, наоборот, каждый ион С 1 — шестью ионами Na.
• Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. • На рис. приведено модельное • изображение кристалла поваренной соли. • Крупные ионы хлора (r= 181 пм) образуют • плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (r= 98 пм). Каждый ион Na окружен шестью ионами С 1, и, наоборот, каждый ион С 1 — шестью ионами Na.
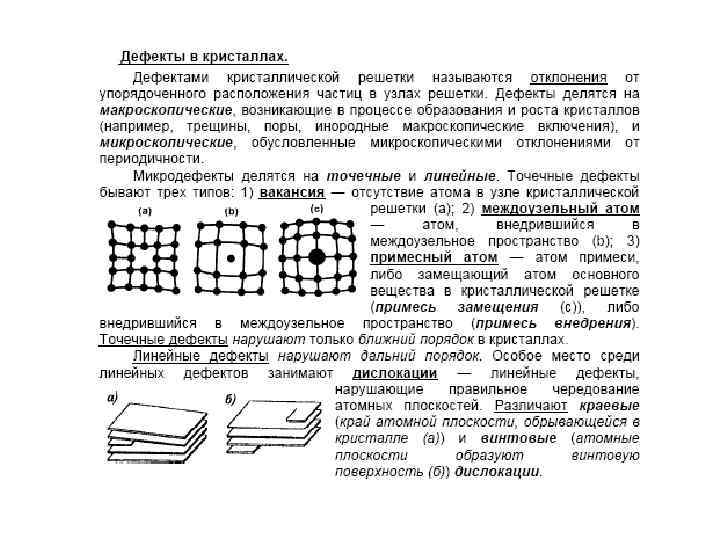
 Дефекты в кристаллах • Рассмотренные идеальные кристаллические структуры существуют лишь в очень малых объемах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности. Микродефекты делятся на точечные и линейные.
Дефекты в кристаллах • Рассмотренные идеальные кристаллические структуры существуют лишь в очень малых объемах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристаллической решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности. Микродефекты делятся на точечные и линейные.
 • Точечные дефекты бывают трех типов: 1) вакансия — отсутствие атома в узле кристаллической решетки (рис. , а); 2) междоузельный атом — атом, внедрившийся в междоузельное пространство (рис. , б); 3) примесный атом — атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. , в), либо внедрившийся в междоузельное пространство (примесь внедрения, рис. , б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, — в этом состоит их характерная особенность.
• Точечные дефекты бывают трех типов: 1) вакансия — отсутствие атома в узле кристаллической решетки (рис. , а); 2) междоузельный атом — атом, внедрившийся в междоузельное пространство (рис. , б); 3) примесный атом — атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. , в), либо внедрившийся в междоузельное пространство (примесь внедрения, рис. , б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, — в этом состоит их характерная особенность.
 • Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокациями. • Дислокации — линейные дефекты, нарушающие правильное чередование атомных плоскостей.
• Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокациями. • Дислокации — линейные дефекты, нарушающие правильное чередование атомных плоскостей.
 • Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. , а). В случае винтовой дислокации (рис. , б) ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности.
• Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. , а). В случае винтовой дислокации (рис. , б) ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности.
 • Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102 103 см 2, для деформированных кристаллов — 1010 1012 см 2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления — в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации. Наличие дефектов в кристаллической структуре влияет на свойства кристаллов, анализ которых проведем ниже.
• Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102 103 см 2, для деформированных кристаллов — 1010 1012 см 2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления — в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации. Наличие дефектов в кристаллической структуре влияет на свойства кристаллов, анализ которых проведем ниже.
 Теплоемкость твердых тел. • В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы, обладает энергией k. T.
Теплоемкость твердых тел. • В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы, обладает энергией k. T.
 • Внутренняя энергия моля твердого тела • где NA— постоянная Авогадро; NAk = R (R — молярная газовая постоянная). • Молярная теплоемкость твердого тела • т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3 R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785— 1838) и Л. Пти (1791 — 1820) и носит название закона Дюлонга и Пти.
• Внутренняя энергия моля твердого тела • где NA— постоянная Авогадро; NAk = R (R — молярная газовая постоянная). • Молярная теплоемкость твердого тела • т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3 R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785— 1838) и Л. Пти (1791 — 1820) и носит название закона Дюлонга и Пти.
 • Если твердое тело является химическим соединением (например, Na. Cl), то число частиц в моле не равно постоянной Авогадро, а равно n. NA, где п — число атомов в молекуле (для Na. Cl число частиц в моле равно 2 NA, так, в одном моле Na. Cl содержится NA атомов Na и NA атомов Сl). Таким образом, молярная теплоемкость твердых химических соединений • , • т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение. •
• Если твердое тело является химическим соединением (например, Na. Cl), то число частиц в моле не равно постоянной Авогадро, а равно n. NA, где п — число атомов в молекуле (для Na. Cl число частиц в моле равно 2 NA, так, в одном моле Na. Cl содержится NA атомов Na и NA атомов Сl). Таким образом, молярная теплоемкость твердых химических соединений • , • т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение. •
 • • • Как показывают опытные данные (табл. ), для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов, опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. ). Вблизи нуля Кельвина теплоемкость тел пропорциональна T 3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (СV=3 R). Алмаз, например, имеет теплоемкость, равную 3 R при 1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
• • • Как показывают опытные данные (табл. ), для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов, опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. ). Вблизи нуля Кельвина теплоемкость тел пропорциональна T 3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (СV=3 R). Алмаз, например, имеет теплоемкость, равную 3 R при 1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
 • Расхождение опытных и теоретических значений теплоемкостей, вычисленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкостей, А. Эйнштейн и П. Дебай (1884— 1966).
• Расхождение опытных и теоретических значений теплоемкостей, вычисленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкостей, А. Эйнштейн и П. Дебай (1884— 1966).

 ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ • Классическая теория теплоемкости • В основу положены два основных предположения. • 1. Атомы, колеблющиеся вблизи узлов атомной решетки, являются пространственными осцилляторами с тремя колебательными степенями свободы. • Поэтому в соответствии с классическим законом о равномерном распределении энергии по степеням свободы энергия одного такого осциллятора равна ik. T (i=3). • 2. Все колеблющиеся атомы решетки образуют систему из N независимых осцилляторов. • В связи с этим для одного моля вещества в кристаллическом состоянии внутренняя энергия • Поскольку U зависит только от температуры, то теплоемкости Ср и СV будут совпадать (Ср = СV = С):
ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ • Классическая теория теплоемкости • В основу положены два основных предположения. • 1. Атомы, колеблющиеся вблизи узлов атомной решетки, являются пространственными осцилляторами с тремя колебательными степенями свободы. • Поэтому в соответствии с классическим законом о равномерном распределении энергии по степеням свободы энергия одного такого осциллятора равна ik. T (i=3). • 2. Все колеблющиеся атомы решетки образуют систему из N независимых осцилляторов. • В связи с этим для одного моля вещества в кристаллическом состоянии внутренняя энергия • Поскольку U зависит только от температуры, то теплоемкости Ср и СV будут совпадать (Ср = СV = С):
 Классическая теория теплоемкости • Полученный результат находится в согласии с экспериментально установленным законом Дюлонга и Пти (1819 г. ) для химически простых кристаллических тел. • В дальнейшем оказалось, что этот закон справедлив только при обычных (комнатных) температурах, а при низких температурах (рис. ) теплоемкость кристалла стремится к нулю, как того и требует третье начало термодинамики. • Понятно, что причины несовпадения опытных данных и классического подхода к определению теплоемкости кристалла содержатся в двух исходных положениях теории. • Они были уточнены Эйнштейном и Дебаем при формулировании квантовых моделей теплоемкости кристалла.
Классическая теория теплоемкости • Полученный результат находится в согласии с экспериментально установленным законом Дюлонга и Пти (1819 г. ) для химически простых кристаллических тел. • В дальнейшем оказалось, что этот закон справедлив только при обычных (комнатных) температурах, а при низких температурах (рис. ) теплоемкость кристалла стремится к нулю, как того и требует третье начало термодинамики. • Понятно, что причины несовпадения опытных данных и классического подхода к определению теплоемкости кристалла содержатся в двух исходных положениях теории. • Они были уточнены Эйнштейном и Дебаем при формулировании квантовых моделей теплоемкости кристалла.
 Модель Эйнштейна • При определении теплоемкости кристалла А. Эйнштейн сохранил без изменения второе положение классической механики (независимость осцилляторов), а в первое положение ввел гипотезу Планка (1900), согласно которой энергия осциллятора может принимать только вполне определенные значения εn = nhν (n = 0, 1, 2, . . . ; ν частота осциллятора). • Средняя энергия такого (квантового) осциллятора • была получена путем усреднения энергии ε с помощью распределения Больцмана, т. е. по формуле
Модель Эйнштейна • При определении теплоемкости кристалла А. Эйнштейн сохранил без изменения второе положение классической механики (независимость осцилляторов), а в первое положение ввел гипотезу Планка (1900), согласно которой энергия осциллятора может принимать только вполне определенные значения εn = nhν (n = 0, 1, 2, . . . ; ν частота осциллятора). • Средняя энергия такого (квантового) осциллятора • была получена путем усреднения энергии ε с помощью распределения Больцмана, т. е. по формуле
 • Внутренняя энергия для NА независимых трехмерных осцилляторов будет иметь следующий вид: • Рассмотрим два предельных случая, когда T→ 0 и T→∞. При T→ 0 в знаменателе можно пренебречь единицей. Тогда получим • Если T→∞, то можно разложить в ряд по x = hν/(k. T) (ех ≈1+ х). В этом случае получаем классический результат:
• Внутренняя энергия для NА независимых трехмерных осцилляторов будет иметь следующий вид: • Рассмотрим два предельных случая, когда T→ 0 и T→∞. При T→ 0 в знаменателе можно пренебречь единицей. Тогда получим • Если T→∞, то можно разложить в ряд по x = hν/(k. T) (ех ≈1+ х). В этом случае получаем классический результат:
 Модель Эйнштейна • Итак, полуквантовая модель Эйнштейна качественно правильно описывает экспериментальную кривую зависимости С от T, однако в количественном отношении имеются различия. Отметим, что в модели Эйнштейна теплоемкость С стремится к нулю по экспоненциальному закону, тогда как экспериментальная зависимость имеет степенной вид: С~Т 3 (см. рис. ). Несоответствие теплоемкости С кристалла, рассчитанной по модели Эйнштейна, экспериментальным данным при T→ 0 обусловлено тем, что в модели Эйнштейна кристалл рассматривается как совокупность независимых квантовых осцилляторов, колеблющихся с одинаковой частотой в окрестности узлов решетки. Но это положение справедливо лишь при достаточно высоких температурах, когда энергия теплового возбуждения атомов превышает значение кванта энергии колебательного движения (k. T>ħω0).
Модель Эйнштейна • Итак, полуквантовая модель Эйнштейна качественно правильно описывает экспериментальную кривую зависимости С от T, однако в количественном отношении имеются различия. Отметим, что в модели Эйнштейна теплоемкость С стремится к нулю по экспоненциальному закону, тогда как экспериментальная зависимость имеет степенной вид: С~Т 3 (см. рис. ). Несоответствие теплоемкости С кристалла, рассчитанной по модели Эйнштейна, экспериментальным данным при T→ 0 обусловлено тем, что в модели Эйнштейна кристалл рассматривается как совокупность независимых квантовых осцилляторов, колеблющихся с одинаковой частотой в окрестности узлов решетки. Но это положение справедливо лишь при достаточно высоких температурах, когда энергия теплового возбуждения атомов превышает значение кванта энергии колебательного движения (k. T>ħω0).
 Модель Дебая • • • В 1914 г. голландский физик П. Дебай ( 1884— 1966) разработал последовательную квантовую теорию теплоемкости кристаллов, в которой учтено взаимодействие атомов или молекул, приводящее к их коллективному движению, представляющему собой упругие (поперечные и продольные стоячие волны). Механизм возбуждения коллективного движения эквивалентен механизму возникновения звука в твердом теле, когда смещение одной частицы из положения равновесия передается соседней, затем следующей и т. д. Основные исходные положения модели Дебая сводятся к следующему: 1. Система атомов или молекул кристалла рассматривается как совокупность связанных квантовых осцилляторов, частота ωi колебаний которых меняется от нуля до некоторого максимально возможного значения ωmах, характерного для каждого кристалла (0 < ωi < ωmах ). Энергия таких колебаний связана с частотой ωi формулой, аналогичной формуле Планка: εi = ħωi . 2. Упругие волны, возникающие в кристалле, представляют собой результат коллективного движения квантовых осцилляторов, описывающих колебательное движение атомов или молекул в окрестности узлов решетки. Квантовая теория теплоемкости Дебая позволила описать экспериментальные данные во всем интервале температур (от нуля до бесконечности).
Модель Дебая • • • В 1914 г. голландский физик П. Дебай ( 1884— 1966) разработал последовательную квантовую теорию теплоемкости кристаллов, в которой учтено взаимодействие атомов или молекул, приводящее к их коллективному движению, представляющему собой упругие (поперечные и продольные стоячие волны). Механизм возбуждения коллективного движения эквивалентен механизму возникновения звука в твердом теле, когда смещение одной частицы из положения равновесия передается соседней, затем следующей и т. д. Основные исходные положения модели Дебая сводятся к следующему: 1. Система атомов или молекул кристалла рассматривается как совокупность связанных квантовых осцилляторов, частота ωi колебаний которых меняется от нуля до некоторого максимально возможного значения ωmах, характерного для каждого кристалла (0 < ωi < ωmах ). Энергия таких колебаний связана с частотой ωi формулой, аналогичной формуле Планка: εi = ħωi . 2. Упругие волны, возникающие в кристалле, представляют собой результат коллективного движения квантовых осцилляторов, описывающих колебательное движение атомов или молекул в окрестности узлов решетки. Квантовая теория теплоемкости Дебая позволила описать экспериментальные данные во всем интервале температур (от нуля до бесконечности).
 Испарение, сублимация, плавление и кристаллизация. Аморфные тела. • Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство. Этот процесс для жидкости называется испарением (или парообразованием), для твердых тел — сублимацией (или возгонкой).
Испарение, сублимация, плавление и кристаллизация. Аморфные тела. • Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство. Этот процесс для жидкости называется испарением (или парообразованием), для твердых тел — сублимацией (или возгонкой).
 • Испарение жидкостей идет при любой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения происходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу поверхности, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
• Испарение жидкостей идет при любой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения происходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу поверхности, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
 • Для большинства твердых тел процесс сублимации при обычных температурах незначителен и давление пара над поверхностью твердого тела мало; оно повышается с повышением температуры. Интенсивно сублимируют такие вещества, как нафталин, камфара, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме — этим пользуются для изготовления зеркал. Известный пример сублимации — превращение льда в пар — мокрое белье высыхает на морозе.
• Для большинства твердых тел процесс сублимации при обычных температурах незначителен и давление пара над поверхностью твердого тела мало; оно повышается с повышением температуры. Интенсивно сублимируют такие вещества, как нафталин, камфара, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме — этим пользуются для изготовления зеркал. Известный пример сублимации — превращение льда в пар — мокрое белье высыхает на морозе.
 • Если твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится, — твердое тело плавится.
• Если твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится, — твердое тело плавится.
 • На рис. , а изображена примерная зависимость T(Q), где Q — количество теплоты, полученное телом при плавлении. По мере сообщения твердому телу теплоты его температура повышается, а при температуре плавления Тпл начинается переход тела из твердого состояния в жидкое. Температура Тпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
• На рис. , а изображена примерная зависимость T(Q), где Q — количество теплоты, полученное телом при плавлении. По мере сообщения твердому телу теплоты его температура повышается, а при температуре плавления Тпл начинается переход тела из твердого состояния в жидкое. Температура Тпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
 • Нагревание твердого тела до Тпл еще не переводит его в жидкое состояние, поскольку энергия частиц вещества должна быть достаточной для разрушения кристаллической решетки. В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому Тпл = const до расплавления всего кристалла. Затем подводимая теплота пойдет опять таки на увеличение энергии частиц жидкости и ее температура начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.
• Нагревание твердого тела до Тпл еще не переводит его в жидкое состояние, поскольку энергия частиц вещества должна быть достаточной для разрушения кристаллической решетки. В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому Тпл = const до расплавления всего кристалла. Затем подводимая теплота пойдет опять таки на увеличение энергии частиц жидкости и ее температура начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.
 • Если жидкость охлаждать, то процесс протекает в обратном направлении (рис. , б; Q' — количество теплоты, отданное телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной Тпл, начинается кристаллизация, после ее завершения температура кристалла начинает понижаться. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д.
• Если жидкость охлаждать, то процесс протекает в обратном направлении (рис. , б; Q' — количество теплоты, отданное телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной Тпл, начинается кристаллизация, после ее завершения температура кристалла начинает понижаться. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д.
 • Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость (на рис, б ей соответствует штриховая кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
• Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость (на рис, б ей соответствует штриховая кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
 • Обычно переохлаждение расплава происходит от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Из за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как и твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, воск, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
• Обычно переохлаждение расплава происходит от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Из за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как и твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, воск, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
 • В последнее время широкое распространение в народном хозяйстве получили полимеры — органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естественные (крахмал, белок, каучук, клетчатка и др. ), так и искусственные (пластмасса, резина, полистирол, лавсан, капрон и др. ) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5 10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии.
• В последнее время широкое распространение в народном хозяйстве получили полимеры — органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естественные (крахмал, белок, каучук, клетчатка и др. ), так и искусственные (пластмасса, резина, полистирол, лавсан, капрон и др. ) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5 10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии.
 • Эластичность полимеров проявляется только в определенном интервале температур, ниже которого они становятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических поли мерных материалов создано очень много (искусственные волокна, заменители кожи, строительные материалы, заменители металлов и др. ), но теория полимеров до настоящего времени полностью не разработана. Ее развитие определяется запросами современной техники, требующей синтеза полимеров с заранее заданными свойствами.
• Эластичность полимеров проявляется только в определенном интервале температур, ниже которого они становятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических поли мерных материалов создано очень много (искусственные волокна, заменители кожи, строительные материалы, заменители металлов и др. ), но теория полимеров до настоящего времени полностью не разработана. Ее развитие определяется запросами современной техники, требующей синтеза полимеров с заранее заданными свойствами.

 Метод Лауэ • • Из закона Брэгга Вульфа следует, что для дифракционного максимума интенсивности необходима определенная связь между θ и λ. Удовлетворить условию Вульфа Брэгга можно двумя способами: подбирать длины волн; подбирать углы падения, производя сканирование. В современных исследованиях применяют модификации трех основных методов. Метод Лауэ. Узкий пучок рентгеновских лучей падает на монокристалл так, как показано на рис. Немонохроматический пучок рентгеновских лучей или нейтронов от источника 1 через коллиматор 6 попадает на монокристаллический образец 2, размеры которого могут не превышать 1 мм. Излучение в этом пучке обладает широким диапазоном длин волн, и для той или иной длины волны, удовлетворяющей условию Вульфа Брэгга, возникает дифракционный рефлекс. По сути, кристалл производит отбор дискретного набора дифракционных отражений. На рис. показаны два положения 3 и 5 плоской фотопластинки или фотопленки для прямой и обратной съемки набора дифракционных «пятен» , распределение которых характеризует структуру и ориентацию кристалла. Получаемая дифракционная картина соответствует симметрии кристалла: если кристалл, например, обладающий осью симметрии 4 го порядка, ориентирован так, что эта ось параллельна падающему пучку, то лауэграмма также будет обладать осью симметрии 4 го порядка. Если структура кристалла заранее неизвестна, набор дифракционных пятен с трудом поддается расшифровке, поскольку при дифракции от одной и той же серии параллельных плоскостей в одну и ту же точку фотопластинки могут отразиться несколько волн разной длины, которым соответствуют различные порядки дифракционных максимумов. Поэтому метод Лауэ редко используют для исследования новых структур. Он находит применение, главным образом, для быстрого определения симметрии или для ориентации кристалла известной структуры. Исторически первым кристаллом, который изучал М. Лауэ с по мощью рентгеновской дифракции, был медный купорос. Однако именно в силу сложности его кристаллическая структура не была расшифрована.
Метод Лауэ • • Из закона Брэгга Вульфа следует, что для дифракционного максимума интенсивности необходима определенная связь между θ и λ. Удовлетворить условию Вульфа Брэгга можно двумя способами: подбирать длины волн; подбирать углы падения, производя сканирование. В современных исследованиях применяют модификации трех основных методов. Метод Лауэ. Узкий пучок рентгеновских лучей падает на монокристалл так, как показано на рис. Немонохроматический пучок рентгеновских лучей или нейтронов от источника 1 через коллиматор 6 попадает на монокристаллический образец 2, размеры которого могут не превышать 1 мм. Излучение в этом пучке обладает широким диапазоном длин волн, и для той или иной длины волны, удовлетворяющей условию Вульфа Брэгга, возникает дифракционный рефлекс. По сути, кристалл производит отбор дискретного набора дифракционных отражений. На рис. показаны два положения 3 и 5 плоской фотопластинки или фотопленки для прямой и обратной съемки набора дифракционных «пятен» , распределение которых характеризует структуру и ориентацию кристалла. Получаемая дифракционная картина соответствует симметрии кристалла: если кристалл, например, обладающий осью симметрии 4 го порядка, ориентирован так, что эта ось параллельна падающему пучку, то лауэграмма также будет обладать осью симметрии 4 го порядка. Если структура кристалла заранее неизвестна, набор дифракционных пятен с трудом поддается расшифровке, поскольку при дифракции от одной и той же серии параллельных плоскостей в одну и ту же точку фотопластинки могут отразиться несколько волн разной длины, которым соответствуют различные порядки дифракционных максимумов. Поэтому метод Лауэ редко используют для исследования новых структур. Он находит применение, главным образом, для быстрого определения симметрии или для ориентации кристалла известной структуры. Исторически первым кристаллом, который изучал М. Лауэ с по мощью рентгеновской дифракции, был медный купорос. Однако именно в силу сложности его кристаллическая структура не была расшифрована.
 Метод вращения кристалла • Метод вращения кристалла. В этом случае монокристалл вращается вокруг какой либо оси в монохроматическом пучке рент геновских лучей или нейтронов (рис. ) • Монохроматизация падающего от источника 1 пучка производится кристаллом монохроматором 5 или с помощью фильтров. Прошедший через коллиматоры 2 монохроматический пучок дифрагирует на определенной атомной плоскости монокристаллического образца 3 всякий раз, когда при вращении образца значение угла 9 удовлетворяет условию Вульфа Брэгга. Серия дифракционных рефлексов регистрируется на фотопленке, свернутой в цилиндр. 6 Рис. Схема метола вращения кристалла: 1 источник излучения; 2 коллиматоры; 3— образец; 4 — дифрагированный пучок в направлении к фотопластинке или счетчику; 5 — кристаллмонохроматор; 6 — неотклоненный пучок
Метод вращения кристалла • Метод вращения кристалла. В этом случае монокристалл вращается вокруг какой либо оси в монохроматическом пучке рент геновских лучей или нейтронов (рис. ) • Монохроматизация падающего от источника 1 пучка производится кристаллом монохроматором 5 или с помощью фильтров. Прошедший через коллиматоры 2 монохроматический пучок дифрагирует на определенной атомной плоскости монокристаллического образца 3 всякий раз, когда при вращении образца значение угла 9 удовлетворяет условию Вульфа Брэгга. Серия дифракционных рефлексов регистрируется на фотопленке, свернутой в цилиндр. 6 Рис. Схема метола вращения кристалла: 1 источник излучения; 2 коллиматоры; 3— образец; 4 — дифрагированный пучок в направлении к фотопластинке или счетчику; 5 — кристаллмонохроматор; 6 — неотклоненный пучок
 Метод порошка • • Метод порошка (метод Дебал-Шеррера). В этом методе (рис. ) пучок монохроматического излучения 1 падает на заключенный в тонкостенную капиллярную трубку образец 2 в виде мелкого порошка или мелкозернистого поликристаллического материала со случайной ориентацией кристаллитов. Кристаллиты должны иметь линейные размеры не более 0, 01 мм, иначе набор ориентации неэквивалентных кристаллографических плоскостей будет недостаточным. Дифрагированные пучки, которые для того или иного кристаллита удовлетворяют условию (Вульфа Брэгга), выходят из образца по направлениям вдоль образующих концентрических конусов, ось которых совпадает с направлением падающего пучка. При этом на плоской фотопленке, помешенной в плоскости, перпендикулярной к падающему пучку, регистрируется серия концентрических окружностей. Обычно, однако, используют цилиндрические камеры, в которых фотопленка 3 располагается в виде цилиндра
Метод порошка • • Метод порошка (метод Дебал-Шеррера). В этом методе (рис. ) пучок монохроматического излучения 1 падает на заключенный в тонкостенную капиллярную трубку образец 2 в виде мелкого порошка или мелкозернистого поликристаллического материала со случайной ориентацией кристаллитов. Кристаллиты должны иметь линейные размеры не более 0, 01 мм, иначе набор ориентации неэквивалентных кристаллографических плоскостей будет недостаточным. Дифрагированные пучки, которые для того или иного кристаллита удовлетворяют условию (Вульфа Брэгга), выходят из образца по направлениям вдоль образующих концентрических конусов, ось которых совпадает с направлением падающего пучка. При этом на плоской фотопленке, помешенной в плоскости, перпендикулярной к падающему пучку, регистрируется серия концентрических окружностей. Обычно, однако, используют цилиндрические камеры, в которых фотопленка 3 располагается в виде цилиндра
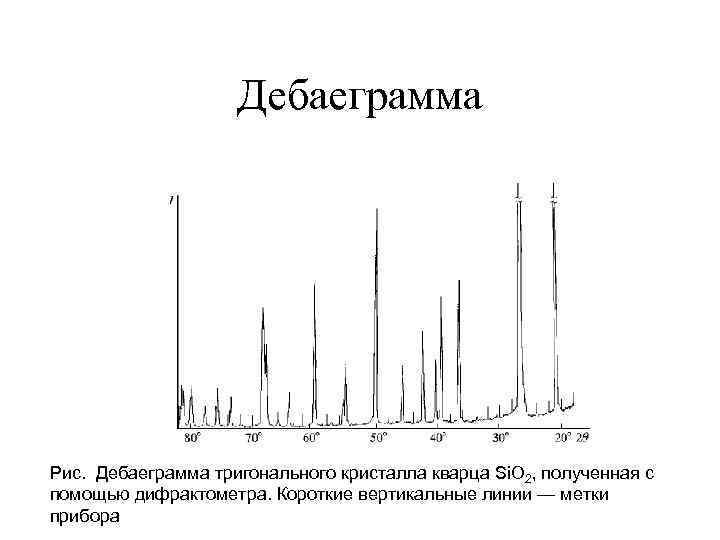 Дебаеграмма Рис. Дебаеграмма тригонального кристалла кварца Si. O 2, полученная с помощью дифрактометра. Короткие вертикальные линии — метки прибора
Дебаеграмма Рис. Дебаеграмма тригонального кристалла кварца Si. O 2, полученная с помощью дифрактометра. Короткие вертикальные линии — метки прибора
 КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА • • Всякое жидкое вещество при охлаждении теряет свойство текучести и переходит в твердое состояние. Однако процесс перехода из жидкого состояния в твердое для разных веществ не одинаков. Известны два различных вида затвердевания. 1. Кристаллизация вещества. В этом случае в жидкости, охлажденной до определенной температуры, появляются мельчайшие кристаллики (области упорядоченно расположенных и прочно связанных между собою частиц (молекул, атомов или ионов)) — центры кристаллизации, которые при дальнейшем отводе тепла от вещества разрастаются за счет присоединения к ним частиц из жидкой фазы и охватывают весь объем вещества. 2. Затвердевание вследствие сравнительно быстрого повышения вязкости жидкости с понижением температуры. Известны две разновидности этого процесса затвердевания. У некоторых веществ (сургуч, воск, смола) кристаллизация совсем не наблюдается: они называются аморфными телами. Другие вещества, например, стекло, способны кристаллизоваться, но вязкость у них быстро возрастает с понижением температуры. Последнее затрудняет перемещение молекул, необходимое для формирования и роста кристаллов и, таким образом, вещество успевает затвердевать до наступления кристаллизации. Такие вещества называются стеклообразными. Процесс кристаллизации этих веществ очень медленно протекает в твердом состоянии, причем легче при более высокой температуре. Известно, например, явление «зарухания» или «расстекловывания» стекла. Оно обусловлено образованием внутри стекла мелких кристалликов, на границах которых происходит отражение и рассеяние света, вследствие чего стекло теряет прозрачность. Аналогичная картина наблюдается при «засахаривании» прозрачного сахарного «леденца» . Иногда одно и то же вещество, может затвердеть как в кристаллической, так и в аморфно стеклообразной форме (стеклообразные тела тоже относятся к разряду аморфных тел, так как внутри них нет кристалликов).
КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА • • Всякое жидкое вещество при охлаждении теряет свойство текучести и переходит в твердое состояние. Однако процесс перехода из жидкого состояния в твердое для разных веществ не одинаков. Известны два различных вида затвердевания. 1. Кристаллизация вещества. В этом случае в жидкости, охлажденной до определенной температуры, появляются мельчайшие кристаллики (области упорядоченно расположенных и прочно связанных между собою частиц (молекул, атомов или ионов)) — центры кристаллизации, которые при дальнейшем отводе тепла от вещества разрастаются за счет присоединения к ним частиц из жидкой фазы и охватывают весь объем вещества. 2. Затвердевание вследствие сравнительно быстрого повышения вязкости жидкости с понижением температуры. Известны две разновидности этого процесса затвердевания. У некоторых веществ (сургуч, воск, смола) кристаллизация совсем не наблюдается: они называются аморфными телами. Другие вещества, например, стекло, способны кристаллизоваться, но вязкость у них быстро возрастает с понижением температуры. Последнее затрудняет перемещение молекул, необходимое для формирования и роста кристаллов и, таким образом, вещество успевает затвердевать до наступления кристаллизации. Такие вещества называются стеклообразными. Процесс кристаллизации этих веществ очень медленно протекает в твердом состоянии, причем легче при более высокой температуре. Известно, например, явление «зарухания» или «расстекловывания» стекла. Оно обусловлено образованием внутри стекла мелких кристалликов, на границах которых происходит отражение и рассеяние света, вследствие чего стекло теряет прозрачность. Аналогичная картина наблюдается при «засахаривании» прозрачного сахарного «леденца» . Иногда одно и то же вещество, может затвердеть как в кристаллической, так и в аморфно стеклообразной форме (стеклообразные тела тоже относятся к разряду аморфных тел, так как внутри них нет кристалликов).
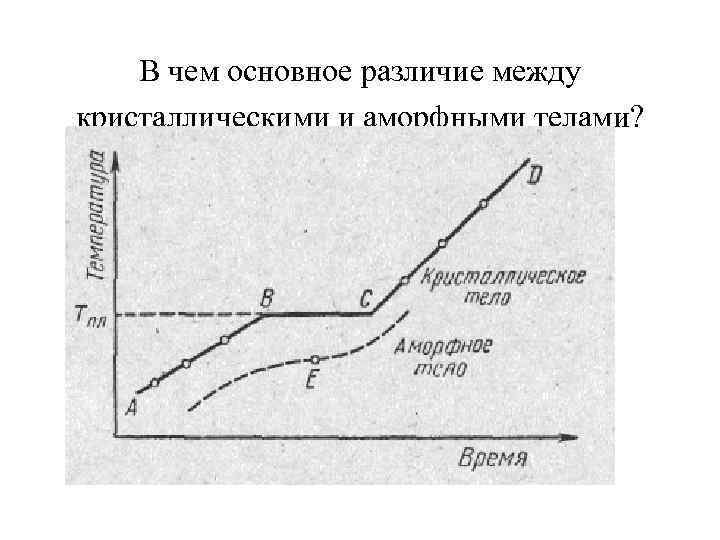 В чем основное различие между кристаллическими и аморфными телами?
В чем основное различие между кристаллическими и аморфными телами?
 КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА • • Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы (атомы, ионы или молекулы), образующие кристалл. В основе кристаллической решетки лежит элементарная кристаллическая ячейка, представляющая собой параллелепипед с характерным для данной решетки расположением атомов (рис. ). Если взять большое число одинаковых кристаллических ячеек и вплотную уложить их в определенном объеме, сохраняя параллельность ребер и граней, то мы будем иметь пример строения идеального монокристалла.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА • • Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы (атомы, ионы или молекулы), образующие кристалл. В основе кристаллической решетки лежит элементарная кристаллическая ячейка, представляющая собой параллелепипед с характерным для данной решетки расположением атомов (рис. ). Если взять большое число одинаковых кристаллических ячеек и вплотную уложить их в определенном объеме, сохраняя параллельность ребер и граней, то мы будем иметь пример строения идеального монокристалла.
 Симметрия • Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия (т. е. свойство совмещаться с собой) по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. • В кристаллах число элементов симметрии ограничено. В них, как в конечных фигурах, различаются следующие элементы симметрии: зеркальная плоскость симметрии, поворотная ось симметрии (простая и винтовая), центр симметрии или центр инверсии.
Симметрия • Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия (т. е. свойство совмещаться с собой) по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. • В кристаллах число элементов симметрии ограничено. В них, как в конечных фигурах, различаются следующие элементы симметрии: зеркальная плоскость симметрии, поворотная ось симметрии (простая и винтовая), центр симметрии или центр инверсии.
 Элементы симметрии • Зеркальная плоскость симметрии соответствует простому отражению в плоскости, как в зеркале. Такая плоскость делит тело на две равные части, совпадающие друг с другом всеми своими точками при отражении в этой плоскости. • Простая поворотная ось симметрии – прямая линия, при повороте вокруг которой на долю окружности, равную 1/n, где n – порядок оси, фигура совмещается сама с собой всеми своими точками. • Зеркально поворотные оси, сочетают одновременно действие поворота около оси на долю окружности 1/n и отражение в перпендикулярной ей плоскости. • Центр симметрии, или центр инверсии, – особая точка внутри фигуры, при отражении в которой фигура совмещается сама с собой, т. е. операция инверсии состоит в отражении фигуры в точке, фигура после отражения получается перевернутой и обращенной.
Элементы симметрии • Зеркальная плоскость симметрии соответствует простому отражению в плоскости, как в зеркале. Такая плоскость делит тело на две равные части, совпадающие друг с другом всеми своими точками при отражении в этой плоскости. • Простая поворотная ось симметрии – прямая линия, при повороте вокруг которой на долю окружности, равную 1/n, где n – порядок оси, фигура совмещается сама с собой всеми своими точками. • Зеркально поворотные оси, сочетают одновременно действие поворота около оси на долю окружности 1/n и отражение в перпендикулярной ей плоскости. • Центр симметрии, или центр инверсии, – особая точка внутри фигуры, при отражении в которой фигура совмещается сама с собой, т. е. операция инверсии состоит в отражении фигуры в точке, фигура после отражения получается перевернутой и обращенной.
 Простейшие элементы симметрии кристаллов • а — ось симметрии (в данном случае второго порядка) совмещает фигуру с собой поворотом на 360°/N (N — порядок оси симметрии); • б — плоскость симметрии m — совмещает фигуру «отражением» ; • в — центр симметрии — действует как поворот и отражение одновременно.
Простейшие элементы симметрии кристаллов • а — ось симметрии (в данном случае второго порядка) совмещает фигуру с собой поворотом на 360°/N (N — порядок оси симметрии); • б — плоскость симметрии m — совмещает фигуру «отражением» ; • в — центр симметрии — действует как поворот и отражение одновременно.
 • • • У кристаллической решетки возможны оси вращения только 2, 3, 4 и 6 го порядков. В кристаллах встречаются оси симметрии только пяти порядков: первого, второго, третьего, четвертого и шестого. Оси пятого порядка, седьмого и выше в кристаллах запрещены, так как их существование несовместимо с представлениями о кристаллической решетке. Доказательство этого положения можно найти в любом учебнике по кристаллографии. Поверхность без промежутков можно покрыть равносторонними треугольниками (n=3), квадратами (n=4) и правильными шестиугольниками (n=6 структура пчелиных сот): Других правильных многоугольников, способных без промежутков покрыть по верхность, не существует. К ним добавляется, очевидно, возможная ось = n 2, соответствующая отражению в плоскости, проходящей через ось, а также тривиальная ось n =1, соответствую щая углу поворота на 2π. Таким образом, у кристаллической решетки возможны оси вращения только 2, 3, 4 и 6 го порядков. Аналогично показывается, что и зеркально поворотные оси могут быть только тех же порядков.
• • • У кристаллической решетки возможны оси вращения только 2, 3, 4 и 6 го порядков. В кристаллах встречаются оси симметрии только пяти порядков: первого, второго, третьего, четвертого и шестого. Оси пятого порядка, седьмого и выше в кристаллах запрещены, так как их существование несовместимо с представлениями о кристаллической решетке. Доказательство этого положения можно найти в любом учебнике по кристаллографии. Поверхность без промежутков можно покрыть равносторонними треугольниками (n=3), квадратами (n=4) и правильными шестиугольниками (n=6 структура пчелиных сот): Других правильных многоугольников, способных без промежутков покрыть по верхность, не существует. К ним добавляется, очевидно, возможная ось = n 2, соответствующая отражению в плоскости, проходящей через ось, а также тривиальная ось n =1, соответствую щая углу поворота на 2π. Таким образом, у кристаллической решетки возможны оси вращения только 2, 3, 4 и 6 го порядков. Аналогично показывается, что и зеркально поворотные оси могут быть только тех же порядков.
 32 точечных класса (группы) симметрии • Все вышеуказанные элементы, преобразования, операции симметрии называются точечными операциями симметрии, так как они оставляют неизменной, по крайней мере одну точку фигуры. • Полную совокупность элементов симметрии, характеризующую симметрию объекта, называют классом симметрии. • Всего существуют 32 точечных класса (группы) симметрии.
32 точечных класса (группы) симметрии • Все вышеуказанные элементы, преобразования, операции симметрии называются точечными операциями симметрии, так как они оставляют неизменной, по крайней мере одну точку фигуры. • Полную совокупность элементов симметрии, характеризующую симметрию объекта, называют классом симметрии. • Всего существуют 32 точечных класса (группы) симметрии.
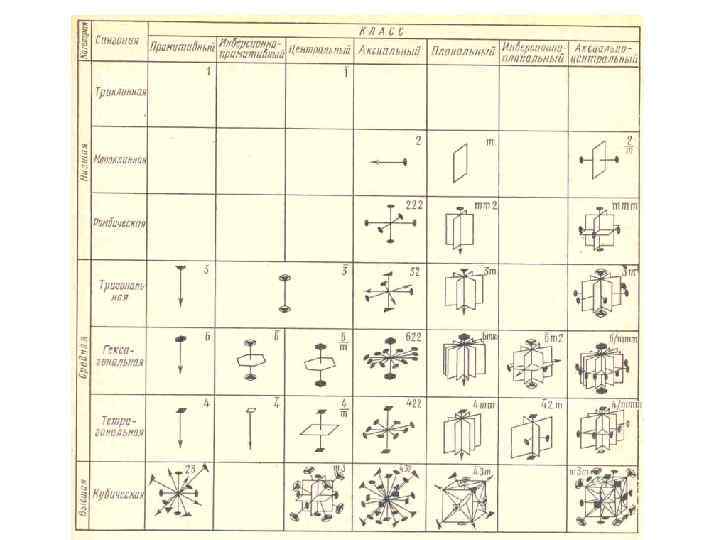
 Трансляция • В пространственной решетке к рассмотренным элементам симметрии – плоскость симметрии, ось симметрии, центр симметрии – добавляется новый элемент симметрии – трансляция • Т=n 1 a+ n 2 b+n 3 c • где n 1, n 2, n 3 – произвольные целые числа, a, b, c – векторы основных (примитивных) трансляций.
Трансляция • В пространственной решетке к рассмотренным элементам симметрии – плоскость симметрии, ось симметрии, центр симметрии – добавляется новый элемент симметрии – трансляция • Т=n 1 a+ n 2 b+n 3 c • где n 1, n 2, n 3 – произвольные целые числа, a, b, c – векторы основных (примитивных) трансляций.
 230 пространственных групп симметрии • Трансляция действует не на какую нибудь точку решетки, а на всю решетку в целом. При перемещении решетки на трансляцию в направлении вектора трансляции решетка совмещается сама с собой всеми своими точками. Всего существует 230 пространственных групп симметрии.
230 пространственных групп симметрии • Трансляция действует не на какую нибудь точку решетки, а на всю решетку в целом. При перемещении решетки на трансляцию в направлении вектора трансляции решетка совмещается сама с собой всеми своими точками. Всего существует 230 пространственных групп симметрии.
 • • Точки двухмерной кристаллической решетки. Все изображенные на рисунке пары векторов a и b являются векторами трансляций решетки. Однако векторы a 4 и b 4 не являются примитивными векторами трансляций, поскольку вектор трансляции кристаллической решетки нельзя выразить как Т=n 1 a 4+ n 2 b 4 где n 1 и n 2— целые числа. Все остальные пары векторов и можно выбрать в качестве векторов примитивных трансляций. Параллелограммы 1, 2, 3 имеют равную площадь и любой из них можно выбрать в качестве плоской примитивной ячейки
• • Точки двухмерной кристаллической решетки. Все изображенные на рисунке пары векторов a и b являются векторами трансляций решетки. Однако векторы a 4 и b 4 не являются примитивными векторами трансляций, поскольку вектор трансляции кристаллической решетки нельзя выразить как Т=n 1 a 4+ n 2 b 4 где n 1 и n 2— целые числа. Все остальные пары векторов и можно выбрать в качестве векторов примитивных трансляций. Параллелограммы 1, 2, 3 имеют равную площадь и любой из них можно выбрать в качестве плоской примитивной ячейки
 решетки Браве • Французский кристаллограф О. Браве в 1848 г. положил начало геометрической теории структуры кристаллов и показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (они получили название решеток Браве). • Различают примитивные (простые), базоцентрированные, объемноцентрированные и гранецентрированные решетки Браве. Если узлы кристаллической решетки расположены только в вершинах параллелепипеда, представляющего собой элементарную ячейку, то такая решетка называется примитивной или простой, если, кроме того, имеются узлы в центре оснований параллелепипеда, то решетка называется базоцентрированной, если есть узел в месте пересечения пространственных диагоналей — решетка называется объемноцентрированной, а если имеются узлы в центре всех боковых граней — гранецентрированной.
решетки Браве • Французский кристаллограф О. Браве в 1848 г. положил начало геометрической теории структуры кристаллов и показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (они получили название решеток Браве). • Различают примитивные (простые), базоцентрированные, объемноцентрированные и гранецентрированные решетки Браве. Если узлы кристаллической решетки расположены только в вершинах параллелепипеда, представляющего собой элементарную ячейку, то такая решетка называется примитивной или простой, если, кроме того, имеются узлы в центре оснований параллелепипеда, то решетка называется базоцентрированной, если есть узел в месте пересечения пространственных диагоналей — решетка называется объемноцентрированной, а если имеются узлы в центре всех боковых граней — гранецентрированной.
 P – простая (примитивная) I – объемноцентрированная F – гранецентрированная C – не примитивная (с центрированными основаниями) R — ромбоэдрическая. 1 Кубическая P, I, F a=b=c = = =900 2 Ромбическая P, C, I, F a b c = = =900 3 Тригональная R a=b=c = = <1200 90 4 Тетрагональная P, I a=b c = = =900 5 Гексагональная P a=b c = =900 =1200 6 Моноклинная P, C a b c = =900 7 Триклинная P a b c 0
P – простая (примитивная) I – объемноцентрированная F – гранецентрированная C – не примитивная (с центрированными основаниями) R — ромбоэдрическая. 1 Кубическая P, I, F a=b=c = = =900 2 Ромбическая P, C, I, F a b c = = =900 3 Тригональная R a=b=c = = <1200 90 4 Тетрагональная P, I a=b c = = =900 5 Гексагональная P a=b c = =900 =1200 6 Моноклинная P, C a b c = =900 7 Триклинная P a b c 0
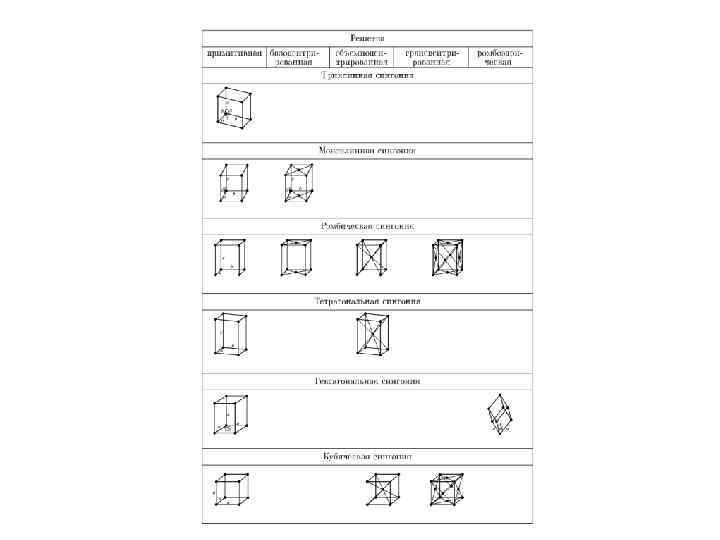
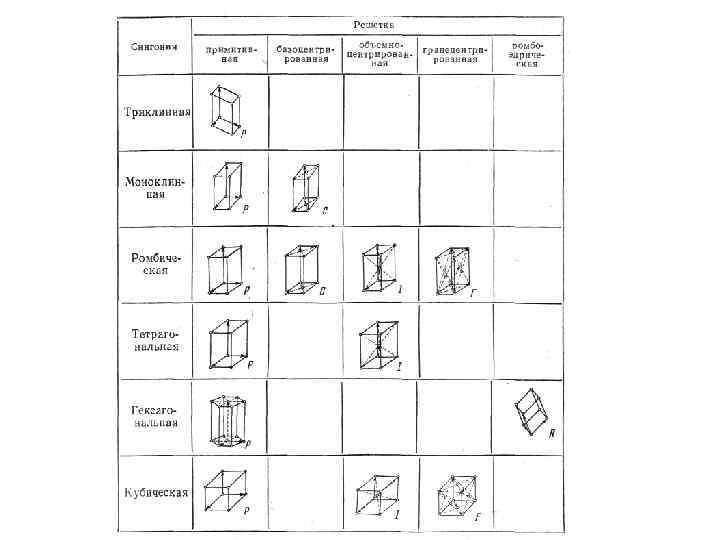
 Плотность упаковки • Смоделируем частицы в узлах кристаллической решетки в виде идеальных (не деформированных) соприкасающихся шаров. Тогда плотность упаковки, коэффициент упаковки или компактность данной решетки представляет собой отношение объема, занимаемого шарами в элементарной ячейке, ко всему объему самой элементарной ячейки.
Плотность упаковки • Смоделируем частицы в узлах кристаллической решетки в виде идеальных (не деформированных) соприкасающихся шаров. Тогда плотность упаковки, коэффициент упаковки или компактность данной решетки представляет собой отношение объема, занимаемого шарами в элементарной ячейке, ко всему объему самой элементарной ячейки.
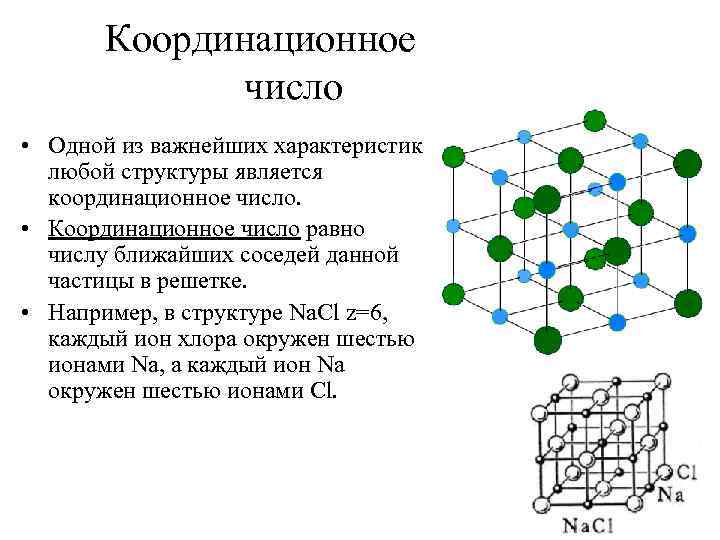 Координационное число • Одной из важнейших характеристик любой структуры является координационное число. • Координационное число равно числу ближайших соседей данной частицы в решетке. • Например, в структуре Na. Cl z=6, каждый ион хлора окружен шестью ионами Nа, а каждый ион Na окружен шестью ионами Cl.
Координационное число • Одной из важнейших характеристик любой структуры является координационное число. • Координационное число равно числу ближайших соседей данной частицы в решетке. • Например, в структуре Na. Cl z=6, каждый ион хлора окружен шестью ионами Nа, а каждый ион Na окружен шестью ионами Cl.
 • АНИЗОТРОПИЯ КРИСТАЛЛОВ Предположим, что имеем простую кубическую решетку 2 2’ 1 – полуплоскость 1’ • Мы видим, что в плоскостях 1 и 1’ плотность частиц существенно выше, чем в плоскостях 2 и 2’. Теперь к такой решетке приложим механическое напряжение сдвига. Так как расстояние между плоскостями 1 и 1’ больше, чем между плоскостями 2 и 2’, то в первую очередь будет наблюдаться сдвиг в направлении 1 и 1’. То есть в кристалле напряжение сдвига будет зависеть от выбранного правления. В направлении 1 и 1’ оно будет меньшим, чем между плоскостями 2 и 2’. То есть для разных направлений в кристалле модуль сдвига будет отличаться. Такие свойства материалов, которые зависят от направлений в кристалле называются анизотропными. Если же физические свойства материала не зависят от выбранного направление, то такие свойства и материалы называется изотропными. Тогда модуль сдвига является анизотропным свойством. Отсюда естественно предположить, что и другие механические модули будут также анизотропными. Из нашей схемы видно, что причина анизотропии лежит в упорядоченном строении решетки. Необходимо отметить, что, например, реальные металлы, не являются чисто анизотропными, так как представляют собой структуру, состоящую из отдельных кристаллических зерен, расположенных хаотически. В пределах каждого зерна существует упорядоченность, а в целом кристалл является изотропным, за счет того, что зерна хаотически ориентированы. Металл является поликристаллическим веществом. Если каким то внешним способом добиться упорядоченности зерен, в каком то направлении, то в этом направлении будет существовать анизотропия физических свойств. Такой материал называется текстурированным.
• АНИЗОТРОПИЯ КРИСТАЛЛОВ Предположим, что имеем простую кубическую решетку 2 2’ 1 – полуплоскость 1’ • Мы видим, что в плоскостях 1 и 1’ плотность частиц существенно выше, чем в плоскостях 2 и 2’. Теперь к такой решетке приложим механическое напряжение сдвига. Так как расстояние между плоскостями 1 и 1’ больше, чем между плоскостями 2 и 2’, то в первую очередь будет наблюдаться сдвиг в направлении 1 и 1’. То есть в кристалле напряжение сдвига будет зависеть от выбранного правления. В направлении 1 и 1’ оно будет меньшим, чем между плоскостями 2 и 2’. То есть для разных направлений в кристалле модуль сдвига будет отличаться. Такие свойства материалов, которые зависят от направлений в кристалле называются анизотропными. Если же физические свойства материала не зависят от выбранного направление, то такие свойства и материалы называется изотропными. Тогда модуль сдвига является анизотропным свойством. Отсюда естественно предположить, что и другие механические модули будут также анизотропными. Из нашей схемы видно, что причина анизотропии лежит в упорядоченном строении решетки. Необходимо отметить, что, например, реальные металлы, не являются чисто анизотропными, так как представляют собой структуру, состоящую из отдельных кристаллических зерен, расположенных хаотически. В пределах каждого зерна существует упорядоченность, а в целом кристалл является изотропным, за счет того, что зерна хаотически ориентированы. Металл является поликристаллическим веществом. Если каким то внешним способом добиться упорядоченности зерен, в каком то направлении, то в этом направлении будет существовать анизотропия физических свойств. Такой материал называется текстурированным.

 • • КЛАССИФИКАЦИЯ КРИСТАЛЛОВ ПО ТИПАМ СИЛ СВЯЗИ Классификация кристаллов по кристаллическим системам дает представление о геометрических характеристиках кристалла, но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической решетки. Можно произвести классификацию кристаллов по другому принципу, а именно: в зависимости от физической природы сил, действующих между частицами кристалла. Тогда мы получим четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. (Существует другая классификация кристаллов по типам сил связи, принятая в США, по которой кристаллы могут быть разделены на пять групп: молекулярные, ионные, валентные, валентно молекулярные, металлические). Классификация кристаллов, основанная на типах, сил связи, позволяет сделать некоторые обобщения относительно свойств и поведения кристаллов, чего нельзя сделать, рассматривая только геометрию решеток. До сих пор мы не учитывали природу сил, удерживающих частицы в строго упорядоченном положении. На самом деле необходимо учитывать природу этих сил, так как она определяет энергию связи в решетке и основные их свойства. Рассмотрим силы взаимодействия и соответственно энергию связи для 2 х частичной модели. Пусть мы имеем частицы одна, из которых расположена в начале координат, а вторая расположена в и из приближается к первой частицы.
• • КЛАССИФИКАЦИЯ КРИСТАЛЛОВ ПО ТИПАМ СИЛ СВЯЗИ Классификация кристаллов по кристаллическим системам дает представление о геометрических характеристиках кристалла, но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической решетки. Можно произвести классификацию кристаллов по другому принципу, а именно: в зависимости от физической природы сил, действующих между частицами кристалла. Тогда мы получим четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. (Существует другая классификация кристаллов по типам сил связи, принятая в США, по которой кристаллы могут быть разделены на пять групп: молекулярные, ионные, валентные, валентно молекулярные, металлические). Классификация кристаллов, основанная на типах, сил связи, позволяет сделать некоторые обобщения относительно свойств и поведения кристаллов, чего нельзя сделать, рассматривая только геометрию решеток. До сих пор мы не учитывали природу сил, удерживающих частицы в строго упорядоченном положении. На самом деле необходимо учитывать природу этих сил, так как она определяет энергию связи в решетке и основные их свойства. Рассмотрим силы взаимодействия и соответственно энергию связи для 2 х частичной модели. Пусть мы имеем частицы одна, из которых расположена в начале координат, а вторая расположена в и из приближается к первой частицы.
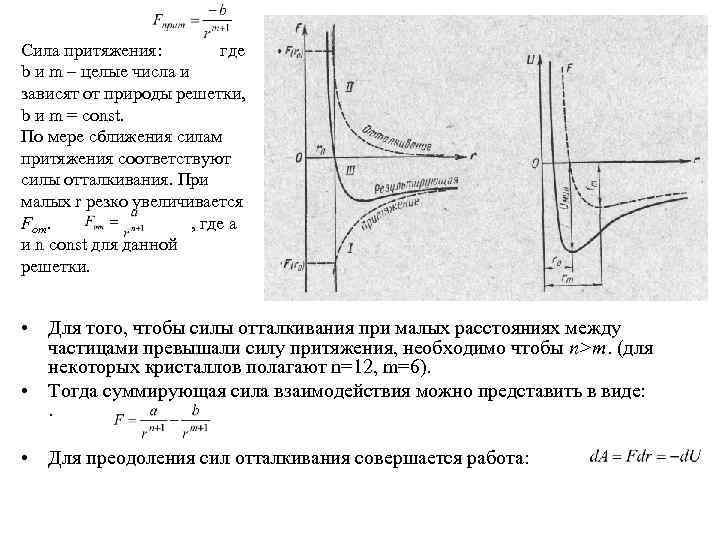 Сила притяжения: где b и m – целые числа и зависят от природы решетки, b и m = const. По мере сближения силам притяжения соответствуют силы отталкивания. При малых r резко увеличивается Fот. , где a и n const для данной решетки. • Для того, чтобы силы отталкивания при малых расстояниях между частицами превышали силу притяжения, необходимо чтобы n>m. (для некоторых кристаллов полагают n=12, m=6). • Тогда суммирующая сила взаимодействия можно представить в виде: . • Для преодоления сил отталкивания совершается работа:
Сила притяжения: где b и m – целые числа и зависят от природы решетки, b и m = const. По мере сближения силам притяжения соответствуют силы отталкивания. При малых r резко увеличивается Fот. , где a и n const для данной решетки. • Для того, чтобы силы отталкивания при малых расстояниях между частицами превышали силу притяжения, необходимо чтобы n>m. (для некоторых кристаллов полагают n=12, m=6). • Тогда суммирующая сила взаимодействия можно представить в виде: . • Для преодоления сил отталкивания совершается работа:
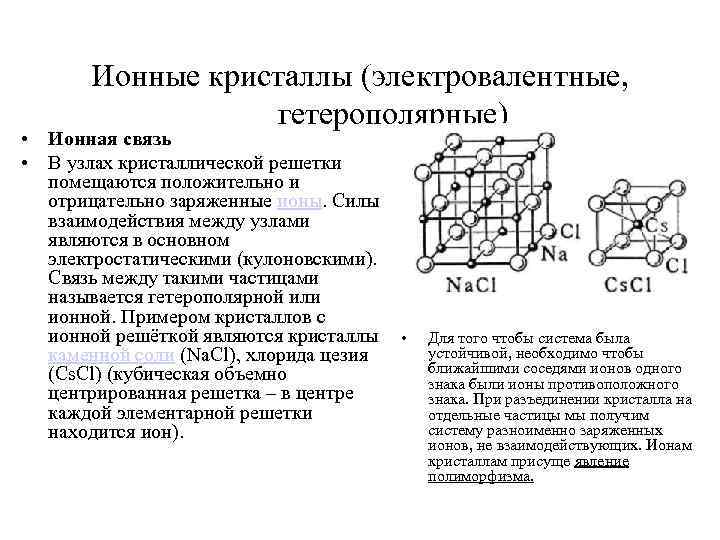 Ионные кристаллы (электровалентные, гетерополярные) • Ионная связь • В узлах кристаллической решетки помещаются положительно и отрицательно заряженные ионы. Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной. Примером кристаллов с ионной решёткой являются кристаллы • каменной соли (Na. Cl), хлорида цезия (Сs. Сl) (кубическая объемно центрированная решетка – в центре каждой элементарной решетки находится ион). Для того чтобы система была устойчивой, необходимо чтобы ближайшими соседями ионов одного знака были ионы противоположного знака. При разъединении кристалла на отдельные частицы мы получим систему разноименно заряженных ионов, не взаимодействующих. Ионам кристаллам присуще явление полиморфизма.
Ионные кристаллы (электровалентные, гетерополярные) • Ионная связь • В узлах кристаллической решетки помещаются положительно и отрицательно заряженные ионы. Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной. Примером кристаллов с ионной решёткой являются кристаллы • каменной соли (Na. Cl), хлорида цезия (Сs. Сl) (кубическая объемно центрированная решетка – в центре каждой элементарной решетки находится ион). Для того чтобы система была устойчивой, необходимо чтобы ближайшими соседями ионов одного знака были ионы противоположного знака. При разъединении кристалла на отдельные частицы мы получим систему разноименно заряженных ионов, не взаимодействующих. Ионам кристаллам присуще явление полиморфизма.
 Атомные кристаллы (ковалентные, гомеополярные) • Система из двух атомов водорода • В узлах кристаллической решетки распложены нейтральные атомы. Силы взаимодействия между атомами называется обменными. Рассмотрим природу этих сил на примере молекулы водорода H 2 (2 атома). схематически изображена на рис. Протоны на схеме обозначены буквами а и b, a электроны — цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r с соответствующими индексами, не требующими пояснений. Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами r атомы можно рассматривать, как изолированные, и энергию системы, состоящей из двух удаленных атомов, можно считать равной 2 Е 0, где Е 0 — энергия изолированного атома в невозбужденном состоянии.
Атомные кристаллы (ковалентные, гомеополярные) • Система из двух атомов водорода • В узлах кристаллической решетки распложены нейтральные атомы. Силы взаимодействия между атомами называется обменными. Рассмотрим природу этих сил на примере молекулы водорода H 2 (2 атома). схематически изображена на рис. Протоны на схеме обозначены буквами а и b, a электроны — цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r с соответствующими индексами, не требующими пояснений. Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами r атомы можно рассматривать, как изолированные, и энергию системы, состоящей из двух удаленных атомов, можно считать равной 2 Е 0, где Е 0 — энергия изолированного атома в невозбужденном состоянии.
 • • • По мере уменьшения расстояния r увеличивается степень перекрытия электронных облаков, т. е. увеличивается вероятность перехода электрона к «чужому» протону. Расчет показывает, что при r 50 А электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r 2 А. В этом случае электрон первого атома, может перейти ко второму, 1014 раз в сек. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов. Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. И наоборот в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов. Такое перераспределение электронной плотности сказывается на изменении энергии системы и проявляется в появлении сил взаимодействия нейтральных атомов. Атомным кристаллам также присуще явление полиморфизма. Главным отличительным признакам этих кристаллов является обобществление электронов (общие пары).
• • • По мере уменьшения расстояния r увеличивается степень перекрытия электронных облаков, т. е. увеличивается вероятность перехода электрона к «чужому» протону. Расчет показывает, что при r 50 А электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет. Сблизим атомы на расстояние r 2 А. В этом случае электрон первого атома, может перейти ко второму, 1014 раз в сек. Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов. Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. И наоборот в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов. Такое перераспределение электронной плотности сказывается на изменении энергии системы и проявляется в появлении сил взаимодействия нейтральных атомов. Атомным кристаллам также присуще явление полиморфизма. Главным отличительным признакам этих кристаллов является обобществление электронов (общие пары).
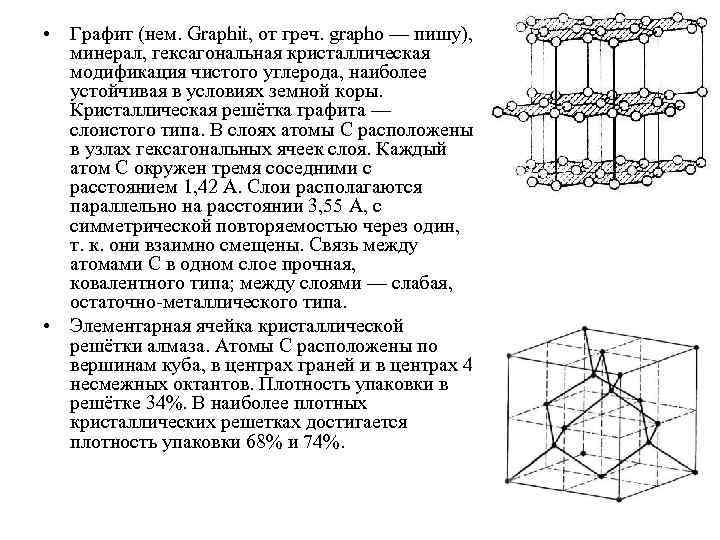 • Графит (нем. Graphit, от греч. grapho — пишу), минерал, гексагональная кристаллическая модификация чистого углерода, наиболее устойчивая в условиях земной коры. Кристаллическая решётка графита — слоистого типа. В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1, 42 A. Слои располагаются параллельно на расстоянии 3, 55 A, с симметрической повторяемостью через один, т. к. они взаимно смещены. Связь между атомами С в одном слое прочная, ковалентного типа; между слоями — слабая, остаточно металлического типа. • Элементарная ячейка кристаллической решётки алмаза. Атомы С расположены по вершинам куба, в центрах граней и в центрах 4 несмежных октантов. Плотность упаковки в решётке 34%. В наиболее плотных кристаллических решетках достигается плотность упаковки 68% и 74%.
• Графит (нем. Graphit, от греч. grapho — пишу), минерал, гексагональная кристаллическая модификация чистого углерода, наиболее устойчивая в условиях земной коры. Кристаллическая решётка графита — слоистого типа. В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1, 42 A. Слои располагаются параллельно на расстоянии 3, 55 A, с симметрической повторяемостью через один, т. к. они взаимно смещены. Связь между атомами С в одном слое прочная, ковалентного типа; между слоями — слабая, остаточно металлического типа. • Элементарная ячейка кристаллической решётки алмаза. Атомы С расположены по вершинам куба, в центрах граней и в центрах 4 несмежных октантов. Плотность упаковки в решётке 34%. В наиболее плотных кристаллических решетках достигается плотность упаковки 68% и 74%.
 Металлические кристаллы (металлы) • • В узлах кристаллической решетки металлов расположены положительно заряженные ионы металлов. Внешние валентные электроны, в отличие от атомных кристаллов, являются общими для всей решетки в целом (образуют электронное облако). Если бы такого «электронного облака» не было бы, то за счет электростатических сил отталкивания такая система не была бы устойчивой. Электронный газ обладает цементирующим действием, обеспечивая устойчивость самой решетки. Металлам присуще поликристаллическая структура, за счет того, они состоят из отдельных кристаллических зерен, расположенных хаотически. Металлы бывают текстурированными в том случае, если за счет внешних факторов в кристаллических зернах будет наблюдаться упорядоченность. Большинство чистых металлов имеют координационное число К=12, либо К=8. Многим металлам присуще явление полиморфизма, они могут существовать в 4 различных , , , кристаллических модификациях, устойчивых в различных интервалах температур.
Металлические кристаллы (металлы) • • В узлах кристаллической решетки металлов расположены положительно заряженные ионы металлов. Внешние валентные электроны, в отличие от атомных кристаллов, являются общими для всей решетки в целом (образуют электронное облако). Если бы такого «электронного облака» не было бы, то за счет электростатических сил отталкивания такая система не была бы устойчивой. Электронный газ обладает цементирующим действием, обеспечивая устойчивость самой решетки. Металлам присуще поликристаллическая структура, за счет того, они состоят из отдельных кристаллических зерен, расположенных хаотически. Металлы бывают текстурированными в том случае, если за счет внешних факторов в кристаллических зернах будет наблюдаться упорядоченность. Большинство чистых металлов имеют координационное число К=12, либо К=8. Многим металлам присуще явление полиморфизма, они могут существовать в 4 различных , , , кристаллических модификациях, устойчивых в различных интервалах температур.
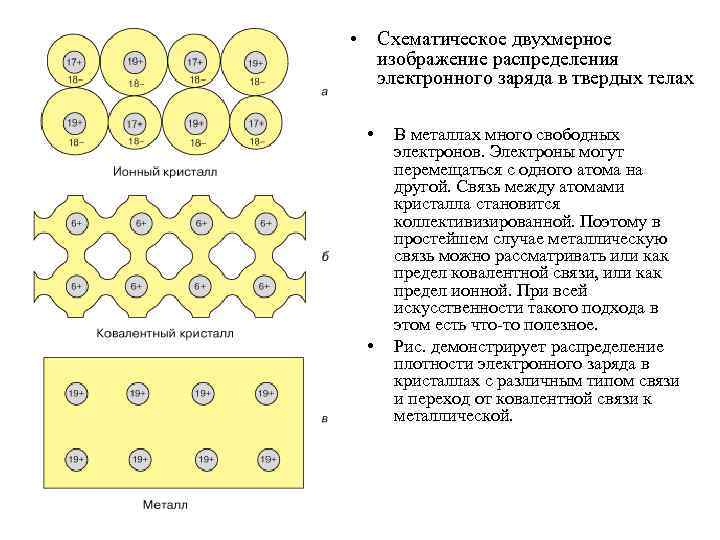 • Схематическое двухмерное изображение распределения электронного заряда в твердых телах • • В металлах много свободных электронов. Электроны могут перемещаться с одного атома на другой. Связь между атомами кристалла становится коллективизированной. Поэтому в простейшем случае металлическую связь можно рассматривать или как предел ковалентной связи, или как предел ионной. При всей искусственности такого подхода в этом есть что то полезное. Рис. демонстрирует распределение плотности электронного заряда в кристаллах с различным типом связи и переход от ковалентной связи к металлической.
• Схематическое двухмерное изображение распределения электронного заряда в твердых телах • • В металлах много свободных электронов. Электроны могут перемещаться с одного атома на другой. Связь между атомами кристалла становится коллективизированной. Поэтому в простейшем случае металлическую связь можно рассматривать или как предел ковалентной связи, или как предел ионной. При всей искусственности такого подхода в этом есть что то полезное. Рис. демонстрирует распределение плотности электронного заряда в кристаллах с различным типом связи и переход от ковалентной связи к металлической.
 Молекулярные кристаллы • В узлах кристаллической решетки находятся устойчивые молекулы, которые сохраняют индивидуальность не только в газообразной, но и в жидкой и твердой фазах (Н 2, N 2, С 12, Br 2 , I 2 , CH 4, СО 2, Н 2 О). Молекулы удерживаются в узлах решетки довольно слабыми вандерваальсовыми силами, природа которых сводится к взаимодействию между молекулярными диполями. • Различают три вида взаимодействия молекул, связанных силами Ван дер Ваальса.
Молекулярные кристаллы • В узлах кристаллической решетки находятся устойчивые молекулы, которые сохраняют индивидуальность не только в газообразной, но и в жидкой и твердой фазах (Н 2, N 2, С 12, Br 2 , I 2 , CH 4, СО 2, Н 2 О). Молекулы удерживаются в узлах решетки довольно слабыми вандерваальсовыми силами, природа которых сводится к взаимодействию между молекулярными диполями. • Различают три вида взаимодействия молекул, связанных силами Ван дер Ваальса.
 Ориентационное • 1. Если молекулы данного вещества являются электрическими диполями, то силы электростатического взаимодействия между ними будут стремиться расположить молекулы в определенном порядке, которому соответствует минимум потенциальной энергии системы (рис. ). Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называется ориентационным. • Тепловое движение молекул стремится нарушить упорядоченное расположение молекул, поэтому энергия ориентационного взаимодействия уменьшается с повышением температуры.
Ориентационное • 1. Если молекулы данного вещества являются электрическими диполями, то силы электростатического взаимодействия между ними будут стремиться расположить молекулы в определенном порядке, которому соответствует минимум потенциальной энергии системы (рис. ). Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называется ориентационным. • Тепловое движение молекул стремится нарушить упорядоченное расположение молекул, поэтому энергия ориентационного взаимодействия уменьшается с повышением температуры.
 Поляризационное • 2. Неполярные молекулы некоторых веществ обладают высокой поляризуемостью, поэтому под влиянием внешнего электрического поля (например, приближении полярной молекулы) у таких молекул возникает наведенный (индуцированный) электрический момент. При сближении такие индуцированные диполи будут взаимодействовать друг с другом аналогично взаимодействию жестких диполей. Такое взаимодействие называют индукционным или поляризационным. • Энергия индукционного взаимодействия не зависит от температуры.
Поляризационное • 2. Неполярные молекулы некоторых веществ обладают высокой поляризуемостью, поэтому под влиянием внешнего электрического поля (например, приближении полярной молекулы) у таких молекул возникает наведенный (индуцированный) электрический момент. При сближении такие индуцированные диполи будут взаимодействовать друг с другом аналогично взаимодействию жестких диполей. Такое взаимодействие называют индукционным или поляризационным. • Энергия индукционного взаимодействия не зависит от температуры.
 Дисперсионное • • 3. Возможен другой вид взаимодействия между нейтральными молекулами, получивший название дисперсионного. Поясним механизм возникновения дисперсионных сил на примере взаимодействия двух атомов водорода, когда они находятся достаточно близко друг к другу, но расстояние между атомами значительно больше того, при котором перекрываются электронные облака и возникают ощутимые силы обменного взаимодействия. Атом водорода представляет собою динамическую систему, которая только в среднем, является электрически нейтральной. В каждый же отдельный момент времени система протон—электрон обладает мгновенным дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Если в двух близко расположенных атомах водорода электроны движутся синхронно и мгновенные значения их дипольных моментов совпадают по направлению (рис. а), то между этими нейтральными атомами возникнет сила притяжения, если же мгновенные дипольные моменты атомов противоположны, то они будут отталкиваться (рис. б). Энергетически более выгодной является конфигурация, соответствующая возникновению сил притяжения. Вообще, в молекулярных кристаллах могут одновременно проявляться все три вида взаимодействия. Большая доля энергии взаимодействия приходится на ориентационный и дисперсионный эффекты и меньшая — на индукционный.
Дисперсионное • • 3. Возможен другой вид взаимодействия между нейтральными молекулами, получивший название дисперсионного. Поясним механизм возникновения дисперсионных сил на примере взаимодействия двух атомов водорода, когда они находятся достаточно близко друг к другу, но расстояние между атомами значительно больше того, при котором перекрываются электронные облака и возникают ощутимые силы обменного взаимодействия. Атом водорода представляет собою динамическую систему, которая только в среднем, является электрически нейтральной. В каждый же отдельный момент времени система протон—электрон обладает мгновенным дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Если в двух близко расположенных атомах водорода электроны движутся синхронно и мгновенные значения их дипольных моментов совпадают по направлению (рис. а), то между этими нейтральными атомами возникнет сила притяжения, если же мгновенные дипольные моменты атомов противоположны, то они будут отталкиваться (рис. б). Энергетически более выгодной является конфигурация, соответствующая возникновению сил притяжения. Вообще, в молекулярных кристаллах могут одновременно проявляться все три вида взаимодействия. Большая доля энергии взаимодействия приходится на ориентационный и дисперсионный эффекты и меньшая — на индукционный.
 СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ • Классификация кристаллов по типам связи весьма условна. Многие тела трудно отнести к тому или иному классу кристаллов по типу связи. Но, тем не менее, приближенная классификация кристаллов по типам связи полезна, хотя бы в том смысле, что знание преобладающего типа связи позволяет оценить энергию связи кристалла. Под энергией связи понимается энергия, необходимая для разъединения твердого тела на отдельные атомы, молекулы или ионы (в зависимости от типа кристалла: ковалентные и металлические кристаллы нужно разделить на атомы, ионные — на ионы, молекулярные и кристаллы с водородными связями — на молекулы).
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ • Классификация кристаллов по типам связи весьма условна. Многие тела трудно отнести к тому или иному классу кристаллов по типу связи. Но, тем не менее, приближенная классификация кристаллов по типам связи полезна, хотя бы в том смысле, что знание преобладающего типа связи позволяет оценить энергию связи кристалла. Под энергией связи понимается энергия, необходимая для разъединения твердого тела на отдельные атомы, молекулы или ионы (в зависимости от типа кристалла: ковалентные и металлические кристаллы нужно разделить на атомы, ионные — на ионы, молекулярные и кристаллы с водородными связями — на молекулы).
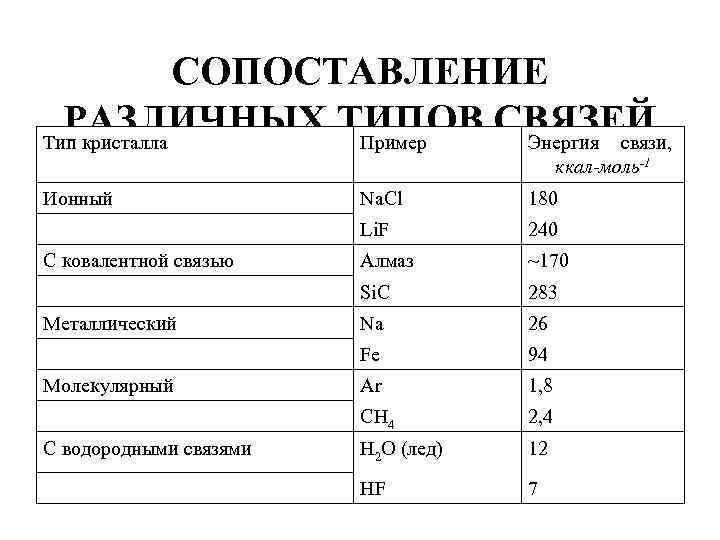 СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ Тип кристалла Пример Энергия связи, ккал-моль-1 Ионный Na. Cl 180 Li. F 240 С ковалентной связью Алмаз ~170 Si. C 283 Металлический Na 26 Fe 94 Молекулярный Ar 1, 8 CH 4 2, 4 С водородными связями H 2 O (лед) 12 HF 7
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ Тип кристалла Пример Энергия связи, ккал-моль-1 Ионный Na. Cl 180 Li. F 240 С ковалентной связью Алмаз ~170 Si. C 283 Металлический Na 26 Fe 94 Молекулярный Ar 1, 8 CH 4 2, 4 С водородными связями H 2 O (лед) 12 HF 7
 СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ • Вандерваальсова связь является наиболее универсальной, она возникает между любыми частицами, но это наиболее слабая связь, энергия ее примерно на два порядка ниже энергии связи ионных и ковалентных кристаллов. Почти на порядок выше энергия связи кристаллов с водородными связями. Энергия металлической связи, возникающая в результате обобществления валентных электронов, по порядку величины сравнима с энергией связи ионных и ковалентных кристаллов, но все же меньше последней в несколько раз. Энергия связи определяет основные физические свойства кристаллов, которые указаны при описании отдельных типов кристаллов.
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ • Вандерваальсова связь является наиболее универсальной, она возникает между любыми частицами, но это наиболее слабая связь, энергия ее примерно на два порядка ниже энергии связи ионных и ковалентных кристаллов. Почти на порядок выше энергия связи кристаллов с водородными связями. Энергия металлической связи, возникающая в результате обобществления валентных электронов, по порядку величины сравнима с энергией связи ионных и ковалентных кристаллов, но все же меньше последней в несколько раз. Энергия связи определяет основные физические свойства кристаллов, которые указаны при описании отдельных типов кристаллов.

 ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ • Классическая теория теплоемкости • В основу положены два основных предположения. • 1. Атомы, колеблющиеся вблизи узлов атомной решетки, являются пространственными осцилляторами с тремя колебательными степенями свободы. • Поэтому в соответствии с классическим законом о равномерном распределении энергии по степеням свободы энергия одного такого осциллятора равна ik. T (i=3). • 2. Все колеблющиеся атомы решетки образуют систему из N независимых осцилляторов. • В связи с этим для одного моля вещества в кристаллическом состоянии внутренняя энергия • Поскольку U зависит только от температуры, то теплоемкости Ср и СV будут совпадать (Ср = СV = С):
ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ • Классическая теория теплоемкости • В основу положены два основных предположения. • 1. Атомы, колеблющиеся вблизи узлов атомной решетки, являются пространственными осцилляторами с тремя колебательными степенями свободы. • Поэтому в соответствии с классическим законом о равномерном распределении энергии по степеням свободы энергия одного такого осциллятора равна ik. T (i=3). • 2. Все колеблющиеся атомы решетки образуют систему из N независимых осцилляторов. • В связи с этим для одного моля вещества в кристаллическом состоянии внутренняя энергия • Поскольку U зависит только от температуры, то теплоемкости Ср и СV будут совпадать (Ср = СV = С):
 Классическая теория теплоемкости • Полученный результат находится в согласии с экспериментально установленным законом Дюлонга и Пти (1819 г. ) для химически простых кристаллических тел. • В дальнейшем оказалось, что этот закон справедлив только при обычных (комнатных) температурах, а при низких температурах (рис. ) теплоемкость кристалла стремится к нулю, как того и требует третье начало термодинамики. • Понятно, что причины несовпадения опытных данных и классического подхода к определению теплоемкости кристалла содержатся в двух исходных положениях теории. • Они были уточнены Эйнштейном и Дебаем при формулировании квантовых моделей теплоемкости кристалла.
Классическая теория теплоемкости • Полученный результат находится в согласии с экспериментально установленным законом Дюлонга и Пти (1819 г. ) для химически простых кристаллических тел. • В дальнейшем оказалось, что этот закон справедлив только при обычных (комнатных) температурах, а при низких температурах (рис. ) теплоемкость кристалла стремится к нулю, как того и требует третье начало термодинамики. • Понятно, что причины несовпадения опытных данных и классического подхода к определению теплоемкости кристалла содержатся в двух исходных положениях теории. • Они были уточнены Эйнштейном и Дебаем при формулировании квантовых моделей теплоемкости кристалла.
 Модель Эйнштейна • При определении теплоемкости кристалла А. Эйнштейн сохранил без изменения второе положение классической механики (независимость осцилляторов), а в первое положение ввел гипотезу Планка (1900), согласно которой энергия осциллятора может принимать только вполне определенные значения εn = nhν (n = 0, 1, 2, . . . ; ν частота осциллятора). • Средняя энергия такого (квантового) осциллятора • была получена путем усреднения энергии е„ с помощью распределения Больцмана, т. е. по формуле
Модель Эйнштейна • При определении теплоемкости кристалла А. Эйнштейн сохранил без изменения второе положение классической механики (независимость осцилляторов), а в первое положение ввел гипотезу Планка (1900), согласно которой энергия осциллятора может принимать только вполне определенные значения εn = nhν (n = 0, 1, 2, . . . ; ν частота осциллятора). • Средняя энергия такого (квантового) осциллятора • была получена путем усреднения энергии е„ с помощью распределения Больцмана, т. е. по формуле
 • Внутренняя энергия для NА независимых трехмерных осцилляторов будет иметь следующий вид: • Рассмотрим два предельных случая, когда T→ 0 и T→∞. При T→ 0 в знаменателе можно пренебречь единицей. Тогда получим • Если T→∞, то можно разложить в ряд по x = hν/(k. T) (ех ≈1+ х). В этом случае получаем классический результат:
• Внутренняя энергия для NА независимых трехмерных осцилляторов будет иметь следующий вид: • Рассмотрим два предельных случая, когда T→ 0 и T→∞. При T→ 0 в знаменателе можно пренебречь единицей. Тогда получим • Если T→∞, то можно разложить в ряд по x = hν/(k. T) (ех ≈1+ х). В этом случае получаем классический результат:
 Модель Эйнштейна • Итак, полуквантовая модель Эйнштейна качественно правильно описывает экспериментальную кривую зависимости С от T, однако в количественном отношении имеются различия. Отметим, что в модели Эйнштейна теплоемкость С стремится к нулю по экспоненциальному закону, тогда как экспериментальная зависимость имеет степенной вид: С~Т 3 (см. рис. ). Несоответствие теплоемкости С кристалла, рассчитанной по модели Эйнштейна, экспериментальным данным при T→ 0 обусловлено тем, что в модели Эйнштейна кристалл рассматривается как совокупность независимых квантовых осцилляторов, колеблющихся с одинаковой частотой в окрестности узлов решетки. Но это положение справедливо лишь при достаточно высоких температурах, когда энергия теплового возбуждения атомов превышает значение кванта энергии колебательного движения (k. T>ħω0).
Модель Эйнштейна • Итак, полуквантовая модель Эйнштейна качественно правильно описывает экспериментальную кривую зависимости С от T, однако в количественном отношении имеются различия. Отметим, что в модели Эйнштейна теплоемкость С стремится к нулю по экспоненциальному закону, тогда как экспериментальная зависимость имеет степенной вид: С~Т 3 (см. рис. ). Несоответствие теплоемкости С кристалла, рассчитанной по модели Эйнштейна, экспериментальным данным при T→ 0 обусловлено тем, что в модели Эйнштейна кристалл рассматривается как совокупность независимых квантовых осцилляторов, колеблющихся с одинаковой частотой в окрестности узлов решетки. Но это положение справедливо лишь при достаточно высоких температурах, когда энергия теплового возбуждения атомов превышает значение кванта энергии колебательного движения (k. T>ħω0).
 Модель Дебая • • • В 1914 г. голландский физик П. Дебай ( 1884— 1966) разработал последовательную квантовую теорию теплоемкости кристаллов, в которой учтено взаимодействие атомов или молекул, приводящее к их коллективному движению, представляющему собой упругие (поперечные и продольные стоячие волны). Механизм возбуждения коллективного движения эквивалентен механизму возникновения звука в твердом теле, когда смещение одной частицы из положения равновесия передается соседней, затем следующей и т. д. Основные исходные положения модели Дебая сводятся к следующему: 1. Система атомов или молекул кристалла рассматривается как совокупность связанных квантовых осцилляторов, частота ωi колебаний которых меняется от нуля до некоторого максимально возможного значения ωmах, характерного для каждого кристалла (0 < ωi < ωmах ). Энергия таких колебаний связана с частотой ωi формулой, аналогичной формуле Планка: εi = ħωi . 2. Упругие волны, возникающие в кристалле, представляют собой результат коллективного движения квантовых осцилляторов, описывающих колебательное движение атомов или молекул в окрестности узлов решетки. Квантовая теория теплоемкости Дебая позволила описать экспериментальные данные во всем интервале температур (от нуля до бесконечности).
Модель Дебая • • • В 1914 г. голландский физик П. Дебай ( 1884— 1966) разработал последовательную квантовую теорию теплоемкости кристаллов, в которой учтено взаимодействие атомов или молекул, приводящее к их коллективному движению, представляющему собой упругие (поперечные и продольные стоячие волны). Механизм возбуждения коллективного движения эквивалентен механизму возникновения звука в твердом теле, когда смещение одной частицы из положения равновесия передается соседней, затем следующей и т. д. Основные исходные положения модели Дебая сводятся к следующему: 1. Система атомов или молекул кристалла рассматривается как совокупность связанных квантовых осцилляторов, частота ωi колебаний которых меняется от нуля до некоторого максимально возможного значения ωmах, характерного для каждого кристалла (0 < ωi < ωmах ). Энергия таких колебаний связана с частотой ωi формулой, аналогичной формуле Планка: εi = ħωi . 2. Упругие волны, возникающие в кристалле, представляют собой результат коллективного движения квантовых осцилляторов, описывающих колебательное движение атомов или молекул в окрестности узлов решетки. Квантовая теория теплоемкости Дебая позволила описать экспериментальные данные во всем интервале температур (от нуля до бесконечности).