12-Первый закон тд.ppt
- Количество слайдов: 52

Молекулярная физика 12

1. Работа 2. Теплота. 3. Первое начало термодинамики.

Внутренняя энергия 1. U=Eк+Eп 2. 3. 4. 5. U=U(T, V) U=U(состояния), подчеркиваем вводя d. U U≠U(V) U – характеризует и вводится для равновесных состояний, когда во всех частях системы Т=const 6. ΔU ← работа, теплота

Работа газа при изменении его объема • Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. ). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу • где S — площадь поршня, Sdl=d. V — изменение объема системы. Таким образом,

Работа • Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием последней формулы : • Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение справедливо при любых изменениях объема твердых, жидких и газообразных тел.

Работа • Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Например, изменение давления газа при его расширении изобразится кривой на рис. При увеличении объема на d. V совершаемая газом работа равна pd. V, т. е. определяется площадью полоски с основанием d. V на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V 1 до объема V 2, определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V 1 и V 2.

Работа • Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = –A'. Если объем газа изменился на малую величину ΔV, то газ совершает работу • p. SΔx = pΔV, • где p – давление газа, S – площадь поршня, Δx – его перемещение (рис. ). При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой: • или в пределе при ΔVi → 0:
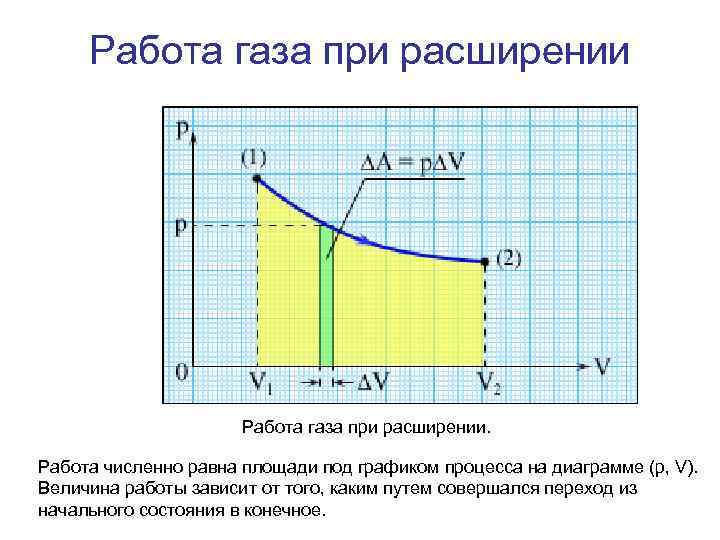
Работа газа при расширении. Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.

Три различных пути перехода • На рис. изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу. Процессы, изображенные на рис. , можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный. Процессы такого рода, которые можно проводить в обоих направлениях, называются обратимыми. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса

Особенности понятия «работа» • δA>0 – совершается системой, δA<0 – над системой • Работа – это макроскопический способ передачи энергии от одних тел к другим, т. к. она всегда связана с макроскопическим перемещением тел или их частей. • Почему δA, а не d. A? A≠f(состояния), это способ! • А зависит от пути перехода из (1) в (2). Признак того, что A≠f(состояния)

Опыт Джоуля по определению механического эквивалента теплоты • В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия. Другим примером может служить опыт Джоуля (1843 г. ) по определению механического эквивалента теплоты (рис. ). При вращении вертушки, погруженной в жидкость, внешние силы совершают положительную работу (A' > 0); при этом жидкость из-за наличия сил внутреннего трения нагревается, т. е. увеличивается ее внутренняя энергия. В этих двух примерах процессы не могут быть проведены в противоположном направлении. Такие процессы называются необратимыми. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.


Теплота и внутренняя энергия • Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена. • Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. • Тепловой поток всегда направлен от горячего тела к холодному. • Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).

Теплота • Процесс (способ) обмена внутренними энергиями тел не сопровождающийся производством макроскопической работы называют теплообменом • Энергия переданная телу в процессе теплообмена – тепло • δQ>0 – сообщают системе, δQ<0 – забирают у системы • δQ=с ΔT. • δQ=с(количество вещества, вид вещества, условий передачи(процесса) ΔT. • Теплоемкость c = δQ / d. T.


Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы • На рис. условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.

Первый закон термодинамики • Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). • Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.

Первый закон термодинамики • Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: • Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. • • ΔU = Q – A.

Первый закон термодинамики • Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме: • • Q = ΔU + A • Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.

Первый закон термодинамики • Первый закон термодинамики является обобщением опытных фактов. • Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. • Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. • Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. • Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.


Первое начало термодинамики • Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно повысить, за счет сообщения ему некоторого количества теплоты - энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).

Первое начало термодинамики • Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.

Первое начало термодинамики • Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U 1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии • будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил: • или

Первое начало термодинамики • Последнее уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. • Выражение в дифференциальной форме будет иметь вид • или в более корректной форме • где (d. U — бесконечно малое изменение внутренней энергии системы, - элементарная работа, - бесконечно малое количество теплоты. В этом выражении d. U является полным дифференциалом, и • таковыми не являются.

Первое начало термодинамики • Из формулы Q=ΔU+A следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж). • Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии • Тогда, согласно первому началу термодинамики, • т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).


Первое начало термодинамики • Первый закон термодинамики является обобщением закона сохранения и превращения энергии с учетом процессов теплообмена. • Принципиальное отличие первого начала ТД от аналогичного закона в механике состоит в учете величины Q – тепловой энергии. • Изучение этой величины и ее превращений и есть предмет ТД

Первое начало термодинамики • Q = ΔU + A • Количество теплоты, полученное системой, идет на изменение ее внутренней энергии • ΔU =U 2 -U 1 и совершение работы над внешними телами. • Так же как в механике этот закон не может предсказать направление развития процесса. Он позволяет только указать возможен ли данный процесс и как в нем изменяются величины Q, U, A.


• • • Применим первый закон термодинамики к изопроцессам в газах. 1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, • Q = ΔU = U(T 2) – U(T 1). • 2. Здесь U(T 1) и U(T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). 3. В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением • A = p(V 2 – V 1) = pΔV. • 4. Первый закон термодинамики для изобарного процесса дает: • Q = U(T 2) – U(T 1) + p(V 2 – V 1) = ΔU + pΔV. • 5. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1; внутренняя энергия убывает, ΔU < 0. 6. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0. •

Первый закон термодинамики для изотермического процесса • Первый закон термодинамики для изотермического процесса выражается соотношением • • Q = A. • • Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.

• Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими. • В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид • • A = –ΔU, • • т. е. газ совершает работу за счет убыли его внутренней энергии.
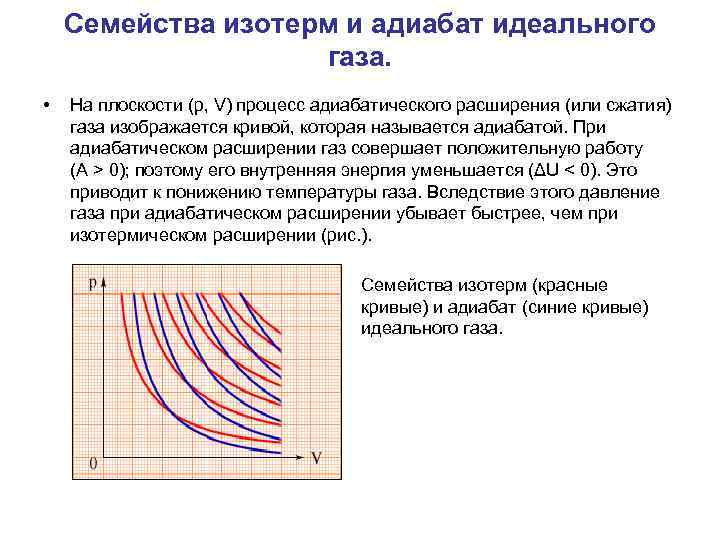
Семейства изотерм и адиабат идеального газа. • На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении газ совершает положительную работу (A > 0); поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом расширении (рис. ). Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.

Уравнение Пуассона • В термодинамике выводится уравнение адиабатического процесса для идеального газа. В координатах (p, V) это уравнение имеет вид • • p. Vγ = const. • • Это соотношение называют уравнением Пуассона. Здесь γ = Cp / CV – показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом.

• Для одноатомного газа • для двухатомного • для многоатомного • Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний: • • A = CV(T 2 – T 1). •

Адиабатический процесс • Адиабатический процесс также можно отнести к изопроцессам. В термодинамике важную роль играет физическая величина, которая называется энтропией. Изменение энтропии в каком-либо квазистатическом процессе равно приведенному теплу ΔQ / T, полученному системой. Поскольку на любом участке адиабатического процесса ΔQ = 0, энтропия в этом процессе остается неизменной. • Адиабатический процесс (так же, как и другие изопроцессы) является процессом квазистатическим. Все промежуточные состояния газа в этом процессе близки к состояниям термодинамического равновесия. Любая точка на адиабате описывает равновесное состояние.

• Не всякий процесс, проведенный в адиабатической оболочке, т. е. без теплообмена с окружающими телами, удовлетворяет этому условию. Примером неквазистатического процесса, в котором промежуточные состояния неравновесны, может служить расширение газа в пустоту. На рис. изображена жесткая адиабатическая оболочка, состоящая из двух сообщающихся сосудов, разделенных вентилем K. В первоначальном состоянии газ заполняет один из сосудов, а в другом сосуде – вакуум. После открытия вентиля газ расширяется, заполняет оба сосуда, и устанавливается новое равновесное состояние. В этом процессе Q = 0, т. к. нет теплообмена с окружающими телами, и A = 0, т. к. оболочка недеформируема. Из первого закона термодинамики следует: ΔU = 0, т. е. внутренняя энергия газа осталась неизменной. Так как внутренняя энергия идеального газа зависит только от температуры, температуры газа в начальном и конечном состояниях одинаковы – точки на плоскости (p, V, изображающие эти состояния, лежат на одной изотерме. Все промежуточные состояния газа неравновесны и их нельзя изобразить на диаграмме

Расширение газа в пустоту • Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.













12-Первый закон тд.ppt