11-Внутр энергия теплота работа.ppt
- Количество слайдов: 45
 Молекулярная физика 11
Молекулярная физика 11
 1. Основы и задачи термодинамики. 2. Внутренняя энергия и ее свойства. 3. Классификация термодинамических процессов.
1. Основы и задачи термодинамики. 2. Внутренняя энергия и ее свойства. 3. Классификация термодинамических процессов.
 Статистический метод • Для изучения системы многих частиц информация должна иметь обобщенный характер и относиться не к отдельным частицам, а к совокупности большого числа частиц. Соответствующие понятия также должны относиться не к отдельным частицам, а к большим совокупностям частиц. Новая форма информации и новые понятия требуют иного метода рассмотрения. Этот метод называется статистическим. Законы поведения совокупностей большого числа частиц, исследуемые статистическими методами, называются статистическими закономерностями. Статистические методы в физике имеют более широкое применение, чем динамические. Это связано с тем, что динамический метод эффективен только в применении к системам с небольшим числом степеней свободы. Большинство же физических систем имеют громадное число степеней свободы и могут изучаться только статистическими методами. Кроме того, квантовомеханические закономерности по своей природе являются статистическими. Поэтому статистические методы необходимо использовать также и для изучения систем с небольшим числом степеней свободы, если только в поведении этих систем существенны квантовые эффекты. Все это указывает на громадную роль статистических методов и статистических закономерностей в физике.
Статистический метод • Для изучения системы многих частиц информация должна иметь обобщенный характер и относиться не к отдельным частицам, а к совокупности большого числа частиц. Соответствующие понятия также должны относиться не к отдельным частицам, а к большим совокупностям частиц. Новая форма информации и новые понятия требуют иного метода рассмотрения. Этот метод называется статистическим. Законы поведения совокупностей большого числа частиц, исследуемые статистическими методами, называются статистическими закономерностями. Статистические методы в физике имеют более широкое применение, чем динамические. Это связано с тем, что динамический метод эффективен только в применении к системам с небольшим числом степеней свободы. Большинство же физических систем имеют громадное число степеней свободы и могут изучаться только статистическими методами. Кроме того, квантовомеханические закономерности по своей природе являются статистическими. Поэтому статистические методы необходимо использовать также и для изучения систем с небольшим числом степеней свободы, если только в поведении этих систем существенны квантовые эффекты. Все это указывает на громадную роль статистических методов и статистических закономерностей в физике.
 Термодинамический метод • Систему многих частиц можно рассматривать подругому, не интересуясь ее внутренней структурой. При таком подходе нужно использовать понятия и физические величины, относящиеся к системе в целом. Например, модель идеального газа в состоянии равновесия при таком подходе характеризуется объемом, давлением и температурой. Экспериментальные исследования призваны установить связи между этими величинами, а теория должна строиться на некоторых общих положениях (например, закон сохранения энергии) и с их помощью объяснять эти связи. Такая теория по своему характеру является феноменологической. Она не интересуется внутренними механизмами процессов, определяющих поведение изучаемой системы в целом; такой метод изучения систем многих частиц называется термодинамическим.
Термодинамический метод • Систему многих частиц можно рассматривать подругому, не интересуясь ее внутренней структурой. При таком подходе нужно использовать понятия и физические величины, относящиеся к системе в целом. Например, модель идеального газа в состоянии равновесия при таком подходе характеризуется объемом, давлением и температурой. Экспериментальные исследования призваны установить связи между этими величинами, а теория должна строиться на некоторых общих положениях (например, закон сохранения энергии) и с их помощью объяснять эти связи. Такая теория по своему характеру является феноменологической. Она не интересуется внутренними механизмами процессов, определяющих поведение изучаемой системы в целом; такой метод изучения систем многих частиц называется термодинамическим.
 Статистический и термодинамический методы • Статистический и термодинамический методы изучения систем многих частиц дополняют друга. • Термодинамический метод характеризуется своей общностью и позволяет изучать явления без знания их внутренних механизмов. • Статистический метод помогает понять суть явлений, установить связь поведения системы в целом с поведением и свойствами отдельных частиц и подсистем. • Их комбинированное применение способствует наиболее эффективному решению той или иной научной проблемы.
Статистический и термодинамический методы • Статистический и термодинамический методы изучения систем многих частиц дополняют друга. • Термодинамический метод характеризуется своей общностью и позволяет изучать явления без знания их внутренних механизмов. • Статистический метод помогает понять суть явлений, установить связь поведения системы в целом с поведением и свойствами отдельных частиц и подсистем. • Их комбинированное применение способствует наиболее эффективному решению той или иной научной проблемы.
 Термодинамика • Термодинамика – это наука о тепловых явлениях. • В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. • Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярнокинетические модели для иллюстрации своих выводов.
Термодинамика • Термодинамика – это наука о тепловых явлениях. • В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. • Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярнокинетические модели для иллюстрации своих выводов.
 Термодинамика • Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. • Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. • Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Термодинамика • Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. • Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. • Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
 Термодинамика • Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. • Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. • Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
Термодинамика • Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. • Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. • Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
 Задача термодинамики • Задача термодинамики – феноменологическое исследование свойств материальных тел, характеризуемых макропараметрами • или • Изучение зависимостей между макропараметрами в различных процессах и предсказание на их основе изменения свойств вещества
Задача термодинамики • Задача термодинамики – феноменологическое исследование свойств материальных тел, характеризуемых макропараметрами • или • Изучение зависимостей между макропараметрами в различных процессах и предсказание на их основе изменения свойств вещества
 Задача термодинамики • Термодинамика изучает процессы связанные с превращением энергии из одного вида в другой и характеризует эти превращения с количественной стороны с помощью понятий теплота и работа.
Задача термодинамики • Термодинамика изучает процессы связанные с превращением энергии из одного вида в другой и характеризует эти превращения с количественной стороны с помощью понятий теплота и работа.
 ТД отвечает на вопросы 1. Возможен ли данный процесс в ТД системе? 2. В каком направлении развивается процесс если он возможен? 3. До каких пор происходит это развитие?
ТД отвечает на вопросы 1. Возможен ли данный процесс в ТД системе? 2. В каком направлении развивается процесс если он возможен? 3. До каких пор происходит это развитие?
 Начала ТД 1. Теплоту можно превратить в работу 2. Полностью это возможно лишь при Т=0 К 3. Однако Т=0 К недостижима Вывод: асимметрия природы Вы конечно слышали формулировки в другой редакции. Их много и это одна из трудностей
Начала ТД 1. Теплоту можно превратить в работу 2. Полностью это возможно лишь при Т=0 К 3. Однако Т=0 К недостижима Вывод: асимметрия природы Вы конечно слышали формулировки в другой редакции. Их много и это одна из трудностей
 Основные исходные понятия • ТД система – совокупность тел, обменивающихся энергией как между собой, так и с внешними телами. • ТД состояние системы – набор ТД параметров, которые характеризуют свойства системы • Стационарное ТД состояние – состояние, для которого значения всех ТД параметров постоянны по времени • Стационарное состояние называется равновесным, если его неизменность во времени не обусловлена протеканием какихлибо процессов во внешних по отношению к данной ТД системе телах
Основные исходные понятия • ТД система – совокупность тел, обменивающихся энергией как между собой, так и с внешними телами. • ТД состояние системы – набор ТД параметров, которые характеризуют свойства системы • Стационарное ТД состояние – состояние, для которого значения всех ТД параметров постоянны по времени • Стационарное состояние называется равновесным, если его неизменность во времени не обусловлена протеканием какихлибо процессов во внешних по отношению к данной ТД системе телах

 Понятие о равновесии в ТД • Система находится в ТД равновесии, если макроскопические величины, определяющие ее состояние, остаются постоянными (р, Т) • В состоянии равновесия не могут происходить диффузия, теплопроводность, фазовые переходы, хим. реакции • Но атомы и молекулы хаотически движутся, но так как их огромное количество, то это позволяет системе находиться в состоянии ТД равновесия
Понятие о равновесии в ТД • Система находится в ТД равновесии, если макроскопические величины, определяющие ее состояние, остаются постоянными (р, Т) • В состоянии равновесия не могут происходить диффузия, теплопроводность, фазовые переходы, хим. реакции • Но атомы и молекулы хаотически движутся, но так как их огромное количество, то это позволяет системе находиться в состоянии ТД равновесия
 ТД процессы • Любое изменение в ТД системе, связанное с изменением хотя бы одного из ее ТД параметров, называется ТД процессом • Процессы, в ходе которых система все время остается в состоянии равновесия называются квазистатическими или равновесными • Принципиально процесс должен вестись бесконечно медленно • Если нет, процесс – неравновесный • Квазистатические – график есть • Неравновесные – графика нет
ТД процессы • Любое изменение в ТД системе, связанное с изменением хотя бы одного из ее ТД параметров, называется ТД процессом • Процессы, в ходе которых система все время остается в состоянии равновесия называются квазистатическими или равновесными • Принципиально процесс должен вестись бесконечно медленно • Если нет, процесс – неравновесный • Квазистатические – график есть • Неравновесные – графика нет
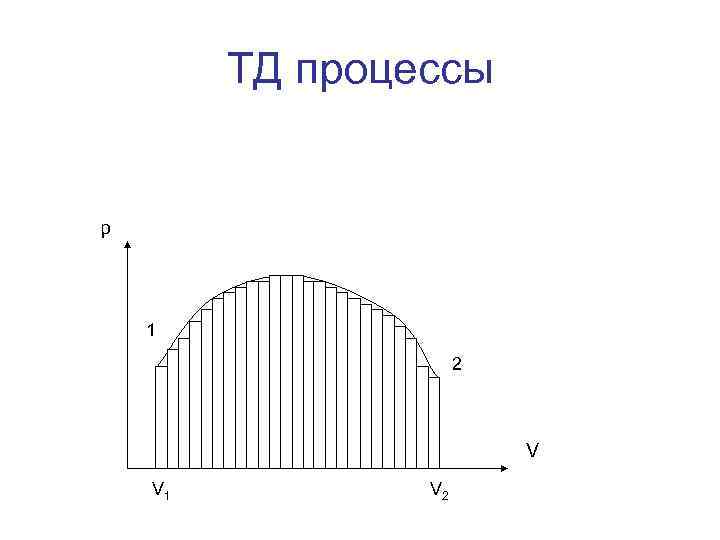
 ТД процессы • Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
ТД процессы • Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
 ТД процессы p 1 2 V V 1 V 2
ТД процессы p 1 2 V V 1 V 2
 ТД процессы • Обратимые процессы – возможен обратный переход через те же промежуточные состояния, что и прямой • Необратимые – обратный переход невозможен • Обратимые квазистатические • Пример: пластическая деформация • Происходит бесконечно медленно, т. е. квазистатически, но необратима
ТД процессы • Обратимые процессы – возможен обратный переход через те же промежуточные состояния, что и прямой • Необратимые – обратный переход невозможен • Обратимые квазистатические • Пример: пластическая деформация • Происходит бесконечно медленно, т. е. квазистатически, но необратима
 ТД процессы • • Пример необратимого процесса: Все неравновесные • Сбросим весь песок сразу 1. Газ нельзя охарактеризовать какими либо р и Т 2. Нельзя изобразить линией-графиком
ТД процессы • • Пример необратимого процесса: Все неравновесные • Сбросим весь песок сразу 1. Газ нельзя охарактеризовать какими либо р и Т 2. Нельзя изобразить линией-графиком
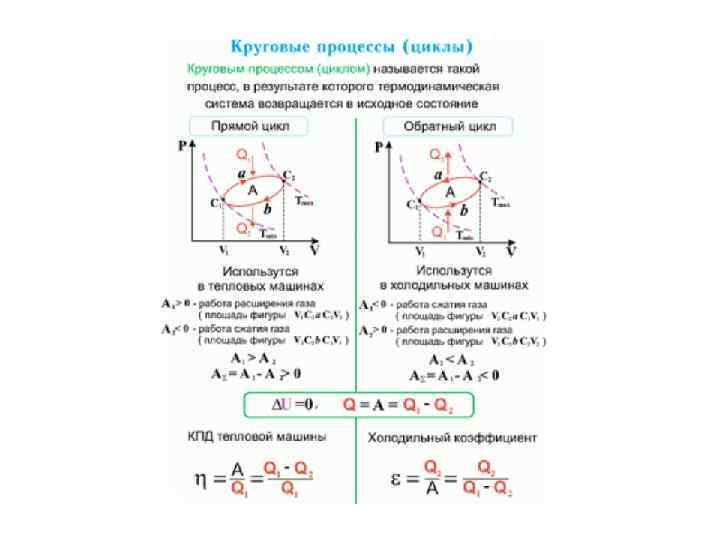
 ТД процессы • Изопроцессы в однокомпонентных газах реализуются путем фиксирования одного из трех параметров состояния р, V, Т. • Круговым процессом или циклом называется процесс, при котором система пройдя ряд состояний, возвращается в исходное.
ТД процессы • Изопроцессы в однокомпонентных газах реализуются путем фиксирования одного из трех параметров состояния р, V, Т. • Круговым процессом или циклом называется процесс, при котором система пройдя ряд состояний, возвращается в исходное.
 Круговой процесс (цикл) • Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой
Круговой процесс (цикл) • Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой
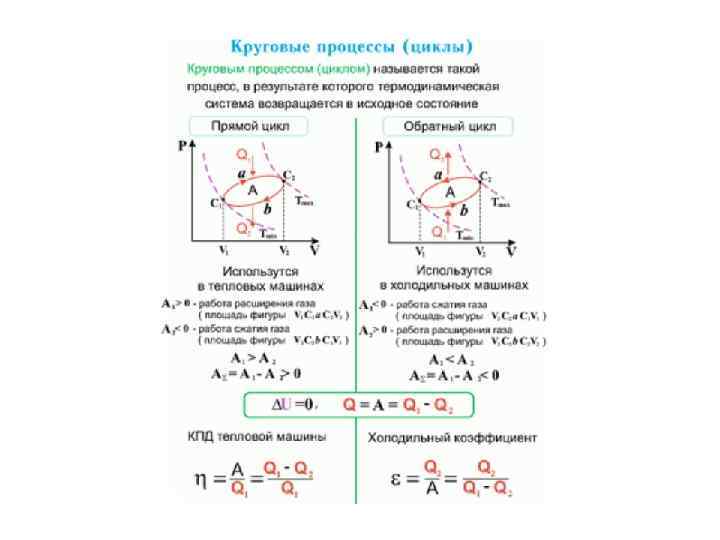
 ТД процессы • Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
ТД процессы • Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
 ТД процессы • Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично» , идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д. ), которая нами не обсуждается. • Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум причинам: • 1) многие процессы в природе и технике практически обратимы; • 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
ТД процессы • Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично» , идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д. ), которая нами не обсуждается. • Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум причинам: • 1) многие процессы в природе и технике практически обратимы; • 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
 ТД процессы • • Пусть пружина, один из концов которой закреплен, деформируется (растягивается) силой F, приложенной к другому ее концу(рис. ). Пружина растягивается, увеличивая свою потенциальную энергию за счет работы силы F. Если после того, как пружина окажется растянутой на определенную длину, прекратить действие силы, то пружина вернется в исходное состояние, соответственно уменьшив свою потенциальную энергию. Можно ли считать описанный процесс растяжения пружины обратимым? Если пружину растянуть быстро и сразу прекратить действие силы, то процесс не будет обратимым. В самом деле, когда сила F начинает растягивать пружину, то прежде всего деформируется та часть пружины, к которой непосредственно приложена сила, т. е. часть, прилегающая к незакрепленному концу. Постепенно деформация передается остальным частям пружины, и последней деформацию испытает та ее часть, которая прилегает к закрепленному концу. После прекращения действия силы пружина начнет сжиматься. Но и теперь деформацию, на этот раз деформацию сжатия, первой испытает часть пружины, прилегающая к точке приложения силы, так как она, очевидно, первой «почувствует» , что сила перестала действовать. От этой части деформация постепенно передастся вдоль пружины, пока не восстановится исходное состояние. Таким образом, хотя процесс сжатия и идет в обратном направлении, но пружина при этом не проходит промежуточные состояния в обратном порядке: в прямом процессе сначала деформировалась та часть пружины, которая прилегает к ее незакрепленному концу, и от нее деформация передавалась остальным частям пружины; в таком же, а не в обратном порядке пружина деформировалась и при сжатии, поэтому в описанном опыте процесс растяжения пружины нельзя считать обратимым. Необратимость скажется в том, что при быстром прекращении действия силы пружина придет в колебательное движение, которое не является обратимым: сила трения приведет к затуханию колебаний и их энергия перейдет в тепло.
ТД процессы • • Пусть пружина, один из концов которой закреплен, деформируется (растягивается) силой F, приложенной к другому ее концу(рис. ). Пружина растягивается, увеличивая свою потенциальную энергию за счет работы силы F. Если после того, как пружина окажется растянутой на определенную длину, прекратить действие силы, то пружина вернется в исходное состояние, соответственно уменьшив свою потенциальную энергию. Можно ли считать описанный процесс растяжения пружины обратимым? Если пружину растянуть быстро и сразу прекратить действие силы, то процесс не будет обратимым. В самом деле, когда сила F начинает растягивать пружину, то прежде всего деформируется та часть пружины, к которой непосредственно приложена сила, т. е. часть, прилегающая к незакрепленному концу. Постепенно деформация передается остальным частям пружины, и последней деформацию испытает та ее часть, которая прилегает к закрепленному концу. После прекращения действия силы пружина начнет сжиматься. Но и теперь деформацию, на этот раз деформацию сжатия, первой испытает часть пружины, прилегающая к точке приложения силы, так как она, очевидно, первой «почувствует» , что сила перестала действовать. От этой части деформация постепенно передастся вдоль пружины, пока не восстановится исходное состояние. Таким образом, хотя процесс сжатия и идет в обратном направлении, но пружина при этом не проходит промежуточные состояния в обратном порядке: в прямом процессе сначала деформировалась та часть пружины, которая прилегает к ее незакрепленному концу, и от нее деформация передавалась остальным частям пружины; в таком же, а не в обратном порядке пружина деформировалась и при сжатии, поэтому в описанном опыте процесс растяжения пружины нельзя считать обратимым. Необратимость скажется в том, что при быстром прекращении действия силы пружина придет в колебательное движение, которое не является обратимым: сила трения приведет к затуханию колебаний и их энергия перейдет в тепло.
 ТД процессы • По той же причине быстрое сжатие или расширение газа - изотермическое или адиабатное - не являются обратимыми процессами. Как и в случае с пружиной, необратимость здесь состоит в том, что чередование промежуточных состояний при прямом и обратном процессах оказывается одинаковым. • К числу необратимых процессов относится и расширение газа в пустоту, не уравновешенное внешними силами. • Необратимыми являются все явления переноса: теплопроводность, диффузия и внутреннее трение.
ТД процессы • По той же причине быстрое сжатие или расширение газа - изотермическое или адиабатное - не являются обратимыми процессами. Как и в случае с пружиной, необратимость здесь состоит в том, что чередование промежуточных состояний при прямом и обратном процессах оказывается одинаковым. • К числу необратимых процессов относится и расширение газа в пустоту, не уравновешенное внешними силами. • Необратимыми являются все явления переноса: теплопроводность, диффузия и внутреннее трение.

 Внутренняя энергия • Одним из важнейших понятий термодинамики является внутренняя энергия тела. • Все макроскопические тела обладают энергией, заключенной внутри самих тел. • С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. • В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. • Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Внутренняя энергия • Одним из важнейших понятий термодинамики является внутренняя энергия тела. • Все макроскопические тела обладают энергией, заключенной внутри самих тел. • С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. • В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. • Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
 Внутренняя энергия • Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др. ), молекулы которого совершают только поступательное движение:
Внутренняя энергия • Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др. ), молекулы которого совершают только поступательное движение:
 Внутренняя энергия • Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V: U = U(T, V). • Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.
Внутренняя энергия • Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V: U = U(T, V). • Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.
 Внутренняя энергия U(T, V) – f (состояния). Это означает, что всякий раз, когда система оказывается в состоянии с заданными значениями V и T, ее внутренняя энергия принимает строго определенной значение присущее этому состоянию, не зависящее от того каким образом система была приведена в это состояние.
Внутренняя энергия U(T, V) – f (состояния). Это означает, что всякий раз, когда система оказывается в состоянии с заданными значениями V и T, ее внутренняя энергия принимает строго определенной значение присущее этому состоянию, не зависящее от того каким образом система была приведена в это состояние.
 Внутренняя энергия • U(T, V) как и потенциальная энергия в механике определена с точностью до постоянного слагаемого.
Внутренняя энергия • U(T, V) как и потенциальная энергия в механике определена с точностью до постоянного слагаемого.
 Внутренняя энергия 1. U=Eк+Eп 2. 3. 4. 5. U=U(T, V) U=U(состояния), подчеркиваем вводя d. U U≠U(V) U – характеризует и вводится для равновесных состояний, когда во всех частях системы Т=const 6. ΔU ← работа, теплота
Внутренняя энергия 1. U=Eк+Eп 2. 3. 4. 5. U=U(T, V) U=U(состояния), подчеркиваем вводя d. U U≠U(V) U – характеризует и вводится для равновесных состояний, когда во всех частях системы Т=const 6. ΔU ← работа, теплота





 Работа • Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = –A'. Если объем газа изменился на малую величину ΔV, то газ совершает работу • p. SΔx = pΔV, • где p – давление газа, S – площадь поршня, Δx – его перемещение (рис. ). При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой: • или в пределе при ΔVi → 0:
Работа • Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = –A'. Если объем газа изменился на малую величину ΔV, то газ совершает работу • p. SΔx = pΔV, • где p – давление газа, S – площадь поршня, Δx – его перемещение (рис. ). При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой: • или в пределе при ΔVi → 0:
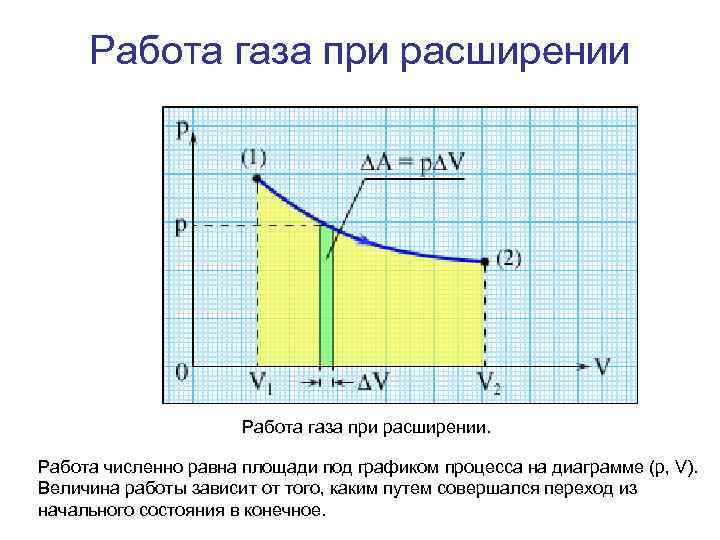 Работа газа при расширении. Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.
Работа газа при расширении. Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.
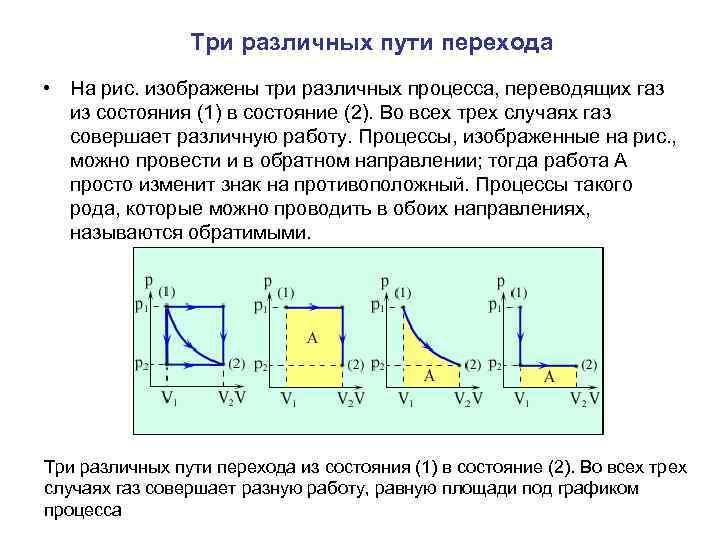 Три различных пути перехода • На рис. изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу. Процессы, изображенные на рис. , можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный. Процессы такого рода, которые можно проводить в обоих направлениях, называются обратимыми. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса
Три различных пути перехода • На рис. изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу. Процессы, изображенные на рис. , можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный. Процессы такого рода, которые можно проводить в обоих направлениях, называются обратимыми. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса
 Опыт Джоуля по определению механического эквивалента теплоты • В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия. Другим примером может служить опыт Джоуля (1843 г. ) по определению механического эквивалента теплоты (рис. ). При вращении вертушки, погруженной в жидкость, внешние силы совершают положительную работу (A' > 0); при этом жидкость из-за наличия сил внутреннего трения нагревается, т. е. увеличивается ее внутренняя энергия. В этих двух примерах процессы не могут быть проведены в противоположном направлении. Такие процессы называются необратимыми. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.
Опыт Джоуля по определению механического эквивалента теплоты • В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия. Другим примером может служить опыт Джоуля (1843 г. ) по определению механического эквивалента теплоты (рис. ). При вращении вертушки, погруженной в жидкость, внешние силы совершают положительную работу (A' > 0); при этом жидкость из-за наличия сил внутреннего трения нагревается, т. е. увеличивается ее внутренняя энергия. В этих двух примерах процессы не могут быть проведены в противоположном направлении. Такие процессы называются необратимыми. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.
 Внутренняя энергия • Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена. • Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. • Тепловой поток всегда направлен от горячего тела к холодному. • Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
Внутренняя энергия • Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена. • Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. • Тепловой поток всегда направлен от горячего тела к холодному. • Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).