Lection 1.ppt
- Количество слайдов: 29
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ КЛЕТКИ изучает жизнь на молекулярном уровне. Разработка тонких физических и химических методов анализа структуры и функций молекул, свойственных прежде всего клетке как элементарной и универсальной составляющей всех организмов, имела решающее значение для рождения молекулярной биологии. «Молекулярная биология изучает связь структуры биологических макромолекул и основных клеточных компонентов с их функцией, а также основные принципы и механизмы саморегуляции клеток, которые опосредуют согласованность и единство всех протекающих в клетке процессов, составляющих сущность жизни» . Дж. Уотсон (1968 г. )

Литература: • • • Коничев А. С. , Севастьянова Г. А. Молекулярная биология. Москва. ACADEMA. 2005. Жимулёв И. Ф. Общая и молекулярная генетика. Новосибирск: Сибирское университетское издание. 2003. Karp G. Cell and molecular biology. 3 d ed. N/Y/: John Wiley and Sons. 2002. Альбертс Б. и др. Молекулярная биология клетки. Москва: Мир. 1994. Спирин А. С. Молекулярная биология. Структура и биосинтез нуклеиновых кислот. Москва: Высшая школа. 1990. Спирин А. С. Молекулярная биология. Структура рибосомы и биосинтез белка. Москва: Высшая школа. 1986. Ченцов Ю. С. Введение в клеточную биологию. Москва: Академкнига. 2004. Михайлов В. С. ДНК-полимеразы эукариот. Молекулярная биология. 1999. 33(4): 567 -580. Богданов А. А. Теломеры и теломеразы. Соросовский образовательный журнал. 1998 ю12: 12 -18. Bell SP, Dutta A. DNA replication in eukaryotic cells. Annu. Rev. Biochem. 2002. 71: 333 -74. Lecrenier N. , Foury F. New features of mitochondrial DNA replication system in yeast and man. Gene 2000. 246: 37 -48. Maleszka R. , Skelly P. J. , Clark-Walker G. D. Rolling circle replication of DNA in yeast mitochondria. The EMBO J. 1991. 10(12): 3923 -3929.

Антони ван Левенгук • Спиральные бактерии spirillum Ему удалось создать очень маленькие короткофокусные, двояковыпуклые линзы, которые работали как лупа и давали увеличение в 250 - 300 раз, что было для того времени совершенно невероятно. Между двумя пластинками меди или бронзы, в которых были предварительно сделаны сквозные отверстия, он помещал маленькую линзу. Существовал также механизм регулировки расстояния между линзой и наблюдаемым объектом.

Предшественники клеточной теории • • 1610 - Антони ван Левенгук, торговец тканями, хобби – изготовление линз, увеличение 500, наблюдал одноклеточные организмы, эритроциты, спермии. 1665 – Р. Гук, повторил опыт Левенгука и наблюдал одноклеточные организмы в воде, написал книгу «Микрография или некоторые физиологические описания мельчайших тел, сделанные посредством увеличительных стекол» , где впервые использовал слово клетка, для обозначения пустот в пробковом материале. 1784 – петербургский академик Ф. У Эпинус сконструировал первую модель ахроматического микроскопа, а в 1780 -1790 – вторую более удачную модель. 1830 – Ф. Мейеном укрепляется представление о клеточном строении растений. 1831 – Р. Броун открыл ядра в пыльце как постоянные структуры клетки, «Об органах и способах оплодотворения у орхидейных» (1833) 1838 – Т. Шванн «Микроскопическое исследование о соответствии в строении и росте животных и растений» , установил, что всеобщей элементарной структурой животных и растений является клетка, которая гомологичная у тех и других, значение ядра как основного признака жизни. Клеточная теория была величайшим биологическим обобщением! 1841 – Р. Ремак показал деление кровяных клеток у зародыша цыпленка. Новые клетки образуются только путем деления. Вирхов в своем учебнике присвоил чужую идею. Но осталась его крылатая фраза: ”Omnis cellula e cellula”.

Лекция 1. Структура белков АМИНОКИСЛОТЫ Общая формула аминокислот: H 2 N-CH-COOH, где R – боковая цепь (радикал) R В белках встречается 20 канонических аминокислот. Существует две изомерные формы аминокислот L- и D-. Обычно в белках встречаются L-аминокислоты. D -аминокислоты обнаруживаются в клеточных стенках микроорганизмов, в антибиотиках, в составе пептидов кожи одного из видов южноамериканской лягушки.

Молекулярная масса аминокислотных остатков варьирует от 57 до 186 Да (среднее значение 110 Да) 1 Да=1, 67 х10 -24 г Аминокислоты в водной среде представляют собой биполярные ионы (цвиттерионы): H O +H 3 N-C-C-OR поэтому не обладают выраженным зарядом вблизи нейтральных значений р. Н. К заряженным аминокислотам относятся те из них, которые содержат дополнительный заряженные группы в боковых цепях. Аминокислоты подразделяют на 4 группы: а) неполярные, или гидрофобные, б) полярные (гидрофильные) незаряженные, в) полярные положительно заряженные (основные), г) полярные отрицательно заряженные (кислые).

ПЕПТИДЫ Аминогруппа (-NH 2) и карбоксильные группа (-СООН) способны реагировать с выделением воды и образованием пептидной связи. В водной среде равновесие сдвинуто в сторону образования свободных аминокислот, в клетках синтез пептидов протекает по энергоемкому механизму с участием рибосом и макроэнергетических соединений. Параметры структуры пептидной связи были определены Л. Полингом и Р. Кори. Транс-пептидная связь – 6 атомов (С, О, N, Н, С 1 и С 2) находятся в одной плоскости.
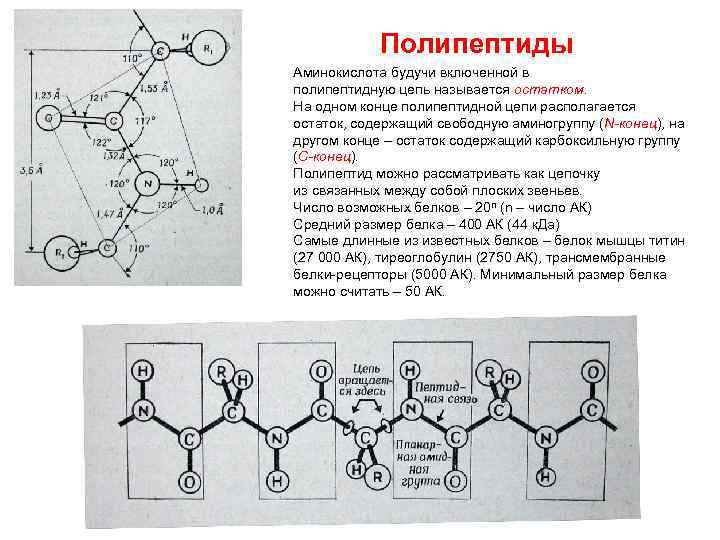
Полипептиды Аминокислота будучи включенной в полипептидную цепь называется остатком. На одном конце полипептидной цепи располагается остаток, содержащий свободную аминогруппу (N-конец), на другом конце – остаток содержащий карбоксильную группу (С-конец). Полипептид можно рассматривать как цепочку из связанных между собой плоских звеньев. Число возможных белков – 20 n (n – число АК) Средний размер белка – 400 АК (44 к. Да) Самые длинные из известных белков – белок мышцы титин (27 000 АК), тиреоглобулин (2750 АК), трансмембранные белки-рецепторы (5000 АК). Минимальный размер белка можно считать – 50 АК.

Первичная структура белка – порядок чередования аминокислотных остатков в полипептидной цепи белка. Задается нуклеотидной последовательностью ДНК и считывается в процессе трансляции. Инсулин – первый белок для которого удалось установить первичную последовательность (Ф. Сангер, 1953) Цепь А – 21 остаток, цепь В – 30 остатков, 3 дисульфидных мостика. α-белок.

Единичная замена может вызывать серьезные последствия. Все зависит от того насколько замена влияет на поверхность белка или на положение функциональных аминокислот. Молекулярные основы серповидной клеточной анемии. На хроматограммах приведены результаты разделения белков при обработке β-цепи гемоглобина из нормальных клеток (слева, гемоглобин типа А) и у больных серповидной анемией (справа, гемоглобин типа S) протеолитическим ферментом трипсином. Обе хроматограммы идентичны за исключением одного пептида, содержащего единственную замену аминокислоты Glu на Val. Вид красной кровяной клетки получен с помощью сканирующего электронного микроскопа. В результате аномальной формы клеток они могут засорять кровеносные сосуды, снижается поставка кислорода организму.

Вторичная структура белка – упорядоченное расположение отдельных участков основной цепи полипептида без учета расположения боковых цепей. α-спираль Плоскости жестких пептидных связей расположены параллельно длинной оси спирали. На рисунке указаны внутрицепочечные водородные связи. Средние размеры α–спирали Шаг спирали и смещение в расчете на один аминокислотный остаток соответствует большому (5. 4 Å) и малому (1. 5 Å) периодам. Радиус спирали - 2. 3 Å. Среднее число АК/ на один оборот – 3, 6. Угол подъема витка спирали – 26 о. Протяженность α–спиральных участков в глобулярных белках не превышает 15 АК (3 -4 оборота).

1951 г. – Linus Pauling и Robert Corey впервые постулировали спиральное расположение в пространстве полипептидных цепей, а затем сформулировали основные принципы построения моделей вторичных структур белков. Было предложено несколько типов спиралей (α, 310, π и др. ), но в белках преимущественно встречаются α-спирали. Возможность образования спирали определяется природой и последовательностью R-групп в цепи. Модель α–спирали, на которой показаны внутрицепочечные водородные связи Пространственная модель α–спирали.

Элементы вторичной структуры правая α-спираль β-лист Белковые нити шерсти и волоса человека состоят преимущественно из α–спирали, а шелка – из β-структур.

Сверхвторичные структуры – энергетически предпочтительные ансамбли вторичной структуры, свертываемые в пространстве по мере синтеза белка. βξβ-звено βαβ-участок β-лист Доменная структура – глобулярные области белка. Молекулярная масса элементарных доменов составляет около 20 к. Да.

Структура иммуноглобулина

Третичная структура – расположение в пространстве всех атомов белковой молекулы. Трехмерная структура белка характеризуется определенной укладкой в пространстве всех звеньев полипептидной цепи. Изучают глобулярные и фибриллярные белки, которые удается кристаллизовать и анализировать с помощью рентгеноструктурного анализа. Важное значение имеют R-взаимодействия (водородные, ионные и гидрофобные), а также ковалентные (дисульфидные мостики). Третичная структура миоглобина Схематическое изображение молекулы. Гемо-группа (красная), связывающая кислород, располагается в гидрофобном кармане. Состоит преимущественно из α–спиралей (75% из 153 АК). Дифракционная картина. Кристаллы белка облучаются рентгеновскими лучами и отраженные от атомов лучи фиксируются на чувствительной пластине. Трехмерная структура молекулы. Показано положение всех атомов.

Цитохром с Расположение гидрофильных (зеленые) и гидрофобных (красные) остатков аминокислот в растворимом белке цитохроме с. В центре расположена гемогруппа. Пример белка, состоящего из α–спиралей.

Pr. PC Pr. PSc ПРИОНЫ Микроскопическое изображение амилоидных бляшек в культуре ткани мозга у пациента, умершего от болезни Альтцгеймера. =43% =3% =34% =43% Нормальный белок состоит из α– спиралей, а в прионе образуется β– лист. В результате различной упаковки нормальный белок растворим в воде, а прион гидрофобный и образует агрегаты, которые приводят к гибели клетки.

Четвертичная структура – структура белков, содержащих более одной полипептидной нити. Отдельные полипептидные цепи, входящие в состав белков, обладающих четвертичной структурой, называются протомерами, или субъединицами. Субъединицы могут быть одинаковыми (гомомер) или разными (гетеромер). Из субъединиц формируется эпимолекула белка-мультимера. Формируется за счет слабых взаимодействий (водородные связи между листами, гидрофобные взаимодействия в контактных областях субъединиц, электростатические взаимодействия между противоположно заряженными радикалами АК, ковалентной связью (дисульфидные мостики). Олигомерные белки не обладают четвертичной структурой. Связывание нескольких белков не приводит к появлению специфических функций. К четвертичной структуре не относятся и надмолекулярные комплексы – мультиэнзимные комплексы и метаболоны. Образование таких структур связано с единой пространственной локализацией и оптимизацией скорости протекания процессов.


Циклин-зависимая киназа h. CDK 2 Фосфатаза h. ITPA Гетеродимер. Состоит из двух субъединиц – каталитической субъединицы и циклина. Показаны молекула АТФ и фрагмент субстрата. Гомодимер

Зеленый флюоресцирующий белок
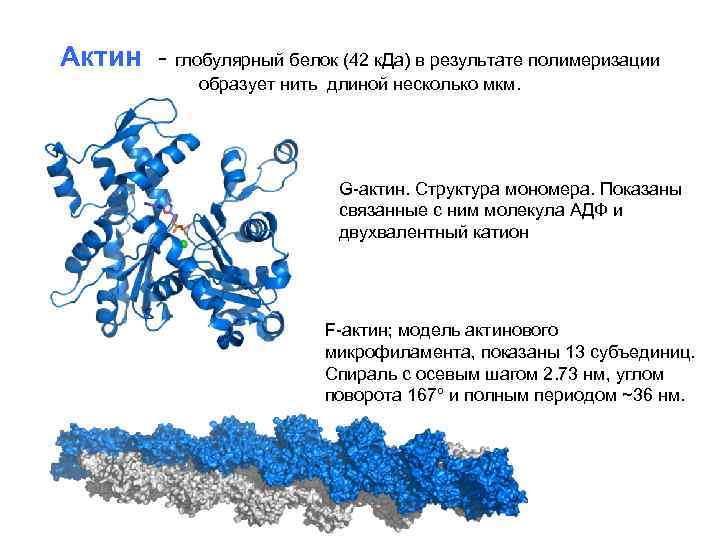
Актин - глобулярный белок (42 к. Да) в результате полимеризации образует нить длиной несколько мкм. G-актин. Структура мономера. Показаны связанные с ним молекула АДФ и двухвалентный катион F-актин; модель актинового микрофиламента, показаны 13 субъединиц. Спираль с осевым шагом 2. 73 нм, углом поворота 167º и полным периодом ~36 нм.

a, Front view. The subunit in our F-actin model (cyan) and the TMR–actin crystal structure (yellow; PDB code 1 J 6 Z)20 are superimposed on subdomains 1 and 2. Subdomains 3 and 4 are rotated with respect to subdomains 1 and 2 about the rotational axis (red line) in the direction indicated by the red arrow. The rotation is associated with bends of the polypeptide chain at residues 141– 142 and 336 – 337, as indicated in blue. b, Side view, viewed from the left-hand side of subdomains 3 and 4 in a. Subdomains 1 and 2 are shown as light cyan and light yellow C traces. c, A subunit in our F-actin model, with ADP depicted as red CPK balls and Ca 2+ as a yellow CPK ball. In a– c, the subdomains are labelled with red numbers. d, Details of the hinge region indicated in green in c. The subunit in our Factin conformation (cyan) and the TMR–actin crystal structure (yellow) are superimposed on the four- -strand core of subdomain 3 including Val 163 and Ile 175 (red). The C positions are indicated by balls. При переходе G-F происходит поворот двух доменов на 20 º и увеличение Dпетли



Фолдинг процесс формирования пространственной структуры белка Денатурация (меркаптоэтанол рвет –S-S-) и рефолдинг рибонуклеазы (124 АК, 4 дисульфидные связи). Денатурация –реструктурирование или развертывание белков. Фолдинг рибонуклеазы осуществляется как самосборка. Для сборки некоторых белков необходимы белки-помощники (шапероны).

СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ • • • 1953 г. - Ф. Сангер с коллегами впервые расшифровал аминокислотную последовательность инсулина (51 АК, две цепи 21+30). 1958 г. - Нобелевская премия по химии за расшифровку первичной структуры белка (George W. Beadle, Joshua Lederberg, Edward L. Tatum, Frederick Sanger, Cambridge Univ. ) 1959 г. –датский биохимик К. Линдерстрем - Ланг предложил различать 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры. 1962 г. – Нобелевская премия по химии за определение третичной структуры миоглобина (John C. Kendrew, Max F. Perutz, Cambridge Univ). 1972 г. – Нобелевская премия по химии за установление соотношения между первичной и третичной структурой белков (Christian B. Anfinsen, NIH) и структуру иммуноглобулина (Gerald Edelman, Rodney R. Porter). 1980 -ые гг. Г. Шульц и Р Ширмер дополнили классификацию еще двумя уровнями: сверхвторичными структурами и доменами.

Основополагающие открытия: • • 1939 – В. А. Энгельгард открыл АТФазную активность миозина. 1944 – О. Т. Эвери (O. T. Avery) установил, что не белок, а ДНК является носителем генетической информации. 1951 – Л. Полинг и Р. Кори (L. Pauling, R. Corey) обосновали существование основных типов укладки аминокислотных остатков в полипептидных цепях белков (α-спирали и складчатые β-слои). 1953 – Ф. Сангер (F. Sanger) расшифровал первичную структуру инсулина быка. 1959 – К. Линдерстрем-Ланг (K. Linderstrem-Lang) предложил различать четыре уровня структурной организации белков. 1960 – Дж. Кедрью (J. Kendrew) впервые описал трехмерную структуру миоглобина кашалота, а М. Перутц (M. Perutz) – структуру гемоглобина. 1965 – К. Анфинсен (Ch. Anfinsen) показал способность белков к самосборке, эксперименты по денатурации – ренатурации. 1980 – Г. Шульц и Р. Ширмер (G. Schultz, R. Schirmer) дополнили еще двумя уровнями организации.
Lection 1.ppt