8870c957d773bcd00769bac72b43e032.ppt
- Количество слайдов: 60

Молекулярная биология для биоинформатиков • Академический университет • Ефимова Ольга Алексеевна

Лекция № 2 Эпигенетические модификации генома человека «Генетика предполагает, а эпигенетика располагает» . P. Medawar & J. Medawar

Доимплантационное развитие человека День 1. Стадия зиготы День 2. Эмбрион в стадии дробления 4 бластомера День 3. Эмбрион на стадии дробления 8 клеток. День 4. Морула. 3 День 5. Бластоциста

Разные судьбы, функции, морфология, «способности» клеток при одинаковом генотипе

Эпигенетическое наследование В более общем смысле, предметом эпигенетики являются явления, связанные с развитием различных фенотипов клеток или организмов на основе одного генотипа. В более узком смысле эпигенетика – раздел генетики, который изучает наследуемые изменения активности генов во время развития организма или деления клеток. Эпигенетическое наследование – наследование паттерна экспрессии генов.

Эпигенетическая регуляция - наследственные и ненаследственные изменения в экспрессии конкретного гена без каких-либо соответствующих структурных изменений в его нуклеотидной последовательности. Эпигенетические явления: импринтинг, эффект положения, особенности структурно-функциональной организации хроматина определенных хромосомных локусов, влияющие на экспрессию генов, интерференция РНК.

ДВА ВИДА ИНФОРМАЦИИ В ГЕНОМЕ Генетическая – закодированная в ДНК программа создания живого организма Эпигенетическая (динамическая) – как, где и когда должна быть реализована генетическая информация. Каждый вид информации обеспечен своими системами: Кодирования Хранения Передачи

Изменения генетические • Необратимы (мутации) • Изменения первичной структуры ДНК • Стабильно наследуемые эпигенетические • Обратимы • Не затрагивают изменений первичной структуры ДНК • Бывают долговременные и кратковременные
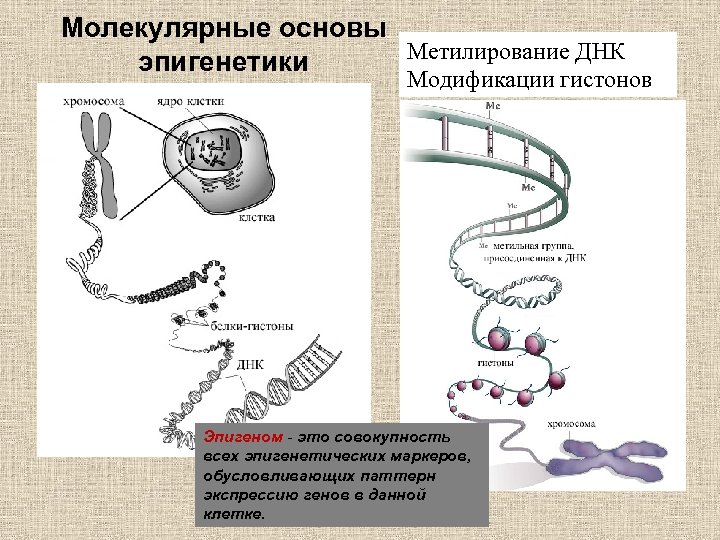
Молекулярные основы Метилирование ДНК эпигенетики Модификации гистонов Эпигеном - это совокупность всех эпигенетических маркеров, обусловливающих паттерн экспрессию генов в данной клетке.

Посттрансляционные модификации гистонов
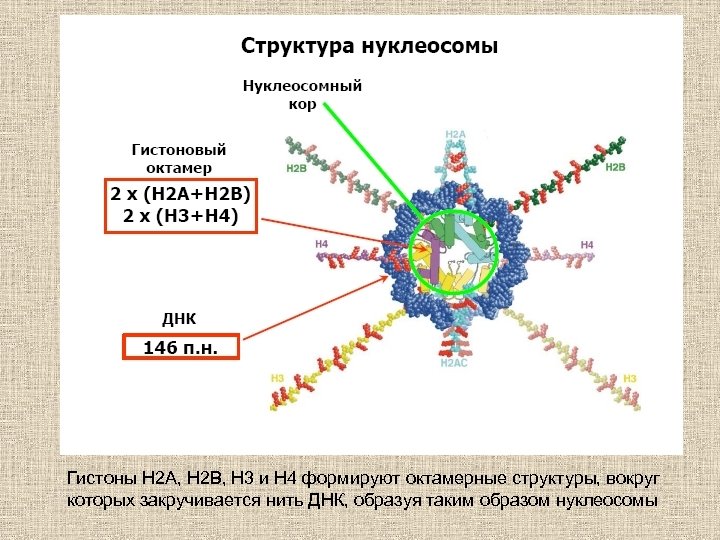
Гистоны Н 2 А, Н 2 В, Н 3 и Н 4 формируют октамерные структуры, вокруг которых закручивается нить ДНК, образуя таким образом нуклеосомы
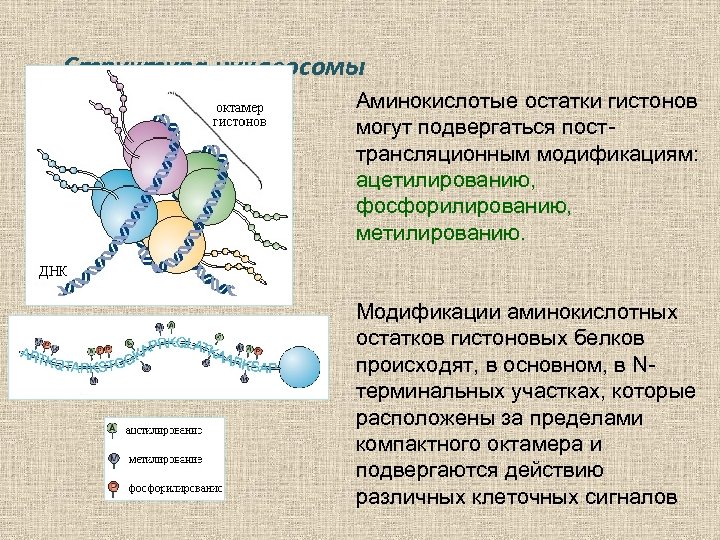
Структура нуклеосомы Аминокислотые остатки гистонов могут подвергаться посттрансляционным модификациям: ацетилированию, фосфорилированию, метилированию. Модификации аминокислотных остатков гистоновых белков происходят, в основном, в Nтерминальных участках, которые расположены за пределами компактного октамера и подвергаются действию различных клеточных сигналов

В зависимости от типа и сайта модификаций аминокислотных остатков, каждая нуклеосома имеет свой «гистоновый код» , регулирующий активность транскрипции

Ацетилирование и деацетилирование гистонов • ацетилирование связано с активацией транскрипции • белки, осуществляющие ацетилирование - гистоновые ацетилтрансферазы (НАТ); донор ацетильной группы – ацетил ко. А • белки, осуществляющие деацетилирование – гистоновые деацетилазы (HDAC) Модель модификации гистонов: ДНК-связывающиеся активаторы привлекают НАТ для ацетилирования нуклеосомных гистонов, а репрессоры привлекают HDAC для деацетилирования гистонов. Эти события приводят к изменению структуры нуклеосом и активации или репрессии транскрипции соответственно.
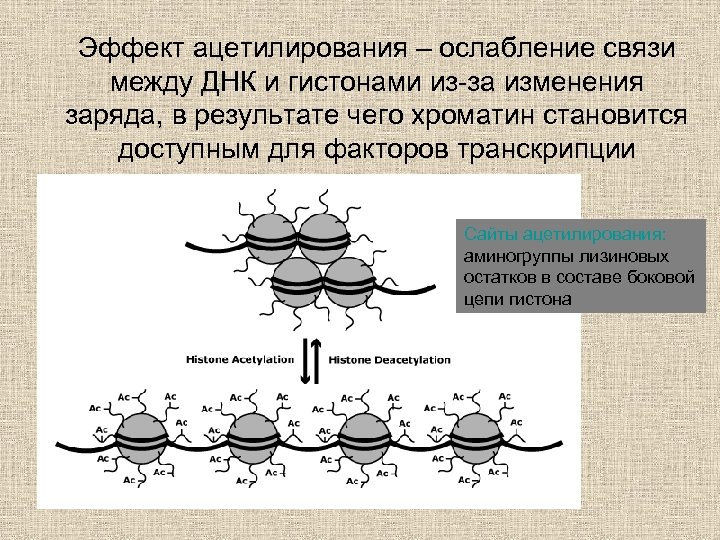
Эффект ацетилирования – ослабление связи между ДНК и гистонами из-за изменения заряда, в результате чего хроматин становится доступным для факторов транскрипции Сайты ацетилирования: аминогруппы лизиновых остатков в составе боковой цепи гистона

Фосфорилирование и дефосфорилирование гистонов • фосфорилирование связано с активацией транскрипции • белки, осуществляющие фосфорилирование – протеинкиназами; донор фосфата – АТФ • белки, осуществляющие дефосфорилирование – фосфатазы Сайты фосфорилирования: гидроксильные группы серина, треонина и тирозина. В результате фосфорилирования увеличивается негативный заряд.

Метилирование гистонов Метилируются -Лизин (моно-, ди- и триметилирование) -Агринин (моно- и диметилирование) Метилирование не приводит к изменению заряда модифицируемого остатка Эффекты метилирования в зависимости от сайта модификации и количества метильных групп: -Репрессия транскрипции -Активация транскрипции Регуляция транскрипции через молекулы-эффекторы

Метилирование лизинов Осуществляют лизиновые метилтрансферазы - НКМТ SET-домен Донор метильной группы – S-аденозилметионин (SAM) 6 наиболее хорошо описанных сайтов метилирования: на гистоне Н 3 (К 4, К 9, К 27, К 36, К 79) на гистоне Н 4 (К 20) Деметлирование лизинов LSD 1 удаляет метильные группы с Н 3 К 4 JHDM 1 – H 3 K 36 me 1 и me 2, JHDM 2 A – H 3 K 9 m 1 и me 2, JHDM 3 A – H 3 K 36 me 3, JMJD 2 A – H 3 K 9 me 3.
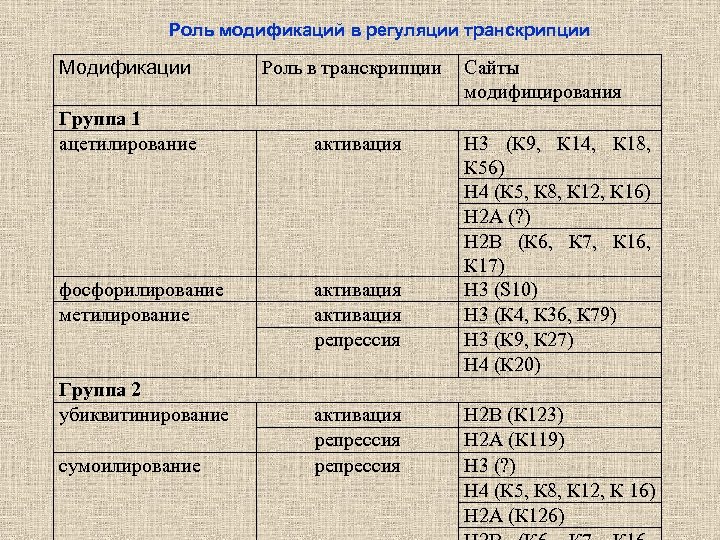
Роль модификаций в регуляции транскрипции Модификации Роль в транскрипции Группа 1 ацетилирование активация фосфорилирование метилирование Группа 2 убиквитинирование сумоилирование активация репрессия Сайты модифицирования Н 3 (К 9, К 14, К 18, К 56) Н 4 (К 5, К 8, К 12, К 16) Н 2 А (? ) Н 2 В (К 6, К 7, К 16, К 17) Н 3 (S 10) Н 3 (К 4, К 36, К 79) Н 3 (К 9, К 27) Н 4 (К 20) Н 2 В (К 123) Н 2 А (К 119) Н 3 (? ) Н 4 (К 5, К 8, К 12, К 16) Н 2 А (К 126)
Метилирование ДНК и связанные с ним процессы

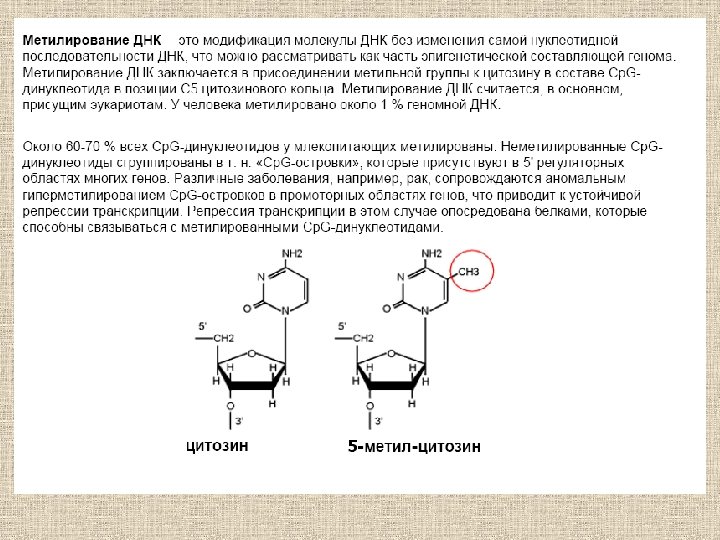
Молекулярные основы эпигенетики H H N CH 3 4 3 5 6 N 1 Б. Ф. Ванюшин Впервые определил природу метилируемых последовательностей ДНК у разных видов организмов (1959 г. ) N 2 O Robin Holliday Обосновал роль метилирования ДНК в регуляции работы гена. Предложил термин «эпимутация» (1987 г. )
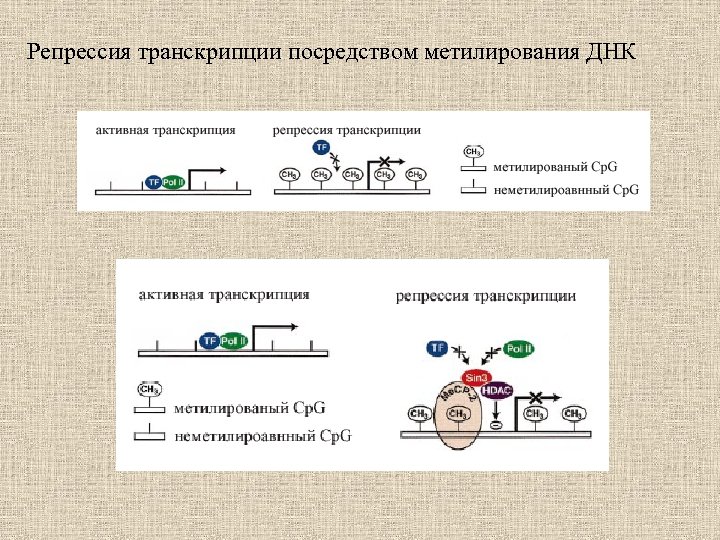
Репрессия транскрипции посредством метилирования ДНК
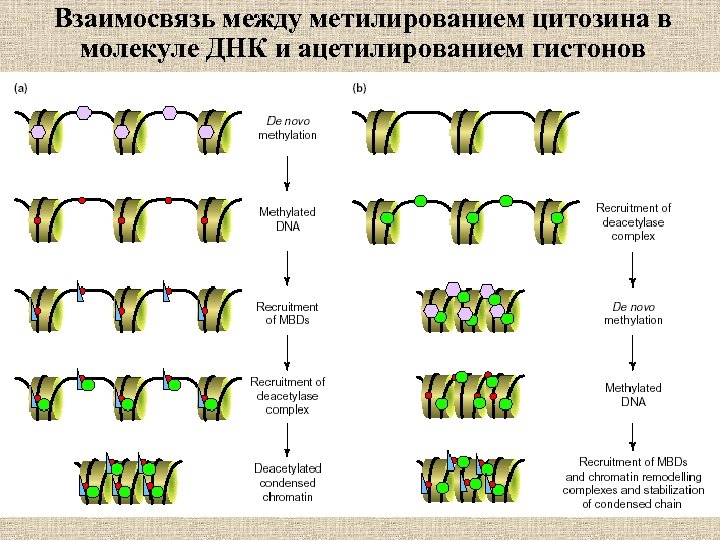
Взаимосвязь между метилированием цитозина в молекуле ДНК и ацетилированием гистонов

Механизмы инактивации гена в результате метилирования промоторной области 1. Метильные группы нарушают ДНК-белковые взаимодействия, выступая в большую бороздку ДНК и препятствуя связыванию специфических транскрипционных факторов. 2. Метилированные районы ДНК специфически связывают транскрипционные репрессоры. 3. Метилирование ДНК влияет на структуру хроматина.

Метилирование ДНК в клетке контролирует все (!) генетические процессы, в том числе такие как : Транскрипция (клеточная дифференцировка) Репликация Рекомбинация Репарация Транспозиция генов Инактивация Х-хромосомы

Биологическая специфичность метилирования ДНК: • • • Видовая (штаммовая) Тканевая (клеточная) Органоидная (ядро, митохондрии, пластиды) Внутримолекулярная (островки метилирования, повторы) Возрастная Резкое искажение метилирования ДНК: • отсутствие метильных доноров (рак, гепатома) • суперметилирование ДНК РАК • полное выключение (knockout) ДНК-метилазного гена остановка развития, апоптоз, смерть (без метилирования ДНК жизни нет!)
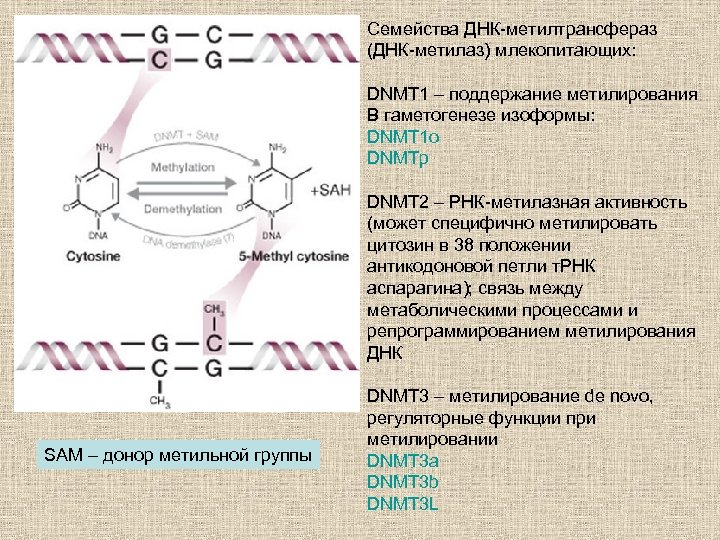
Семейства ДНК-метилтрансфераз (ДНК-метилаз) млекопитающих: DNMT 1 – поддержание метилирования В гаметогенезе изоформы: DNMT 1 o DNMTp DNMT 2 – РНК-метилазная активность (может специфично метилировать цитозин в 38 положении антикодоновой петли т. РНК аспарагина); связь между метаболическими процессами и репрограммированием метилирования ДНК SAM – донор метильной группы DNMT 3 – метилирование de novo, регуляторные функции при метилировании DNMT 3 a DNMT 3 b DNMT 3 L

De novo метилирование ДНК и сохранение характера метилирования ДНК Высокометилированые последовательности: • Сателлитная ДНК • Повторяющиеся элементы (в т. ч. транспозоны и их инертные формы) • Уникальная межгенная ДНК • Экзоны генов
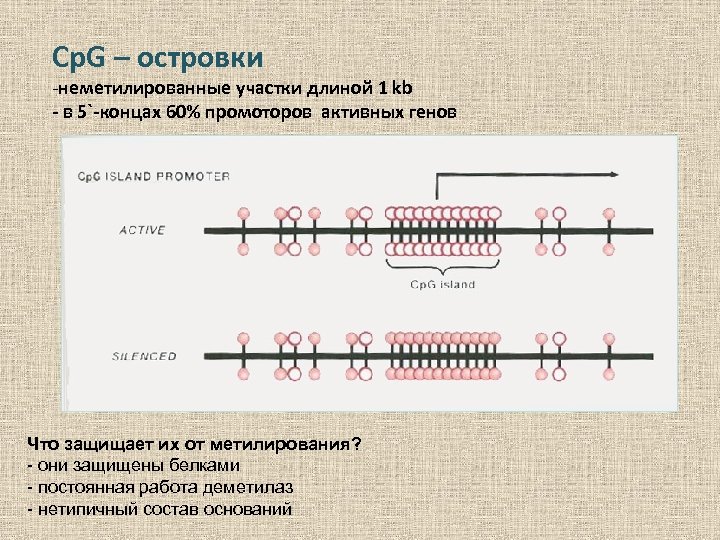
Cp. G – островки -неметилированные участки длиной 1 kb - в 5`-концах 60% промоторов активных генов Что защищает их от метилирования? - они защищены белками - постоянная работа деметилаз - нетипичный состав оснований

Деметилирование – удаление метильных групп из ДНК Пассивное деметилирование – реализуется после репликации ДНК, за счет отсутствия метилазной активности. Новосинтезированная нить ДНК не метилируется по образцу старой, и образуется полуметилированная (гемиметилированная) ДНК. Активное деметилирование – задействована ферментативная система, превращающая 5 -метилцитозин в цитозин независимо от репликации Долгое время механизм и ферменты, вовлеченные в процесс активного деметилирования ДНК оставались неизвестными!
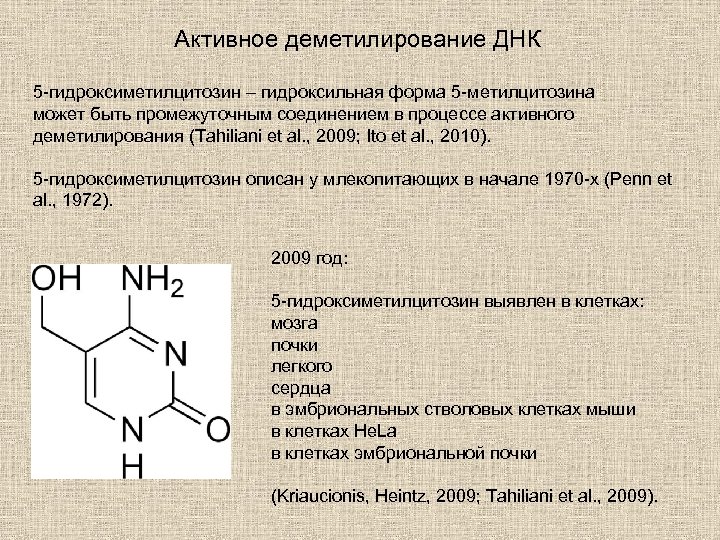
Активное деметилирование ДНК 5 -гидроксиметилцитозин – гидроксильная форма 5 -метилцитозина может быть промежуточным соединением в процессе активного деметилирования (Tahiliani et al. , 2009; Ito et al. , 2010). 5 -гидроксиметилцитозин описан у млекопитающих в начале 1970 -х (Penn et al. , 1972). 2009 год: 5 -гидроксиметилцитозин выявлен в клетках: мозга почки легкого сердца в эмбриональных стволовых клетках мыши в клетках He. La в клетках эмбриональной почки (Kriaucionis, Heintz, 2009; Tahiliani et al. , 2009).
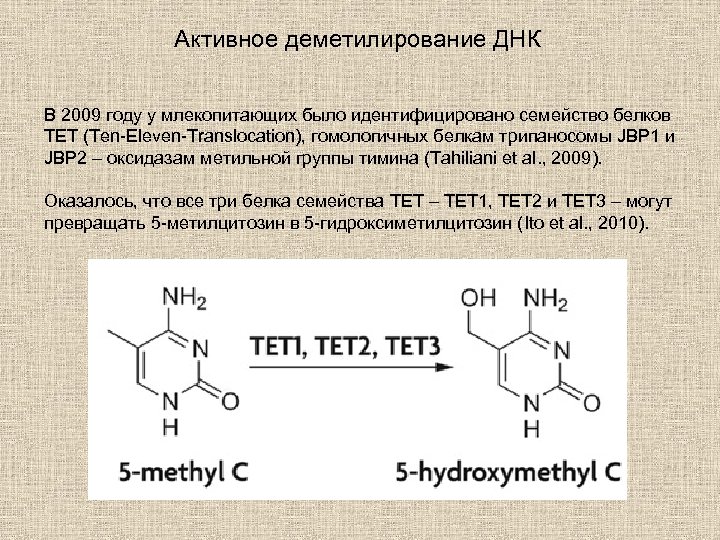
Активное деметилирование ДНК В 2009 году у млекопитающих было идентифицировано семейство белков TET (Ten-Eleven-Translocation), гомологичных белкам трипаносомы JBP 1 и JBP 2 – оксидазам метильной группы тимина (Tahiliani et al. , 2009). Оказалось, что все три белка семейства TET – TET 1, TET 2 и TET 3 – могут превращать 5 -метилцитозин в 5 -гидроксиметилцитозин (Ito et al. , 2010).
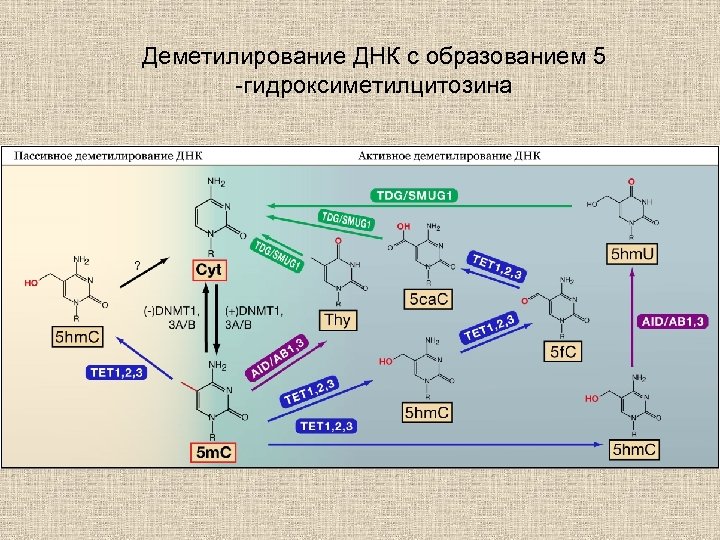
Деметилирование ДНК с образованием 5 -гидроксиметилцитозина

Методы анализа метилирования 1. Метилчувствительная ПЦР (Not 1, Eag 1, Sac. II, Hpa. II, Hha. I) 2. Метилспецифическая ПЦР Трансформация цитозина в урацил бисульфитом Na 3. Methyl. Light – метилспецифическая ПЦР в реальном времени 4. Биологические микрочипы 5. Специфические антиметилцитозиновые антитела
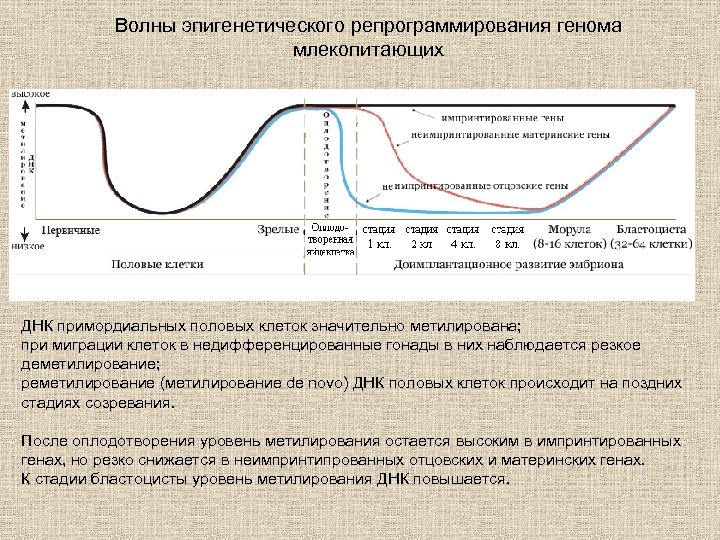
Волны эпигенетического репрограммирования генома млекопитающих ДНК примордиальных половых клеток значительно метилирована; при миграции клеток в недифференцированные гонады в них наблюдается резкое деметилирование; реметилирование (метилирование de novo) ДНК половых клеток происходит на поздних стадиях созревания. После оплодотворения уровень метилирования остается высоким в импринтированных генах, но резко снижается в неимпринтипрованных отцовских и материнских генах. К стадии бластоцисты уровень метилирования ДНК повышается.
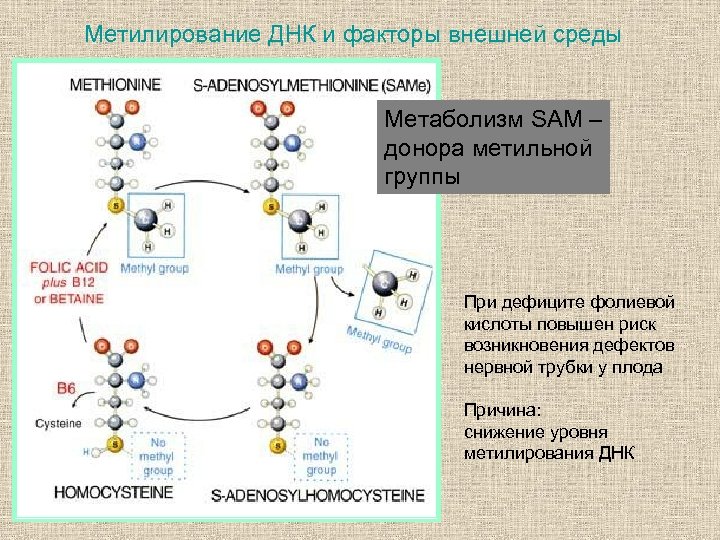
Метилирование ДНК и факторы внешней среды Метаболизм SAM – донора метильной группы При дефиците фолиевой кислоты повышен риск возникновения дефектов нервной трубки у плода Причина: снижение уровня метилирования ДНК

Метилирование ДНК и факторы внешней среды Доказано влияние на метилирование ДНК металлов – никеля, кадмия, мышьяка, а также хрома, ртути, трихлорэтилена, дихлоруксусной и трихлоруксусной кислоты, бензола, бисфенола. Металлы способствуют образованию в клетке активных форм кислорода, вызывающих повреждения ДНК, которые затрудняют или делают невозможной работу ДНК метилтрансфераз. В 1992 году Баркером была выдвинута гипотеза FEBAD (fetal basis of adult disease). В пользу гипотезы свидетельствует обнаруженная взаимосвязь между воздействием на плод экзогенных и эндогенных факторов и риском последующего развития сердечно-сосудистых заболеваний, сахарного диабета второго типа, остеопороза и некоторых видов рака.
Внешние факторы, действующие на женщину в период беременности, могут изменять характер метилирования ДНК в ее клетках, модифицировать формирующиеся эпигенетические паттерны плода, а также влиять на процесс репрограммирования в формирующихся половых клетках плода!

Метилирование ДНК является обратимой реакцией и в значительной степени подвержено воздействию эндогенных и экзогенных факторов. Эти особенности, с одной стороны, увеличивают риск возникновения ошибок из-за влияния негативных факторов, но с другой – дают возможность проводить коррекцию эпигенетической регуляции генома за счет определенных внешних воздействий, в том числе лекарственных средств, гормонов и диеты.

Интерференция РНК и регуляция экспрессии генов

Нобелевская премия по физиологии и медицине 2006 год "RNA interference – gene silencing by double-stranded RNA" Andrew Z. Fire Craig C. Mello

Предположение Fire & Mello: Двуцепочечные РНК (ds. RNA) – запускающий механизм (триггер) системы интерференции РНК.

Интерференция РНК – это замолкание (сайленсинг) генов, обеспечиваемое двуцепочечными молекулами РНК (ds. РНК). Явление интерференции РНК открыто в 1998 г. у Nematoda (Fire et al. , 1998)
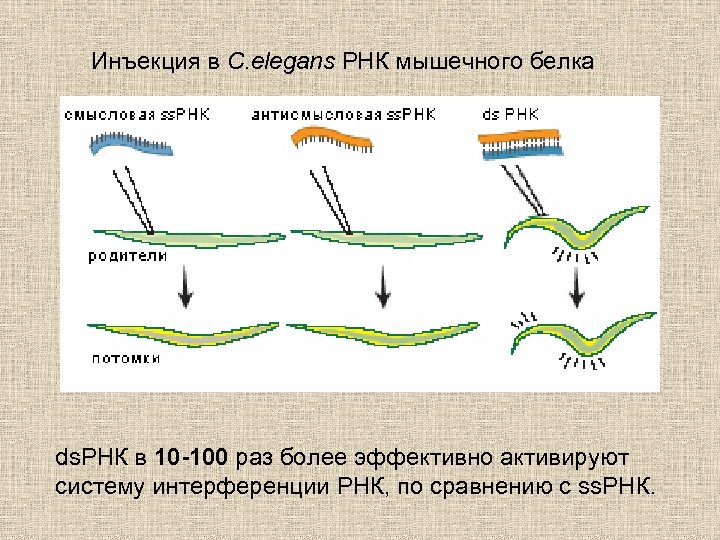
Инъекция в C. elegans РНК мышечного белка ds. РНК в 10 -100 раз более эффективно активируют систему интерференции РНК, по сравнению с ss. РНК.

Fire A. , Xu S. Q. , Montgomery M. K. , Kostas S. A. , Driver S. E. , Mello C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806– 811 (1998). Эффект генетического сайленсинга посредством интерференции РНК: распространяется в тканях организма (!) наследуется (!!!)

Механизм интерференции РНК • при исследовании интерференции РНК у растений обнаружены короткие молекулы РНК, маркирующие ген, подверженный сайленсингу; • в условиях in vitro воспроизведены биохимические реакции интерференции РНК. Малые интерферирующие РНК (si. RNAs – short interfering RNAs) – класс 21 -22 нуклеотидных двуцепочечных РНК, образующихся из более длинных двуцепочечных РНК.
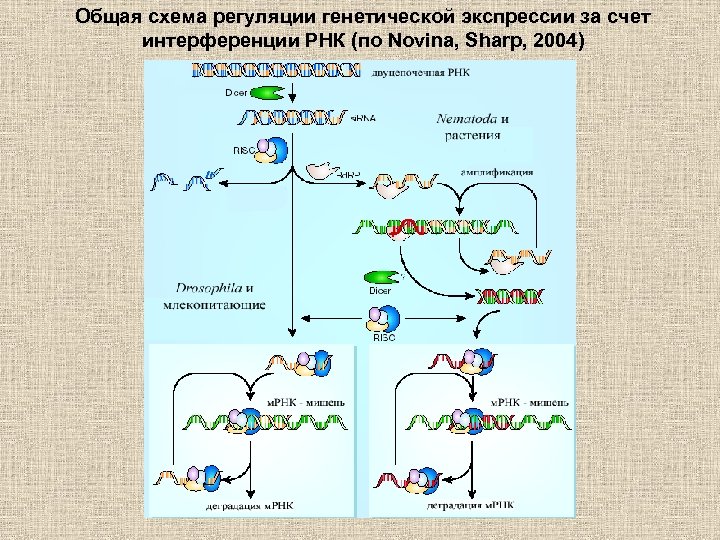
Общая схема регуляции генетической экспрессии за счет интерференции РНК (по Novina, Sharp, 2004)

Функции si. РНК 1. Сайленсинг мобильных генетических элементов; 2. Сайленсинг гетерохроматиновых повторов; 3. Сайленсинг генетического материала вирусного происхождения; 4. Ограничение степени экспрессии гена в определенных тканях.

При выделение фракций коротких РНК (19 -25 нуклеотидов) из различных организмов обнаружен еще один класс малых РНК – микро. РНК. Микро. РНК (mi. RNAs - micro RNAs) – класс 19 -25 нуклеотидных одноцепочечных РНК, закодированных в уникальных генах геномов многоклеточных организмов.
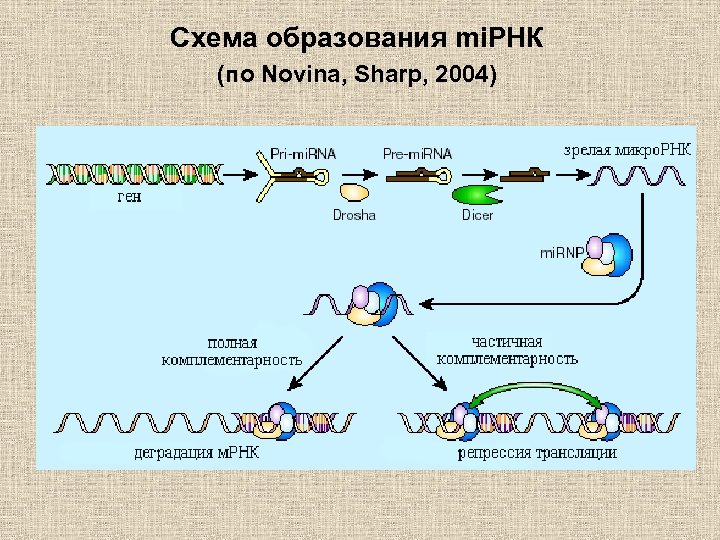
Схема образования mi. РНК (по Novina, Sharp, 2004)

Функция mi. РНК Обеспечивают сайленсинг различных генов, обычно, за счет частично комплементарного связывания с м. РНК, в результате которого блокируется ее трансляция. • один тип mi. РНК может регулировать трансляцию м. РНК более 100 различных генов; • степень ингибирования зависит от количества связывающихся mi. РНК (в 3’UTR м. РНК содержится несколько сайтов связывания).

Отличия mi. РНК и si. РНК mi. РНК si. РНК • Продукт ds. РНК, закодированных в уникальных генах геномов многоклеточных организмов (>1% от всех генов у человека); • Продукт ds. РНК, образующихся в результате транскрипции транспозонов, гетерохроматиновых повторов или генетического материала вирусного происхождения ; • м. РНК может не разрушаться; • Один тип mi. РНК регулирует разные гены. • м. РНК разрушается; • Один тип si. РНК обычно регулирует только один тип м. РНК.

• созданы библиотеки коротких РНК и ДНК- векторов, кодирующих короткие РНК, мишенями которых является около 8000 генов генома человека; • внедряется в практику терапевтическое применение синтетических коротких РНК для целенаправленного подавления генетической экспрессии при некоторых заболеваниях.

«В последние годы … установлен особый класс заболеваний человека, обусловленный дефектами структуры и модификаций хроматина - так называемые «хроматиновые болезни» . С. Назаренко, 2005 г.

Синдром Ретта (OMIM 312750) Частота 1 на 10000 -15000 детей женского пола Впервые описан Реттом в 1966 г (Rett, 1966), повторно в 1983 Хогбергом ( Hagberg, 1993). Мутация в гене Me. CP 2 (Me. C binding protein), расположенном на Xq 28 http: //www. mississippichallenge. or g/rettsyndrome. html http: //www. rodim. ru/conference/in dex. php? s=0 b 8265 fee 36 f 1322 b 6 da b 8 dae 8 f 038 a 7&showtopic=83503& pid=4926083&st=765&#entry 49260 83 • регрессия развития • аутизм • стереотипные движения рук http: //swimpig. blogspot. com/200 7_02_01_archive. html
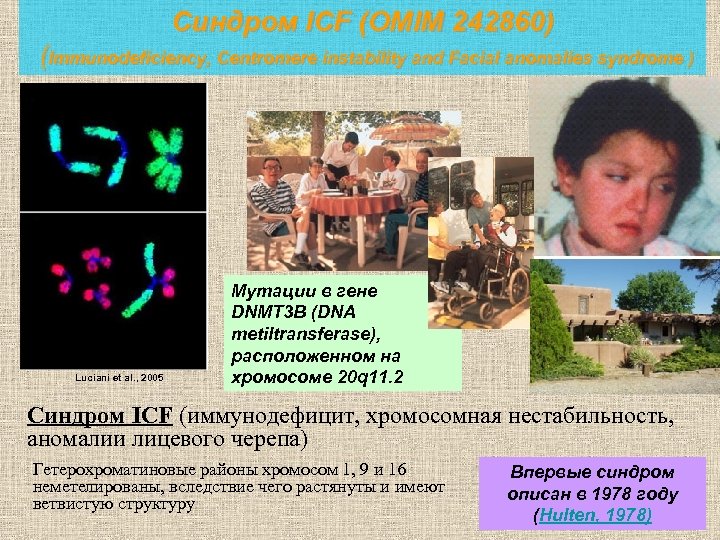
Синдром ICF (OMIM 242860) (Immunodeficiency, Centromere instability and Facial anomalies syndrome ) Luciani et al. , 2005 Мутации в гене DNMT 3 B (DNA metiltransferase), расположенном на хромосоме 20 q 11. 2 Синдром ICF (иммунодефицит, хромосомная нестабильность, аномалии лицевого черепа) Гетерохроматиновые районы хромосом 1, 9 и 16 неметелированы, вследствие чего растянуты и имеют ветвистую структуру Впервые синдром описан в 1978 году (Hulten, 1978)
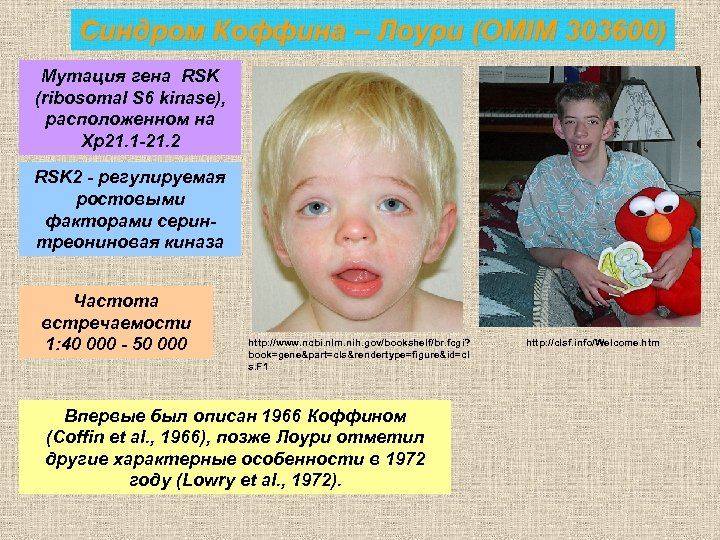
Синдром Коффина – Лоури (OMIM 303600) Мутация гена RSK (ribosomal S 6 kinase), расположенном на Хp 21. 1 -21. 2 RSK 2 - регулируемая ростовыми факторами серинтреониновая киназа Частота встречаемости 1: 40 000 - 50 000 http: //www. ncbi. nlm. nih. gov/bookshelf/br. fcgi? book=gene&part=cls&rendertype=figure&id=cl s. F 1 Впервые был описан 1966 Коффином (Coffin et al. , 1966), позже Лоури отметил другие характерные особенности в 1972 году (Lowry et al. , 1972). http: //clsf. info/Welcome. htm

Газета "Российское здоровье и общество" «Капризная дама» ГЕНЕТИКА: «Три—четыре года прошло, как появились хроматиновые болезни. Одна из них — синдром Халькинсона-Килборга. Со времен вьетнамской войны его связывали с дефолиантами, применяемыми американской армией, затем с другими экстремальными воздействиями экологического характера. Причиной оказалась аномалия прикрепления хроматина к генам» .
8870c957d773bcd00769bac72b43e032.ppt