1 mol b-ka.ppt
- Количество слайдов: 133

МОЛЕКУЛЯРНА БІОФІЗИКА • 1. Макромолекули та їх конформації. • 2. Внутрішньомолекулярні взаємодії в біомакромолекулах. • 3. Структура води. • 4. В’язкість розчинів та дифузія біомакромолекул. • 5. Седиментація та електрофорез макромолекул. • 6. Теорія електролітичної дисоціації солей С. Арреніуса. Теорія Дебая-Хюккеля. • 7. Методи, які використовуються для дослідження біологічних макромолекул. • 8. Квазіпружне розсіювання світла.

МОЛЕКУЛЯРНА БІОФІЗИКА Молекулярна біофізика – вивчає структуру макромолекул, їх фізичні властивості та зв’язок будови молекул з їх функціями. Основними об’єктами дослідження є нуклеїнові кислоти, білки, полісахариди, ліпідні комплекси та ін. З одного боку, біомакромолекули розглядаються як макроскопічні системи. З іншого – біомакромолекули характеризуються високою внутрішньомолекулярною рухомістю й динамікою їхньої структури, що зумовлює існування різних конформацій біомакромолекул. Центральне питання молекулярної біології (зокрема, молекулярної біофізики) – це зв’язок між структурою та функцією молекул.

• Молекулярна маса білків та нуклеїнових кислот від 103 до 1010 Да. • Лише рентгеноструктурний аналіз дозволяє отримувати пряму інформацію просторову будову біомакромолекул (розміщення всіх атомів у тривимірному просторі). Для цього потрібні гомогенні, добре очищенні препарати у кристалічному стані. • У більшості випадків використовуються непрямі методи дослідження структурних особливостей біологічних макромолекул. На відміну від рентгеноструктурного аналізу ці методи дозволяють вивчати макромолекули в розчині за таких умов, коли їхній структурний стан і поведінка наближені до нативних макромолекул у клітині.
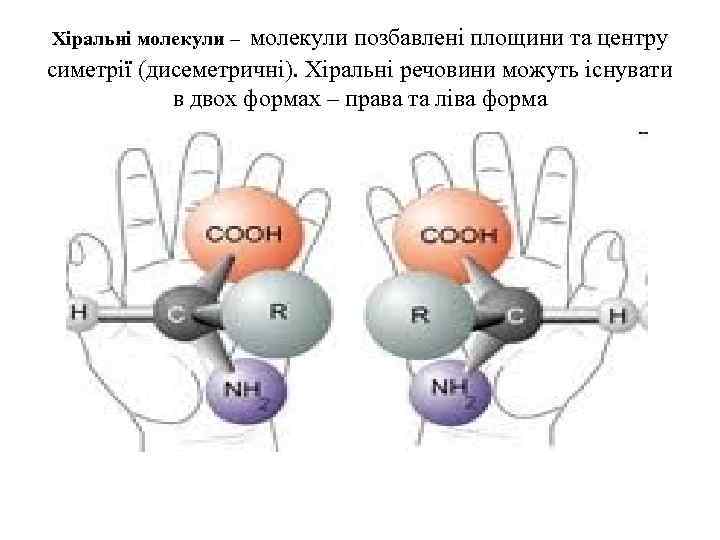
молекули позбавлені площини та центру симетрії (дисеметричні). Хіральні речовини можуть існувати в двох формах – права та ліва форма Хіральні молекули –

Конформації біомакромолекул. • Функціональний стан біомакромолекул у клітині визначається їхньою просторовою організацією. • первинна структура біомакромолекул – послідовність мономерних елементів у ланцюгу биополімеру, які міцно ковалентно зв’язані. Ковалентні зв’язки є достатньо стійкими. Вільна енергія їх утворення становить 400– 800 к. Дж моль-1. • вторинну структуру – локальне упорядкування окремих ділянок полімерного ланцюга; • третинну структуру – просторову укладку всього полімерного ланцюга; • четвертинну структуру – просторове розміщення кількох компактно організованих полімерних ланцюгів з утворенням надмолекулярного комплексу. На цих рівнях організації важливого значення набувають нековалентні, слабкі зв’язки, які стабілізують просторову структуру біомакромолекул.

Обертання навколо простих ковалентних зв’язків зумовлює утворення різних поворотних ізомерів або конформерів полімерного ланцюга. Конформація макромолекули – це спосіб складання полімерного ланцюга (без розриву ковалентних зв’язків) за допомогою великої кількості слабких зв’язків, через що утворюється найбільш термодинамічно вигідна й стабільна просторова структура макромолекули. Енергія слабких зв’язків є достатньою для стабілізації конформації.
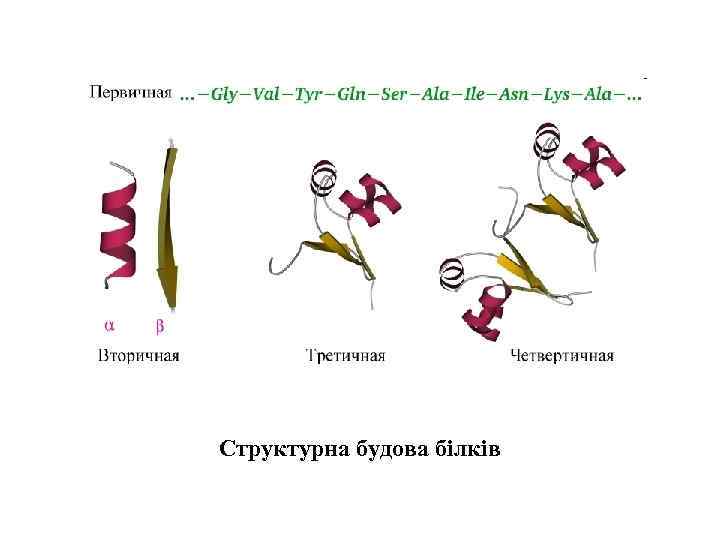
Структурна будова білків
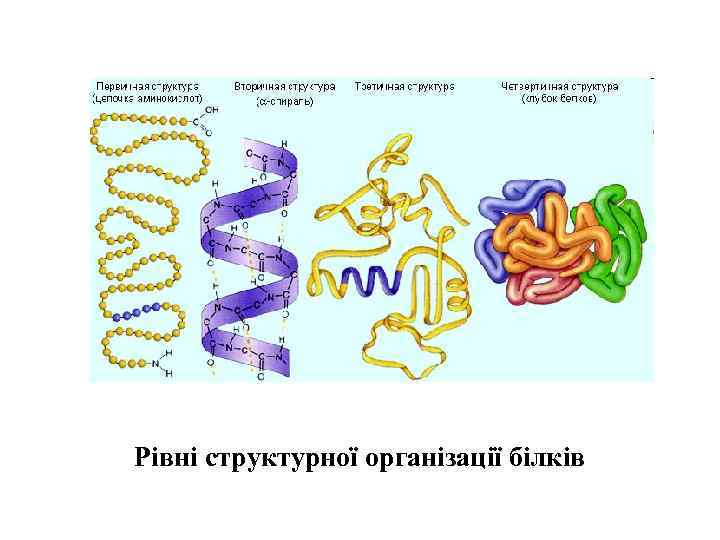
Рівні структурної організації білків
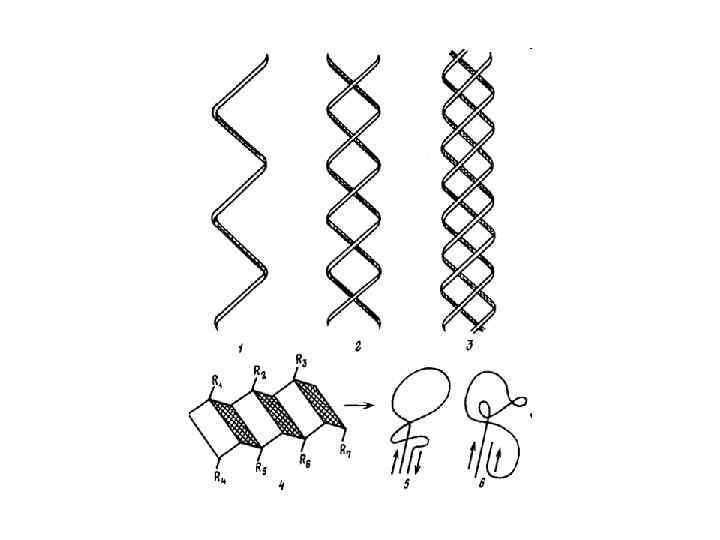

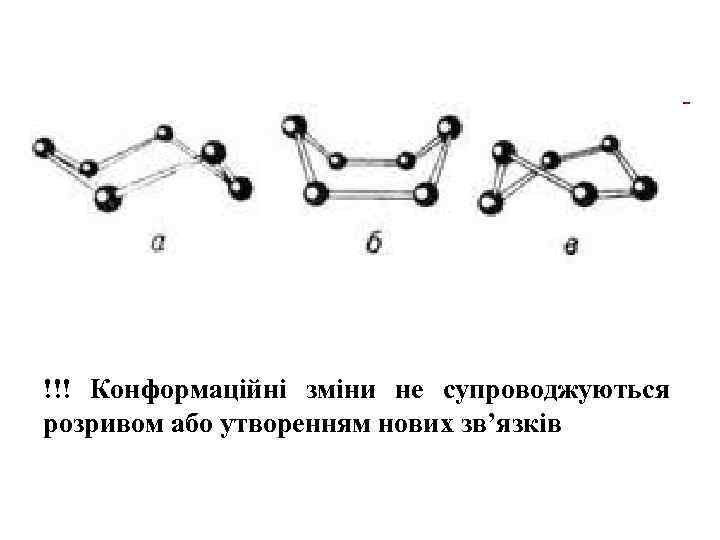
!!! Конформаційні зміни не супроводжуються розривом або утворенням нових зв’язків

Просторова структура макромолекули

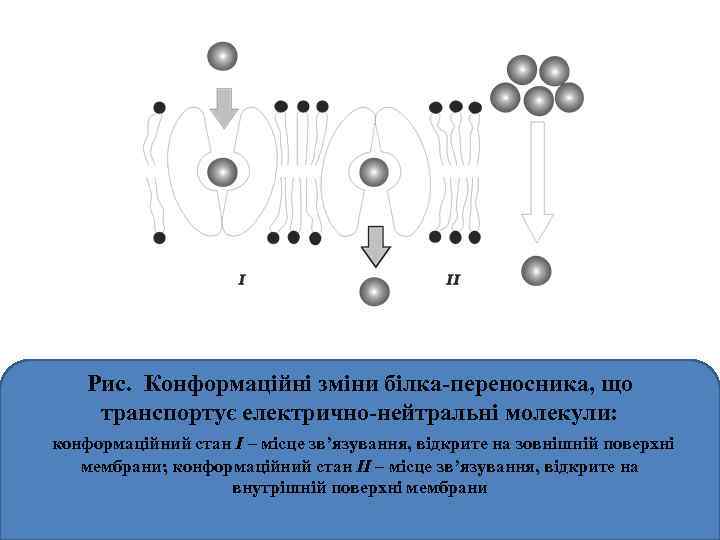
Рис. Конформаційні зміни білка-переносника, що транспортує електрично-нейтральні молекули: конформаційний стан I – місце зв’язування, відкрите на зовнішній поверхні мембрани; конформаційний стан II – місце зв’язування, відкрите на внутрішній поверхні мембрани
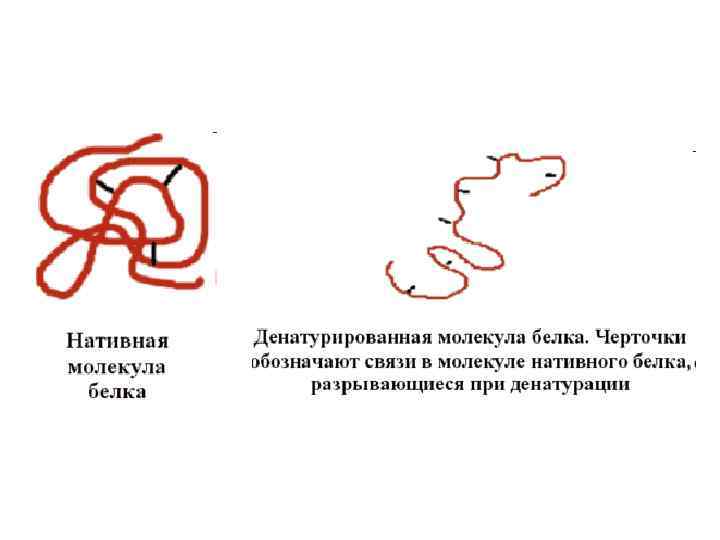
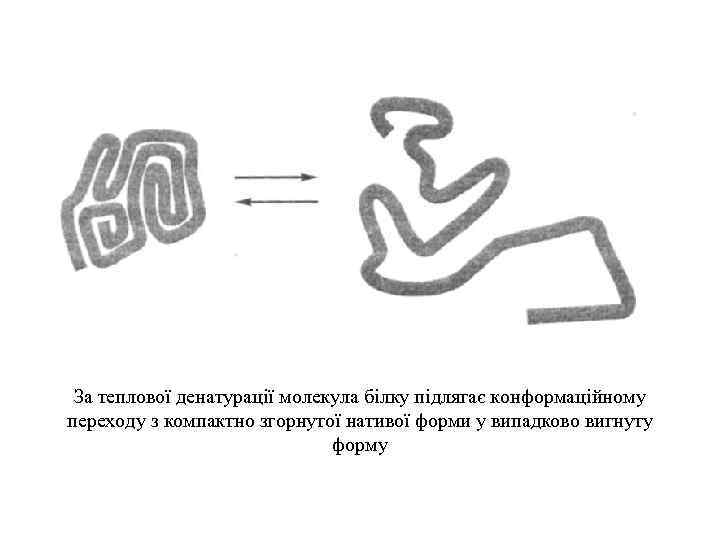
За теплової денатурації молекула білку підлягає конформаційному переходу з компактно згорнутої нативої форми у випадково вигнуту форму
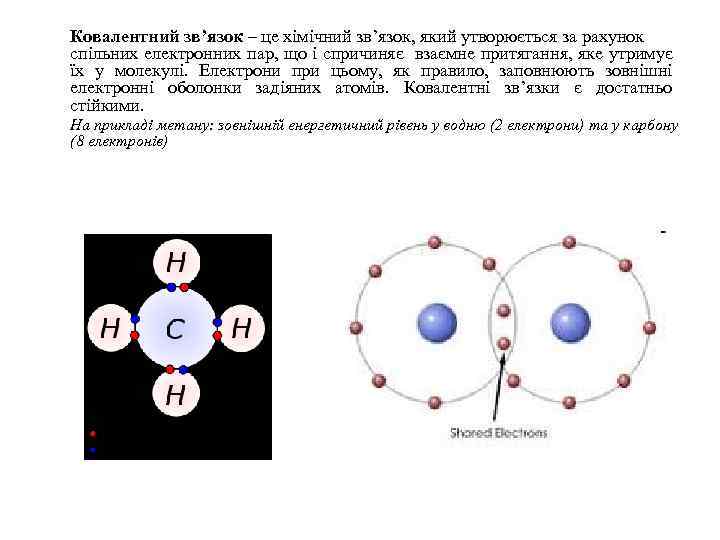
Ковалентний зв’язок – це хімічний зв’язок, який утворюється за рахунок спільних електронних пар, що і спричиняє взаємне притягання, яке утримує їх у молекулі. Електрони при цьому, як правило, заповнюють зовнішні електронні оболонки задіяних атомів. Ковалентні зв’язки є достатньо стійкими. На прикладі метану: зовнішній енергетичний рівень у водню (2 електрони) та у карбону (8 електронів)
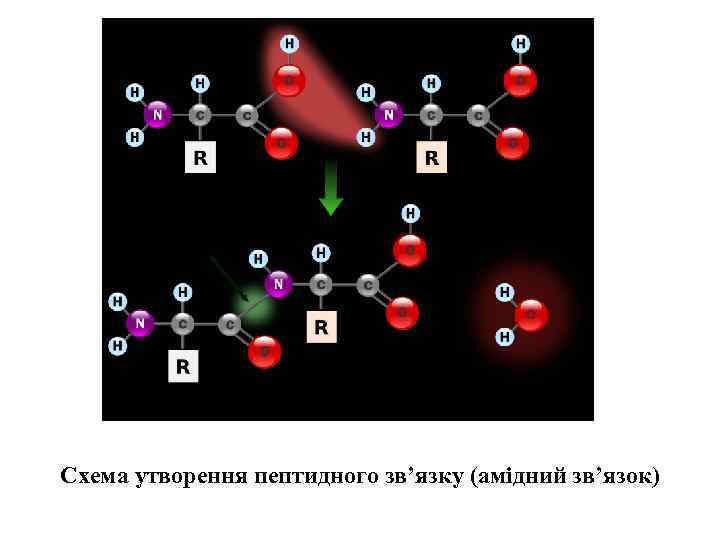
Схема утворення пептидного зв’язку (амідний зв’язок)

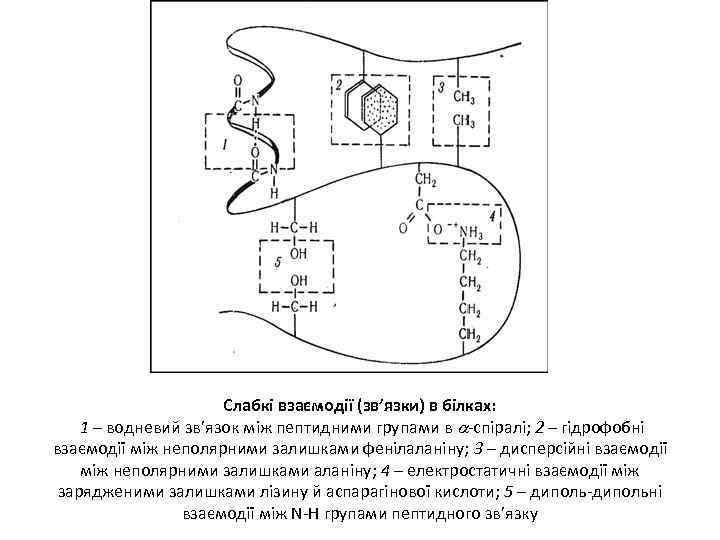
Слабкі взаємодії (зв’язки) в білках: 1 – водневий зв’язок між пептидними групами в -спіралі; 2 – гідрофобні взаємодії між неполярними залишками фенілаланіну; 3 – дисперсійні взаємодії між неполярними залишками аланіну; 4 – електростатичні взаємодії між зарядженими залишками лізину й аспарагінової кислоти; 5 – диполь-дипольні взаємодії між N-Н групами пептидного зв’язку

Типовий іонний зв’язок

Енергія електростатичних взаємодій q 1 i q 2 – електричні заряди груп; r – відстань між зарядженими групами; – діелектрична стала; 0 = 8, 85 10 -12 Кл В-1 м-1.
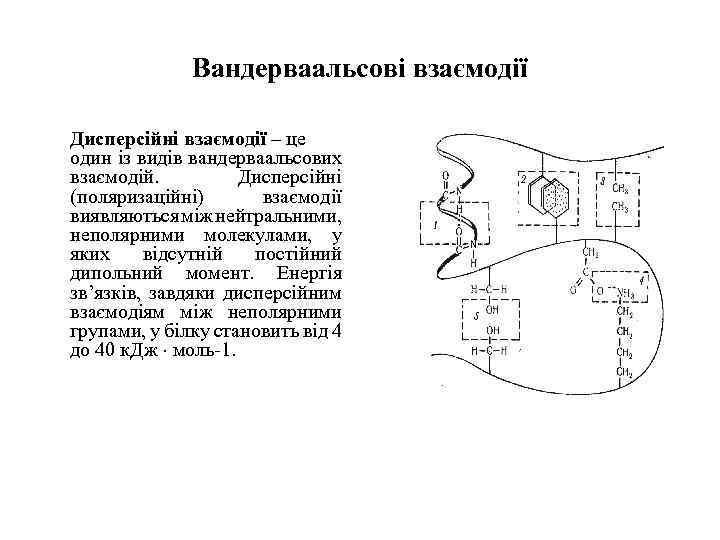
Вандерваальсові взаємодії Дисперсійні взаємодії – це один із видів вандерваальсових взаємодій. Дисперсійні (поляризаційні) взаємодії виявляються між нейтральними, неполярними молекулами, у яких відсутній постійний дипольний момент. Енергія зв’язків, завдяки дисперсійним взаємодіям між неполярними групами, у білку становить від 4 до 40 к. Дж моль-1.

Енергія дисперсійних взаємодій І1 та І2 – потенціали іонізації груп; 1 і 2 – поляризованість груп.

Диполь-дипольні (орієнтаційні) взаємодії Диполь електричний – це два різнойменних точкових заряди рівних за модулем. Диполь – це вектор, що направлений від негативного заряду до позитивного й чисельно дорівнює відстані між ними. Дипольний момент електричний – векторна величина, що характеризує асиметрію розподілу позитивних та негативних зарядів в електрично нейтральній системі. Два однакових за величиною заряди + q і – q утворюють електричний диполь з дипольним моментом m = ql, де l – відстань між зарядами.
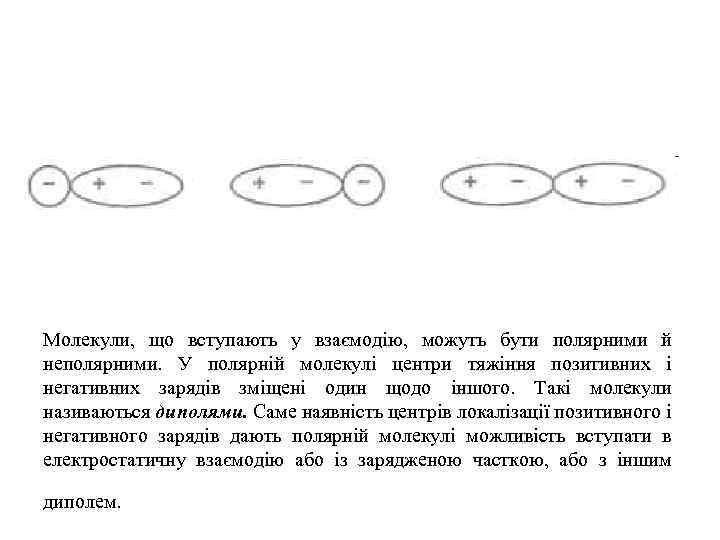
Молекули, що вступають у взаємодію, можуть бути полярними й неполярними. У полярній молекулі центри тяжіння позитивних і негативних зарядів зміщені один щодо іншого. Такі молекули називаються диполями. Саме наявність центрів локалізації позитивного і негативного зарядів дають полярній молекулі можливість вступати в електростатичну взаємодію або із зарядженою часткою, або з іншим диполем.

Енергія диполь-дипольних взаємодій Т – температура; к 0 – стала Больцмана, постійні дипольні моменти 1 і 2

Взаємодія диполь-індукований диполь Якщо є дві близько розташовані молекули, одна з яких полярна, а інша — неполярна, то під дією електричного поля, створюваного полярною молекулою, у неполярній утворюється диполь Подальша взаємодія відбувається аналогічно до орієнтаційної. У силу того, що диполь у неполярній молекулі індукується електричним полем полярної, то й сили називаються індукційними.

Енергія взаємодій диполь-індукований диполь –постійний диполь полярної групи; –– поляризованість неполярної групи.

• Електростатичні взаємодії - далекодіючі (виявляються на значних відстанях і залежать від значення 1/r); • Вандерваальсові взаємодії – близькодіючі (ефективні тільки на малих відстанях і залежать від 1/r 6 між групами). Водневий зв’язок. • ІЧ- спектрофотометрія • Протонний магнітний резонанс (ПМР). Утворення водневих зв’язків супроводжується збільшенням температури замерзання Тз і кипіння Тк в різних рідинах. Н 2 О – Тз = 273 К і Тк = 373 К; Н 2 S – Тз = 190 К і Тк = 211 К.

Водневий зв’язок – різновид хімічного зв’язку, що реалізується за донорноакцепторним механізмом між атомом гідрогену Н, та ковалентно зв’язаними атомами з великим значенням електронегативності (О, N, F). Розрізняють міжмолекулярний та внутрішньомолекулярний водневий зв’язок.

• Водневий зв’язок утворюється між полярними групами, в яких присутній атом водню (О-Н, N-H, S-H), і атомами - О, N за рахунок електростатичних та ван-дер-ваальсових взаємодій. • При утворенні зв’язку всі три атоми повинні бути колінеарними N-H····O=C. • Енергія водневих зв’язків становить від 4 до 30 к. Дж моль-1. • Водневі зв’язки відіграють основну роль у стабілізації: 1. вторинної структури білків (зв’язки між пептидними групами) 2. подвійної спіралі ДНК (зв’язки між комплементарними парами, Г-Ц і А-Т).

Структура води • Будова молекули води: довжина ОН-зв’язків = 0, 096 нм, кут = 104, 52º, дипольний момент =1, 82; за Т = 298, 15 К діелектрична проникність води = 78, 54, поверхневий натяг = 0, 07275 Н м-1 • Властивості води: за 4ºС (277, 15 К) вода має максимальну густину = 1 103 кг м-3, за 0ºС (273, 15 К) = 0, 9167 103 кг м-3 вода має максимально високі температури плавлення й кипіння велику теплоємність с = 75, 3 Дж моль-1 К-1. Усі ці аномалії зумовлено структурними особливостями молекули води. Кожна молекула може виступати донором і акцептором водневих зв’язків, завдяки чому вода є сильно асоційованою з координаційним числом 4.
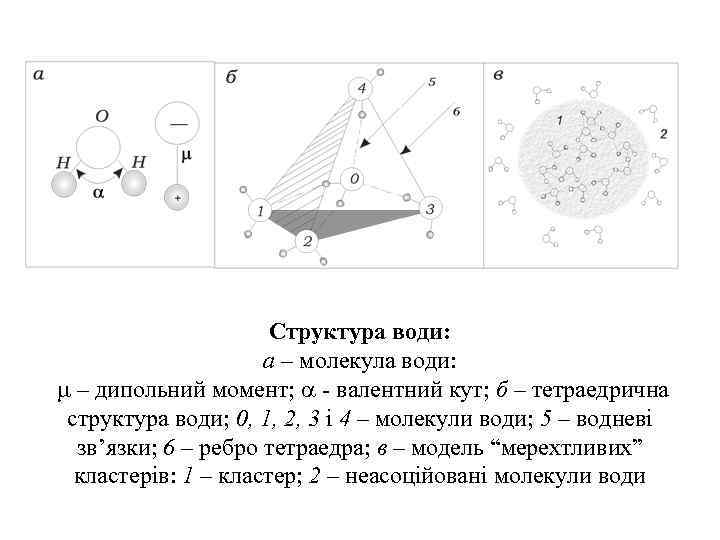
Структура води: а – молекула води: – дипольний момент; - валентний кут; б – тетраедрична структура води; 0, 1, 2, 3 і 4 – молекули води; 5 – водневі зв’язки; 6 – ребро тетраедра; в – модель “мерехтливих” кластерів: 1 – кластер; 2 – неасоційовані молекули води
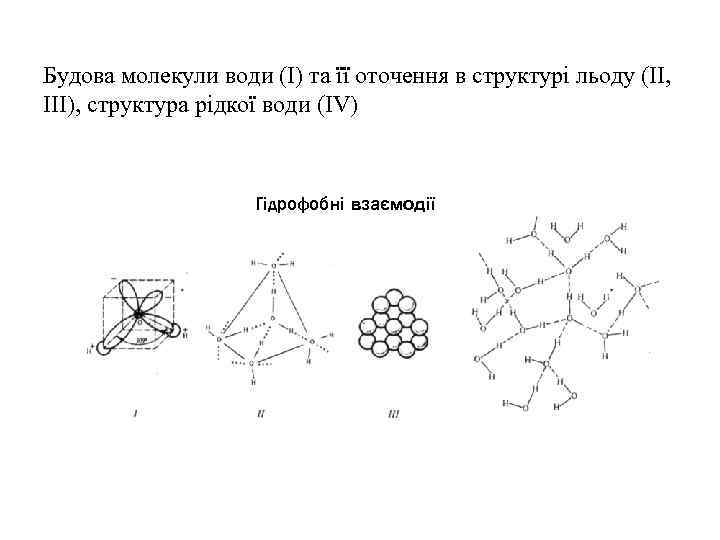
Будова молекули води (І) та її оточення в структурі льоду (ІІ, ІІІ), структура рідкої води (IV) Гідрофобні взаємодії

• Найпоширеніші дві моделі рідкої води. Модель неперервної структури води - вода розглядається як єдина тривимірна структура тетраедрично скоординованих молекул. За цією моделлю, фактори зовнішнього середовища (температура чи тиск) викликають тільки деформацію (розтяг, згинання) водневих зв’язків, але не їх розрив. Модель мерехтливих кластерів - вода розглядається як сукупність молекул, які по-різному асоційовані водневими зв’язками. Кластери – це короткоживучі асоціати молекул води (час життя кластера становить 10 -10– 10 -11 с). Вони постійно розпадаються й знову утворюються, як кооперативні структури – утворення або розрив одного водневого зв’язку значно полегшує такий самий процес для іншого. !!! Водне оточення (молекули води) значно впливають на конформації макромолекул

Гідрофобні взаємодії та структура води. • Гідрофобні взаємодії – це взаємодії, що полягають у сприятливому зближенні та взаємодії неполярних молекул між собою для того, щоб ліквідувати або зменшити невигідні контакти з полярними молекулами води. • Гідрофобні взаємодії сприяють відштовхуванню один від одного неполярних незаряджених груп та молекул води. • Ці сили визначають формування структури біологічних мембран та глобулярних білків. • За термодинамічними даними включення неполярних молекул у воду супроводжується певними змінами термодинамічних величин: загальна зміна ентальпії майже не змінюється ( Н 0), але при цьому значно зростає вільна енергія ( G 0). • G = Н Т S, зростання G відбувається з одночасним зменшенням ентропії ( S 0) • Це означає, що система переходить у нестійкий, нерівноважний стан з більшою вільною енергією. Такий перехід є енергетично невигідним.
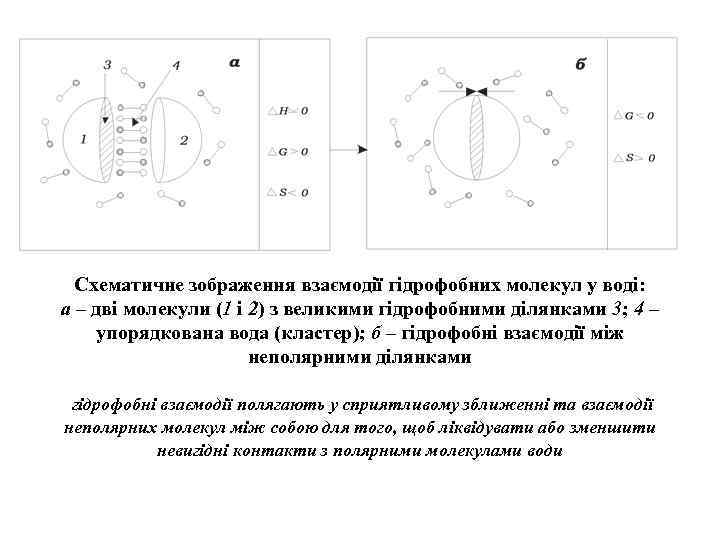
Схематичне зображення взаємодії гідрофобних молекул у воді: а – дві молекули (1 і 2) з великими гідрофобними ділянками 3; 4 – упорядкована вода (кластер); б – гідрофобні взаємодії між неполярними ділянками гідрофобні взаємодії полягають у сприятливому зближенні та взаємодії неполярних молекул між собою для того, щоб ліквідувати або зменшити невигідні контакти з полярними молекулами води
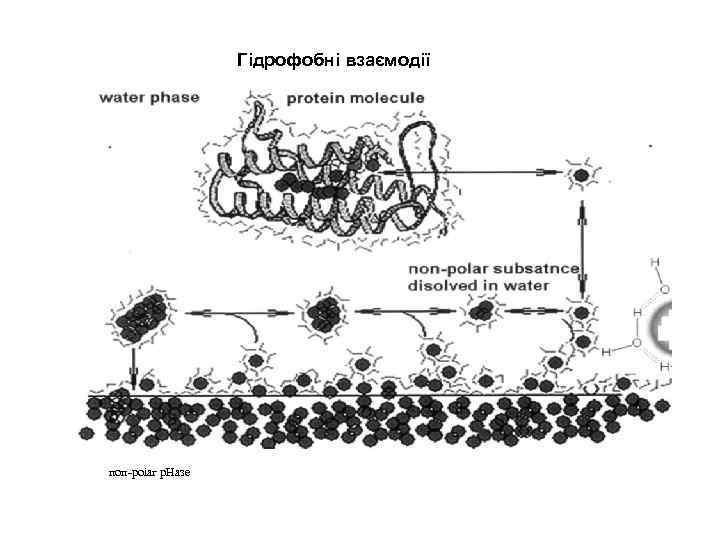
Гідрофобні взаємодії поп-роіаг р. Назе

При вкладанні білкової молекули амінокислотні залишки з гідрофобними бічними ланцюгами розміщуються у внутрішній частині молекули (сірий колір), полярні групи (чорний колір) локалізовані на поверхні молекули.
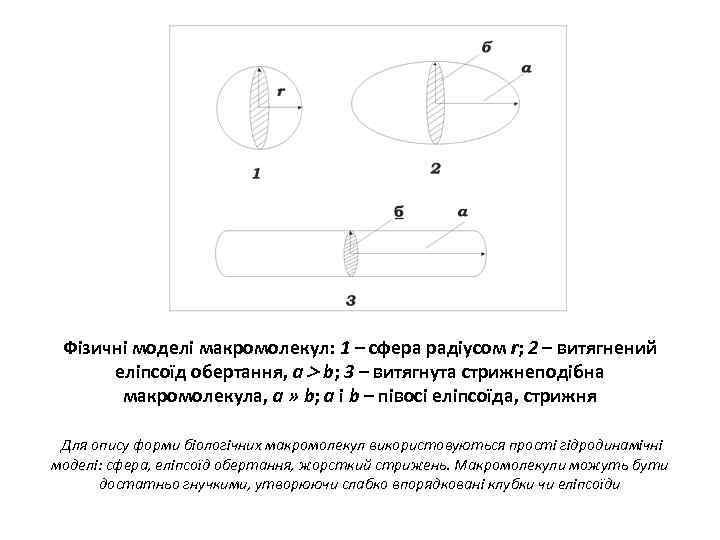
Фізичні моделі макромолекул: 1 – сфера радіусом r; 2 – витягнений еліпсоїд обертання, а b; 3 – витягнута стрижнеподібна макромолекула, а » b; а і b – півосі еліпсоїда, стрижня Для опису форми біологічних макромолекул використовуються прості гідродинамічні моделі: сфера, еліпсоїд обертання, жорсткий стрижень. Макромолекули можуть бути достатньо гнучкими, утворюючи слабко впорядковані клубки чи еліпсоїди

В’язкість розчинів біомакромолекул • Рух макромолекул у розчині залежить від їхньої форми та розмірів. Гідродинамічні методи (вимірювання в’язкості, дифузії, седиментації) дозволяють визначати певні характеристики руху і за ними встановлювати загальну форму, ефективний розмір і молекулярну масу макромолекул. В’язкість цитоплазми – важливий показник функціонального стану клітини. Під в’язкістю будь-якої рідини (або газу) розуміють властивість створювати опір, який виникає внаслідок міжмолекулярних сил при зміщенні одного шару рідини відносно іншого. Міжмолекулярні взаємодії зумовлюють внутрішнє тертя й відповідну в’язкість розчину.

Якщо виділити два шари рідини, які розташовані на відстані dy і які рухаються з різними швидкостями u 1 i u 2 в напрямку х, тоді за законом Ньютона сила тертя між шарами буде такою:

• У системі СІ коефіцієнт вимірюється в паскалях за секунду (несистемна одиниця 1 пуаз = 0, 1 Па с). • Закон Ньютона виконується у випадку, коли швидкість руху рідини є незначною й потік рідини має ламінарний характер (перемішування між сусідніми шарами рідин відсутнє). • В’язкість розчинів вимірюють капілярним віскозиметром Оствальда.

М – молекулярна маса макромолекули; N 0 – число Авогадро, V – об’єм макромолекули; – інкремент в’язкості або фактор форми (коефіцієнт Сімхи; 2, 5 для сферичних молекул), с - концентрація

Дифузія макромолекул Під час руху макромолекули у розчині виникає сила тертя F 0 = -fv f - коефіцієнт тертя (фрикційний коефіцієнт), v – швидкість руху молекули Для сферичних макромолекул коефіцієнт тертя визначається формулою Стокса: f = 6 r Згідно законів статистичної фізики хаотичний “броунівський” рух макромолекул визначається середньоквадратичним зміщенням. k 0 – стала Больцмана, t – час реєстрації хаотичного руху макромолекул

Дифузія макромолекул Поступальна дифузія – хаотичний рух молекул з об’єму, де висока концентрація, в об ’єм з низькою концентрацією. Потік речовини за рахунок дифузії описується рівнянням Фіка: Знак мінус означає, що потік спрямований до зменшення концентрації.

Коефіцієнт дифузії D зв’язаний з середньоквадратичним відхилинням (визначає хаотичний рух молекул).
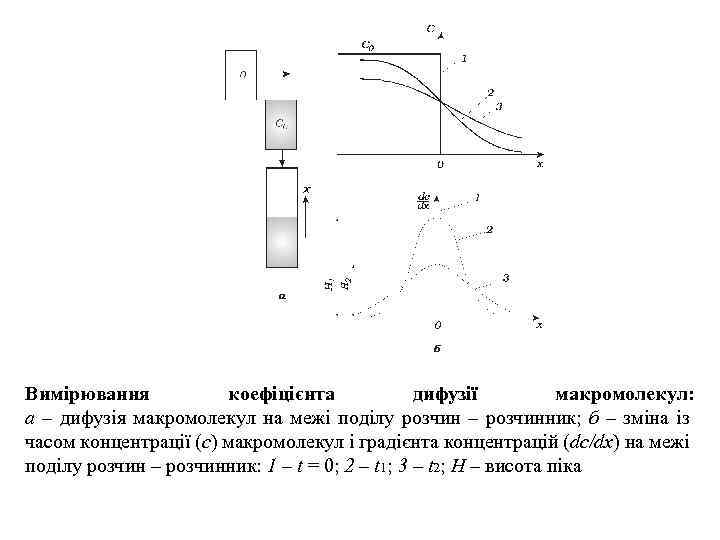
Вимірювання коефіцієнта дифузії макромолекул: а – дифузія макромолекул на межі поділу розчин – розчинник; б – зміна із часом концентрації (с) макромолекул і градієнта концентрацій (dc/dx) на межі поділу розчин – розчинник: 1 – t = 0; 2 – t 1; 3 – t 2; Н – висота піка

Основним законом абсорбційної спектрофотометрії є закон Ламберта–Бера: Закон Ламберта–Бера в логарифмічній формі записується таким чином: Екстинція – послаблення пучка світла за рахунок дії поглинання чи розсіювання світла. D = lc,

Седиментація – це осідання часток у рідині під дією сили тяжіння. В ультрацентрифугах створюються такі центробіжні прискорення, які перевершують прискорення земного тяжіння g в 104– 105 разів, завдяки чому легко відбувається седиментація макромолекул. коефіцієнт седиментації s (с) – відношення швидкості седиментації v до кутового прискорення 2 х: Розмірність коефіцієнта седиментації – [c]. За одиницю коефіцієнта седиментації прийнято 1 Сведберг (s) = 10 -13 с.
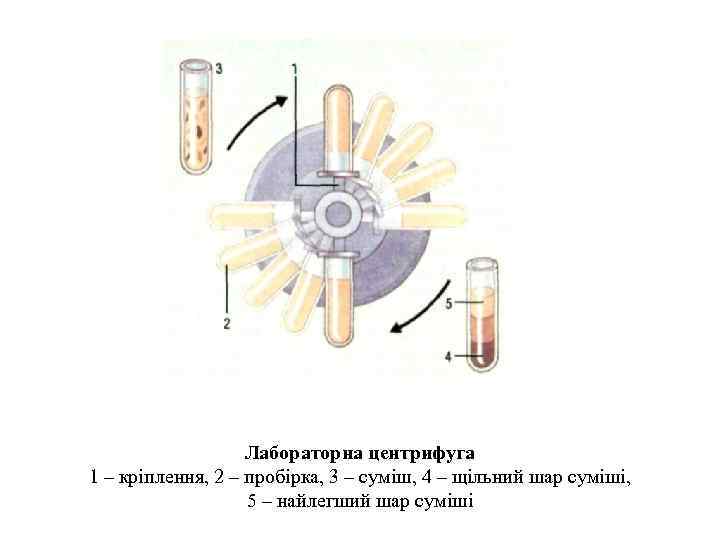
Лабораторна центрифуга 1 – кріплення, 2 – пробірка, 3 – суміш, 4 – щільний шар суміші, 5 – найлегший шар суміші

Рух частинок у рідкій фазі або гелі під дією електричного поля називається електрофорезом. Вперше явище електрофорезу було відкрите професором Московського університету Ф. Ф. Рейссом (1809 р. ). Розрізняють два типи електрофорезу: катафорез та анафорез Електрофорез білків – методики розділення суміші білків на фракції чи індивідуальні білки, засновані на явищі електрофорезу На макромолекулу із сумарним зарядом q в електричному полі напруженістю Е діє електрична сила: Fe = q. E Під дією цієї сили відбувається прискорення руху макромолекул, що створює опір у в’язкому середовищі із силою тертя F 0= fv, де v – швидкість руху макромолекул; f – коефіцієнт внутрішнього тертя. Через певний період, коли сили врівноважуються (Fe = F 0), макромолекули рухаються рівномірно з постійною швидкістю v. За цієї умови q E = fv.

• Відношення v до напруженості електричного поля Е називається електрофоретичною рухомістю u: • Для сферичних макромолекул f = 6 r і тоді, де – в’язкість середовища; r – радіус макромолекули. Електрофоретична рухомість дає інформацію про форму й розміри макромолекули. Але це відповідає ідеальному випадку, коли макромолекула представлена як сфера і впливом іонного оточення навколо неї можна знехтувати.
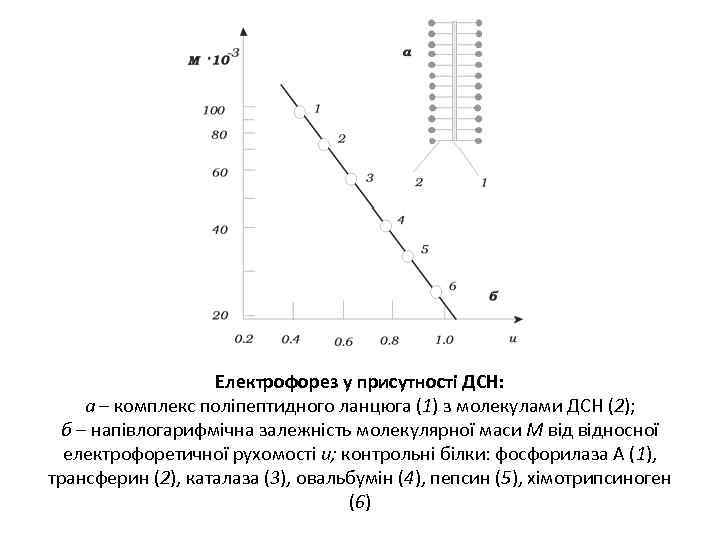
Електрофорез у присутності ДСН: а – комплекс поліпептидного ланцюга (1) з молекулами ДСН (2); б – напівлогарифмічна залежність молекулярної маси М відносної електрофоретичної рухомості u; контрольні білки: фосфорилаза А (1), трансферин (2), каталаза (3), овальбумін (4), пепсин (5), хімотрипсиноген (6)
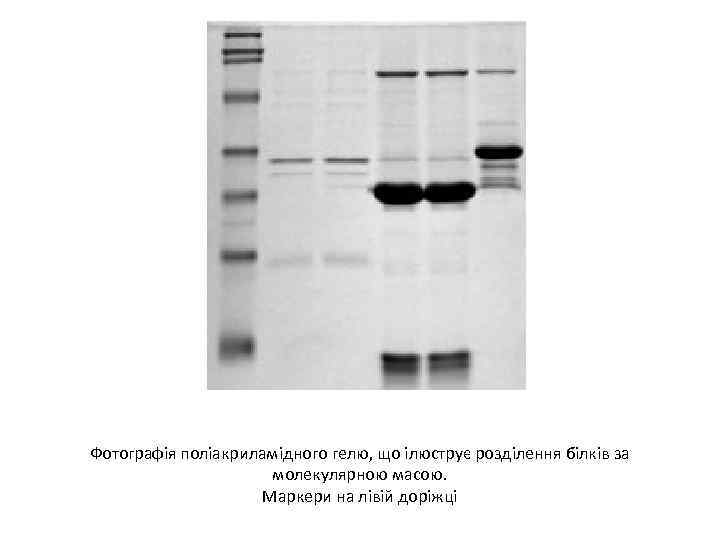
Фотографія поліакриламідного гелю, що ілюструє розділення білків за молекулярною масою. Маркери на лівій доріжці
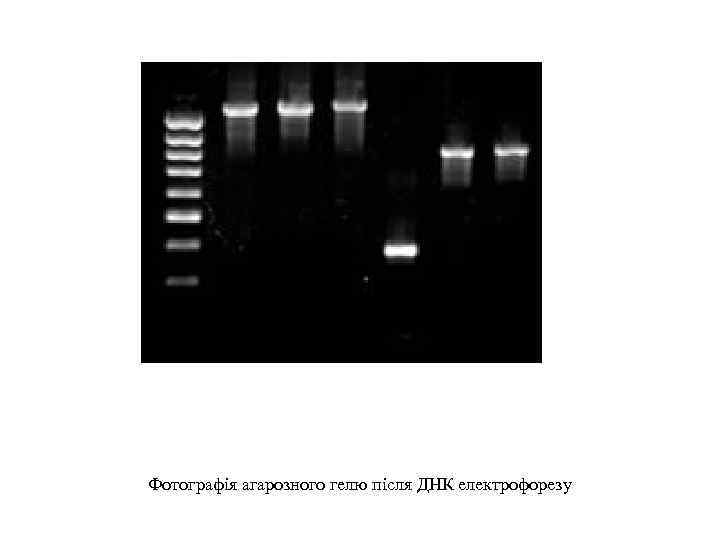
Фотографія агарозного гелю після ДНК електрофорезу
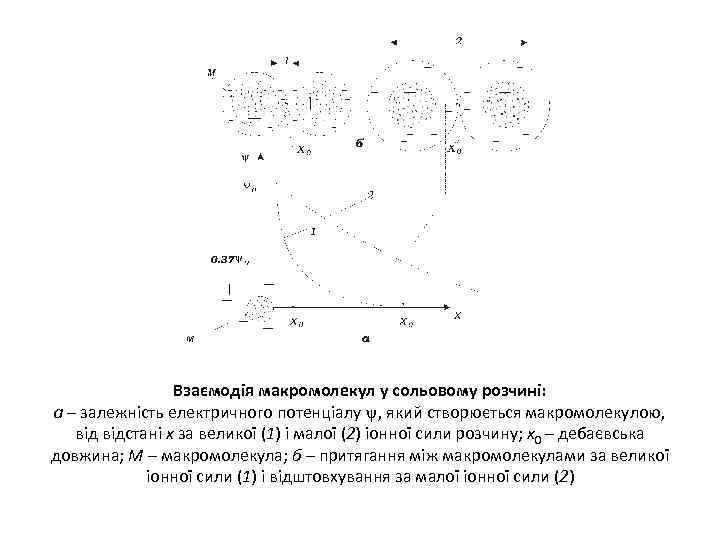
Взаємодія макромолекул у сольовому розчині: а – залежність електричного потенціалу , який створюється макромолекулою, відстані х за великої (1) і малої (2) іонної сили розчину; х0 – дебаєвська довжина; М – макромолекула; б – притягання між макромолекулами за великої іонної сили (1) і відштовхування за малої іонної сили (2)

Якщо в розчині макромолекула внаслідок іонізації має на поверхні електричні заряди то взаємодія макромолекул буде сильно залежати від наявності іонів в розчині Основні положення теорії Дебая-Хюккеля • 1. Внаслідок розподілення зарядів по поверхні молекули виникає електричний потенціал ψ-потенціал. • 2. Заряджена молекула притягує до себе іони протилежного знаку (протиіони) внаслідок чого у найближчому оточенні макромолекули відбувається перерозподіл іонів. • 3. На певній відстані від макромолекули розчин електроліту нейтральний. • 4. Енергія електростатичної взаємодії протиіонів з молекулою менше енергії теплового руху внаслідок чого постійно відбувається відтік і притік протиіонів в об’єм і з об’єму розчину електроліту.

БІЛКИ • • 1. Функції білків 2. Первинна структура білків 3. Вторинна та надвторинна структура 4. Дисперсія оптичного обертання та круговий дихроїзм • 5. Домени й третина структура білків • 6. Динаміка структури білків
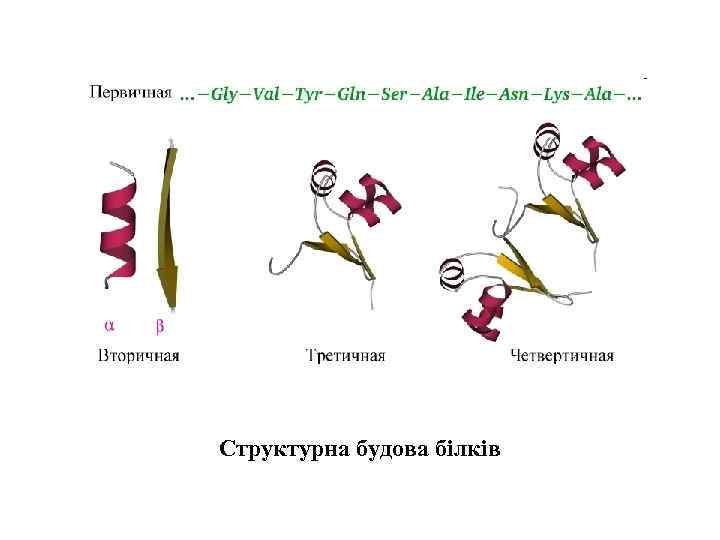
Структурна будова білків
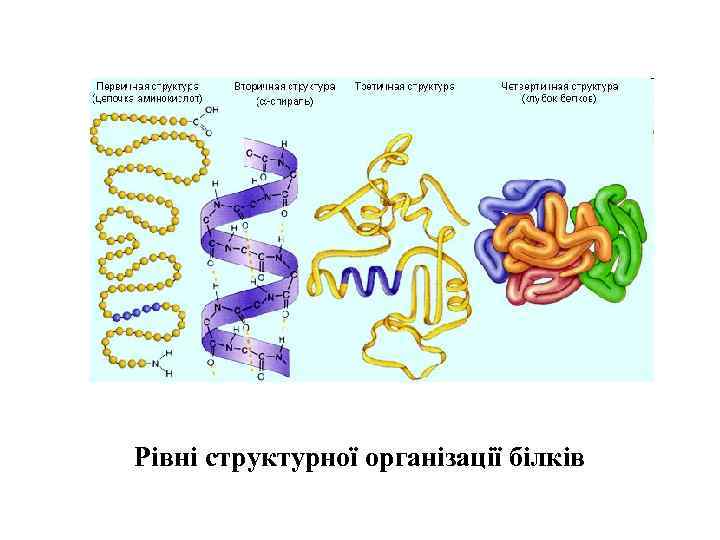
Рівні структурної організації білків
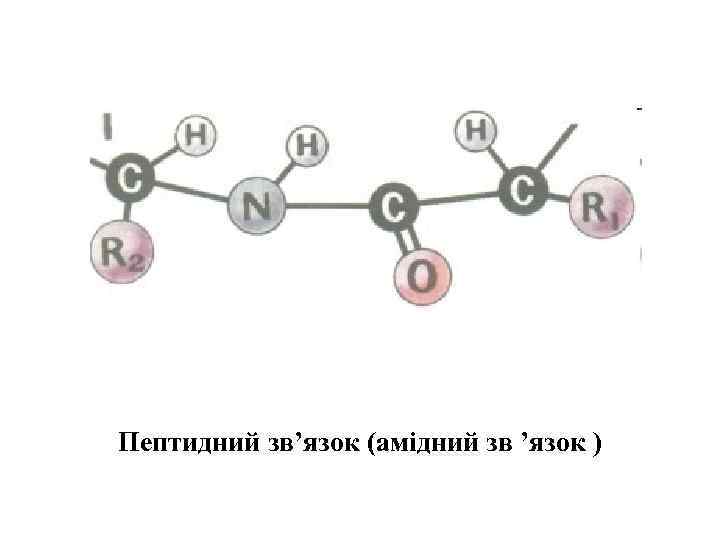
Пептидний зв’язок (амідний зв ’язок )
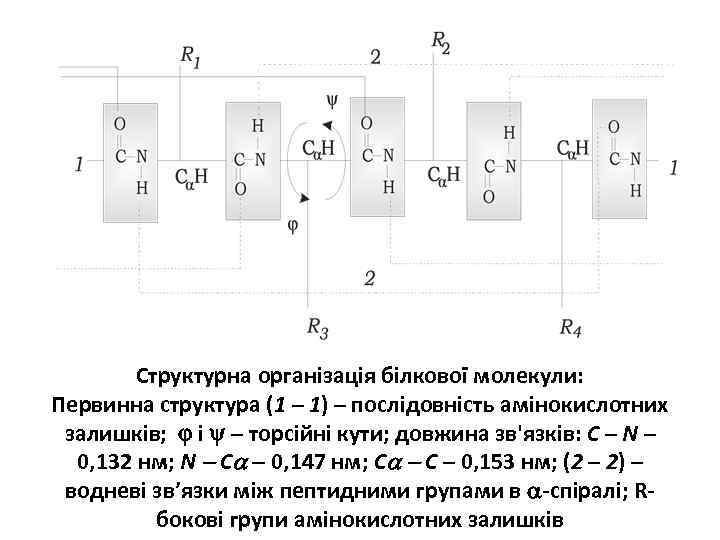
Структурна організація білкової молекули: Первинна структура (1 – 1) – послідовність амінокислотних залишків; і – торсійні кути; довжина зв'язків: C – N – 0, 132 нм; N C 0, 147 нм; C C – 0, 153 нм; (2 – 2) – водневі зв’язки між пептидними групами в -спіралі; Rбокові групи амінокислотних залишків
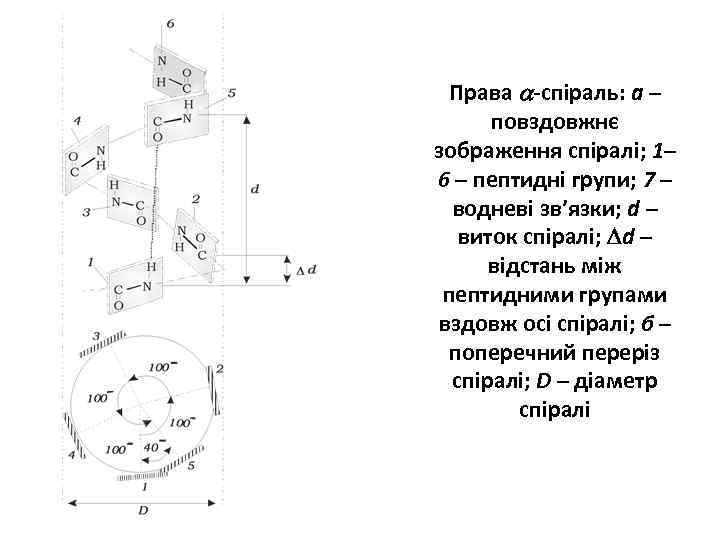
Права -спіраль: а – повздовжнє зображення спіралі; 1– 6 – пептидні групи; 7 – водневі зв’язки; d – виток спіралі; d – відстань між пептидними групами вздовж осі спіралі; б – поперечний переріз спіралі; D – діаметр спіралі
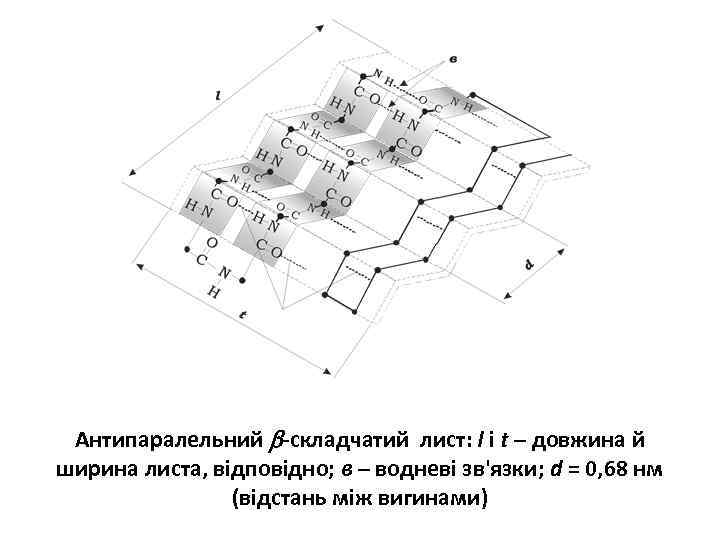
Антипаралельний -складчатий лист: l і t – довжина й ширина листа, відповідно; в – водневі зв'язки; d = 0, 68 нм (відстань між вигинами)
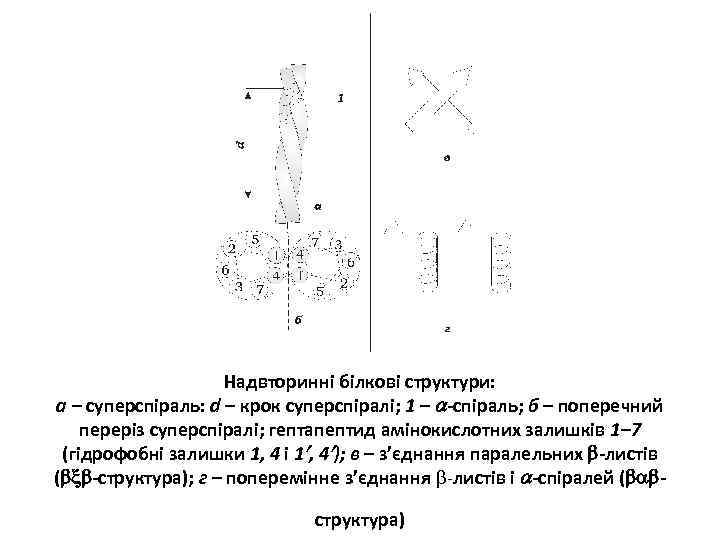
Надвторинні білкові структури: а – суперспіраль: d – крок суперспіралі; 1 – -спіраль; б – поперечний переріз суперспіралі; гептапептид амінокислотних залишків 1– 7 (гідрофобні залишки 1, 4 і 1 , 4 ); в – з’єднання паралельних -листів ( -структура); г – поперемінне з’єднання -листів і -спіралей ( структура)

• Поляризація світла – терміном поляризація електромагнітної хвилі або поляризація світла описується просторова орієнтація електричної складової електромагнітної хвилі – вектора напруженості електричного поля. Поляризація світла виникає при відбиванні та заломленні світла на межі поділу двох середовищ; під час проходження світла крізь анізотропне середовище; внаслідок подвійного променезаломлення.
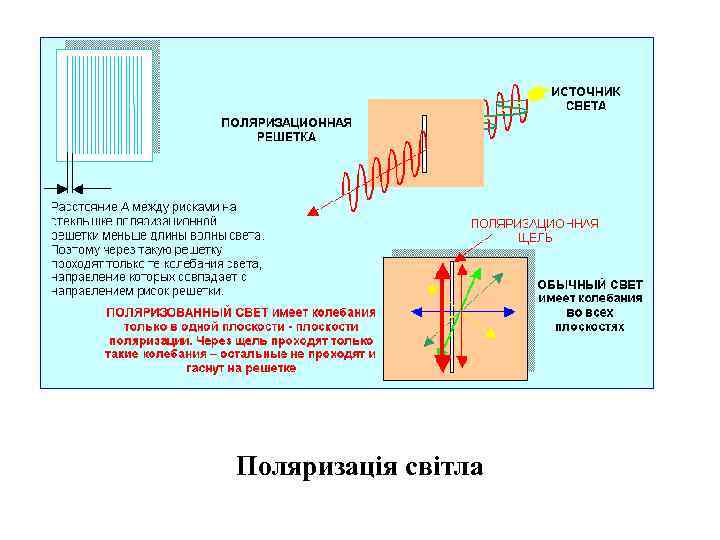
Поляризація світла

Фото зроблене з використанням неполяризованого та поляризованого світла

• Дисперсія оптичного обертання (ДОО) – це оптичний метод, що широко використовується для дослідження вторинної структури білків. В основі лежить фізичне явище – взаємодія лінійно поляризованого світла з оптично активними молекулами. Амінокислоти мають асиметричні атоми вуглецю, які викликають появу оптичної активності. Спектри ДОО реєструються в ділянці поглинання пептидних груп (ультрафіолетова ділянка спектру 180 – 230 нм).
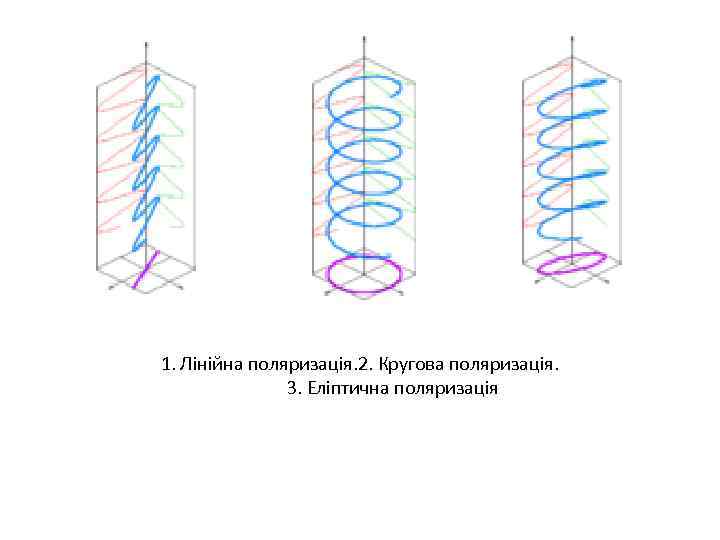
1. Лінійна поляризація. 2. Кругова поляризація. 3. Еліптична поляризація

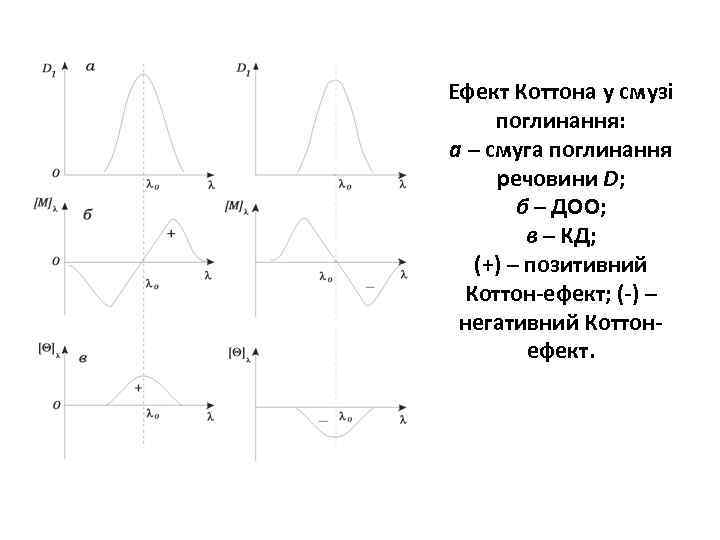
Ефект Коттона у смузі поглинання: а – смуга поглинання речовини D; б – ДОО; в – КД; (+) – позитивний Коттон-ефект; (-) – негативний Коттонефект.
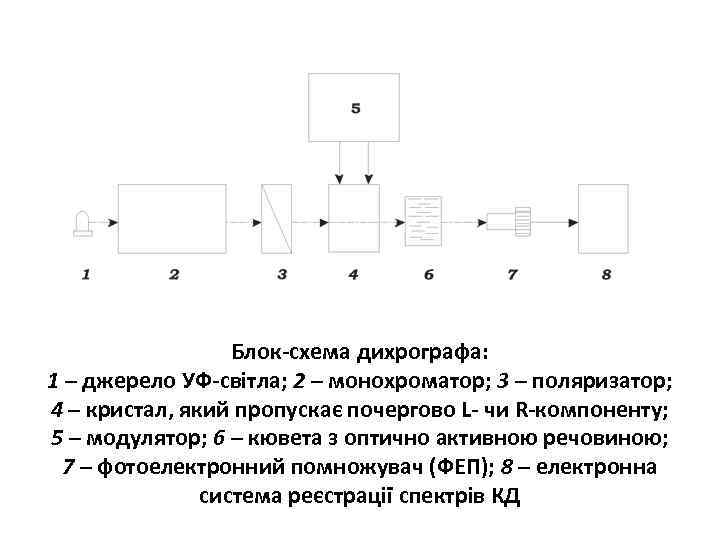
Блок-схема дихрографа: 1 – джерело УФ-світла; 2 – монохроматор; 3 – поляризатор; 4 – кристал, який пропускає почергово L- чи R-компоненту; 5 – модулятор; 6 – кювета з оптично активною речовиною; 7 – фотоелектронний помножувач (ФЕП); 8 – електронна система реєстрації спектрів КД
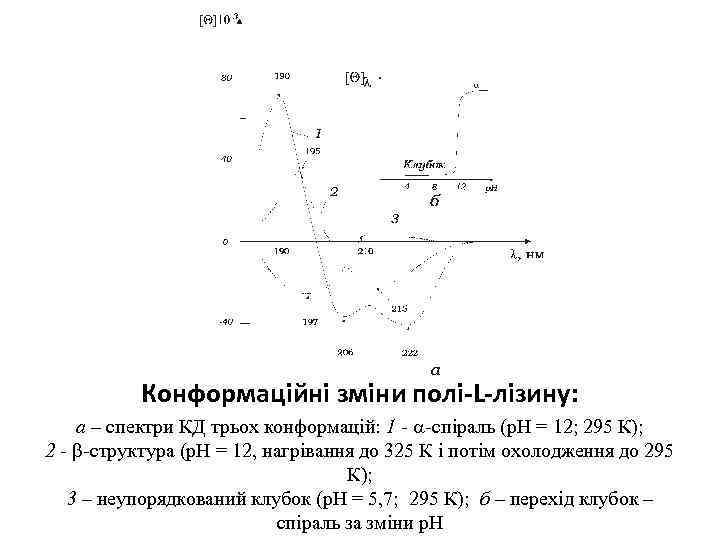
Конформаційні зміни полі-L-лізину: а – спектри КД трьох конформацій: 1 - -спіраль (р. Н = 12; 295 К); 2 - -структура (р. Н = 12, нагрівання до 325 К і потім охолодження до 295 К); 3 – неупорядкований клубок (р. Н = 5, 7; 295 К); б – перехід клубок – спіраль за зміни р. Н
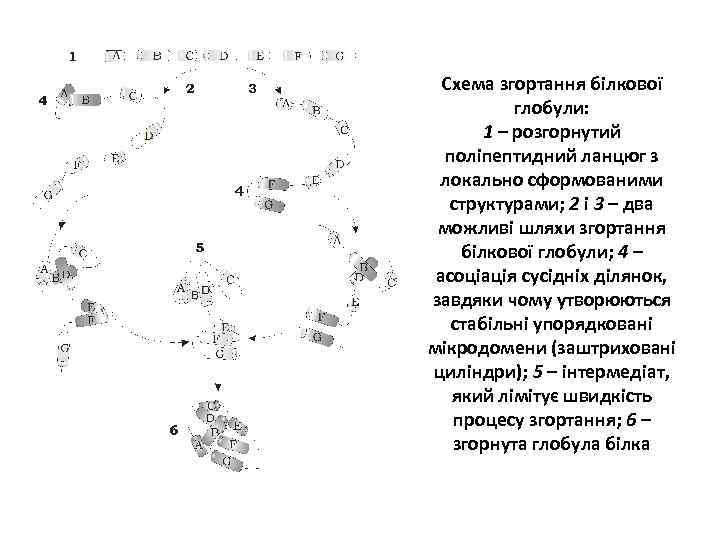
Схема згортання білкової глобули: 1 – розгорнутий поліпептидний ланцюг з локально сформованими структурами; 2 і 3 – два можливі шляхи згортання білкової глобули; 4 – асоціація сусідніх ділянок, завдяки чому утворюються стабільні упорядковані мікродомени (заштриховані циліндри); 5 – інтермедіат, який лімітує швидкість процесу згортання; 6 – згорнута глобула білка
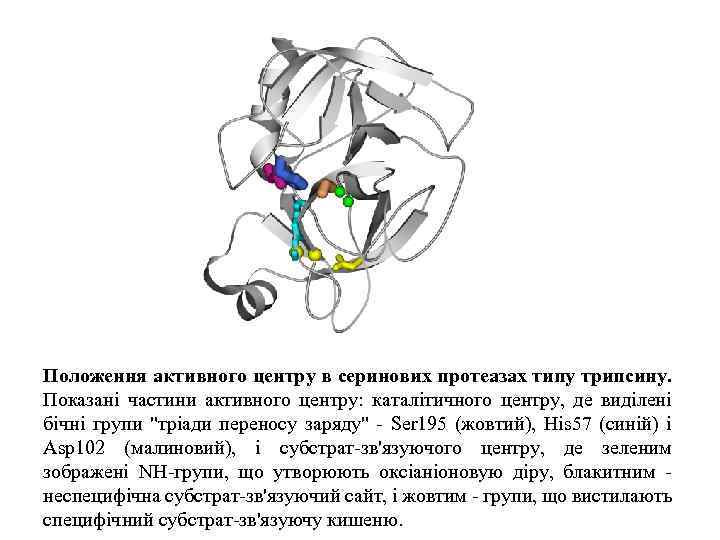
Положення активного центру в серинових протеазах типу трипсину. Показані частини активного центру: каталітичного центру, де виділені бічні групи "тріади переносу заряду" - Ser 195 (жовтий), His 57 (синій) і Asp 102 (малиновий), і субстрат-зв'язуючого центру, де зеленим зображені NH-групи, що утворюють оксіаніоновую діру, блакитним неспецифічна субстрат-зв'язуючий сайт, і жовтим - групи, що вистилають специфічний субстрат-зв'язуючу кишеню.
Четвертинна структура білка
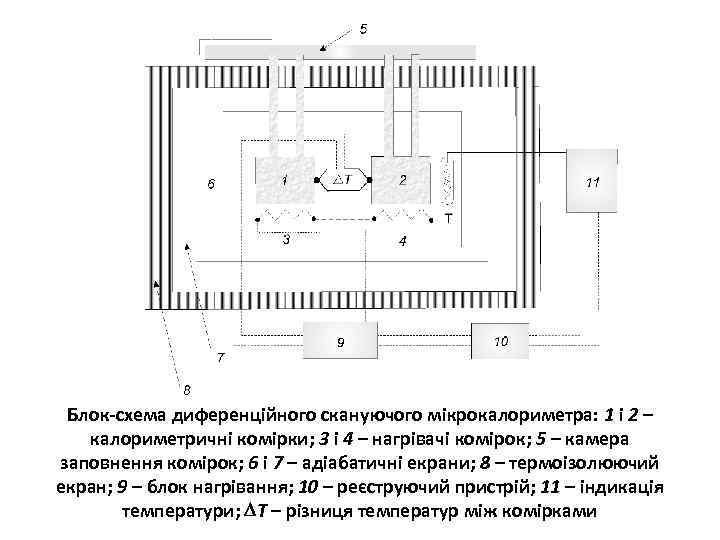
Блок-схема диференційного скануючого мікрокалориметра: 1 і 2 – калориметричні комірки; 3 і 4 – нагрівачі комірок; 5 – камера заповнення комірок; 6 і 7 – адіабатичні екрани; 8 – термоізолюючий екран; 9 – блок нагрівання; 10 – реєструючий пристрій; 11 – індикація температури; Т – різниця температур між комірками

ПЛАН 1. 2. 3. 4. 5. 6. Спектрофотометрія Флуоресцентна спектроскопія білків УФ-флуоресценція білка Флуоресцентні зонди та мітки Ядерний магнітний резонанс (ЯМР) Електронний парамагнітний резонанс (ЕПР)

отометрія Спектрофотометрія (абсорбційна) — фізико-хімічний метод досліджень розчинів і твердих речовин, оснований на вивченні спектрів поглинання в ультрафіолетовій (200— 400 нм), видимій (400— 760 нм) та інфрачервоній (>760 нм) областях спектра. Основна залежність, що вивчається у спектрофотометрії - залежність інтенсивності поглинання падаючого світла від довжини хвилі. Спектр поглинання білка в УФ-ділянці (230– 310 нм) зумовлено поглинанням ароматичних амінокислот – триптофану, тирозину й фенілаланіну. Світло поглинають хромофорні групи цих амінокислот
Дисперсія світла

закон Ламберта–Бера І – інтенсивність світла, яке пройшло через розчин досліджуваної речовини; Іо – інтенсивність світла, яке падає на кювету; n – кількість молекул в одиниці об’єму; k – ефективна площа поперечного розрізу яка поглинає кванти світла; l – товщина кювети. Закон Ламберта–Бера в логарифмічній формі записується таким чином: D = lc,

Залежність D чи від довжини хвилі світла називається спектром поглинання: D = f( ) чи = f( ). Залежність Т = f( ) називається спектром пропускання речовини.

Спектрофотометр
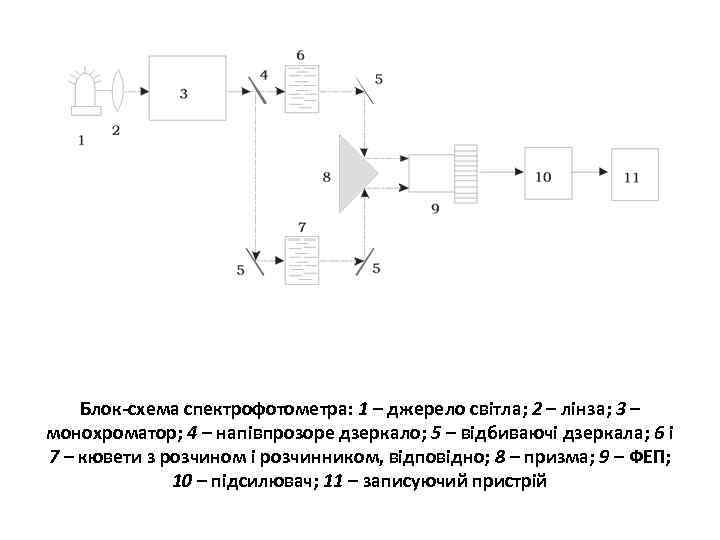
Блок-схема спектрофотометра: 1 – джерело світла; 2 – лінза; 3 – монохроматор; 4 – напівпрозоре дзеркало; 5 – відбиваючі дзеркала; 6 і 7 – кювети з розчином і розчинником, відповідно; 8 – призма; 9 – ФЕП; 10 – підсилювач; 11 – записуючий пристрій
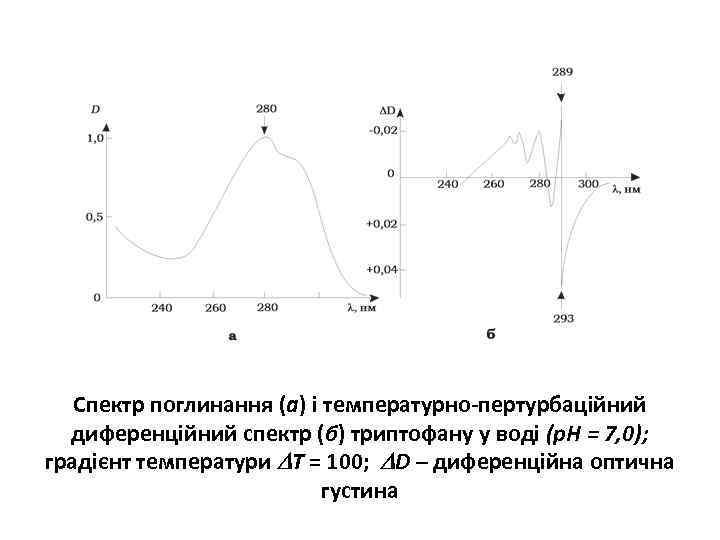
Спектр поглинання (а) і температурно-пертурбаційний диференційний спектр (б) триптофану у воді (р. Н = 7, 0); градієнт температури Т = 100; D – диференційна оптична густина

Люмінесценція - нетеплове світіння речовини, що відбувається після поглинання ним енергії збудження. Вперше люмінесценція була описана в XVIII столітті.

Флуоресцентна спектроскопія білків Поглинені кванти світла переводять електрони з основного, незбудженого рівня S 0 на збуджені рівні S 1*, S 2*… залежно від енергії кванта Збуджена молекула перебуває в нерівноважному стані, з якого вона має повернутися в рівноважний стан. Процес, який супроводжується випромінюванням квантів світла при переході електронів між синглетними рівнями S 1* S 0 (спіни електронів не змінють напрямок), називається флуоресценцією. Переходи електронів з триплетних на синглетні рівні (Т 1 S 0) супроводжуються фосфоресценцією
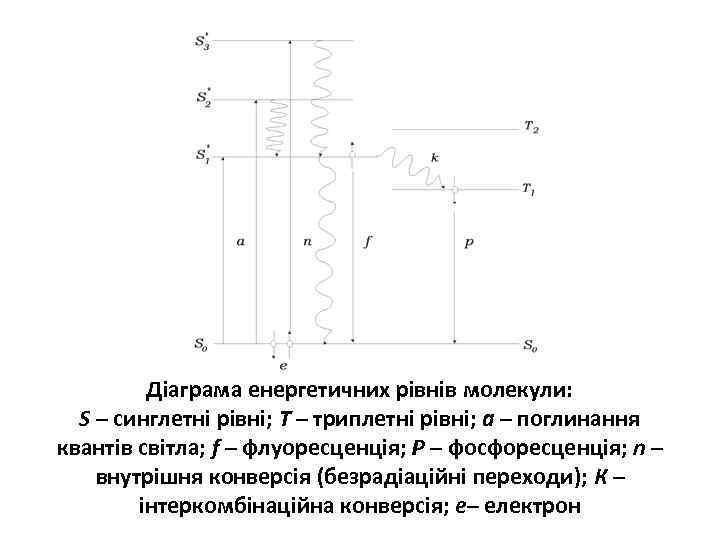
Діаграма енергетичних рівнів молекули: S – синглетні рівні; Т – триплетні рівні; а – поглинання квантів світла; f – флуоресценція; Р – фосфоресценція; n – внутрішня конверсія (безрадіаційні переходи); К – інтеркомбінаційна конверсія; е– електрон
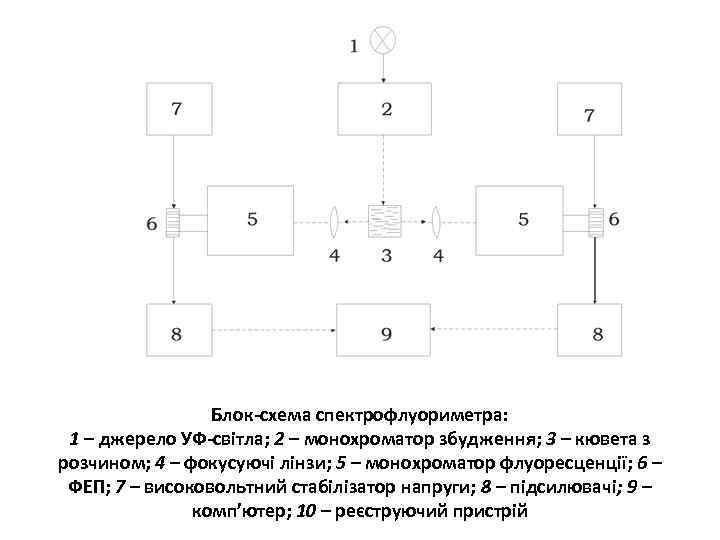
Блок-схема спектрофлуориметра: 1 – джерело УФ-світла; 2 – монохроматор збудження; 3 – кювета з розчином; 4 – фокусуючі лінзи; 5 – монохроматор флуоресценції; 6 – ФЕП; 7 – високовольтний стабілізатор напруги; 8 – підсилювачі; 9 – комп’ютер; 10 – реєструючий пристрій
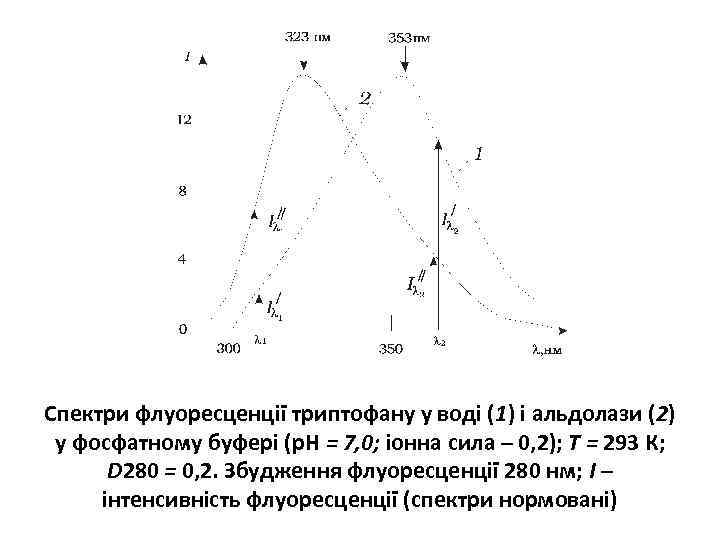
Спектри флуоресценції триптофану у воді (1) і альдолази (2) у фосфатному буфері (р. Н = 7, 0; іонна сила – 0, 2); Т = 293 К; D 280 = 0, 2. Збудження флуоресценції 280 нм; І – інтенсивність флуоресценції (спектри нормовані)
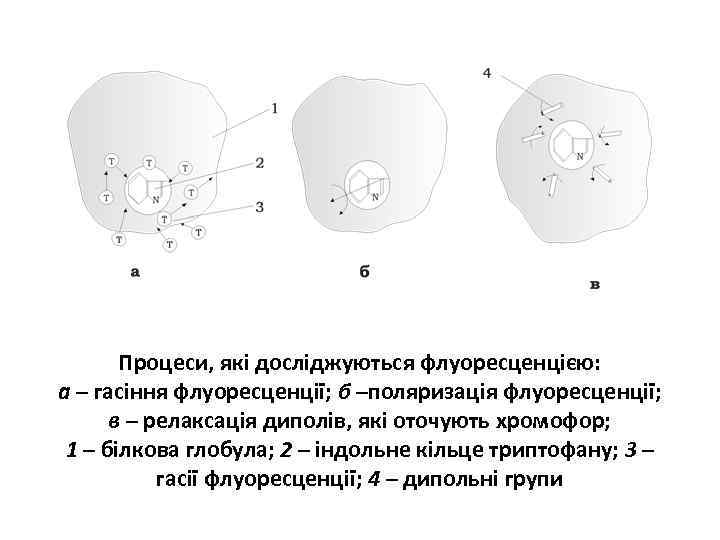
Процеси, які досліджуються флуоресценцією: а – гасіння флуоресценції; б –поляризація флуоресценції; в – релаксація диполів, які оточують хромофор; 1 – білкова глобула; 2 – індольне кільце триптофану; 3 – гасії флуоресценції; 4 – дипольні групи

флуоресцентні зонди для дослідження конформацій білків: АНС 1 -анілінонафталін-8 -сульфонат, ТНС 2 -толуїдиннафталін-6 -сульфонат). структури мембран - пірен, мембранних потенціалів - мероціанін, внутрішньоклітинного кальцію -квін-2, фура-2, індо-1, флуо-3)
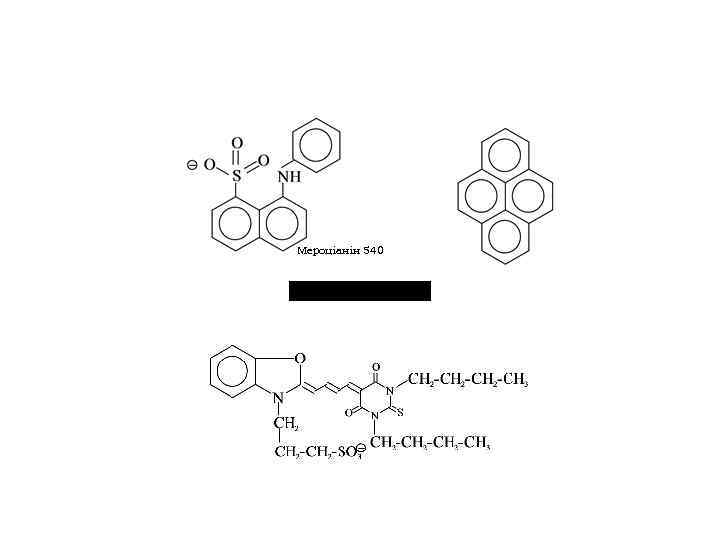
Мероціанін 540

Обертання протона спричиняє появу ядерного магнітного моменту я = gя яІ, H В результаті накладання магнітного поля 0 воно взаємодіє з протонами з енергією Е і орієнтує їх у зовнішньому магнітному полі. E = - я Н 0 = -gя я. IH 0
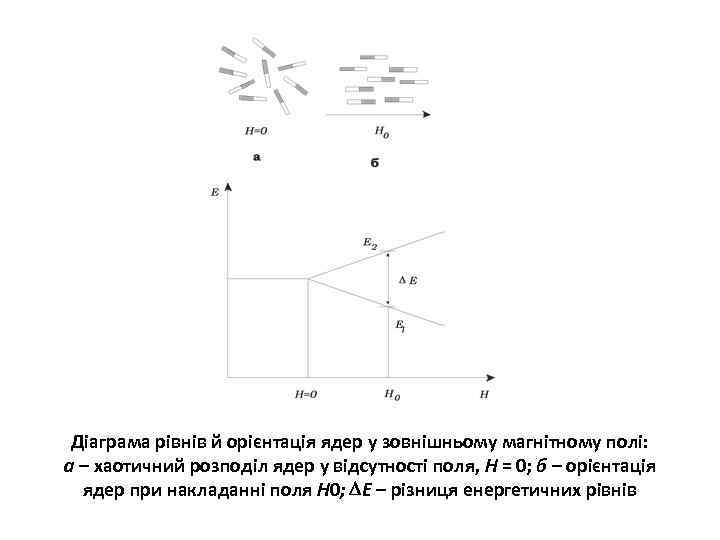
Діаграма рівнів й орієнтація ядер у зовнішньому магнітному полі: а – хаотичний розподіл ядер у відсутності поля, H = 0; б – орієнтація ядер при накладанні поля Н 0; Е – різниця енергетичних рівнів
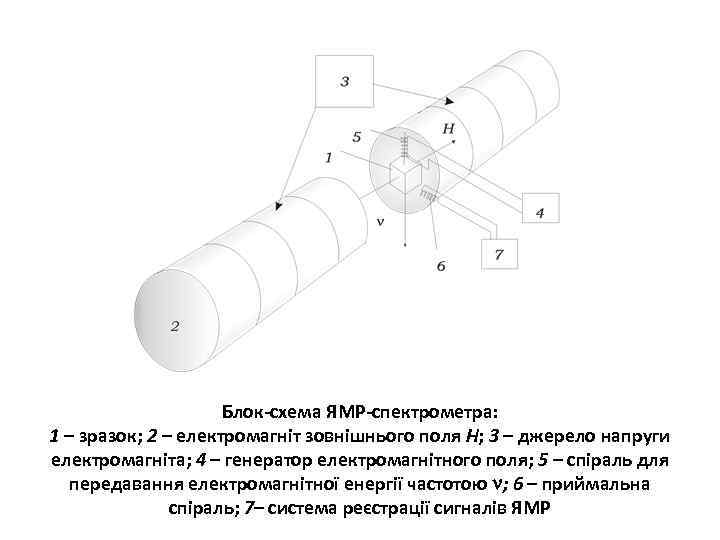
Блок-схема ЯМР-спектрометра: 1 – зразок; 2 – електромагніт зовнішнього поля Н; 3 – джерело напруги електромагніта; 4 – генератор електромагнітного поля; 5 – спіраль для передавання електромагнітної енергії частотою ; 6 – приймальна спіраль; 7– система реєстрації сигналів ЯМР
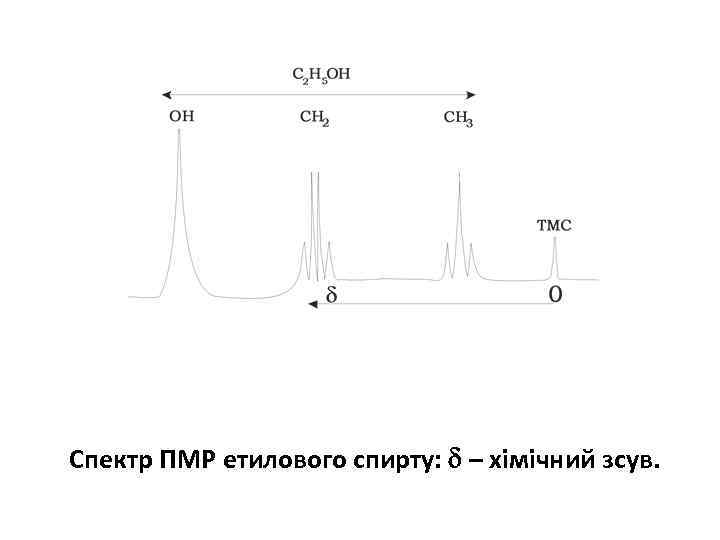
Спектр ПМР етилового спирту: – хімічний зсув.
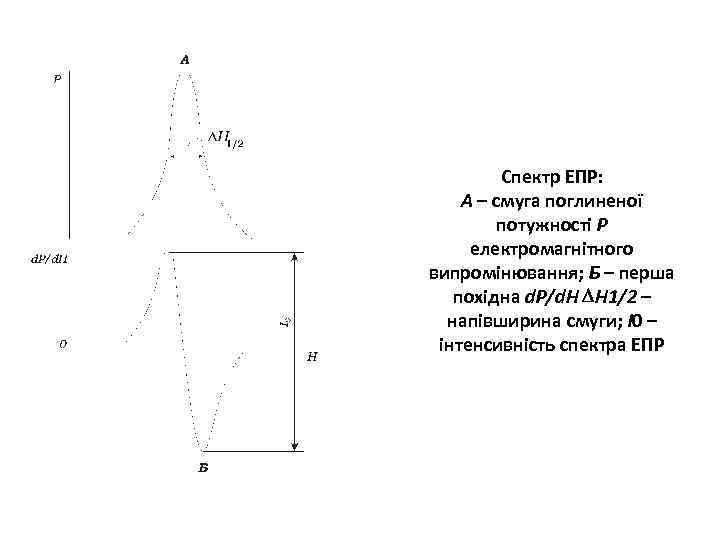
Спектр ЕПР: А – смуга поглиненої потужності Р електромагнітного випромінювання; Б – перша похідна d. P/d. H H 1/2 – напівширина смуги; І0 – інтенсивність спектра ЕПР

БІОФІЗИКА ФЕРМЕНТІВ • 1. Структура та механізм дії ферментів • 2. Термодинаміка ферментативного каталізу • 3. Моделі ферментативного каталізу • 4. Кінетика ферментативних процесів • 5. Алостеричні ферменти • 6. Вплив температури на швидкість реакцій

Активність ферментів визначається їх структурою. • Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. • Кожна послідовність амінокислот згортається особливим чином, і молекула володіє унікальними властивостями. • Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс.
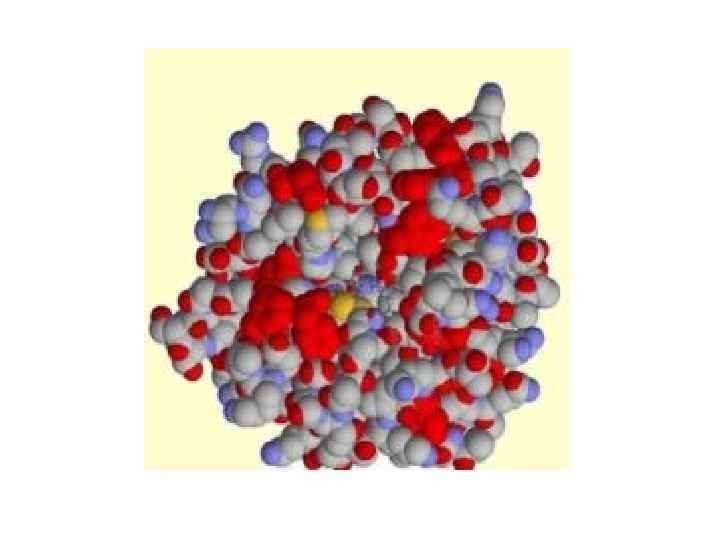

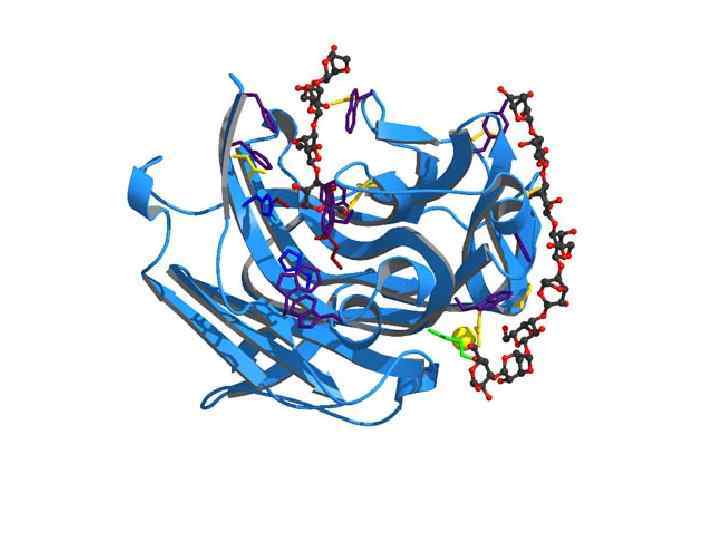
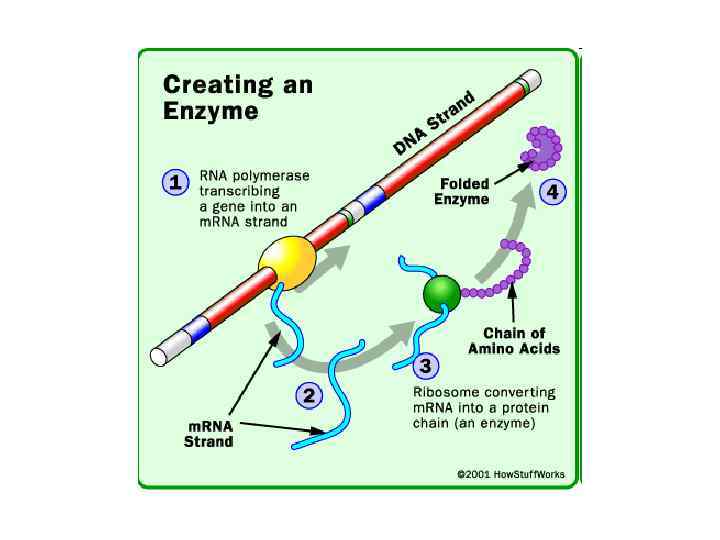

• Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. • Білковий ланцюг ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, де зв'язуються субстрати. • Ця область називається сайтом зв'язування субстрату. Зазвичай він збігається з активним центром ферменту або знаходиться поблизу від нього. • Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів.

• Кофактори ферментів Деякі ферменти виконують каталітичну функцію самі по собі, без додаткових компонентів. Проте є ферменти, яким для здійснення каталізу необхідні компоненти небілкової природи. Кофактори можуть бути як неорганічними молекулами (іони металів та інші), так і органічними (наприклад, флавін або гем). Органічні кофактори, що міцно зв”язані з ферментом, називають також простетичними групами. Кофактори органічної природи, що здатні відділятися від ферменту, називають коферментами.
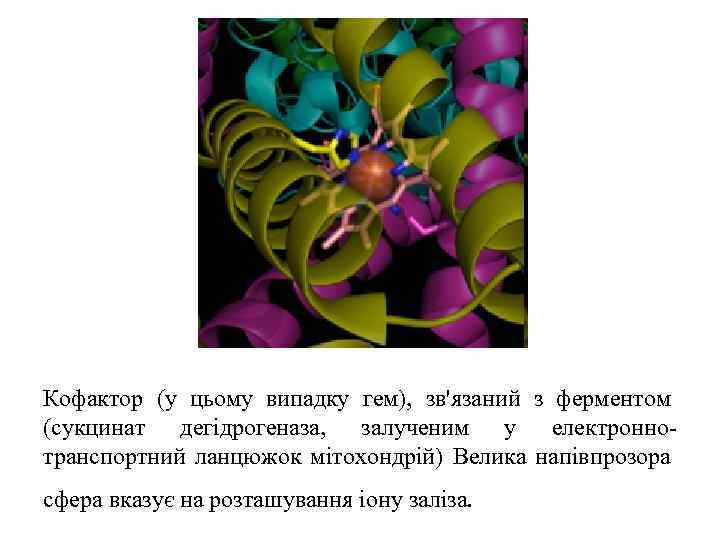
Кофактор (у цьому випадку гем), зв'язаний з ферментом (сукцинат дегідрогеназа, залученим у електроннотранспортний ланцюжок мітохондрій) Велика напівпрозора сфера вказує на розташування іону заліза.


Фермент, який вимагає наявності кофактора для здійснення каталітичної активності, але не звязаний з ним, називається апоферментом. Апофермент в комплексі з кофактором носить назву холоферменту. Більшість кофакторів з”єднана з ферментом нековалентними, але досить міцними взаємодіями. Є й такі простетичні групи, які пов'язані з ферментом ковалентно.

А + В Р
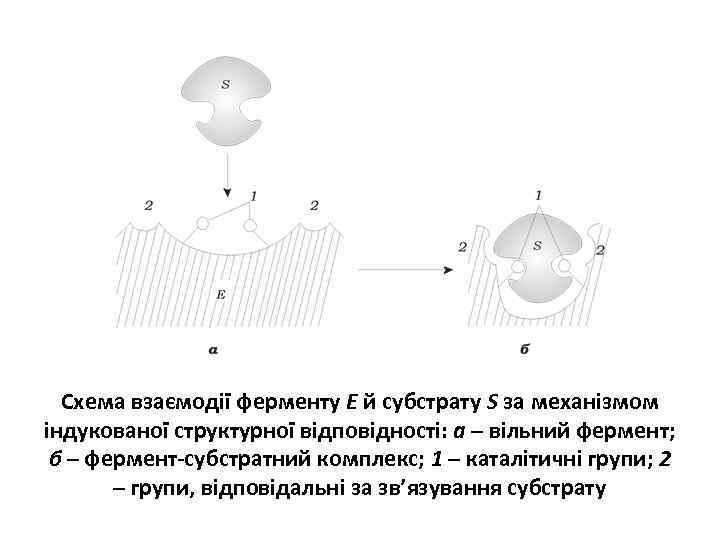
Схема взаємодії ферменту Е й субстрату S за механізмом індукованої структурної відповідності: а – вільний фермент; б – фермент-субстратний комплекс; 1 – каталітичні групи; 2 – групи, відповідальні за зв’язування субстрату
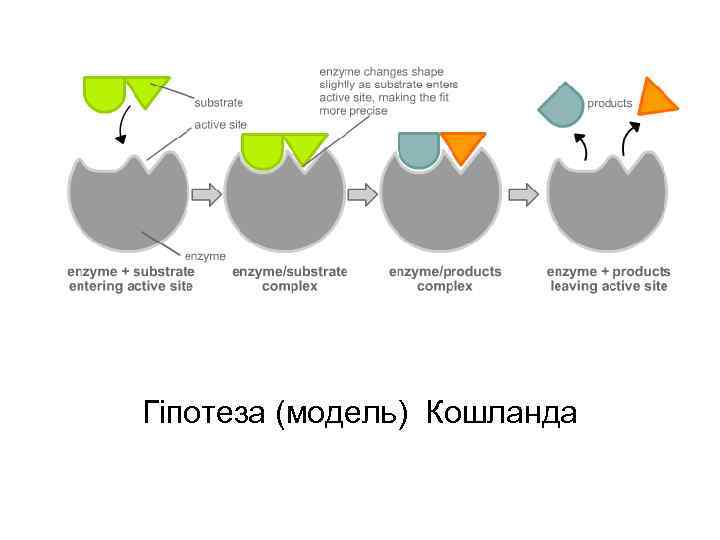
Гіпотеза (модель) Кошланда
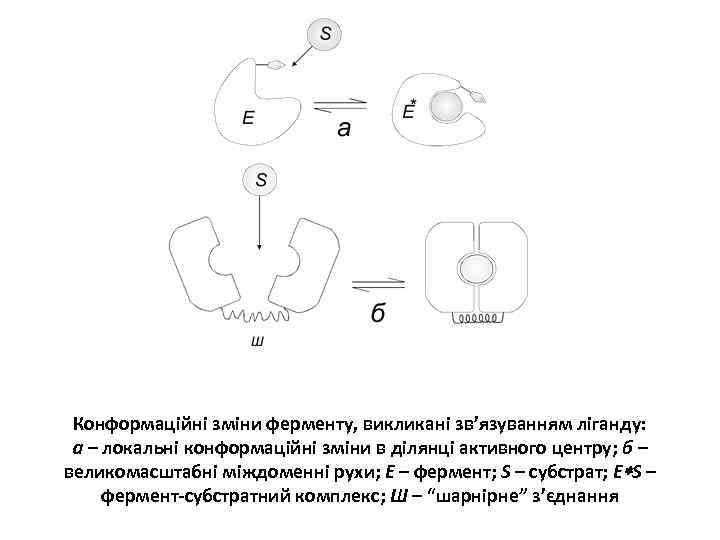
Конформаційні зміни ферменту, викликані зв’язуванням ліганду: а – локальні конформаційні зміни в ділянці активного центру; б – великомасштабні міждоменні рухи; Е – фермент; S – субстрат; Е S – фермент-субстратний комплекс; Ш – “шарнірне” з’єднання
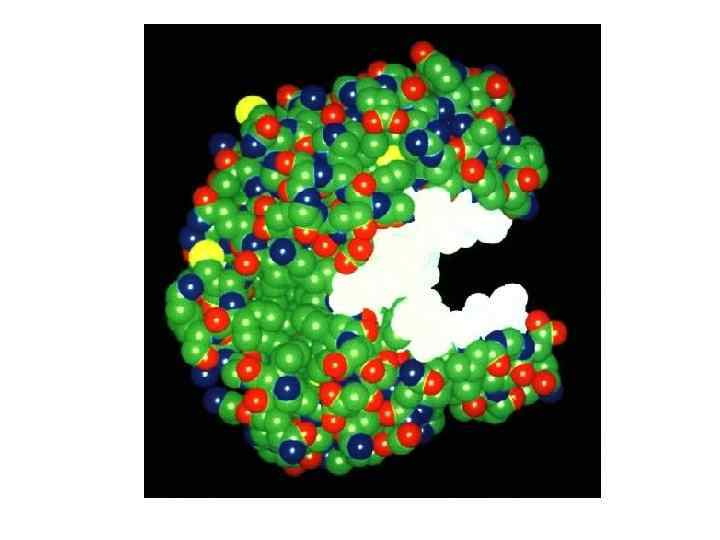
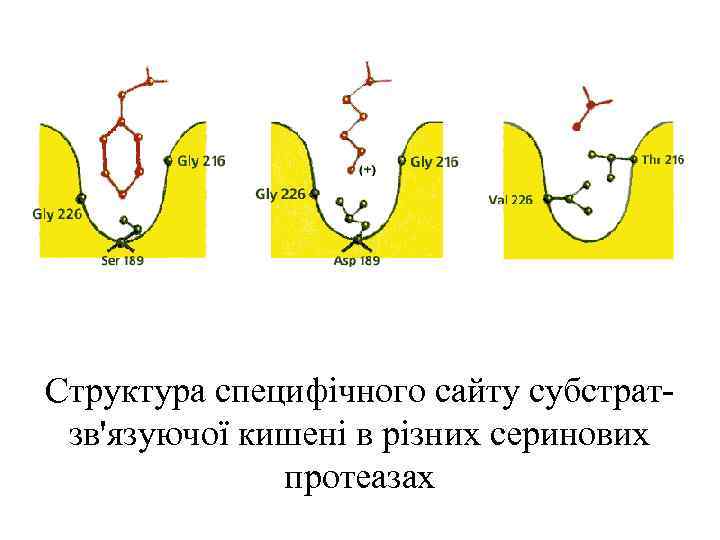
Структура специфічного сайту субстратзв'язуючої кишені в різних серинових протеазах
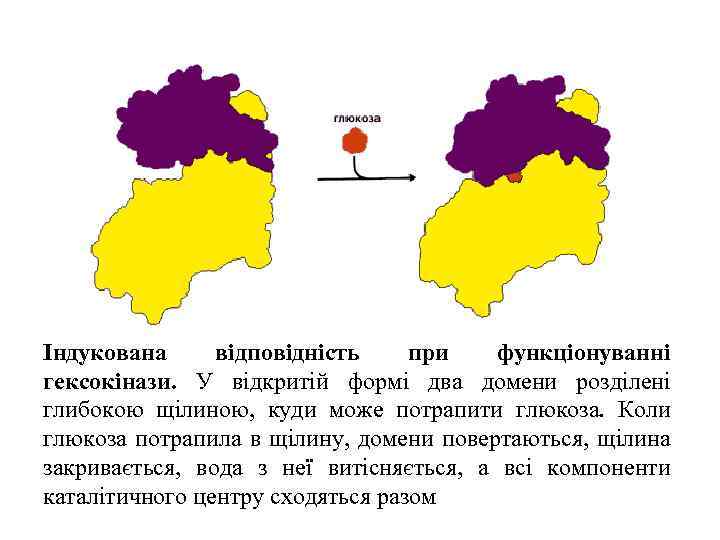
Індукована відповідність при функціонуванні гексокінази. У відкритій формі два домени розділені глибокою щілиною, куди може потрапити глюкоза. Коли глюкоза потрапила в щілину, домени повертаються, щілина закривається, вода з неї витісняється, а всі компоненти каталітичного центру сходяться разом
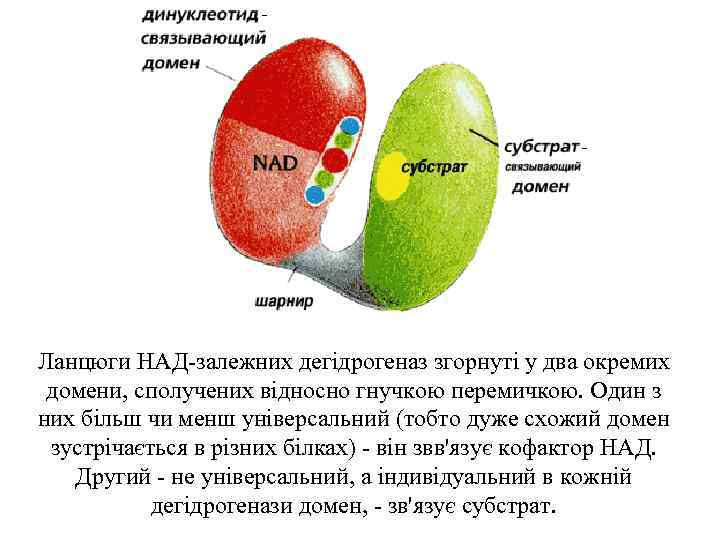
Ланцюги НАД-залежних дегідрогеназ згорнуті у два окремих домени, сполучених відносно гнучкою перемичкою. Один з них більш чи менш універсальний (тобто дуже схожий домен зустрічається в різних білках) - він звв'язує кофактор НАД. Другий - не універсальний, а індивідуальний в кожній дегідрогенази домен, - зв'язує субстрат.
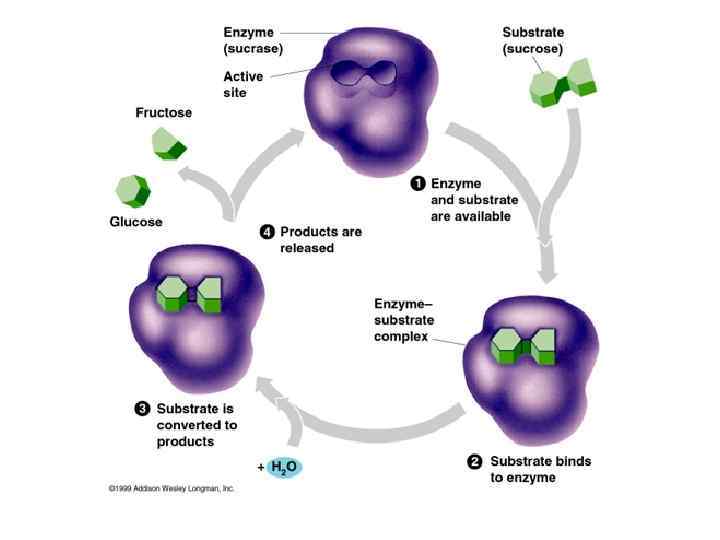

Фермент, з'єднуючись із субстратом: ”Очищає” субстрат від водяної «шуби» Розміщує реагуючі молекули субстрату у просторі певним чином Готує до реакції (наприклад, поляризує) молекули субстратів. Зазвичай приєднання ферменту до субстрату відбувається за рахунок іонних або водневих зв'язків, рідко - за рахунок ковалентних. У кінці реакції її продукт (або продукти) відділяються від ферменту.
![А + В Р [E] = [E 1] + [ES] А + В Р [E] = [E 1] + [ES]](https://present5.com/presentation/26586901_133293242/image-127.jpg)
А + В Р [E] = [E 1] + [ES]
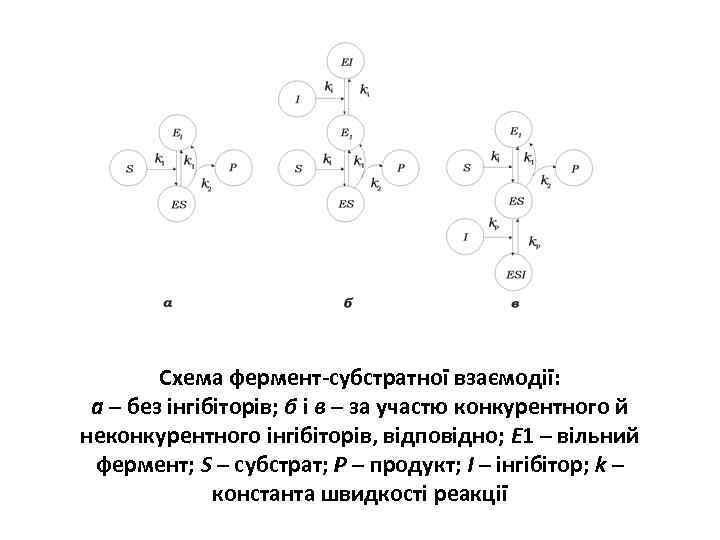
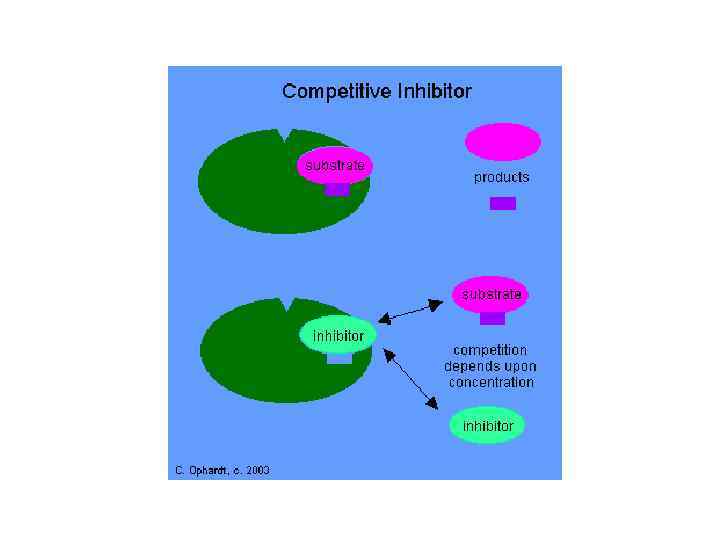
Схема фермент-субстратної взаємодії: а – без інгібіторів; б і в – за участю конкурентного й неконкурентного інгібіторів, відповідно; Е 1 – вільний фермент; S – субстрат; Р – продукт; І – інгібітор; k – константа швидкості реакції
![Крива насичення хімічної реакції, що ілюструє співвідношення між концентрацією субстрату [S] і швидкістю реакції Крива насичення хімічної реакції, що ілюструє співвідношення між концентрацією субстрату [S] і швидкістю реакції](https://present5.com/presentation/26586901_133293242/image-130.jpg)
Крива насичення хімічної реакції, що ілюструє співвідношення між концентрацією субстрату [S] і швидкістю реакції v

Кінетичні залежності фермент-субстратної взаємодії: а – швидкості v від концентрації субстрату; vmax – максимальна швидкість ферментативної реакції; КM – константа Міхаеліса

Біологічна регуляція за типом зворотного зв’язку: Тр – треонін; Кб – кетобутират; Аб – ацетогідроксибутират; Дб – дигідроксиметилвалерат; Кв – кето-метилвалерат; Із – ізолейцин; Е 1 – треоніндезаміназа; Е 2 – синтетаза ацетогідроксикислот; Е 3 – ізомероредуктаза ацетогідроксикислот; Е 4 – дегідраза дегідроксикислот; Е 5 – трансаміназа В
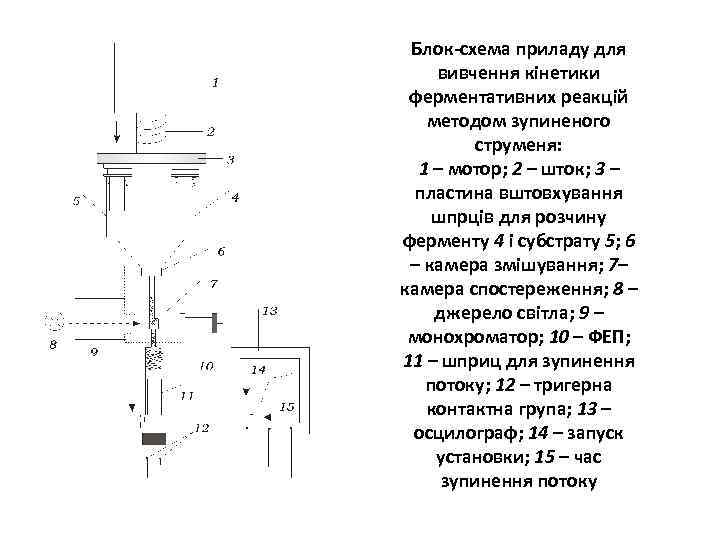
Блок-схема приладу для вивчення кінетики ферментативних реакцій методом зупиненого струменя: 1 – мотор; 2 – шток; 3 – пластина вштовхування шпрців для розчину ферменту 4 і субстрату 5; 6 – камера змішування; 7– камера спостереження; 8 – джерело світла; 9 – монохроматор; 10 – ФЕП; 11 – шприц для зупинення потоку; 12 – тригерна контактна група; 13 – осцилограф; 14 – запуск установки; 15 – час зупинення потоку
1 mol b-ka.ppt