7кл_Молекулы в биологии.pptx
- Количество слайдов: 77

Молекулы в биологии (Биохимия) Бизяев Никита Сергеевич, студент 3 курса каф. биохимии Биологического факультета МГУ им. М. В. Ломоносова
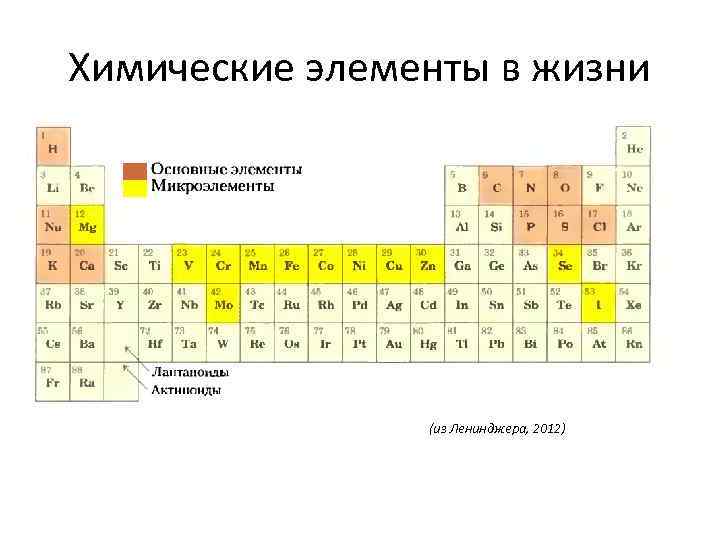
Химические элементы в жизни (из Ленинджера, 2012)

Законы термодинамики • Первый: Энергия не берется из ниоткуда и никуда не исчезает «Вы не можете выиграть» (здесь и далее на слайде цит. Носова) • Второй: В изолированных системах произвольно идут лишь процессы, в которых увеличивется энтропия (мера беспорядочности) системы «Вы не можете остаться «при своих» • Третий: Лишь энтропия идеального кристалла индивидуального вещества при 0 К равна 0 «Вы не можете не участвовать в игре»
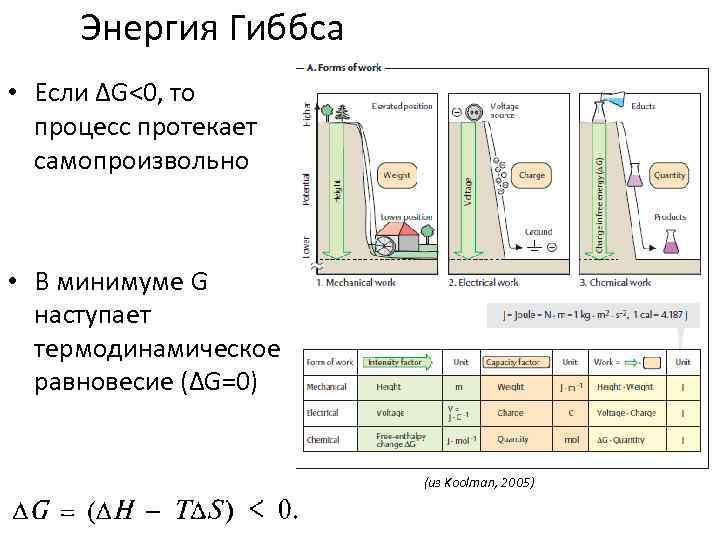
Энергия Гиббса • Если ΔG<0, то процесс протекает самопроизвольно • В минимуме G наступает термодинамическое равновесие (ΔG=0) (из Koolman, 2005)

Равновесие (из Principles of General Chemistry) p (из Третьякова, 2004) Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то в результате протекающих в ней процессов положение равновесия смещается в сторону, ослабляющую это воздействие
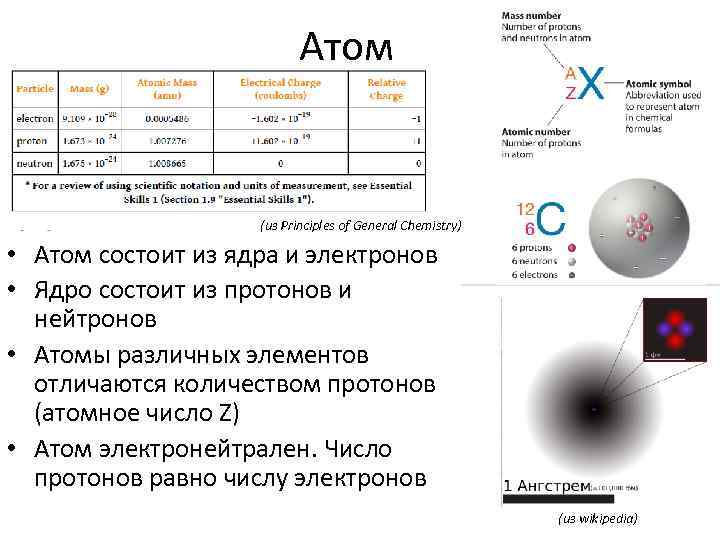
Атом (из Principles of General Chemistry) • Атом состоит из ядра и электронов • Ядро состоит из протонов и нейтронов • Атомы различных элементов отличаются количеством протонов (атомное число Z) • Атом электронейтрален. Число протонов равно числу электронов (из wikipedia)
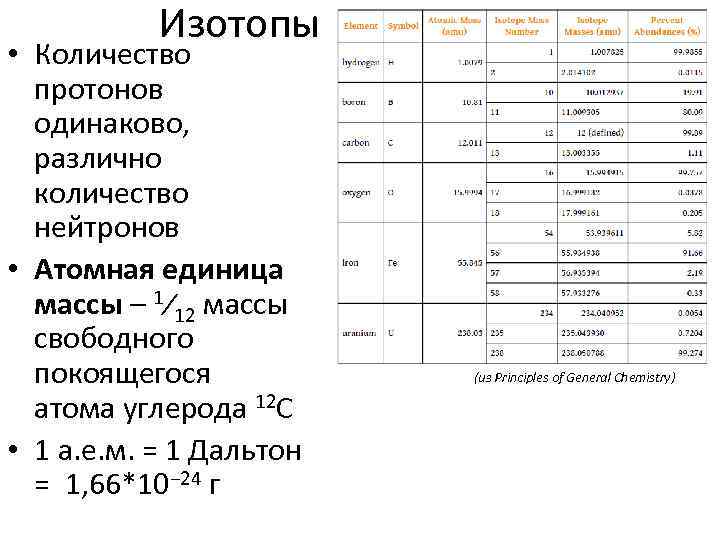
Изотопы • Количество протонов одинаково, различно количество нейтронов • Атомная единица массы – 1⁄12 массы свободного покоящегося атома углерода 12 C • 1 а. е. м. = 1 Дальтон = 1, 66*10− 24 г (из Principles of General Chemistry)
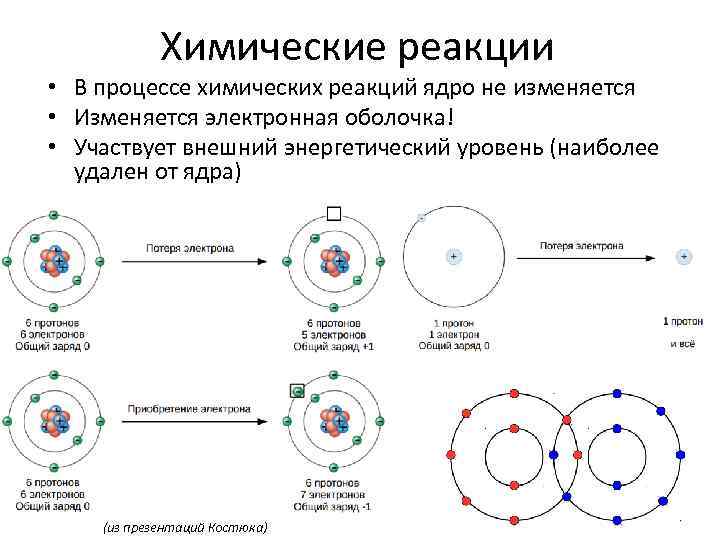
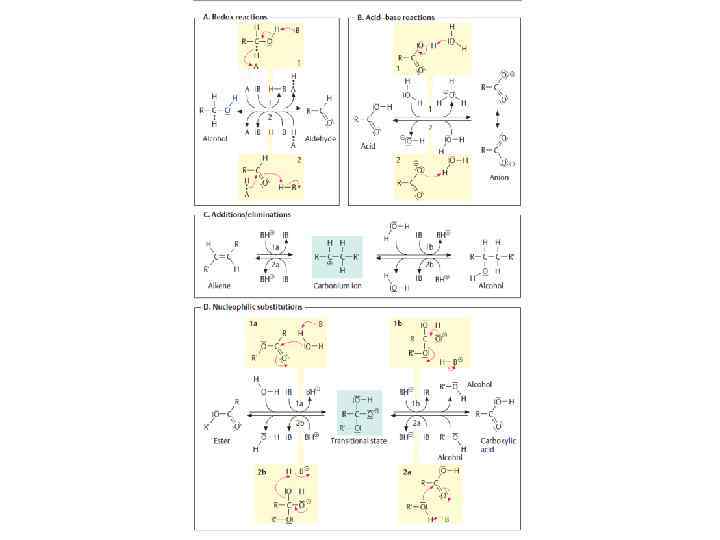
Химические реакции • В процессе химических реакций ядро не изменяется • Изменяется электронная оболочка! • Участвует внешний энергетический уровень (наиболее удален от ядра) (из презентаций Костюка)
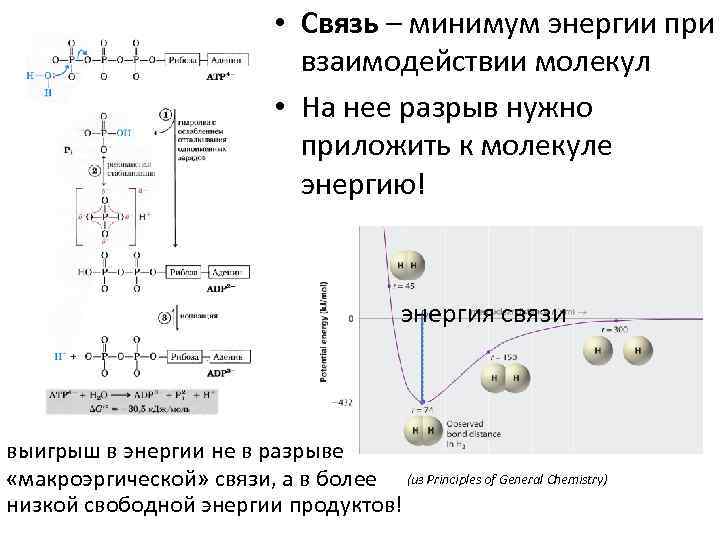
• Связь – минимум энергии при взаимодействии молекул • На нее разрыв нужно приложить к молекуле энергию! энергия связи выигрыш в энергии не в разрыве «макроэргической» связи, а в более (из Principles of General Chemistry) низкой свободной энергии продуктов!
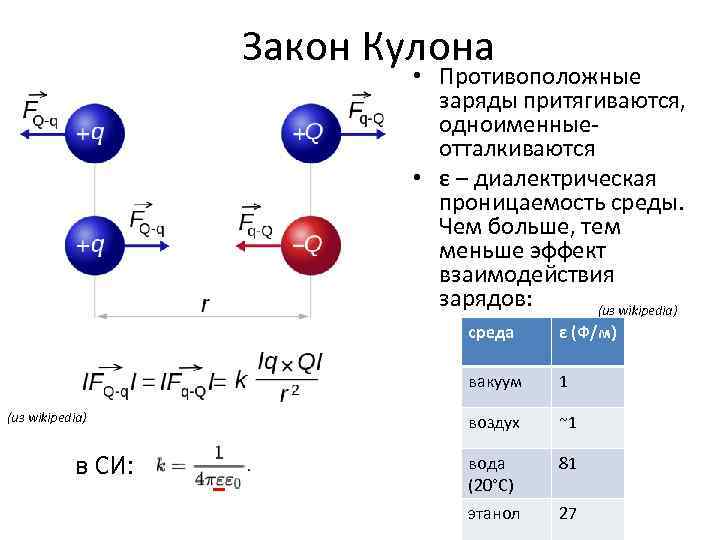
Закон Кулона • Противоположные заряды притягиваются, одноименные- отталкиваются • ε – диалектрическая проницаемость среды. Чем больше, тем меньше эффект взаимодействия зарядов: (из wikipedia) среда вакуум (из wikipedia) в СИ: ε (Ф/м) 1 воздух ~1 вода (20°C) 81 этанол 27
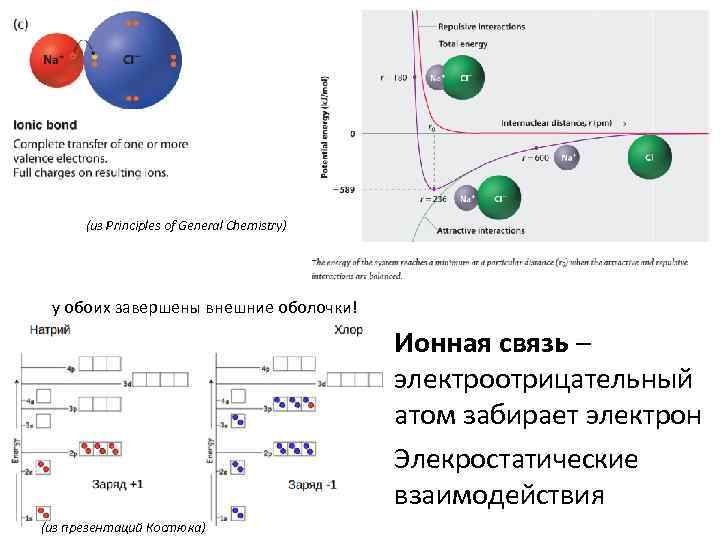
(из Principles of General Chemistry) у обоих завершены внешние оболочки! Ионная связь – электроотрицательный атом забирает электрон Элекростатические взаимодействия (из презентаций Костюка)
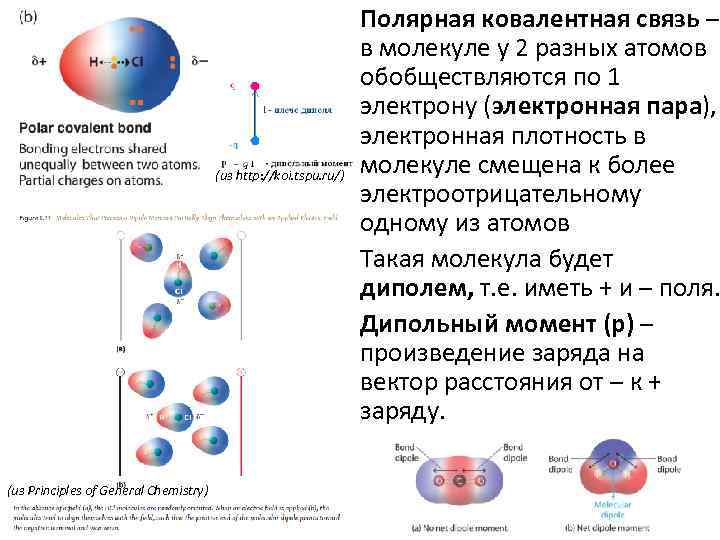
Полярная ковалентная связь – в молекуле у 2 разных атомов обобществляются по 1 электрону (электронная пара), электронная плотность в молекуле смещена к более (из http: //koi. tspu. ru/) электроотрицательному одному из атомов • Такая молекула будет диполем, т. е. иметь + и – поля. • Дипольный момент (p) – произведение заряда на вектор расстояния от – к + заряду. (из Principles of General Chemistry)

(из Ленинджера, 2012)
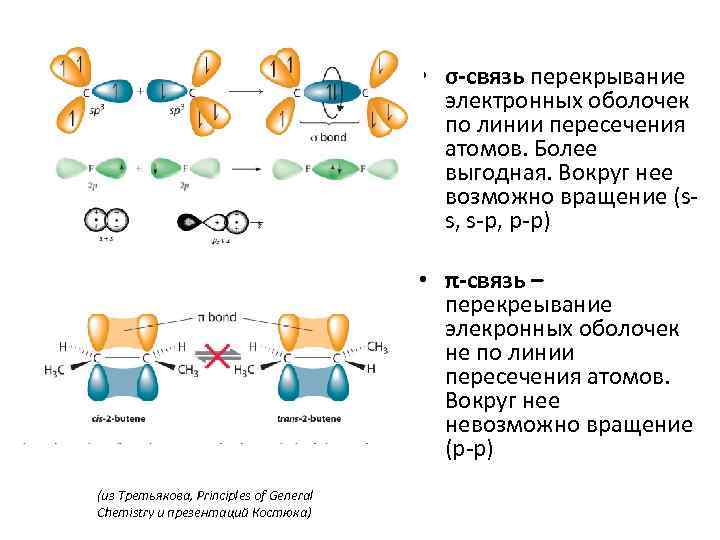
• σ-связь перекрывание электронных оболочек по линии пересечения атомов. Более выгодная. Вокруг нее возможно вращение (ss, s-p, p-p) • π-связь – перекреывание элекронных оболочек не по линии пересечения атомов. Вокруг нее невозможно вращение (p-p) (из Третьякова, Principles of General Chemistry и презентаций Костюка)
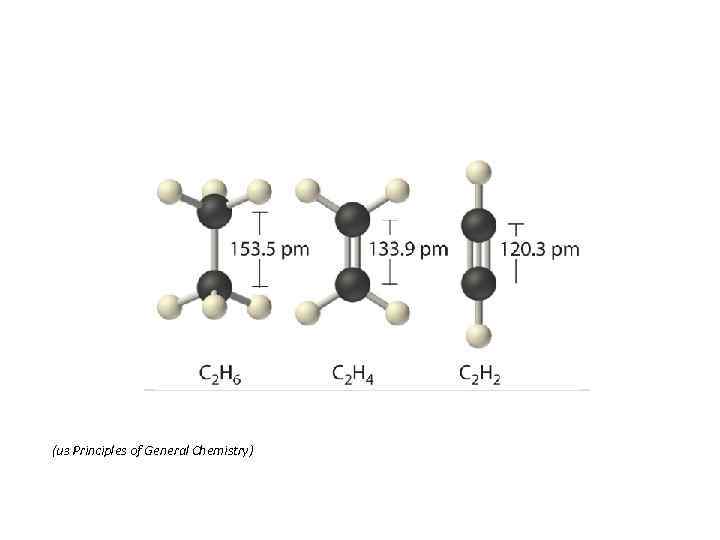
(из Principles of General Chemistry)
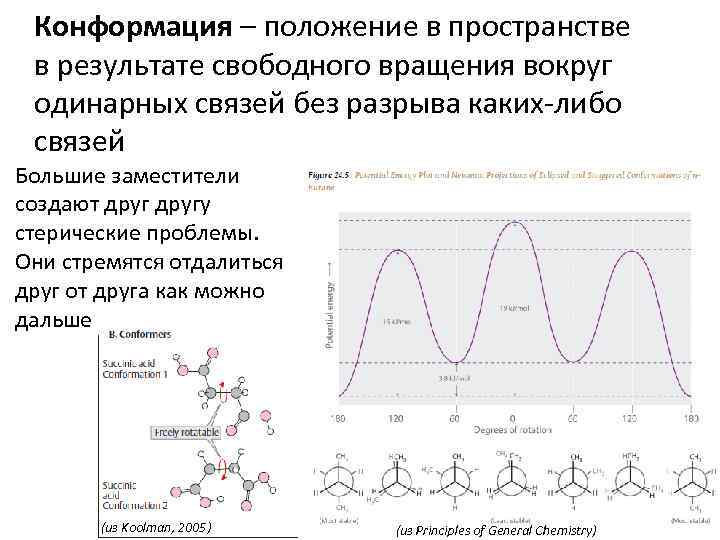
Конформация – положение в пространстве в результате свободного вращения вокруг одинарных связей без разрыва каких-либо связей Большие заместители создают другу стерические проблемы. Они стремятся отдалиться друг от друга как можно дальше (из Koolman, 2005) (из Principles of General Chemistry)
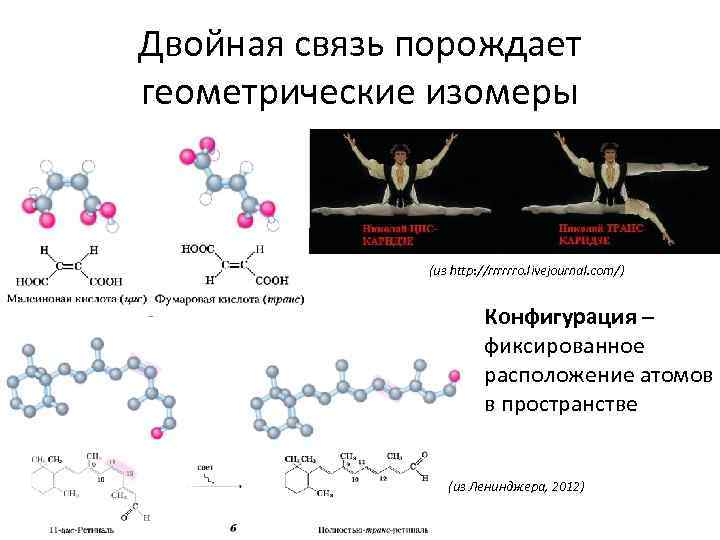
Двойная связь порождает геометрические изомеры (из http: //rrrrrro. livejournal. com/) Конфигурация – фиксированное расположение атомов в пространстве (из Ленинджера, 2012)
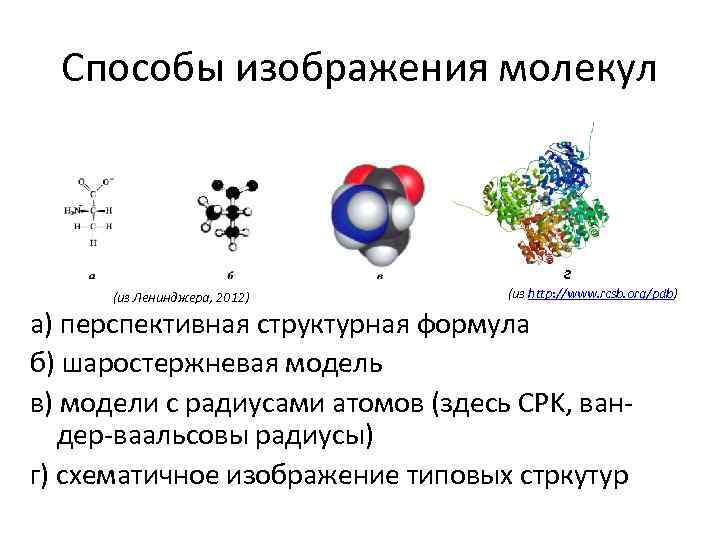
Способы изображения молекул г (из Ленинджера, 2012) (из http: //www. rcsb. org/pdb) а) перспективная структурная формула б) шаростержневая модель в) модели с радиусами атомов (здесь CPK, вандер-ваальсовы радиусы) г) схематичное изображение типовых стркутур
(из Ленинджера, 2012)
М

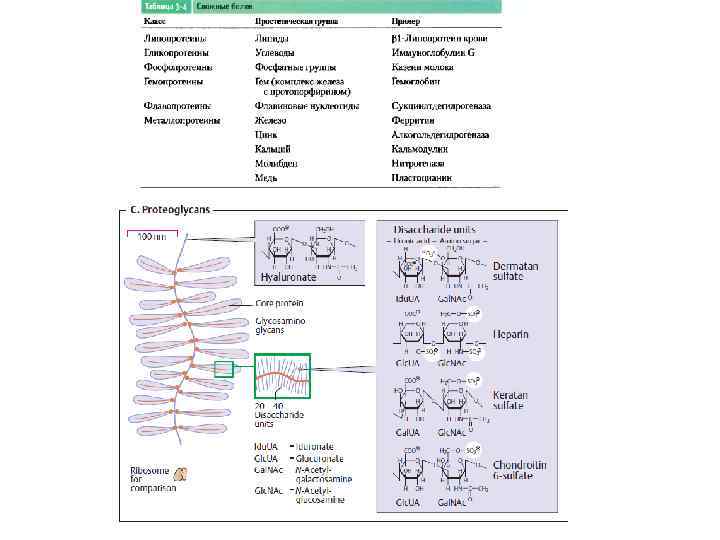
Разнообразие биологических молекул • белки • липиды • углеводы • нуклеиновые кислоты … • витамины • разные низкомолекулярные соединения
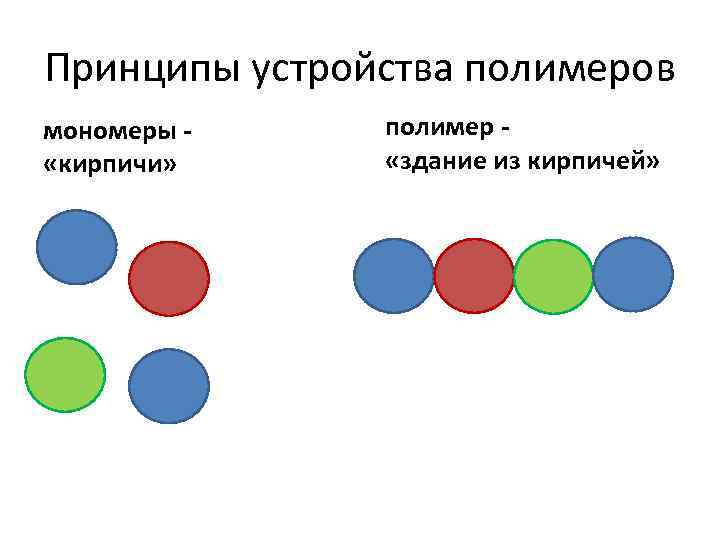
Принципы устройства полимеров мономеры «кирпичи» полимер «здание из кирпичей»

Электростатические (ван-дер-ваальсовы) взаимодействия – взаимодействие диполей (из Третьякова, 2004) а) диполь-дипольное: между двумя постоянным диполями, E ~ 1/r 3 б) индукционное: между полярной и неполярной молекулой, которая поляризуется под действием первой , E ~ 1/r 6 в) дисперсионное (лондоновские силы): взаимодействие между мгновенными диполями в результате случайных флуктуаций электронной плотности между в неполярной молекуле , E ~ 1/r 6
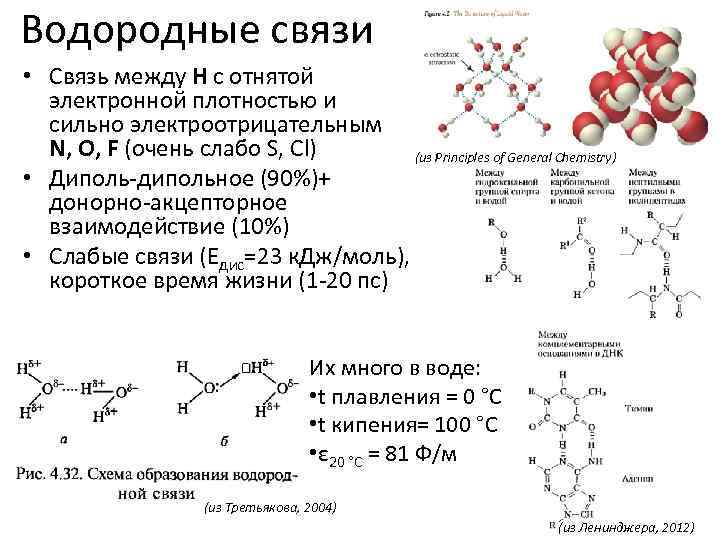
Водородные связи • Связь между H с отнятой электронной плотностью и сильно электроотрицательным N, O, F (очень слабо S, Cl) (из Principles of General Chemistry) • Диполь-дипольное (90%)+ донорно-акцепторное взаимодействие (10%) • Слабые связи (Едис=23 к. Дж/моль), короткое время жизни (1 -20 пс) Их много в воде: • t плавления = 0 °C • t кипения= 100 °C • ε 20 °C = 81 Ф/м (из Третьякова, 2004) (из Ленинджера, 2012)
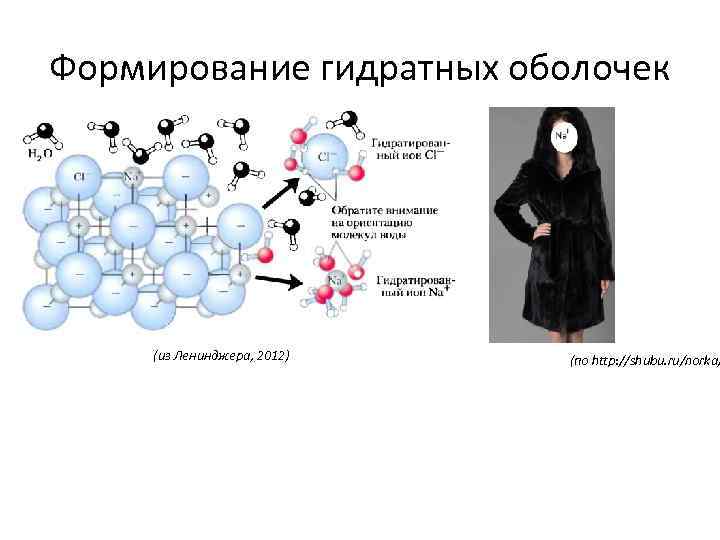
Формирование гидратных оболочек (из Ленинджера, 2012) (по http: //shubu. ru/norka/
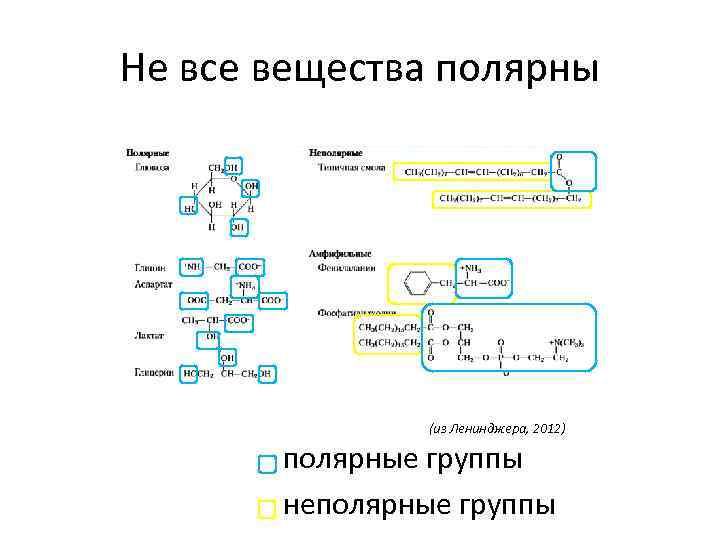
Не все вещества полярны (из Ленинджера, 2012) полярные группы неполярные группы
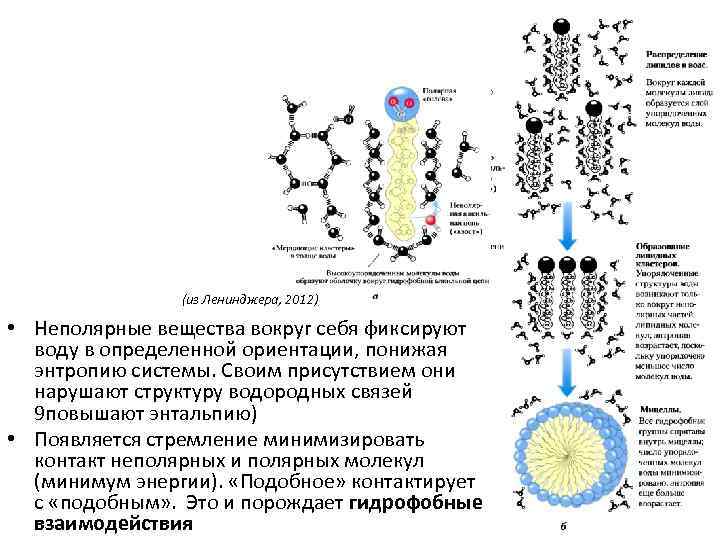
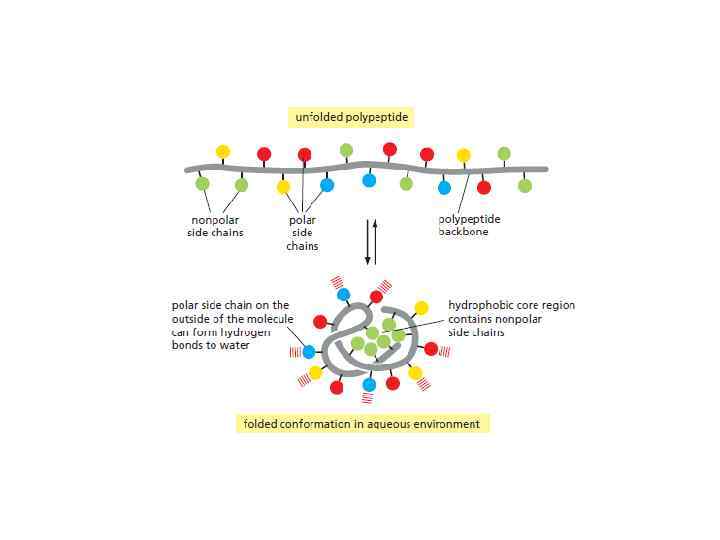
(из Ленинджера, 2012) • Неполярные вещества вокруг себя фиксируют воду в определенной ориентации, понижая энтропию системы. Своим присутствием они нарушают структуру водородных связей 9 повышают энтальпию) • Появляется стремление минимизировать контакт неполярных и полярных молекул (минимум энергии). «Подобное» контактирует с «подобным» . Это и порождает гидрофобные взаимодействия
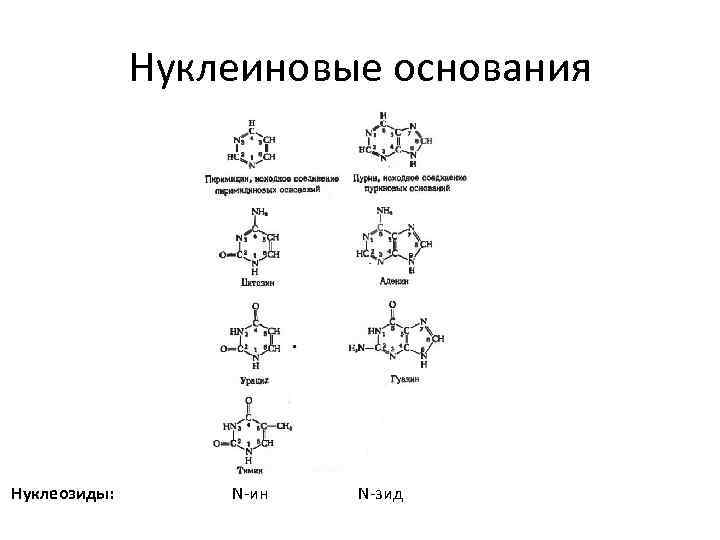
Нуклеиновые основания Нуклеозиды: N-ин N-зид
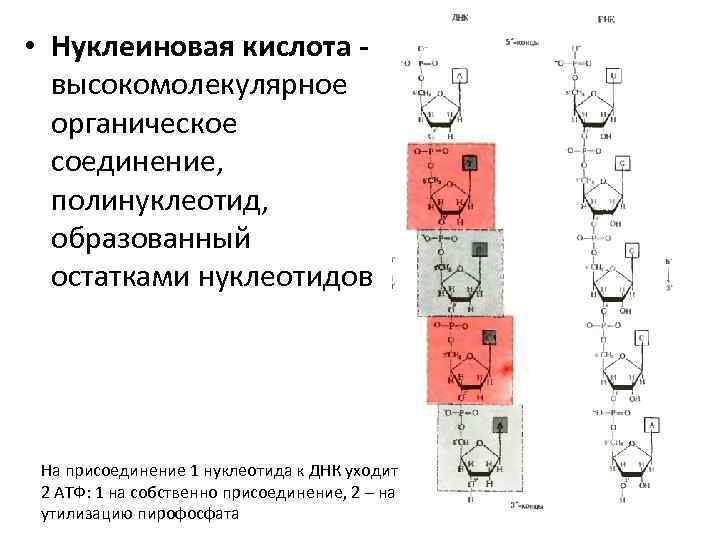
• Нуклеиновая кислота высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов На присоединение 1 нуклеотида к ДНК уходит 2 АТФ: 1 на собственно присоединение, 2 – на утилизацию пирофосфата
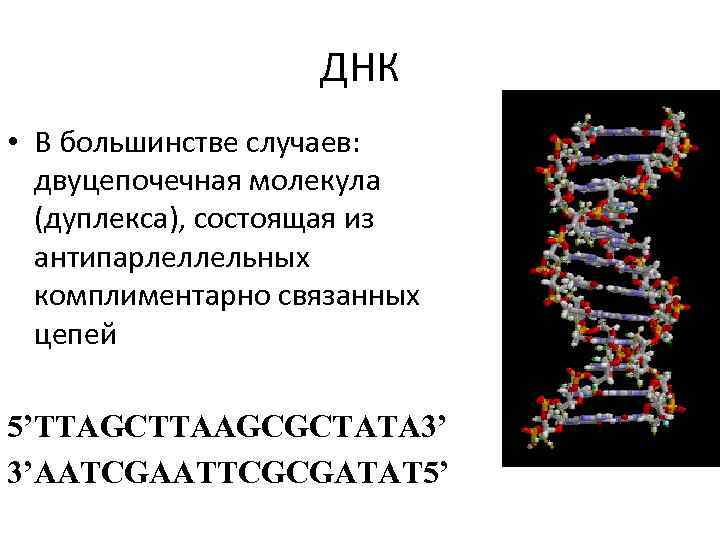
ДНК • В большинстве случаев: двуцепочечная молекула (дуплекса), состоящая из антипарлеллельных комплиментарно связанных цепей 5’TTAGCTTAAGCGCTATA 3’ 3’AATCGAATTCGCGATAT 5’
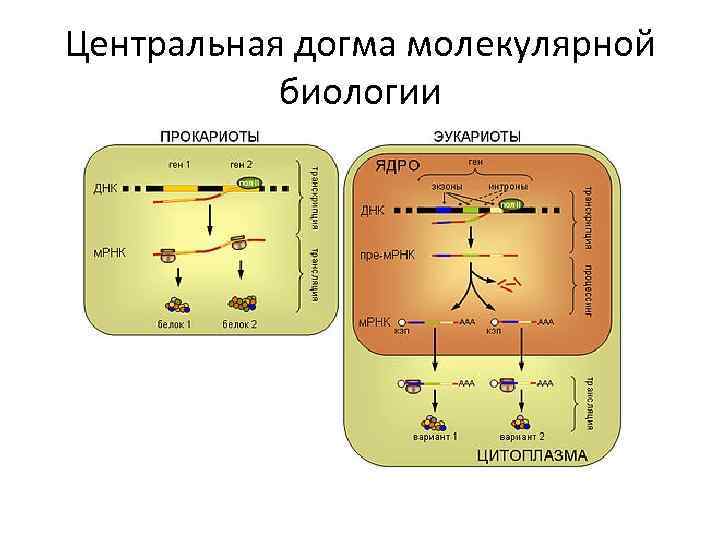
Центральная догма молекулярной биологии
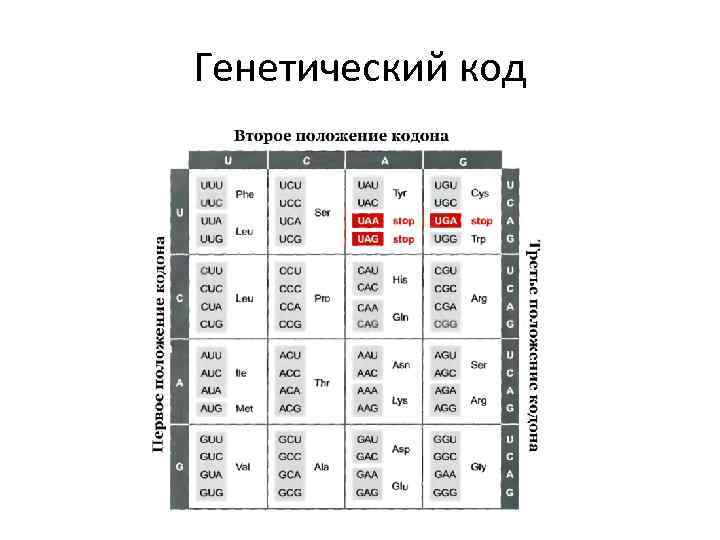
Генетический код
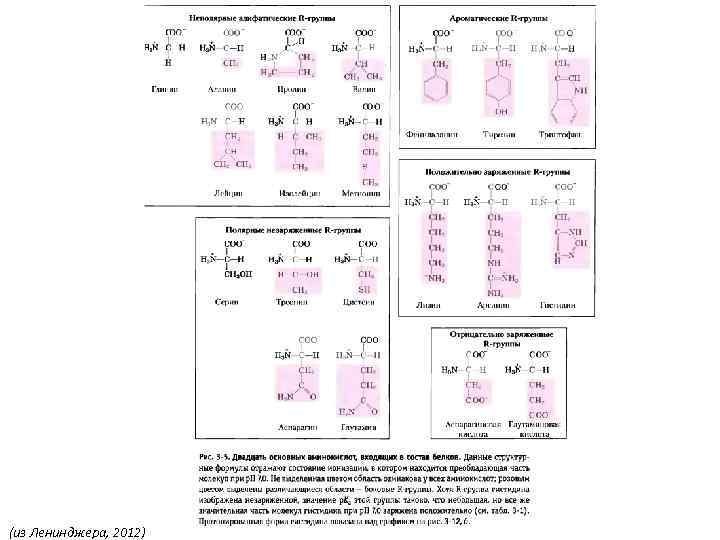
(из Ленинджера, 2012)
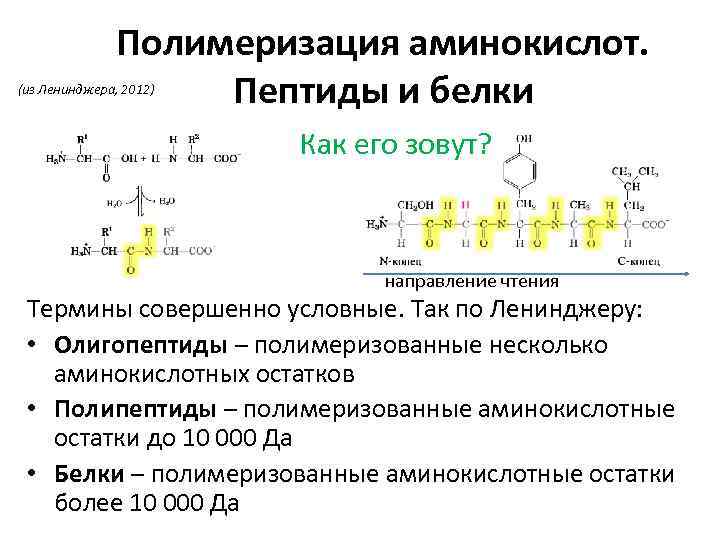
Полимеризация аминокислот. Пептиды и белки (из Ленинджера, 2012) Как его зовут? направление чтения Термины совершенно условные. Так по Ленинджеру: • Олигопептиды – полимеризованные несколько аминокислотных остатков • Полипептиды – полимеризованные аминокислотные остатки до 10 000 Да • Белки – полимеризованные аминокислотные остатки более 10 000 Да
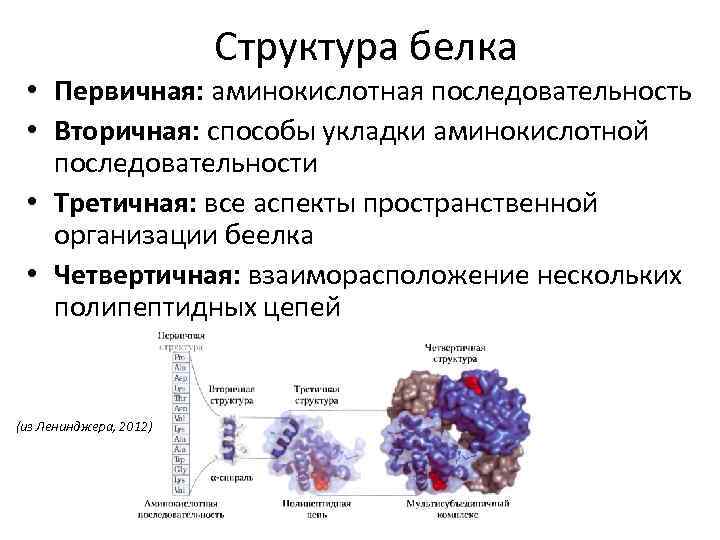
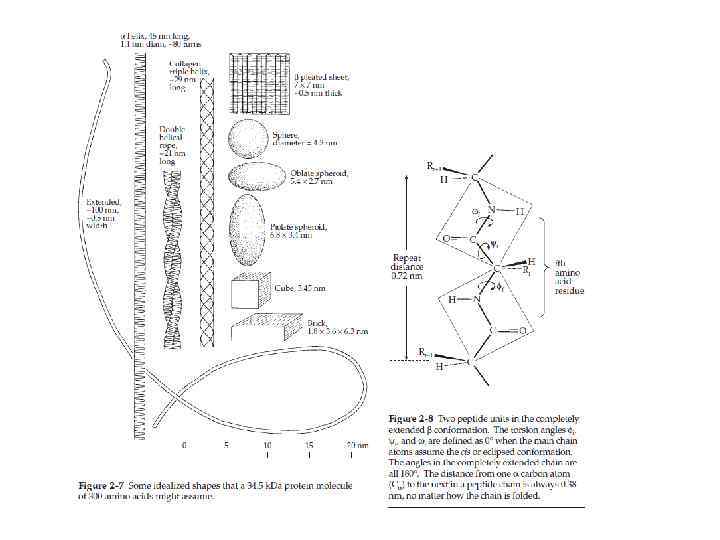
Структура белка • Первичная: аминокислотная последовательность • Вторичная: способы укладки аминокислотной последовательности • Третичная: все аспекты пространственной организации беелка • Четвертичная: взаиморасположение нескольких полипептидных цепей (из Ленинджера, 2012)
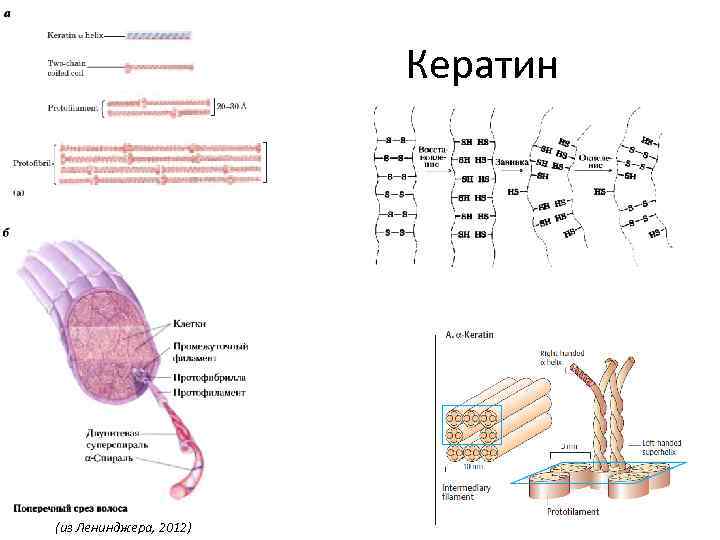
Кератин (из Ленинджера, 2012)
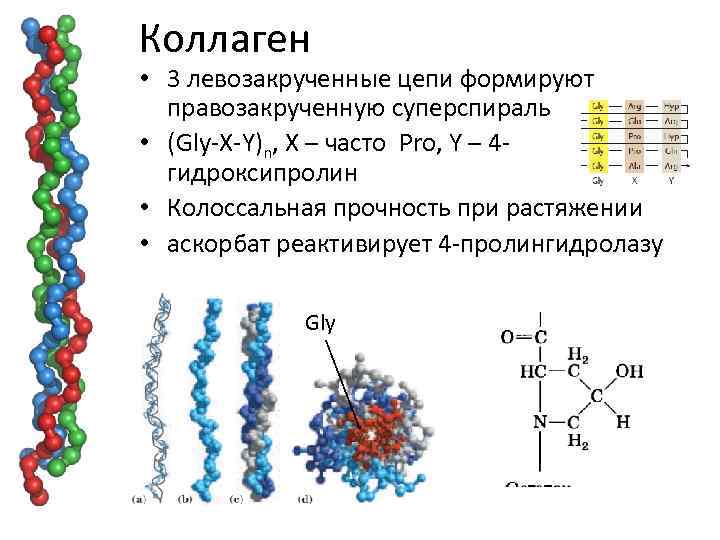
Коллаген • 3 левозакрученные цепи формируют правозакрученную суперспираль • (Gly-X-Y)n, X – часто Pro, Y – 4 гидроксипролин • Колоссальная прочность при растяжении • аскорбат реактивирует 4 -пролингидролазу Gly
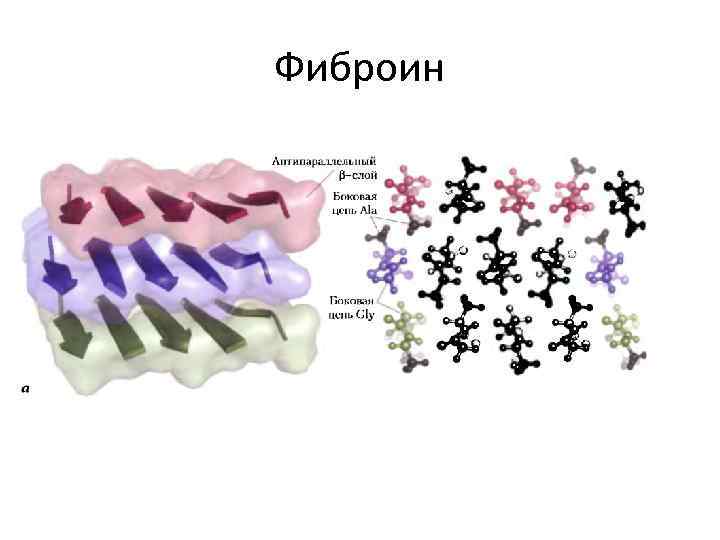
Фиброин
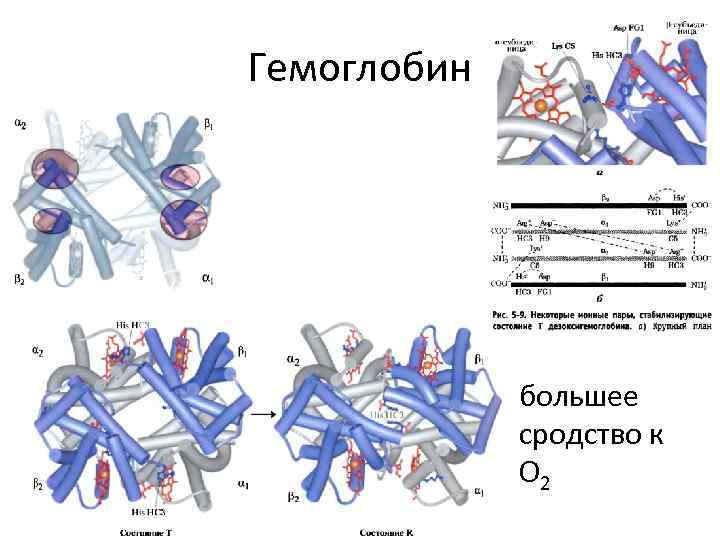
Гемоглобин • большее сродство к O 2
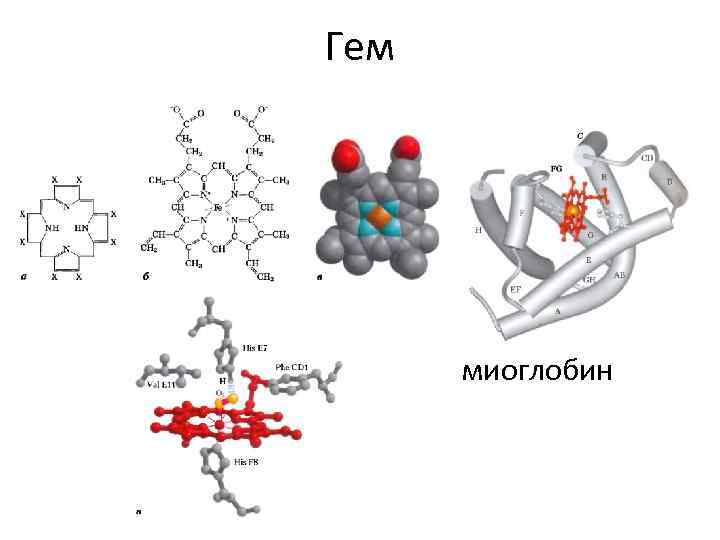
Гем миоглобин
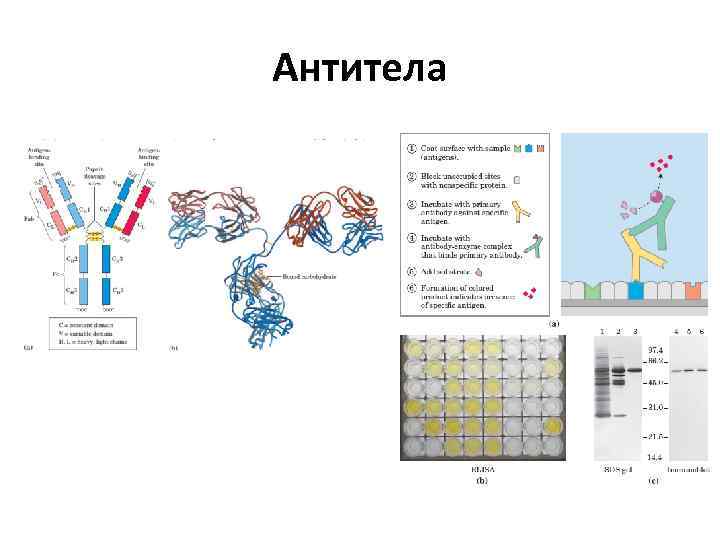
Антитела

Миозин
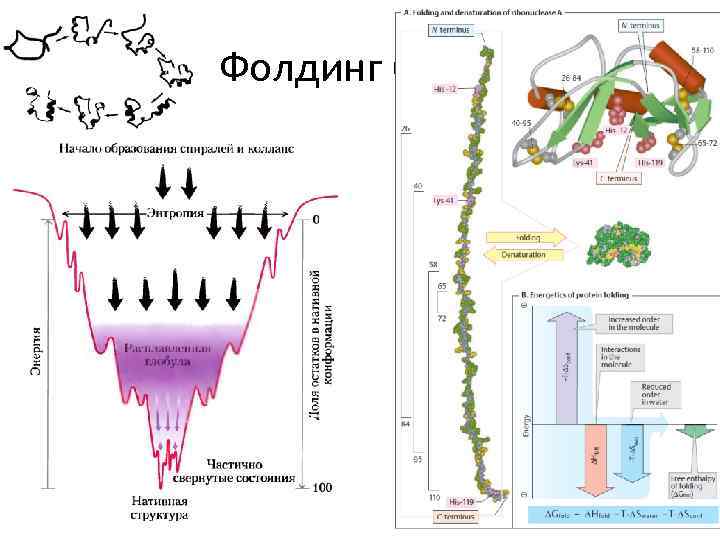
Фолдинг белка
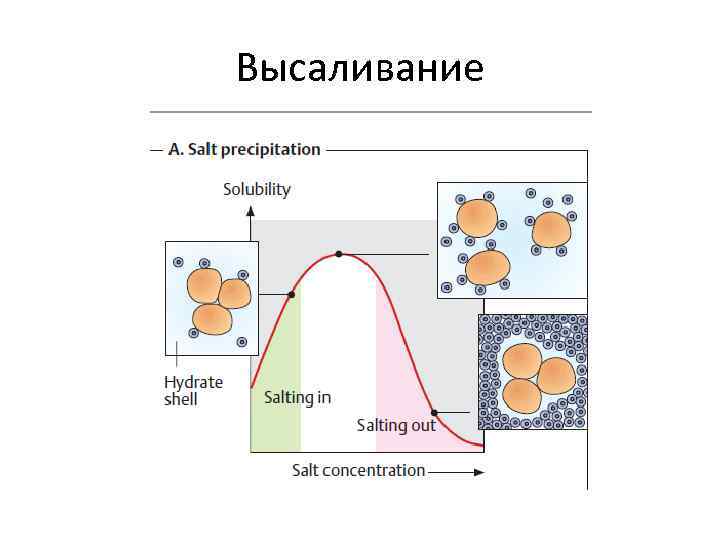
Высаливание
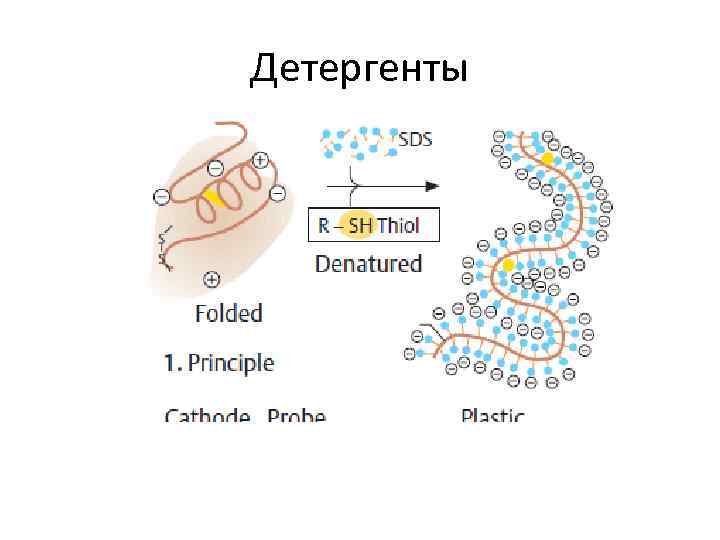
Детергенты

Л
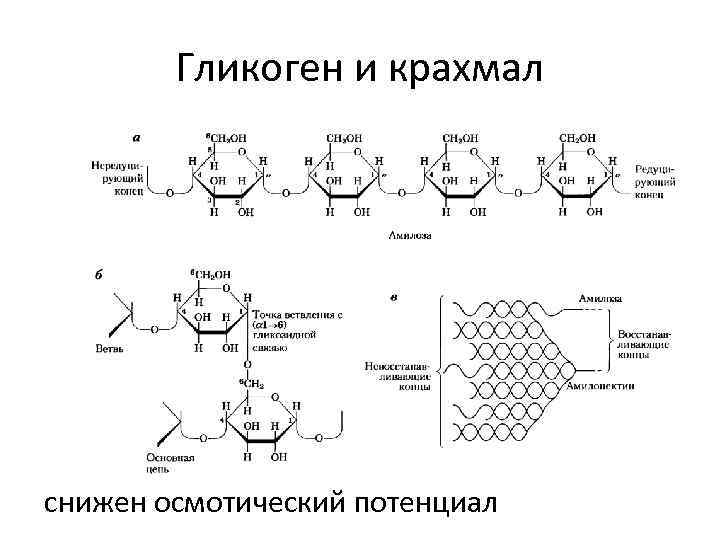
Гликоген и крахмал снижен осмотический потенциал
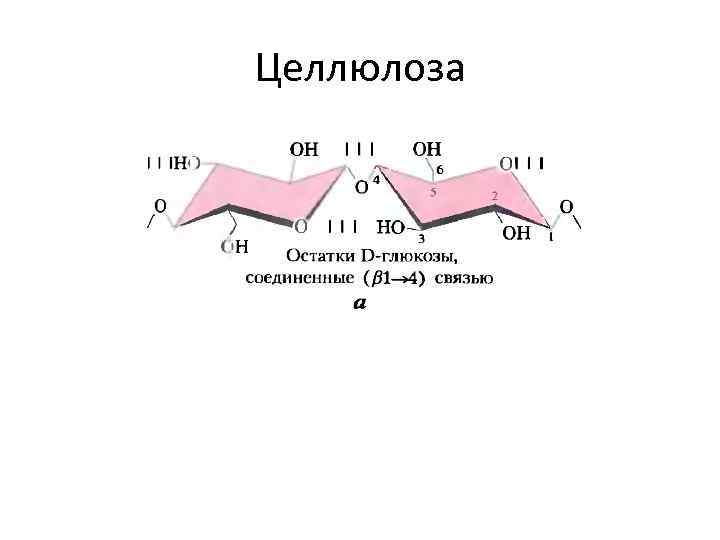
Целлюлоза
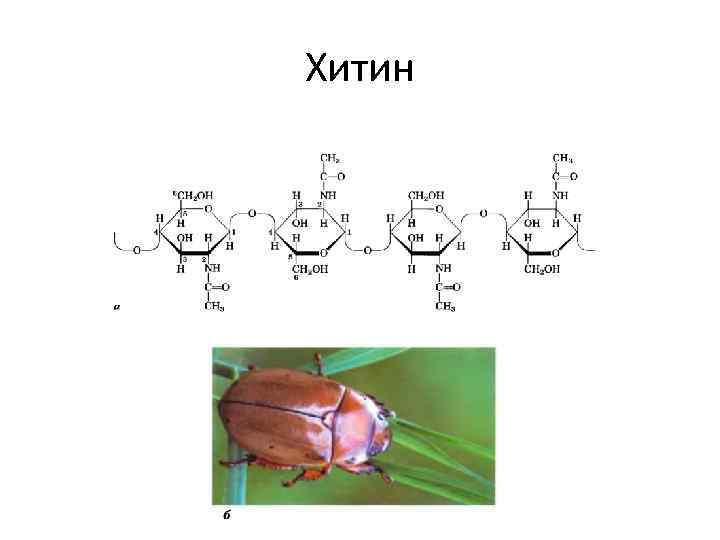
Хитин
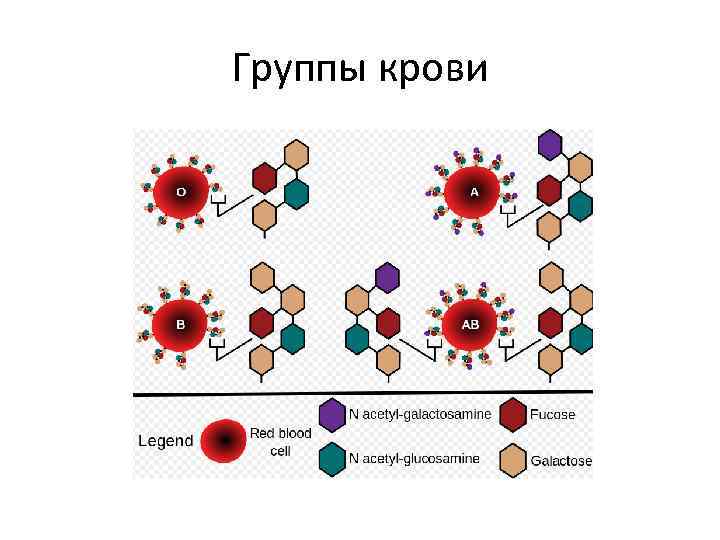
Группы крови
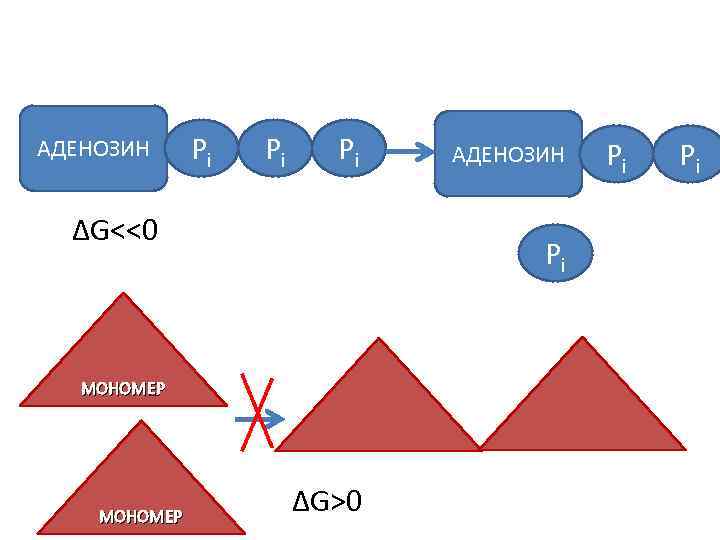
АДЕНОЗИН Pi Pi Pi ΔG<<0 Pi МОНОМЕР АДЕНОЗИН ΔG>0 Pi Pi
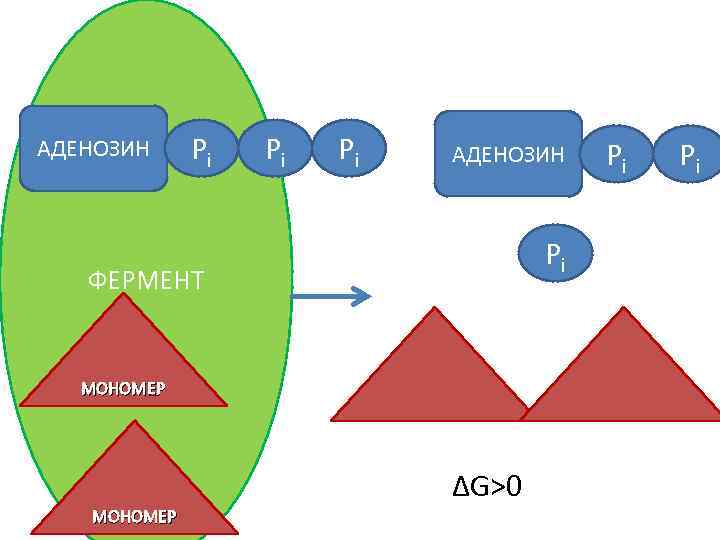
АДЕНОЗИН Pi Pi Pi АДЕНОЗИН Pi ФЕРМЕНТ МОНОМЕР ΔG>0 МОНОМЕР Pi Pi
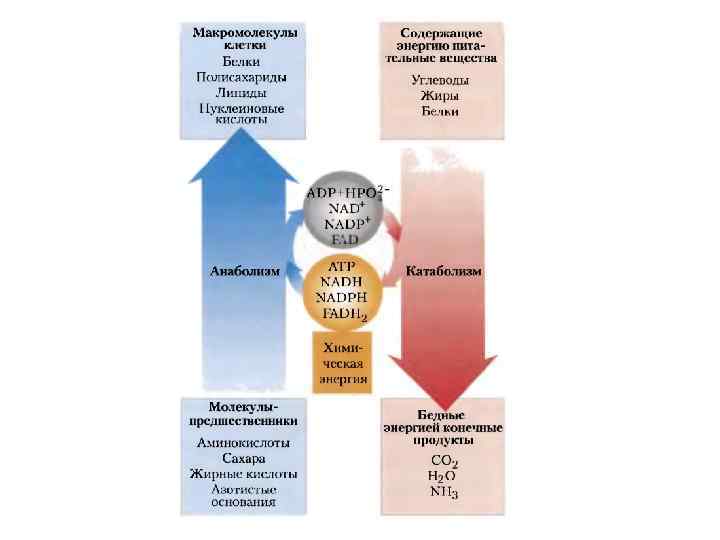

Откуда взять энергию?
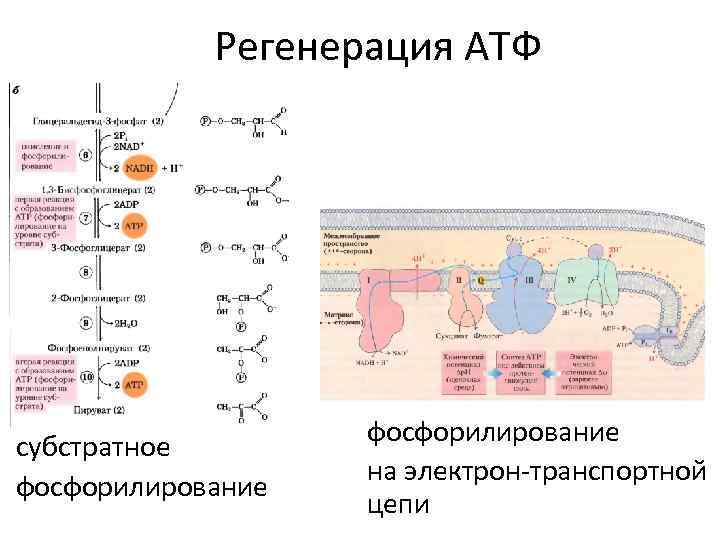
Регенерация АТФ субстратное фосфорилирование на электрон-транспортной цепи

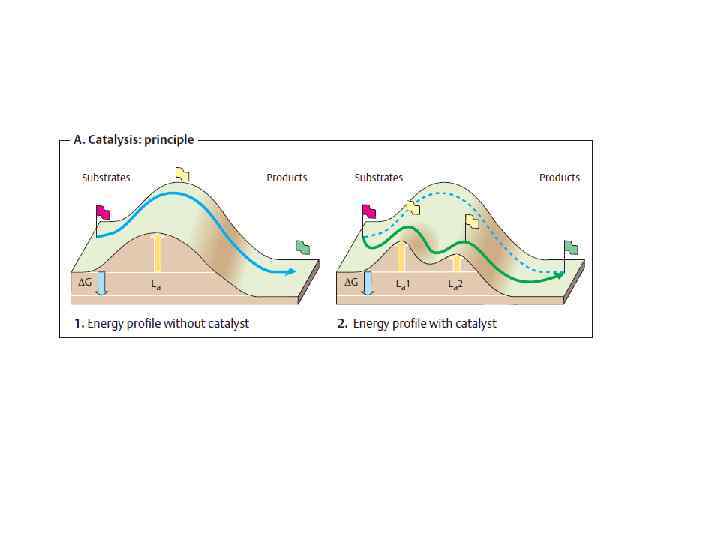
• Катализатор – вещество, ускоряющее протекание химической реакции. Катализатор не смещает химическое равновесие. • Ферменты – белки или РНК, являющиеся катализаторами Являются очень эффективными и специфичными катализаторами
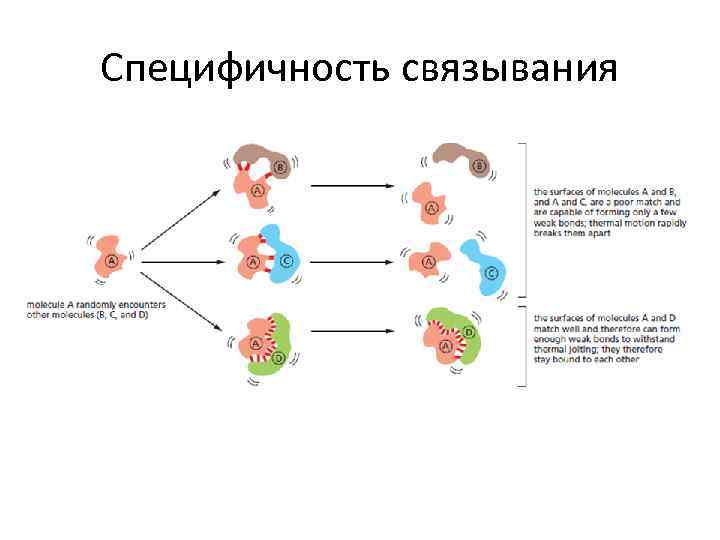
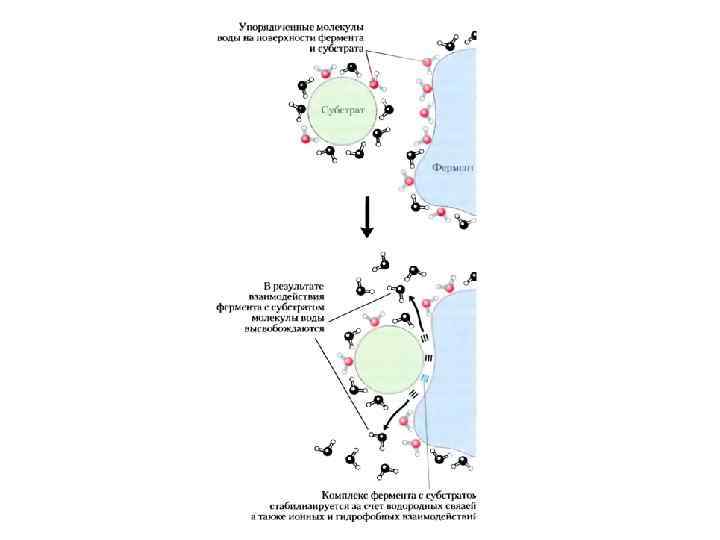
Специфичность связывания
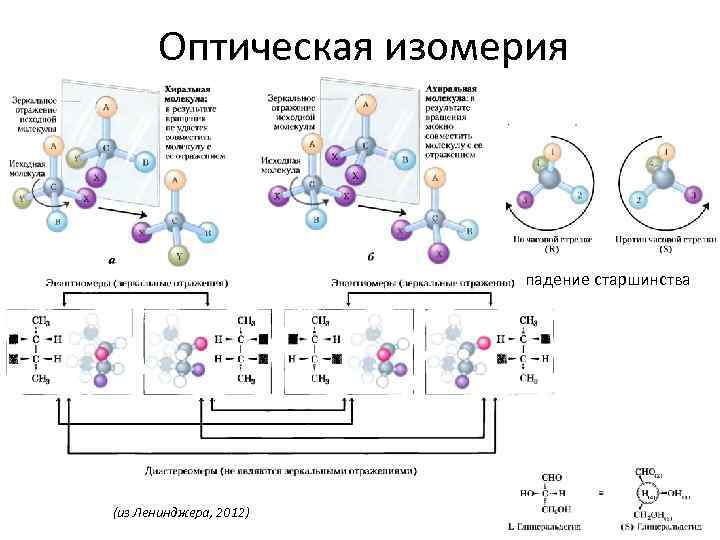
Оптическая изомерия падение старшинства (из Ленинджера, 2012)
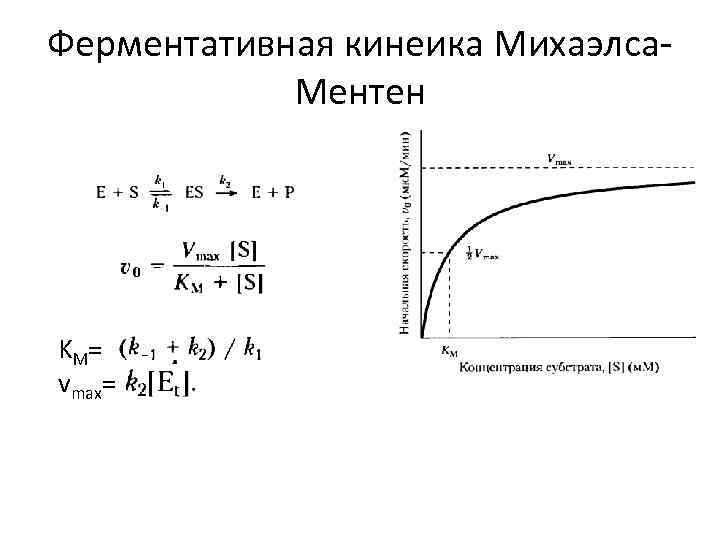
Ферментативная кинеика Михаэлса. Ментен KM= vmax=
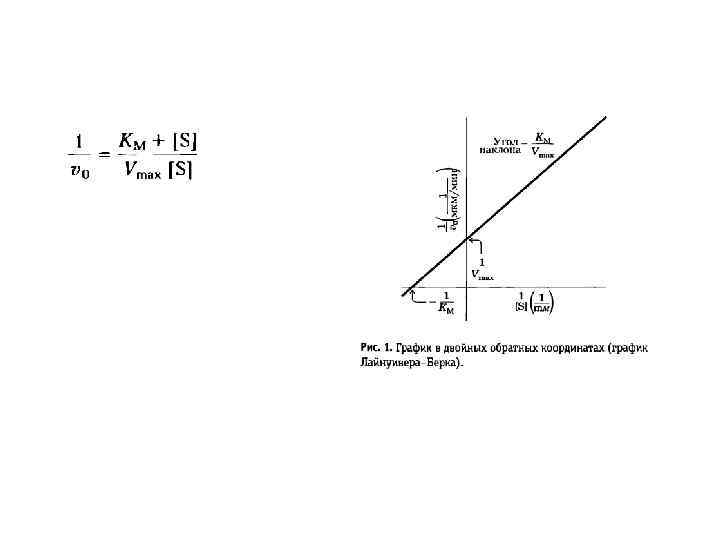

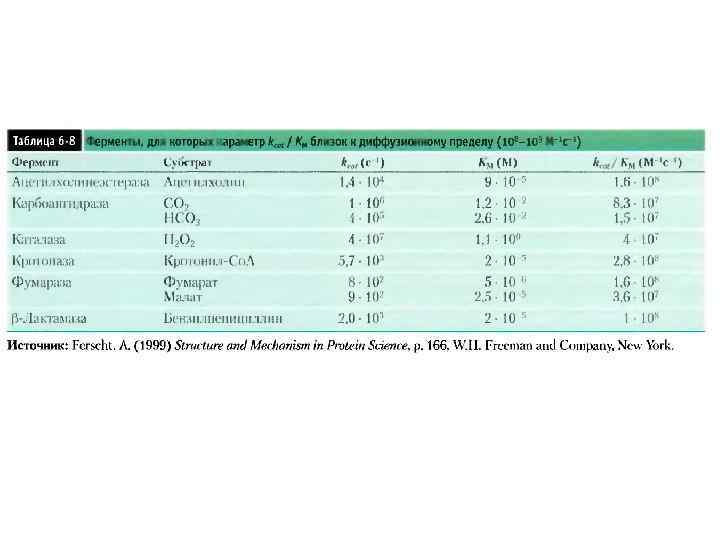
Неидеальный случай kcat – число оборотов Оценка специфичности фермента: коэффициент специфичности:

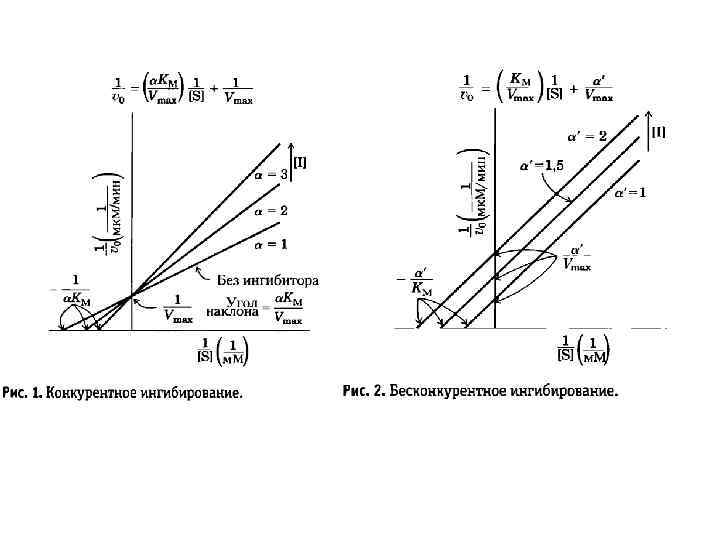
Ингибирование
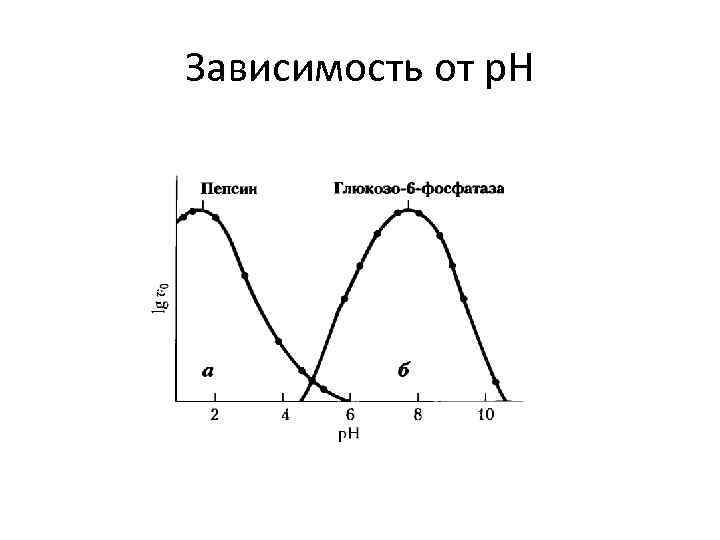
Зависимость от p. H






Используемая литература: • Koolman J. Color atlas of biochemistry. – Koolman J. , Klaus-Heinrich Roehm 2 d edition, Stuttgart : Thieme, 2005. • Principles of General Chemistry v. 1. 0 [Электронный ресурс] / URL: http: //2012 books. lardbucket. org/books/principles-of-general-chemistryv 1. 0/ (дата обращения 28. 01. 2016) • Лекции Костюка А. по биохимии на Биологическом отделении в ЛМШ 2016 11 классу • Лекции Кузьменко Н. Е. по физической химии на 2 курсе биохимического потока Биологического факультета МГУ имени М. В. Ломоносова в 20152016 годах • Ленинджер. Нельсон Д. Основы биохимии Ленинджера: в 3 т. Т. 1/ Д. Нельсон, М. Кокс; пер. с англ. – М. : БИНОМ. Лаборатория знаний, 2012 – 694 с. • Реутов О. А, Курц А. Л. , Бутин К. П Органическая химия. / Учебник в 4 ч. 1999 -2336 с • Третьяков Ю. Д. Неорганическая химия: в 3 т. /Под ред. Ю. Д. Третьякова. Т. 1: Физико-химические основы неорганической химии: Учебник для студ. высш. уеб. заведений/ М. Е. Тамм Ю. Д. Третьяков; – М. : Издательский центр «Академия» , 2004 – 240 с. • https: //ru. wikipedia. org/
7кл_Молекулы в биологии.pptx