физика-8-9-лекция.ppt
- Количество слайдов: 24

МОЛЕКУЛАЛЫҚ ФИЗИКА Молекулалық физика заттың физикалық қасиеттерін затты құрайтын ішкі элементтерінің қозғалысымен байланыстыра зерттейтін физиканың бөлімі. Зат мөлшері (моль сыны) сол заттың структуралық элементтерінің санымен сипатталады. Грамм-молекуланы көбінесе моль деп атайды. Грамм-молекула деп сол элементтің граммен алынған массасын айтады. Кез келген заттың грамм-молекуласындағы молекулалар саны бірдей болады және ол Авогадро санына тең болады. NA=6. 023× 1023. Идеал газ деп материялық нүктелік бөлшектерден тұратын, өзара алыстан әсерлеспейтін қасиеттерге ие газдарды айтады. Статикалық физика деп макроскопиялық денелердің қасиеттерін зерттейтін физиканың бөлімін атайды, яғни өте көп бөлшектерден (молекулалардан, атомдардан, т. б. ) тұратын жүйелерді зерттейтін бөлім. 1

ИДЕАЛ ГАЗ КҮЙІНІҢ ТЕҢДЕУІ Бойль-Мариотт заңы. T=Const. Изотермдік процесс. Гей-Люссак заң. Изобарлық процесс. P=const. Шарль заңы. Изохорлық процесс. V=const. Клапейрон теңдеуі. Клапейрон-Менделеев өрнегі. – Моль саны. R – универсал газ тұрақтысы R=8. 31 Дж/моль. К 2

Больцман тұрақтысы. – молекулалар концентрациясы (көлем бірлігіндегі саны). Лошмидт саны – қалыпты жағдайдағы газдың 1 м 3 көлеміндегі молекулалар саны. 3

МОЛЕКУЛА - КИНЕТИКАЛЫҚ ТЕОРИЯ Газ молекулаларының тік бұрышты куб формалы ыдыстың бір қабырғасымен соқтығысу саны Z барлық соқтығысулардың 1/6 тең. n – молекулалар концентрациясы. Ыдыстың бір қабырғасына түсетін газ молекулаларының қысымы : 4
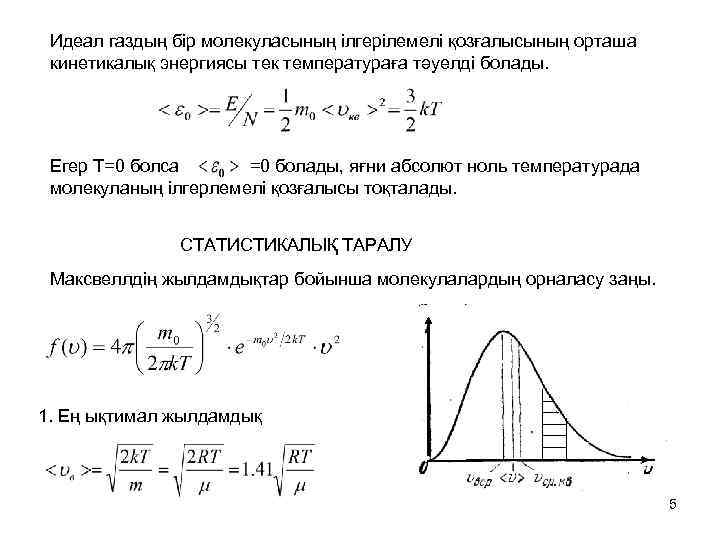
Идеал газдың бір молекуласының ілгерілемелі қозғалысының орташа кинетикалық энергиясы тек температураға тәуелді болады. Егер Т=0 болса =0 болады, яғни абсолют ноль температурада молекуланың ілгерлемелі қозғалысы тоқталады. СТАТИСТИКАЛЫҚ ТАРАЛУ Максвеллдің жылдамдықтар бойынша молекулалардың орналасу заңы. 1. Ең ықтимал жылдамдық 5

Молекулалардың жылдамдықтар бойынша орналасуын зерттеген кезде ең ықтимал жылдамдықты қолданылады. 2. Орташа арифметикалық жылдамдық молекуланың орташа еркін жүру жолының ұзындығын есептеген кезде қолданылады. 3. Орташа квадраттық жылдамдық Молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясын есептеу кезінде орташа квадраттық жылдамдық қолданылады. Орташа квадраттық жылдамдықтың шамасы ең үлкен, одан кейінгісі орташа арифметикалық жылдамдық, ең ықтимал жылдамдықтың шамасы ең кіші болады. 6
![Барометрлік өрнек p=poe-μgh/(RT) [m] n=n 0 e-mgh/(k. T) Молекулалардың потенциялық энергиясы mgh қай жерде Барометрлік өрнек p=poe-μgh/(RT) [m] n=n 0 e-mgh/(k. T) Молекулалардың потенциялық энергиясы mgh қай жерде](https://present5.com/presentation/324596534_426424726/image-7.jpg)
Барометрлік өрнек p=poe-μgh/(RT) [m] n=n 0 e-mgh/(k. T) Молекулалардың потенциялық энергиясы mgh қай жерде аз болса, сол жерде газ тығыздығы көп болады. [к. Па] 0 1 1013. 3 1000 0. 8869 898. 7 2000 0. 7845 794. 9 3000 Больцман таралуы [atm] 0. 6918 701 4000 0. 6082 616. 3 6000 0. 4655 471. 7 8000 0. 3512 355. 9 7

Молекулалардың еркін жүру жолының ұзындығы n-молекулалардың концентрациясы; d-молекулалардың диаметрі. Газдардағы диффузия Әр түрлі қоспадан тұратын газдардың жеке молекулаларының өздігінен бірінің араларына бірінің енуі нәтижесінде қоспадағы әртүрлі газдардың концентрацияларының бірдей болу құбылысын диффузия деп атайды. Масса ағынының тығыздығы Диффузия коэффициенті D М- газдың молярлық массасы. 8

ТЕРМОДИНАМИКА НЕГІЗДЕРІ Термодинамика макраскопиялық денелердің жылулық қасиеттерін зерттейді. Термодинамиканың бірінші бастамасы: d. Q = d. U + d. A Жүйеге берілген барлық жылу, оның ішкі энергиясын d. U арттыруға және оның сырттқы күштерге қарсы істелген d. A жұмысына кетеді. мұндағы d. Q жүйеге берілген жылу, d. U -ішкі энергияның өзгерісі, d. A - жұмыс. Жүйенің ішкі энергиясы жүйені құрайтын барлық микробөлшектердің кинетикалық энергиялары мен потенциалды энергияларының қосындысына тең. Ішкі энергия күйдің функциясы, әрбір күйге ішкі энергияның анықталған бір ғана мәні сәйкес келеді. Дөңгелек прцесс кезінде ішкі энергия өзгерісі нольге тең болады. 9

Жұмыс процесстің функциясы. Газ күйінің 1 - нен 2 - күйге өткенде орындалған жұмыс V 1 1 а 2 V 2 - фигураның ауданы арқылы анықталған, Газдың цикл кезінде жасайтын жұмысы қисық ауданымен шектелген аудан арқылы анықталады. Егер циклда оң жұмыс жасалса (цикл сағат тілі бағытымен 1 a 2 өтсе), онда ол тура цикл деп аталады, ал циклда теріс жұмыс (сағат тіліне қарама-қарсы бағытта 2 b 1) жасалса, онда ол кері цикл деп аталады. Дөңгелектік процесс кезінде жүйенің істейтін жұмысы нөлге тең болмайды. Жылу - энергияның берілуінің микроскопиялық түрі, ол жұмыс сияқты тек жылу алмасу процесінде пайда болады. Мысалы, әртүрлі күйлерде тұрған екі денені тиістірсек, онда өзара әсерлесуші денелердің ішкі энергиясы өзгереді. 10

ГАЗДЫҢ ЖЫЛУ СИЫМДЫЛЫҒЫ Дененің меншікті жылу сиымдылығы деп, массасы 1 кг денені температурасын 1 К температураға көтеру үшін қажетті жылу мөлшерін айтады. Меншікті жылу сиымдылықтың өлшем бірлігі (Дж/кг∙К). Дененің молярлық жылу сиымдылығы деп 1 моль дененің температурасын 1 К температураға көтеруге қажетті жылу мөлшерін айтады. мұндағы - моль саны. Дененің меншікті жылу сиымдылығы с мен молярлық жылу сиымдылығы сμ арасындағы байланыс: 11

Газдардың жылу сиымдылығы қыздыру жағдайына тәуелді болады. Қыздыру тұрақты көлемде жүргізілетін болса, онда газдардың жылу сиымдылығы – с V деп белгіленеді. Егер газды тұрақты қысымда қыздыратын болсақ оның жылу сиымдылығы – с. Р деп белгіленеді. Олар сан жағынан тең болмайды. а) Қыздыру процессі изохорлық болса V=const болады, олай болса d. V=0 болады. Жұмыс d. А=P∙d. V=0 болады. Газдың алған барлық жылуы оның ішкі энергиясын арттыруға кетеді. d. Q=d. U. Газдың бір молі үшін немесе 12

б) Изобарлық процесс кезіндегі газдың жылу сиымдылығы. CP =CV + R Бұл өрнек Майер теңдеуі деп аталады. Бұдан CP >CV Тұрақты қысымдағы жылу сиымдылықтың тұрақты көлемдегі жылу сиымдылыққа қатынасы: 13

Термодинамиканың бірінші бастамасының изопроцестерге қолдану Изопроцестер деп, термодинамикалық параметрлердің ішінен біреуі тұрақты болып, қалған екеуі арaсындағы тәуелсіздікті анықтайтын процестерге айтылады. 1. Изохорлық процесс: бұл процесс кезінде көлем тұрақты V=const, демек d. V=0 болады да, жұмыс болады. Бұл процесс үшін термодинамиканың бірінші бастамасы 2. Изобарлық процесс: процесс қысым тұрақты болған кезде өтеді p=const және d. P=0 болады. Бұл кезде орындалатын жұмыс: eгер △T=1 К және бір моль болса, онда A=R болады. 14

Соңғы өрнек, R газ тұрақтысының физикалық мағынасын тағайындауға мүмкіндік береді. Демек, R тұрақтысы деп, 1 моль идеал газды 1 К температураға қыздырған кездегі орындалатын изобарлық ұлғаю жұмысына тең шаманы айтады. Изобаралық процесс үшін термодинамиканың бірінші бастамасының жазылуы 3. Изотермдік процесс: температура тұрақты болған кезде өтетін процесс. T=const кезінде ішкі энергия U=const, яғни ішкі энргияның өзгерісі (d. U=0) болмайды. Бұл процесс үшін термодинамиканың бірінші бастамасының жазылуы 15

Изотермдік процесс кезінде газға берілген барлық жылу мөлшері тек сыртқы күштерге қарсы істелген жұмысқа жұмсалады, Изотермалық процесс кезінде температура кемімеу үшін жүйеге сыртқы жұмысқа эквивалентті жылу мөлшерін беру қажет. Шын мәнінде, бұл жүйе жылулық энергияны механикалық энергияға айналдыруды іске асырады. МОЛЕКУЛАЛАРДЫҢ ЕРКІНДІК ДӘРЕЖЕЛЕР САНЫ Бір атомды газдың молекулаларында үш еркіндік дәрежесі бар i =3. Екі атомды газдың жалпы еркіндік дәреже саны i =5. Үш атомды және көп атомды газдың молекуласы алты еркіндік дәреже санына ие болады i =6. 16

Әрбір еркіндік дәрежеге ілгерілемелі қозғалыстың 1/3 энергиясы сәйкес келеді, яғни ИДЕАЛ ГАЗДЫҢ ІШКІ ЭНЕРГИЯСЫ Идеал газдар молекулаларының арасында өзара ісерлесу болмайды. Сондықтан, өзара потенциалдық энергиялары нольге тең болады. Идеал газдардың ішкі энергиясы жеке молекулалардың кинетикалық энергиялардың қорытындысынан тұрады. Бір моль идеал газдың ішкі энергиясы : Кез келген мөлшердегі массасы m - идеал газдың ішкі энергиясы 17

АДИАБАТТЫҚ ПРОЦЕСС Адиабаталық процесс деп қарастырылатын жүйемен қоршаған орталар араларында ешқандай жылу алмасуы болмайтын процессті айтады, яғни d. Q=0 болатын процессті айтады. Термодинамиканың бірінші бастамасы адиабаталық процесс үшін былай жазылады: d. A = - d. U. Бір моль газды қарастырып және ондағы қысым орнына оның мәнін қойсақ 18

Тұрақты шама адиабаттық көрсеткіш деп аталады, немесе Пуассон коэффициенті деп те аталады. Бір атомды газ молекуласы үшін і =3 және γ= 1, 67. Екі атомды газ үшін і =5 және γ= 1, 4. Көп атомды газ молекуласы үшін і =6 және γ= 1, 33. Бұл сурет адиабаттық процессінің изотермалары изотермдік процесстің изотермаларына қарағанда әлде қайда тік орналасуын көрсетеді. Газдардың адиабаттық процессі кезінде орындалатын жұмысы: Массасы кез келген (m) мөлшердегі газ үшін немесе көлем өзгерісі арқылы 19

ТЕРМОДИНАМИКАНЫҢ ЕКІНШІ БАСТАМАСЫ Жүйені сипаттайтын параметрлер (P, V, T) сыртқы себептердің ықпалысыз өзінің белгілі бір сан мәндерін өзгертпейтін болса, онда жүйенің мұндай күйі тепе-теңдік күй деп аталады. Олай болса, мейлінше баяу (жай) өтетін процесс тепе-тең процесс деп аталады. Екі бағытта да жүре алатын процесті қайтымды процесс деп атайды. Әрбір тепе-тең процесс қайтымды процесс болады. Ал тепе-тең емес процестердің кез-келген түрі қайтымсыз процесс болады. Жылу машинасы (двигательдері) дегеніміз, периодты түрде сырттан алған жылуының есебінен механикалық жұмыс орындайтын және әрбір период соңында бастапқы күйге келіп отыратын машина. Бұл машина тұйық процесс жасайды. Газ ұлғаю кезінде оң таңбалы жұмыс жасайды. Сығылу кезінде орындалатын жұмыс теріс таңбалы болады. Бір циклде жасалған жұмыстар қорытындысы А оң таңбалы. A > 0 болса тура цикл, A < 0 болса кері цикл деп аталады. 20

Сырттан алынған жылудың барлығы жұмысқа айланбайды. Сондықтан жылу машиналарының пайдалы әсер коэффициенті (ПӘК) мынадай өрнекпен анықтайды: Термодинамиканың ІІ бастамасы: Сырттан алған жылудың барлығын жұмысқа айналдыратын двигательдің болуы мүмкін емес , немесе температурасы төмен денеден температурасы жоғары денеге жылудың өздігінен көшуі мүмкін емес. Карно циклі: Екі изотерма және екі адиабатадан тұратын қайтымды циклді Карно циклі деп атайды. Карно циклінің ПӘК-і ең жоғары болады. 21

ЭНТРОПИЯ Энтропия деп тепе-теңдік күйде тұрған жүйедегі элементар өзгеріс кезіндегі жүйенің алған немесе берген жылуының оның температурасына қатынасы арқылы жүйе күйі анықталатын функцияны атайды, яғни Мұндағы d. Q – жүйенің берген немесе алған жылуы; Т – процесс өту кезіндегі жүйенің температурасы; d. S – жүйенің күйін анықтаушы функция – энтропия – бұл толық дифференциал. Мұндағы d. Q – жылудың шамасын, термодинамиканың бірінші бастамасын және бір моль идеал газ күйінің теңдеуін пайдаланып анықтаймыз. d. Q=d. U+d. A=Cvd. T+Pd. V=Cvd. T+R (d. V/V). d. S=d(ln. TCv VR) Температура өскен сайын және газдың көлемі ұлғайған сайын энтропия өседі. 22

ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІ Нақты газдарды қарастырғанда молекулалардың өзара әсерлесу күші және молекулалардың меншікті көлемі есепке алынады. a) Молекулалардың меншікті көлемін есепке алу. Бір моль газ күйінің теңдеуі мынадай түрде жазылады: p(V-b)=RT. Мұндағы V–газ орналасқан ыдыстың көлемі; b - молекулалар орналасқан көлемге енгізілген түзету. б ) Молекуланың тартылыстарын есепке алу. Бір моль нақты газ үшін Ван-дер-Ваальс теңдеуі мынадай түрде жазылады: Мұндағы “a ” - “Ван-дер-Ваальс тұрақтысы” деп аталады. Ван-дер-Ваальс тұрақтысы молекулалардың тартылыс күшін сипаттайды. 23

Массасы m кез келген мөлшердегі газға арналған Ван-дер-Ваальс теңдеуі: мұндағы m - газ массасы; μ – газдың молярлық массасы, “a ” және “b” – тұрақты шамалар, әртүрлі газ үшін бұл тұрақтылардың сан мәндері әр түрлі болады. Аса күрделі емес түрлендірулерден Ван-дер-Ваальс теңдеуін мынадай түрде де жазып көрсетуге болады: Бұл теңдеуі р және Т үшін Vμ- ге қатысты үшінші дәрежелі теңдеу болғандықтан, оның нақты үш түбірі (төменгі температура үшін) болуы мүмкін немесе бір нақты және екі жалған шешімі (жоғары температура үшін) болуы мүмкін. Жалған түбірлердің физикалық мағынасы болмайды, сондықтан нақты түбірін ғана қарастыратын боламыз. 24
физика-8-9-лекция.ppt