Модель атома в виде «булочки с изюмом» (Дж.Томсон,

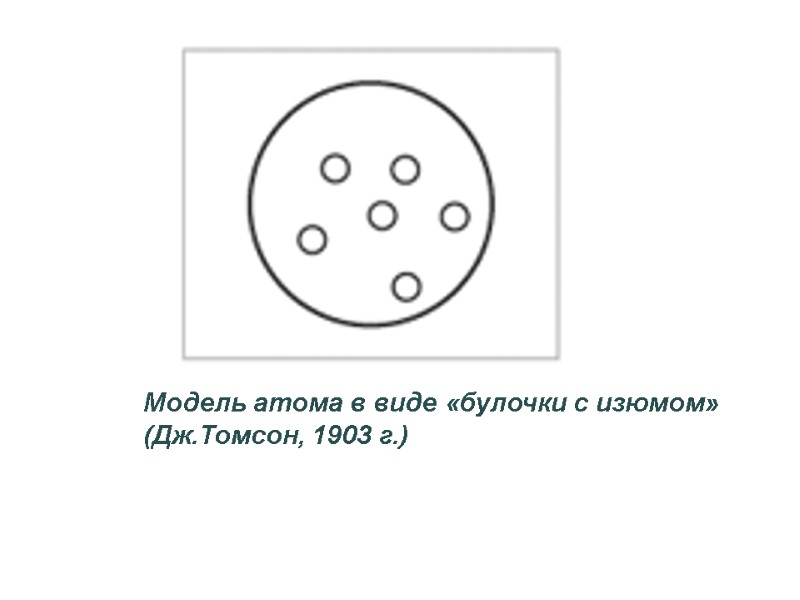
Модель атома в виде «булочки с изюмом» (Дж.Томсон, 1903 г.)
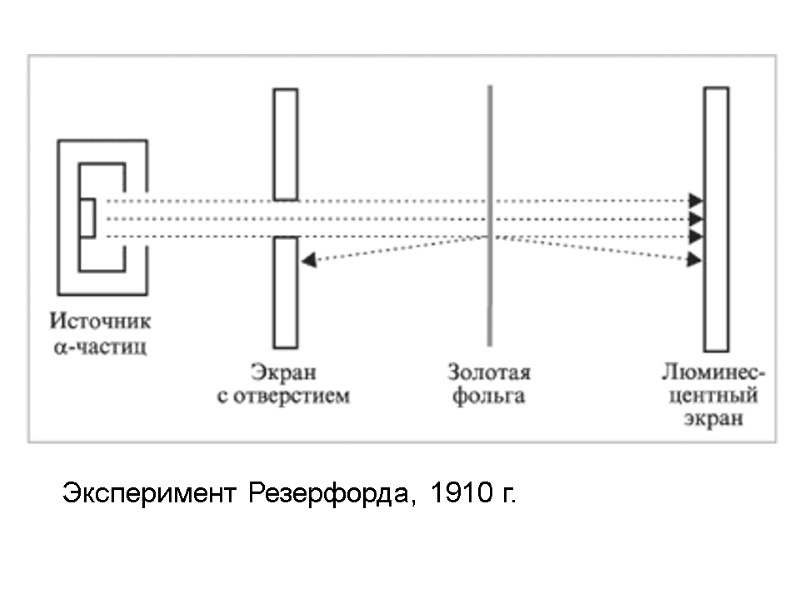
Эксперимент Резерфорда, 1910 г.
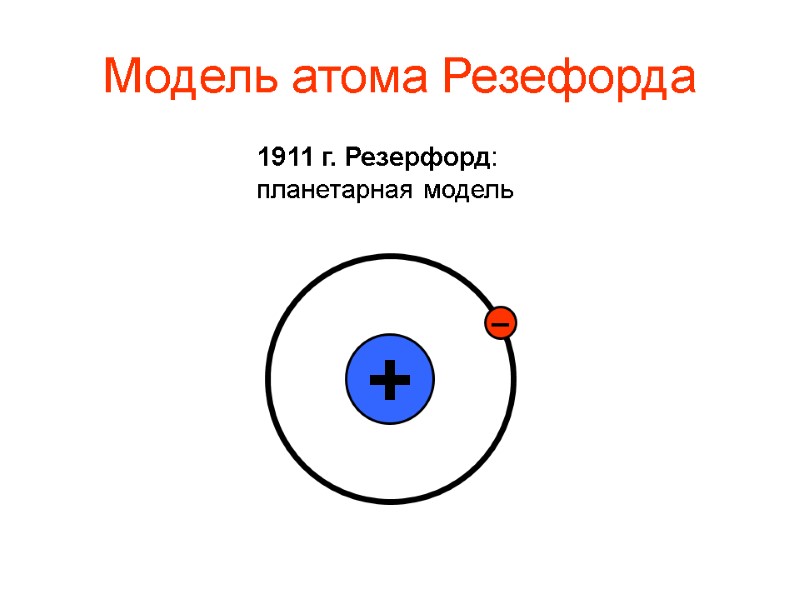
Модель атома Резефорда
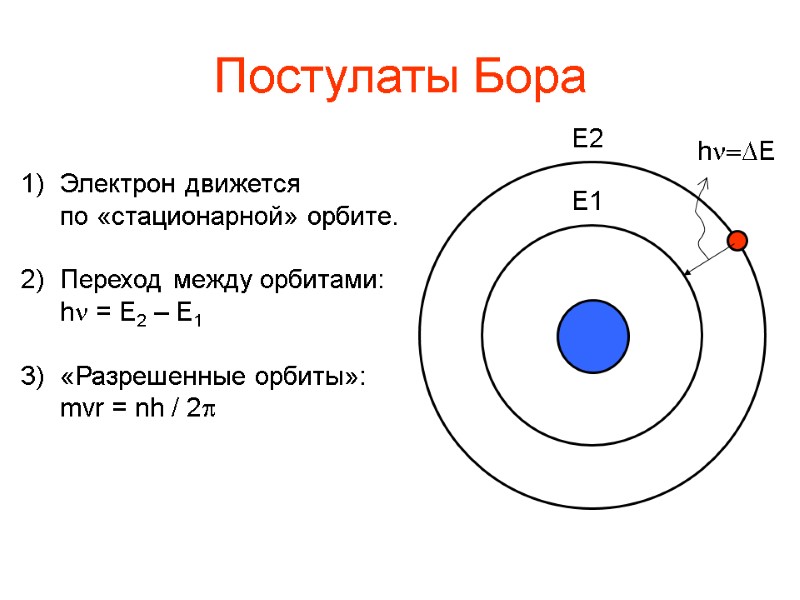
Постулаты Бора 1) Электрон движется по «стационарной» орбите. 2) Переход между орбитами: h = E2 – E1 3) «Разрешенные орбиты»: mvr = nh / 2

Квантовая механика 1924 Корпускулярно-волновой дуализм электрона (Луи де Бройль) 1925 Принцип неопределенности Гейзенберга

Уравнение Шрёдингера ψ – волновая функция ψ2 dV – вероятность нахождения электрона в объеме dV

Квантовые числа n – главное. Энергия орбитали. n = {1, 2, 3, 4…} l – побочное (орбитальное). Форма орбитали. l = {0, …(n-1)} ml – магнитное. Ориентация в пространстве. ml = {-l,…0…+l }
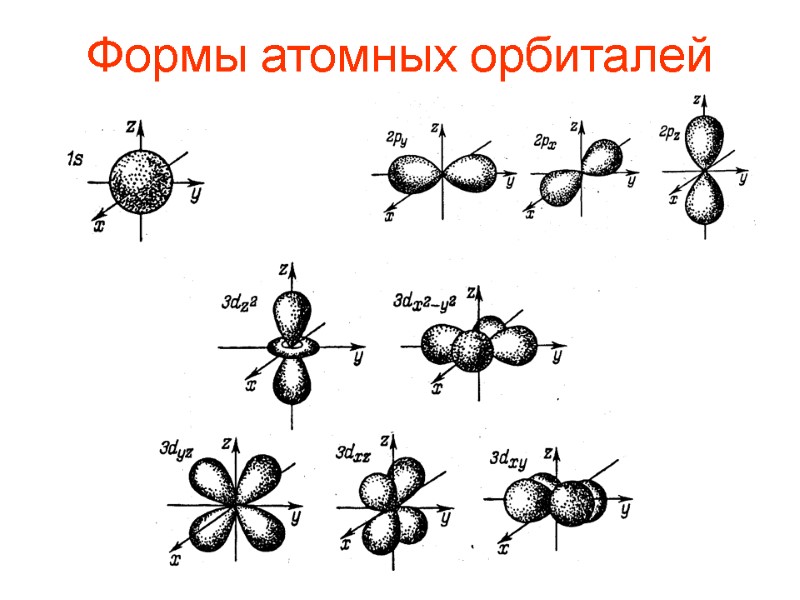
Формы атомных орбиталей
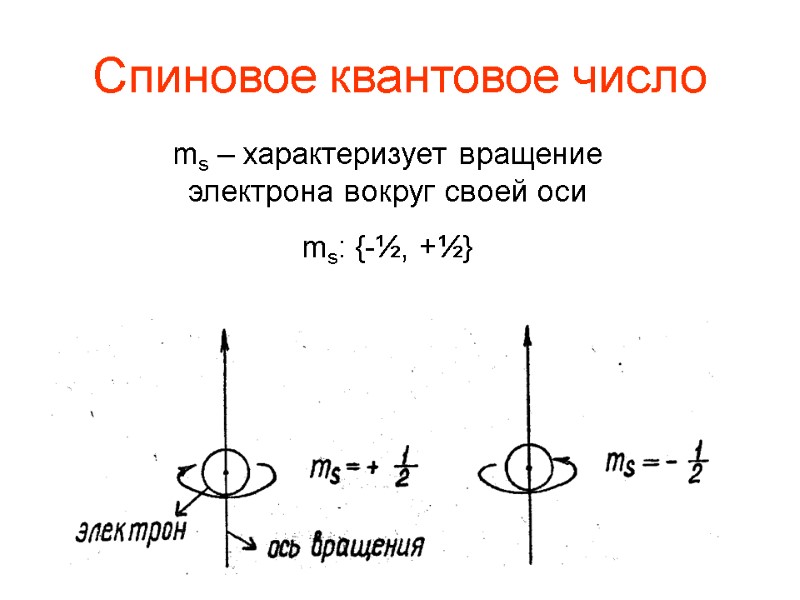
Спиновое квантовое число ms – характеризует вращение электрона вокруг своей оси ms: {-½, +½}

Заполнение электронами энергетических уровней Принцип наименьшей энергии: 1 → 2 → 3 → … 1ое правило Клечковского: min (n + l) 2ое правило Клечковского: при равных (n + l) первым заполняется подуровень с меньшим n Принцип Паули: в атоме нет электронов с одинаковыми значениями всех 4-х квантовых чисел Правило Хунда: суммарный спин электронов должен быть максимальным
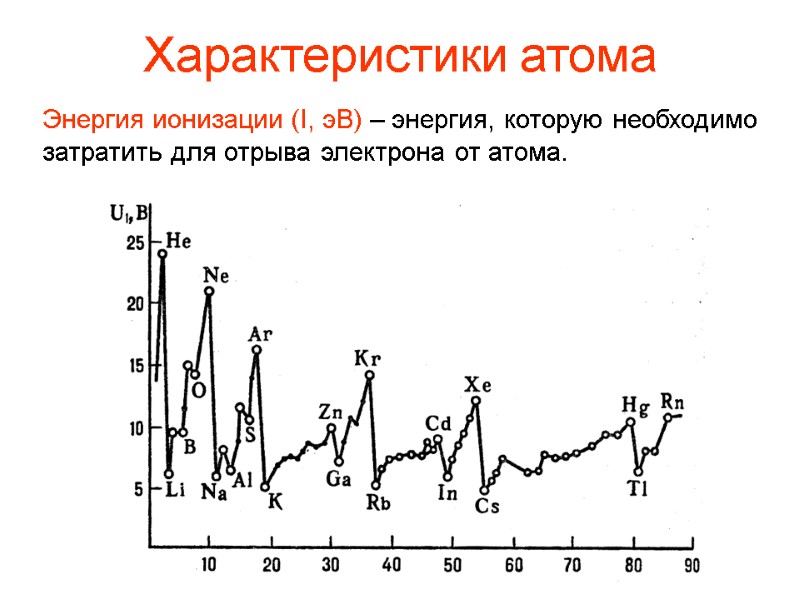
Характеристики атома Энергия ионизации (I, эВ) – энергия, которую необходимо затратить для отрыва электрона от атома.

Характеристики атома Сродство к электрону (ЕСР, эВ) – энергия, которая выделяется при добавлении электрона к нейтральному атому Э + е – = Э –
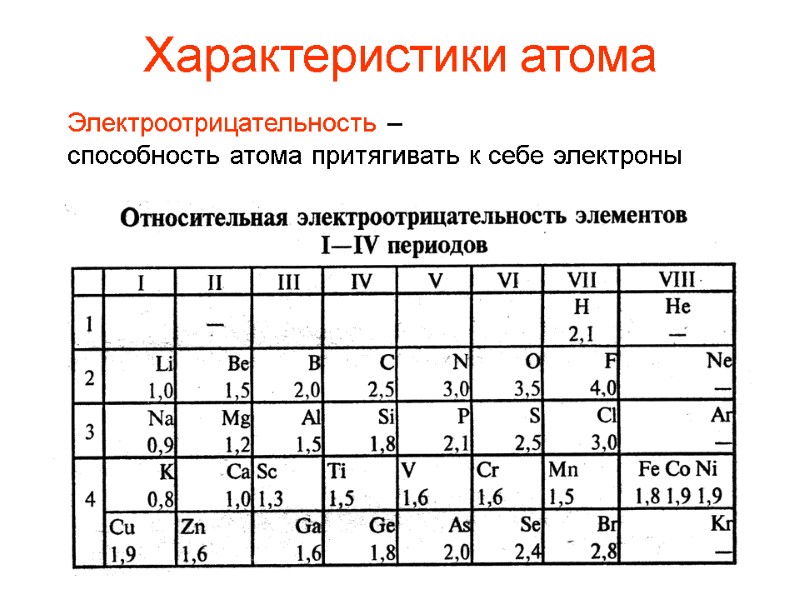
Электроотрицательность – способность атома притягивать к себе электроны Характеристики атома

Периодическое изменение свойств
7836-svetlana-str_atoma.ppt
- Количество слайдов: 14

