угольная кислота.ppt
- Количество слайдов: 49

МОБУ «СОШ № 1» с. Бураево Угольная кислота и её соли 9 класс Химия Учитель: Хамзин Азат Фаилович 1

Что мы знаем об углероде? Ø Углерод? 2

Общая характеристика углерода Углерод (Carboneumрождающий уголь) 1. Характеристика по ПСХЭ. а) неметалл б) IV группа, главная подгруппа в) II период , 2 ряд 3

Углерод Электронное строение 12 С 0 2 p 2 +6 2 4 2 s 2 1 s 2 4

Значит, углерод: Ø г) степени окисления -4, 0, +2, +4 Ø д) оксиды- СО( не образует кислот)- угарный газ, , моноокись углерода, оксид углерода II Ø СО 2 ( кислотообразующий) – углекислый газ, двуокись углерода, оксид углерода IV Ø е) образует огромное число соединений с водородом, самое простое СН 4 5 метан

Аллотропные модификации углерода ØØ Ø алмаз, графит карбин. 6

Кристаллическая решётка графита Ø для графита характерна гексагональная кристаллическая решетка. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов углерода. 7

жирное на ощупь вещество черного или серого цвета с металлическим блеском, тугоплавок (плавится под давлением 105 атм и при температуре свыше 3700 °C), электропроводен, мягок, легко расслаивается. Ø Из графита изготавливают огнестойкие изделия, устойчивые против действия щелочей и расплавленных систем; графитом покрывают формы для литья, чтобы предупредить прилипание к изделию формовой земли; изготавливают электротехнические изделия, карандаши, краски, смазки, антифрикционные материалы и изделия. Графит применяется в атомной технике как замедлитель нейтронов, изоляционный материал Ø Видоизменения графита, часто встречающиеся в природе- кокс, сажа. древесный уголь. Ø 8

АЛМАЗ Ø Ø Ø бесцветное кристаллическое вещество с атомной решеткой. Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам. Алмаз имеет высокую твердость, плотность 3, 5 г/см 2, плохо проводит тепло и практически не проводит электрический ток. В чистом виде алмаз сильно преломляет свет. Его применяют как украшение, а также для резки стекла, бурения горных пород и шлифования особо твердых материалов. 9

Взаимное превращение алмаза и графита Ø При огромном давлении графит превращается в алмаз, и наоборот при высоких температурах алмаз превращается в графит 10

Углерод Применение типогра фия ювелирн ые изделия медиц ина адсор бент С резина сталь сельское хозяйство топл иво 11

Cвойства окислителя: а) с металлами образует карбиды Ø 4 Al+3 C=Al 4 C 3 ( при нагревании) Ø Ca+2 C=Ca. C 2 ( при нагревании) б) с водородом Ø С +2 H 2 =CH 4 (метан) ( при нагревании) 12

Свойства восстановителя в) восстанавливает металлы из их оксидов Ø Cu. O + C = CO 2 +Cu г) горит в кислороде с выделением большого количества тепла Ø 2 C + O 2 = 2 CO + Q Ø C + O 2 = CO 2 + Q 13

Угольная кислота и её соли Цели урока: Познакомить учащихся с особенностями угольной кислоты; с основными её природными соединениями; повторить понятия: кислые и средние соли на примере карбонатов и гидрокарбонатов и их техническими названиями. Изучить химические свойства солей угольной кислоты и основными областями их применения. 14

Немного литературы Генри Райдер Хаггард – автор романа «Клеопатра» 15

В романе Г. Р. Хаггарда «Клеопатра» читаем: Ø : «… она вынула из уха одну из 3 -х огромных жемчужин и опустила жемчужину в … ? Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли» . 16

1. Угольная кислота Ø Какой оксид углерода является ангидридом угольной кислоты? Ø Степень окисления углерода в угольной кислоте? Ø +4, значит ангидрид угольной кислоты – оксид углерода 4 или углекислый газ Ø СО 2 17

Углекислый газ (двуокись углерода) 18

Внимание, видеоопыт 19

Уравнение реакции Ø СО 2 (г) + Н 2 О (ж) ↔ Н 2 СО 3 (ж) + Q Характеристика реакции: Ø Соединения Ø не ОВР Ø ЭКЗОТЕРМИЧЕСКАЯ Ø обратимая Ø гетерогенная Ø некаталитическая 20
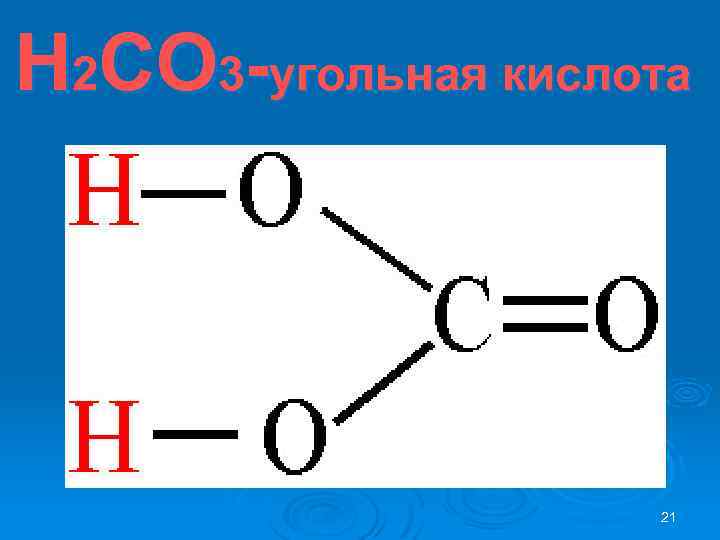
Н 2 СО 3 -угольная кислота 21

Свойства Н 2 СО 3 Øкислородосодержащая двухосновная Ø слабая Øнестабильная Ø 22

Запомни! Ø СО 2 + Н 2 О ↔ Н 2 СО 3 Ø Равновесие смещено влево, поэтому в ионных уравнениях пишем: Н 2 СО 3 → Н 2 О + СО 2 23

2. Соли угольной кислоты 24

А) Карбонаты: Са. СО 3 - карбонат кальция. (Мел, мрамор, известняк, скорлупа яиц, ракушечник, жемчуг) 25

Минералы Mg. CO 3 – доломит K 2 CO 3 – поташ Na 2 CO 3 – техническая сода Na 2 CO 3 10 Н 20 – каустическая сода 26

Б)Гидрокарбонаты – кислые соли ØNa. НСО 3 - питьевая сода , натрий углекислый, пищевая сода ØСа(НСО 3)2 – гидрокарбонат кальция (временная жесткость воды) 27

3. Химические свойства карбонатов и гидрокарбонатов Ø А) Устранение временной жесткости воды кипячением Ø Са(НСО 3)2=Са. СО 3+Н 2 О+СО 2 Ø Б) Термическое разложение, например обжиг известняка Ø Са. СО 3=Са. О+СО 2 28

Напишите уравнения реакции Ø В) Растворения питьевой соды Ø Nа. НСО 3= Nа(+) + НСО 3(-) Ø Г) «Вскипание» пищевой соды при действии кислот Взаимодействия питьевой соды с соляной кислотой Ø Nа. НСО 3+НС 1= Nа. С 1+СО 2+Н 2 О 29

Качественные реакции на карбонаты и гидрокарбонаты: Ø -При взаимодействии карбонатов и гидрокарбонатов с кислотами происходит «вскипание» - выделение пузырьков углекислого газа 30

Внимание, видеоопыт! 31

Качественная реакция на карбонаты Ø Ме. СО 3 или Ме. НСО 3+ кислота= соль+СО 2+вода Ø Мел + соляная кислота Ø Са. СО 3+2 НС 1= Ø Са. С 12+СО 2+Н 2 О 32

Взаимодействие с раствором нитрата серебра 33

В) Взаимопревращения карбонатов и гидрокарбонатов 34

Карбонат-гидрокарбонат и наоборот Ø Са. СО 3+СО 2+Н 2 О=Са(НСО 3)2 Ø (наблюдаем растворение «мути» ) Ø Са(НСО 3)2=Са. СО 3+Н 2 О+СО 2 Ø (образование накипи в чайнике, трубах отопления. . ) 35

ЖЕСТКОСТЬ ВОДЫ 36

Устранение жесткости воды 37

Роль взаимопревращений карбонатов и гидрокарбонатов в природе 38

Закрепление Ø 1. В чем же растворила Клеопатра жемчужину? Ø 2. В какой кислоте, если она выпила затем раствор? 39

Подумайте! Какую роль выполняет питьевая сода, когда ее пьют от изжоги? (Первым применил раствор гидрокарбоната натрия от изжоги нем. врач, по имени которого это вещество одно время даже называли «солью Бульриха» ) Ø В желудке человека находится HCl, которую нейтрализует сода: Ø Ø Na. HCO 3 + HCl → Na. Cl + CO 2 + H 2 O. 40

Подумайте! Ø Как очистить яйцо от скорлупы, не разбивая его? 41

Растворение скорлупы в уксусной кислоте Скорлупа состоит из карбоната кальция в основном, который растворяется в соляной или уксусной кислотах. 42

Тест вариант № 1 1. Какая реакция не протекает до конца? а) H 2 O + CO 2 =. . . ; б) Сa. O + CO 2 =. . . ; в) KOH + CO 2 =. . . ; г) К 2 СO 3 + CO 2 + Н 2 О =. . Ø 2. Чему равна валентность углерода в угольной кислоте Н 2 СO 3: а) II; б) IV; в) III; г) VI. 3. Для протекания реакции Сa. СO 3 = Са. О + CО 2 необходимым условием является: а) охлаждение; б) измельчение исходного Са. СО 3 в) наличие катализатора; г) нагревание. Ø 4. Выберите ряд, соответствующий убыванию силы кислот: а) H 2 SO 4, H 3 PO 4, H 2 CO 3; б) H 2 SO 4, H 2 CO 3, H 3 PO 4; в) H 3 PO 4, H 2 SO 4, H 2 CO 3; г) H 2 СO 3, H 3 PO 4, H 2 SO 4. Ø 5. Кислые соли угольной кислоты называют: а) нитраты; б) карбонаты; в) гидрокарбонаты; г) карбиды. Ø 43

Тест вариант № 2 1. Какая характеристика относится к угольной кислоте: а) нестабильная б) одноосновная в) сильная г) органическая 2. Формула питьевой соды: а)Са(НСО 3)2 б)Nа. НСО 3 в)Nа 2 СО 3 г)Са. СО 3 3. Условие, необходимое для разложения карбонатов: а)давление б)температура в)свет г)вода 4. Вещество, с помощью которого распознают карбонаты: а)НСl б)Са(ОН)2 в)Ва. Сl 2 г)СО 2 5. Где применяется питьевая сода? а)в кондитерском деле б)в строительстве в)в производстве стекла г)получение удобрений 44

Ответы вариант № 1 1. Какая реакция не протекает до конца? а) H 2 O + CO 2 =. . . ; б) Сa. O + CO 2 =. . . ; в) KOH + CO 2 =. . . ; г) К 2 СO 3 + CO 2 + Н 2 О =. . 2. Чему равна валентность углерода в угольной кислоте Н 2 СO 3: а) II; б) IV; в) III; г) VI. 3. Для протекания реакции Сa. СO 3 = Са. О + CО 2 необходимым условием является: а) охлаждение; б) измельчение исходного Са. СО 3 в) наличие катализатора; г) нагревание. 4. Выберите ряд, соответствующий убыванию силы кислот: а) H 2 SO 4, H 3 PO 4, H 2 CO 3; б) H 2 SO 4, H 2 CO 3, H 3 PO 4; в) H 3 PO 4, H 2 SO 4, H 2 CO 3; г) H 2 СO 3, H 3 PO 4, H 2 SO 4. 5. Кислые соли угольной кислоты называют: а) нитраты; б) карбонаты; в) гидрокарбонаты; г) карбиды 45 45

Ответы вариант № 2 1. Какая характеристика относится к угольной кислоте: а) нестабильная б) одноосновная в)сильная г) органическая 2. Формула питьевой соды: а)Са(НСО 3)2 б)Nа. НСО 3 в)Nа 2 СО 3 г)Са. СО 3 3. Условие, необходимое для разложения карбонатов: а)давление б)температура в)свет г)вода 4. Вещество, с помощью которого распознают карбонаты: а)НСl б)Са(ОН)2 в)Ва. Сl 2 г)СО 2 5. Где применяется питьевая сода? а)в кондитерском деле б)в строительстве в)в производстве стекла г)получение удобрений 46

ответы Вопр В-1 В-2 1 2 3 4 5 а б б а а а б г а в 47

Домашнее задание § 30 до конца, упр. 4 устно; 5 -7 письменно. 48

До свидания!!! Спасибо за урок! Удачи! 49
угольная кислота.ppt