36 Многоатомные спирты.pptx
- Количество слайдов: 26

Многоатомные спирты. Фенол. Преподаватель химии Назаров Борис Константинович

Определение. • Многоатомными спиртами называют вещества, которые являются производными углеводородов в которых два или более атомов водорода замещены на гидрооксогруппы. • R-(OH)n где n>2

Физические свойства CH 2 -OH | CH 2 -OH этиленгликоль (Р. Н. ) этандиол (М. Н. ) Хорошо растворимая, вязкая жидкость, сладкая на вкус, тем. кип. 197 градусов.
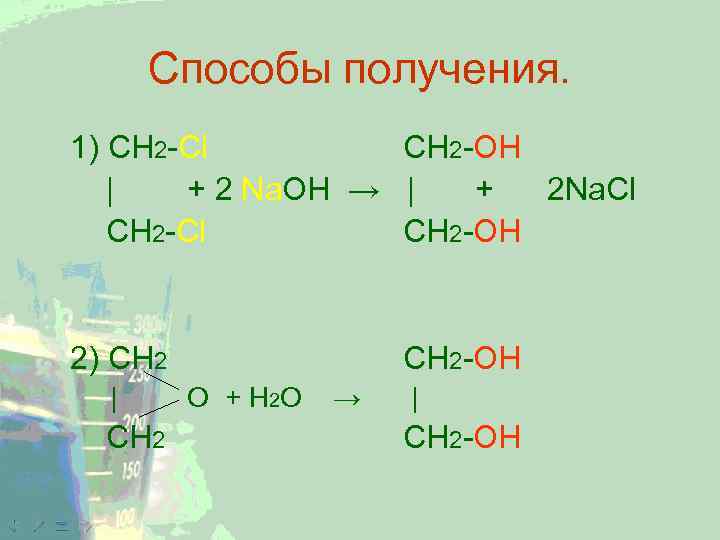
Способы получения. 1) CH 2 -Cl CH 2 -OH | + 2 Na. OH → | + 2 Na. Cl CH 2 -OH 2) CH 2 | CH 2 -OH O + H 2 O → | CH 2 -OH
![Способы получения. CH 2 -OH 3) СН 2=СН 2 + [O] + H 2 Способы получения. CH 2 -OH 3) СН 2=СН 2 + [O] + H 2](https://present5.com/presentation/69605649_132727798/image-5.jpg)
Способы получения. CH 2 -OH 3) СН 2=СН 2 + [O] + H 2 O → | CH 2 -OH Используется в качестве антифризов (тем. зам. до – 40), исходного сырья для получения растворителей при получении ацетатного шелка, лавсана и др. веществ. KMn. O 4
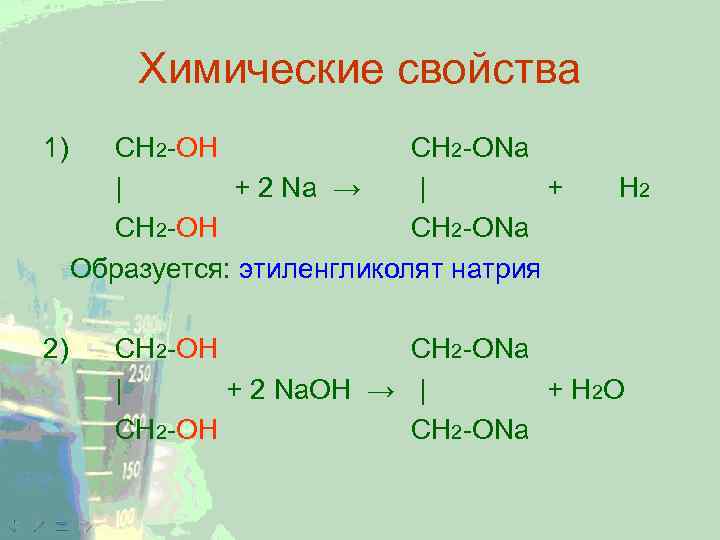
Химические свойства 1) 2) CH 2 -ОН CH 2 -ONa | + 2 Na → | + CH 2 -ОН CH 2 -ONa Образуется: этиленгликолят натрия Н 2 CH 2 -ОН CH 2 -ONa | + 2 Na. ОН → | + Н 2 О CH 2 -ОН CH 2 -ONa
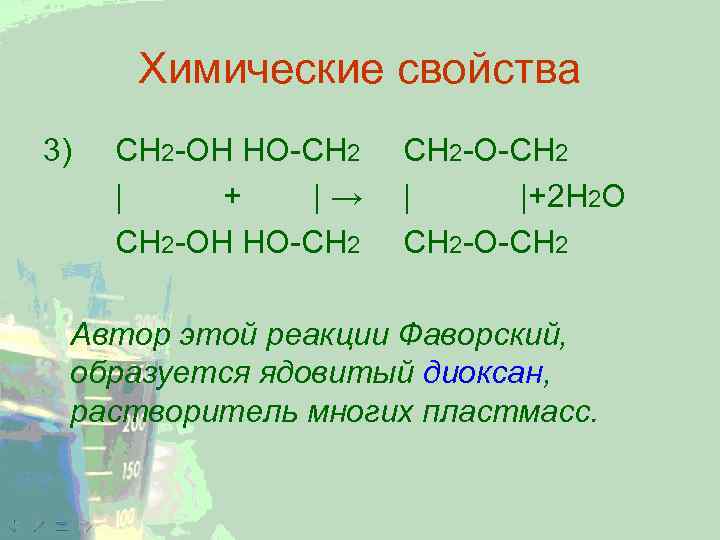
Химические свойства 3) CH 2 -ОН HO-CH 2 | + |→ CH 2 -ОН HO-CH 2 -O-CH 2 | |+2 Н 2 О CH 2 -О-CH 2 Автор этой реакции Фаворский, образуется ядовитый диоксан, растворитель многих пластмасс.
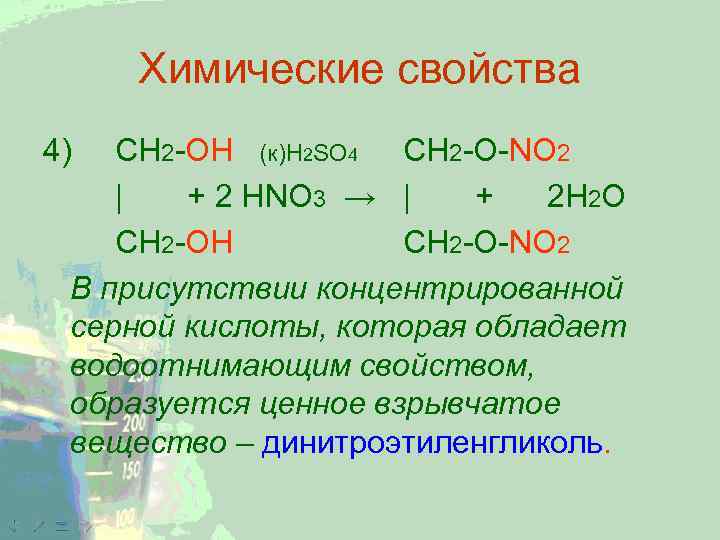
Химические свойства 4) CH 2 -ОН (к)H 2 SO 4 CH 2 -O-NO 2 | + 2 HNО 3 → | + 2 Н 2 О CH 2 -ОН CH 2 -O-NO 2 В присутствии концентрированной серной кислоты, которая обладает водоотнимающим свойством, образуется ценное взрывчатое вещество – динитроэтиленгликоль.
![Химические свойства 5) CH 2 -ОН CH 2 -OH H-C=O | + [O] KMn. Химические свойства 5) CH 2 -ОН CH 2 -OH H-C=O | + [O] KMn.](https://present5.com/presentation/69605649_132727798/image-9.jpg)
Химические свойства 5) CH 2 -ОН CH 2 -OH H-C=O | + [O] KMn. O 4 → | +[O] KMn. O 4 → | CH 2 -ОН -H 2 O CH-OH -H 2 O H-C=O | OH Образуется вещество - глиоксаль, которое используется как ускоритель вулканизации резины.
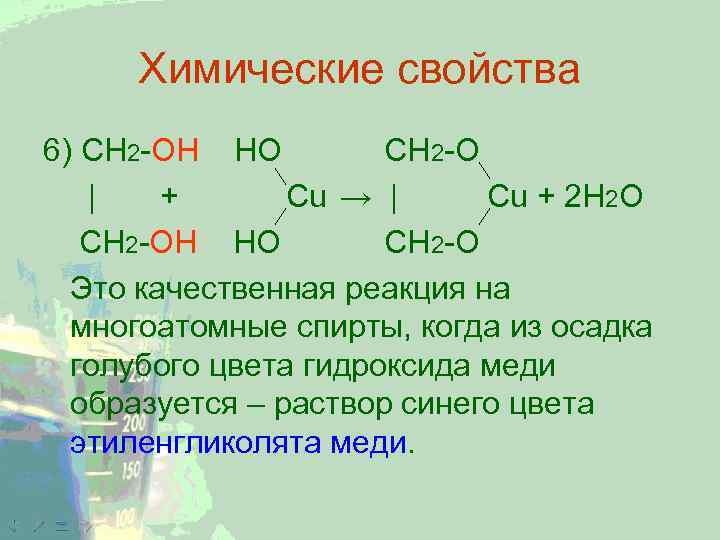
Химические свойства 6) CH 2 -ОН НО CH 2 -O | + Cu → | Cu + 2 Н 2 О CH 2 -ОН НО CH 2 -O Это качественная реакция на многоатомные спирты, когда из осадка голубого цвета гидроксида меди образуется – раствор синего цвета этиленгликолята меди.

Химические свойства 7) CH 2 -ОН | CH 2 -ОН водородные связи расшатывают связь между водородом и кислородом при этом появляется большая подвижность атомов водорода.

Глицерин был открыт французским учёным - Шееле в 1779 г. Густая жидкость, хорошо растворимая в воде, сладкая на вкус, плотность 1, 265 гсм 3, тем. кип. 290. Получают синтетическим путем или при разложении жиров.
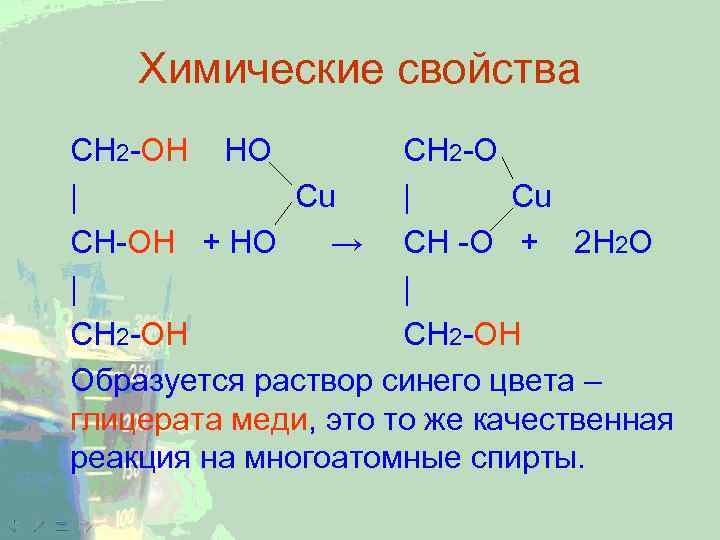
Химические свойства CH 2 -ОН НО CH 2 -O | Cu CH-ОН + НО → CH -O + 2 Н 2 О | | СН 2 -ОН Образуется раствор синего цвета – глицерата меди, это то же качественная реакция на многоатомные спирты.
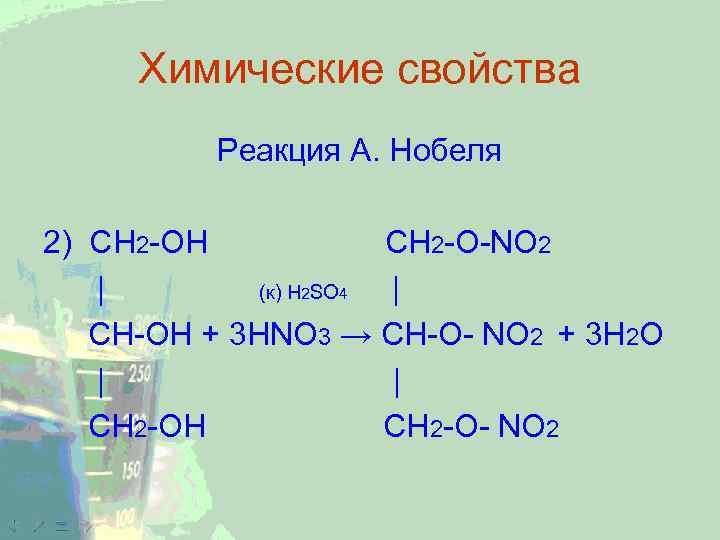
Химические свойства Реакция А. Нобеля 2) CH 2 -ОН CH 2 -O-NO 2 | (к) H 2 SO 4 | CH-ОН + 3 НNO 3 → CH-O- NO 2 + 3 Н 2 О | | СН 2 -ОН СН 2 -О- NO 2

Химические свойства Образуется тринитроглицерин, ценное взрывчатое вещество, которое в чистом виде не используется из-за высокой бризантности, а в виде динамита или бездымного пороха, впервые его получил шведский ученый Нобель, так же используется в медицине как сердечное лекарство. 4 C 3 H 5(ONO 2)3 → 12 CO 2 + 10 H 2 O + 6 N 2 + O 2
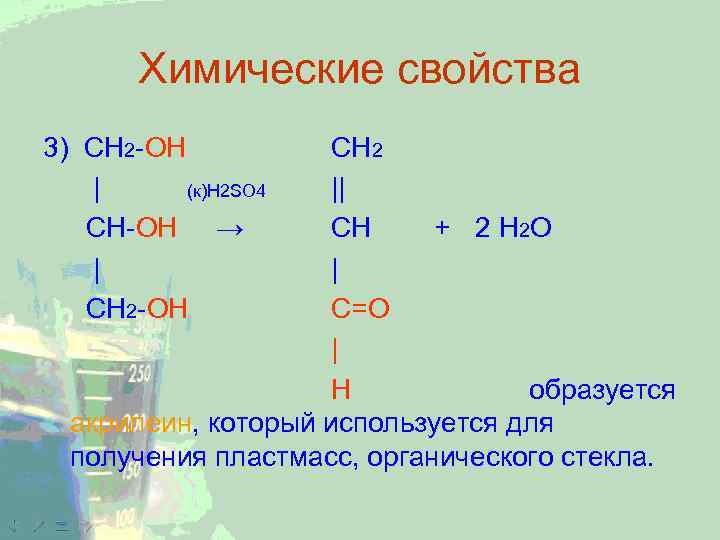
Химические свойства 3) CH 2 -ОН | (к)H 2 SO 4 CH-ОН → | СН 2 -ОН CH 2 || CH + 2 H 2 O | С=О | Н образуется акрилеин, который используется для получения пластмасс, органического стекла.

Физические свойства ОН | Карболовая кислота, бесцветные | кристаллы, при слабом окислении – розовые, плохо растворимые в воде (6, 3 г. В 100 г. воды), при темп. 70 градусов растворяются почти полностью. Получают из каменноугольной смолы
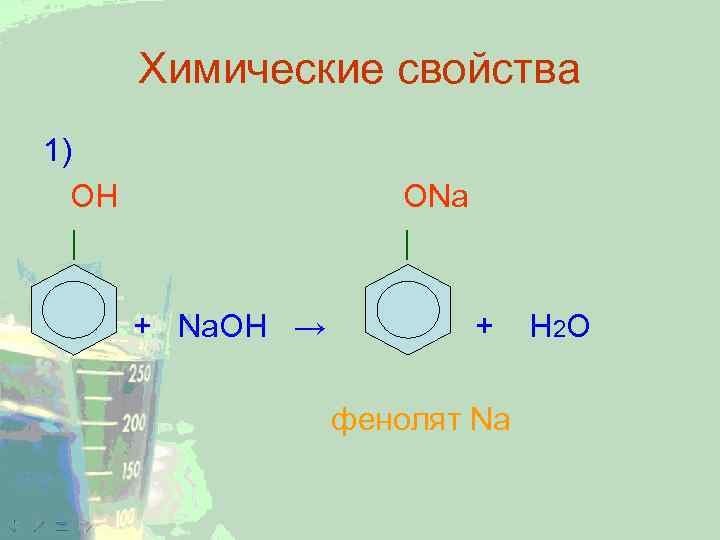
Химические свойства 1) ОН | ОNa | + Na. OH → + фенолят Na H 2 O
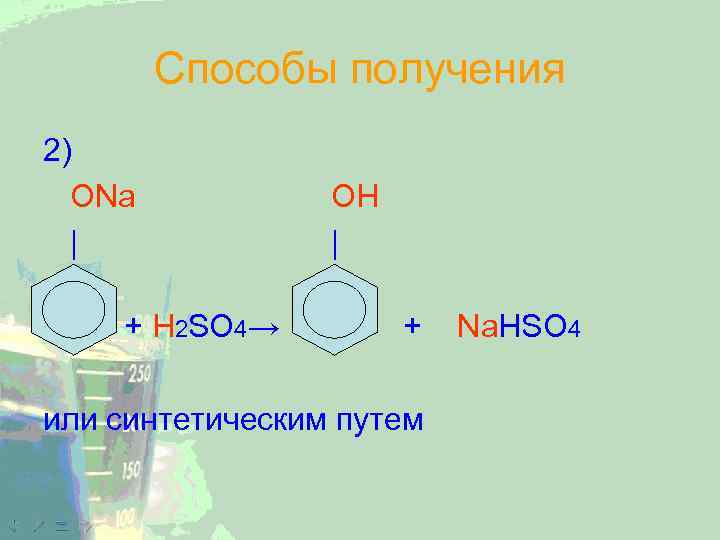
Способы получения 2) ОNa | + H 2 SO 4→ ОН | + или синтетическим путем Na. HSO 4
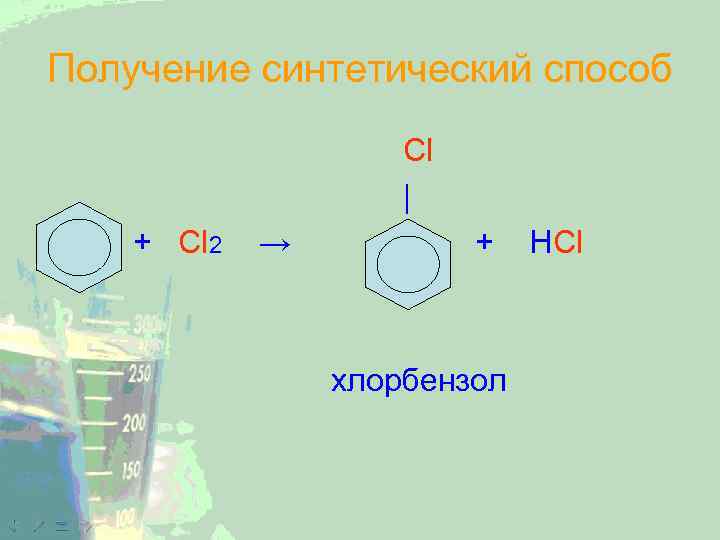
Получение синтетический способ Cl | + Cl 2 → + хлорбензол HCl
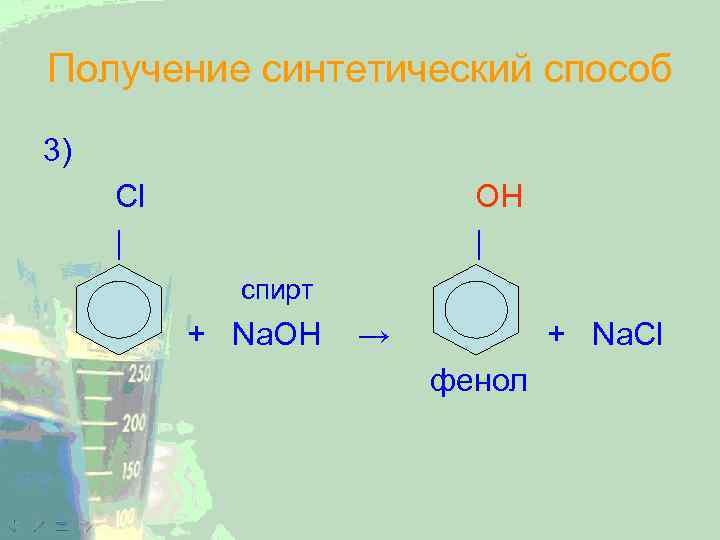
Получение синтетический способ 3) Cl | OH | спирт + Na. OH → + Na. Cl фенол
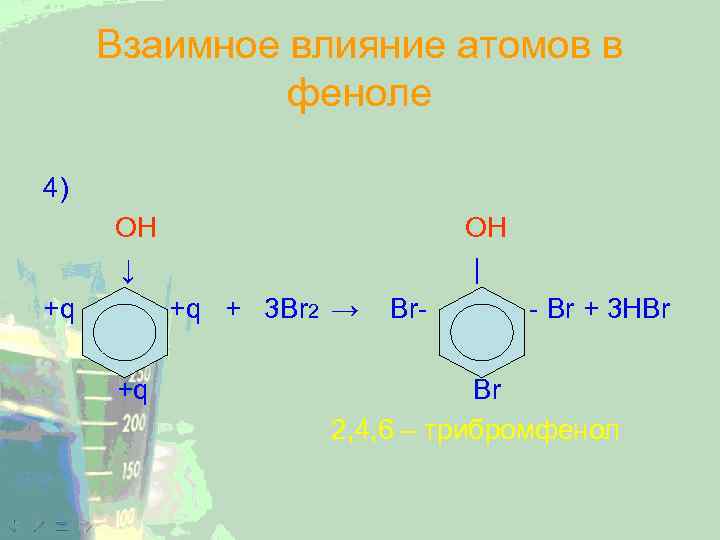
Взаимное влияние атомов в феноле 4) OH ↓ +q OH | +q + 3 Br 2 → +q Br- - Br + 3 HBr Br 2, 4, 6 – трибромфенол

Химические свойства 5) C 6 H 5 -ONa + Cl-C 6 H 5 → C 6 H 5 -0 - C 6 H 5 дифениловый эфир 6) 2 C 6 H 5 -OH + 2 Na → 2 C 6 H 5 -ONa + H 2 фенолят натрия

Химические свойства 7) качественная реакция на фенол 3 C 6 H 5 -OH + Fe. Cl 3 →(C 6 H 5 -O-)3 Fe + 3 HCl фенолят железа 8)C 6 H 5 -OH + 3 HNO 3 → C 6 H 2(NO 2)3 -OH тринитрофенол (пикриновая кислота) взрывчатое вещество

Химические свойства 9) фенол слабая кислота, поэтому угольная кислота вытесняет из растворов её солей. C 6 H 5 -ONa + CO 2 + H 2 O → C 6 H 5 -OH +Na. HCO 3
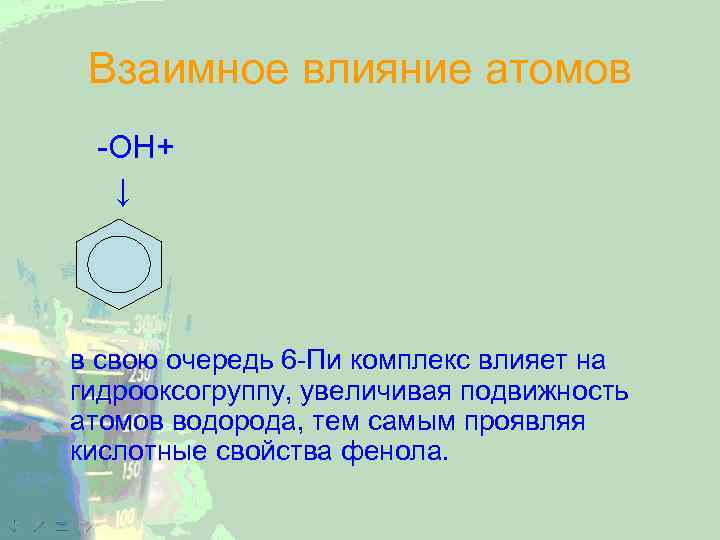
Взаимное влияние атомов -OH+ ↓ в свою очередь 6 -Пи комплекс влияет на гидрооксогруппу, увеличивая подвижность атомов водорода, тем самым проявляя кислотные свойства фенола.
36 Многоатомные спирты.pptx