Митохондриальные болезни.pptx
- Количество слайдов: 27

Митохондриальные болезни Выполнил Студент 4 курса 3 группы Медико-биологического факультета Желудков Е. В. Волгоград 2013

Содержание Митохондриальные болезни Особенности строения и функционирования мт. ДНК по сравнению с ядерным геномом. Классификация митохондриальных болезней на основе этиологии Современная классификация митохондриальных болезней Синдром MERRF Синдром MELAS Синдром NARP Атрофия зрительных нервов Лебера Синдром Лея Синдром Кернс-Сейера Синдром Пирсона

Митохондриальные болезни – большая группа наследственных заболеваний, обусловленных нарушением структуры и биохимических процессов в митохондриях.
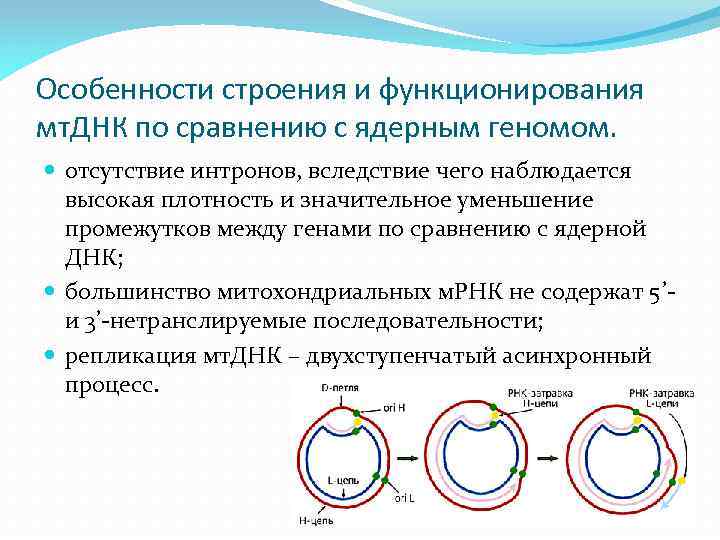
Особенности строения и функционирования мт. ДНК по сравнению с ядерным геномом. отсутствие интронов, вследствие чего наблюдается высокая плотность и значительное уменьшение промежутков между генами по сравнению с ядерной ДНК; большинство митохондриальных м. РНК не содержат 5’и 3’-нетранслируемые последовательности; репликация мт. ДНК – двухступенчатый асинхронный процесс.

Мт. ДНК содержит: гены, которые кодируют 13 полипептидов, входящих в пять комплексов дыхательных цепей митохондрий; 22 гена транспортной РНК; 2 гена рибосомной РНК. Остальные 70 белков, участвующих в процессах окислительного фосфорилирования, находятся под контролем ядерных генов.

Классификация митохондриальных болезней на основе этиологии 1) заболевания, обусловленные мутациями в генах ядерной ДНК; 2) заболевания, связанные с мутациями в митохондриальном геноме; 3) заболевания, вызванные нарушением межгеномных сигнальных эффектов.

На основе этиологии и патогенеза создана современная классификация митохондриальных болезней 1. Болезни, обусловленные дефектами мт. ДНК: а) точковыми мутациями; б)делециями; в)изолированными дупликациями или в сочетании с делециями; 2. Болезни, обусловленные дефектами ядерной ДНК: а) мутациями, нарушающими работу электронтранспортной цепи митохондрий; б) мутациями, нарушающими окислительное фосфорилирование в) мутациями, вызывающими дефекты ферментов цикла Кребса г) мутациями, нарушающими утилизацию субстратов д) мутациями, нарушающими транспорт субстратов 3. Болезни, обусловленные дефектами мт. ДНК, которые вызваны нарушением ядерной ДНК: а) тканеспецифическими делециями или дупликациями мт. ДНК; б) истощением (делецией) мт. ДНК.

Синдром MERRF (МИОКЛОНУС-ЭПИЛЕПСИЯ, НАЛИЧИЕ "РВАНЫХ КРАСНЫХ ВОЛОКОН" В МЫШЕЧНОМ БИОПТАТЕ) MYOCLONIC EPILEPSY ASSOCIATED WITH RAGGED-RED FIBERS; MERRF Тип наследования: материнский Мутации: Точковая замена A 8334 G в гене т. РНК лизина встречается у большинства больных, реже - точковая замена Т 8356 С в том же гене мт. ДНК. Распространенность синдрома MERRF, обусловленного мутацией A 8344 G среди взрослой популяции в Финляндии составляет 1, 5: 100 000, на севере Англии - 0, 25: 100 000 и 0, 25: 100 000 среди детского населения на западе Швеции. Патогенез: Молекулярные механизмы патогенеза синдрома определяются нарушением белкового синтеза в митохондриях из-за мутации в гене т. РНК, поражающей синтез всех 13 полипептидов, контролируемых мт. ДНК. Причиной неполной экспрессии заболевания у пораженных родственников по материнской линии является феномен гетероплазмии и пороговая экспрессия клинического фенотипа. Поражение мышечной ткани сопровождается гиперпролиферацией митохондрий (под сарколеммой и, менее заметно, между миофибриллами), морфологическим маркером которой являются миофибриллы с рваными красными краями (RRF), выявляемые при окраске по Гомори трихром.

Клинические проявления синдрома MERRF Возраст начала заболевания - от юношеского до пятого десятилетия жизни. Ранний возраст начала коррелирует с тяжестью клинических проявлений. Клинический фенотип часто представлен неполными клиническими формами и характеризуется выраженным внутрисемейным клиническим полиморфизмом. Основной симптомокомплекс включает: различные виды эпилептических приступов (миоклонические, генерализованные тоникоклонические, атонические и другие), мозжечковую атаксию и прогрессирующую мышечную слабость. миоклонии обычно провоцируются звуковыми раздражителями и фотостимуляцией. нейросенсорная тугоухость, полиневропатический синдром, снижение интеллекта, атрофия зрительных нервов, спастические парезы/параличи и липомы. Пигментная дегенерация сетчатки, хронический панкреатит и сахарный диабет встречаются редко. Клиническая картина заболевания у пораженных родственников по материнской линии может варьировать от практически бессимптомной до мягко выраженной, включая только нейросенсорную тугоухость и задержку роста.

Диагностика синдрома MERRF У всех пациентов с синдромом MERRF выявляют повышение лактата и пирувата в крови и ЦСЖ, как в покое, так и после физической нагрузки. В ЦСЖ обнаруживают повышение белка, но не более 100 мг/дл. При компьютерной электроэнцефалографии обычно регистрируют различную эпилептиформную активность. При электронейрографии - выявляют первично-мышечные нарушения и /или признаки смешанной полиневропатии. У многих пациентов при МРТ головного мозга визуализируют атрофию головного мозга и кальцификацию базальных ганглиев. У всех пациентов при исследовании мышечного биоптата обнаруживают феномен RRF.

Синдром MELAS СИНДРОМ MELAS (МИТОХОНДРИАЛЬНАЯ ЭНЦЕФАЛОМИОПАТИЯ, ЛАКТАТ-АЦИДОЗ, ИНСУЛЬТООДОБНЫЕ СОСТОЯНИЯ) MITOCHONDRIAL MYOPATHY, ENCEPHALOPATHY, LACTIC ACIDOSIS, AND STROKE-LIKE EPISODES; MELAS Мутации: У большинства пациентов (80%) синдром MELAS обусловлен точковой заменой A 3243 G в гене т. РНК лейцина (UUR), 7, 5% - точковой заменой Т 3271 С, еще реже - заменой А 3252 G в том же гене мт. ДНК и точковой мутацией в гене COX III. Злокачественная мигрень с инсультоподобными состояниями может быть обусловлена спорадическими делециями мт. ДНК. Тип наследования: материнский Эпидемиология: Точная частота заболевания не известна. В литературе имеются единичные данные о частоте заболевания. На севере Финляндии частота мутации A 3243 G, составляет 16. 3: 100 000. Патогенез: Мутации мт. ДНК, контролирующих дыхательную цепь митохондрий, сопровождаются нарушением процессов окислительного фосфорилирования - важнейшего источника энергии для метаболических процессов в клетке. Точковые мутации мт. ДНК, затрагивающие функцию т. РНК, поражают синтез практически всех белков, кодируемых мт. ДНК, приводя к их сочетанной недостаточности. При мутациях мт. ДНК чаще всего наблюдается сочетанной ферментной недостаточностью (например, комплексов I+III+IV), причем эта недостаточность вариабельна, но всегда частичная, иногда почти граничит с нормой. Это объясняется двойным генетическим контролем - ядерным и митохондриальным - окислительного фосфорилирования

Клинические проявления синдрома MELAS: Синдром MELAS как правило дебютирует в возрасте от 5 до 35 лет. Заболевание манифестирует либо инсульто-подобными состояниями (кортикальный или субкортикальный инфаркт), либо злокачественной мигренью. Инсульто-подобные состояния чаще всего развиваются в возрасте 5 -15 лет. Типичная локализация очагов, выявляемая при проведении КТ/МРТ головного мозга, - височная, теменная или затылочная область. В большинстве случаев они сопровождаются гемипарезами и гемианопсией и имеют тенденцию к относительно быстрому восстановлению при выраженном рекуррентном характере. Основными неврологическими симптомами являются: различные эпилептические приступы ( фокальные, вторично генерализованные, диалептические и другие), мозжечковые расстройства, миоклонус-эпилепсия, корковая агнозия, мигренеподобными головными болями и подкорковыми нарушениями (мышечная дистония, различные виды гиперкинезов). Нейропатологические изменения головного мозга включают гибель нейронов, демиелинизацию, пролиферацию астроцитов. Инсульто-подобные состояния никогда не являются следствием тромбоэмболии, а возникают вследствие митохондриальной ангиопатии и не соответствуют локализации магистральных сосудов мозга. К числу редких симптомов относятся нарушения сердечной проводимости, кардиомиопатия, почечно-канальцевая тубулопатия. Клиническая картина заболевания у пораженных родственников по материнской линии может варьировать от практически бессимптомной до мягко выраженной, включая только тугоухость, отставание роста, мигренеподобные головные боли.

Диагностика синдрома MELAS: У всех пациентов с синдромом MELAS выявляют повышение лактата и пирувата в крови и ЦСЖ, как в покое, так и после физической нагрузки. Наиболее частой мутацией, приводящей к этому синдрому является замена A 3243 G. Эта мутация встречается у 80% больных с данным синдромом. Мутация G 13513 A является второй по частоте среди пациентов европейского происхождения.

Синдром NARP (НЕВРОПАТИЯ, АТАКСИЯ, ПИГМЕНТНАЯ ДЕГЕНЕРАЦИЯ СЕТЧАТКИ, АТАКСИЯ И ПИГМЕНТНАЯ ДЕГЕНЕРАЦИЯ СЕТЧАТКИ) NEUROPATHY, ATAXIA, AND RETINITIS PIGMENTOSA; NARP SYNDROME Мутации гена АТФазы 6 мт. ДНК (MTATP 6). Тип наследования: материнский Эпидемиология: На сегодняшний день нет точных данных о распространенности синдрома NARP. Патогенез: Клиническая манифестация наступает при превышении 70% уровня содержания мутантной мт. ДНК в цитоплазме лейкоцитов, тромбоцитов и миобластов. При 90% уровне содержания мутантной мт. ДНК наблюдается болезнь Ли. Причиной неполной экспрессии заболевания у родственников по материнской линии является феномен гетероплазмии и пороговая экспрессия клинического фенотипа. При данном синдроме синтез АТФ нарушается вследствие недостаточности V комплекса дыхательной цепи митохондрий.

Клинические проявления: Заболевание манифестирует, как правило, в детском возрасте, но иногда и гораздо позже - на втором десятилетии жизни. Ведущими клиническими симптомами заболевания являются мышечная слабость, атаксия, пигментная дегенрация сетчатки по типу "соль с перцем" или макулодистрофия. Другими частыми симптомами болезни являются полиневропатия, эпилептические приступы и нарушение интеллекта. Наиболее частой мутацией, приводящей к синдрому NARP является замена Т С или Т G в положении 8993 гена АТФ-азы-6 мт. ДНК. Наиболее тяжелые проявления болезни коррелируют со степенью гетероплазмии в крови. Если процент мутантной ДНК составляет более 90% развивается наиболее тяжелая клиническая симптоматика, соответствующая синдрому Ли, от 70 -90% - синдром менее NARP , менее 70%- проявления могут ограничиваться пигментной дегенерацией сетчатки.

Диагностика: Лактат-ацидоз в отличие от других синдромов, обусловленных точковыми мутациями мт. ДНК, не является облигатным симптомом синдрома NARP. В мышечном биоптате редко обнаруживают феномен RRF. При ЭНМГ регистрируют признаки периферической сенсорной и сенсомоторной полиневропатии. При электроретинографии часто выявляют дисфункцию палочек сетчатки. В ряде случаев, при МРТ головного мозга обнаруживают атрофию мозжечка и коры головного мозга, в наиболее тяжелых случаях - некрозы в области базальных ганглиев. При МР-спектроскопии выявляют повышение лактата.

Атрофия зрительных нервов Лебера (СИНДРОМ LHON, НАСЛЕДСТВЕННАЯ НЕЙРОРЕТИНОПАТИЯ, АЗН ). LEBER OPTIC ATROPHY; LEBER HEREDITARY OPTIC NEUROPATHY; LHON Мутации: Описано более десяти точковых мутаций мт. ДНК, ассоциирующихся с LHON. Мутации подразделяют на первичные, которые могут сами по себе приводить к LHON, и вторичные, которые становятся патогенными только в сочетании с другими точковыми мутациями мт. ДНК. К числу первичных, безусловно, относятся G 11778 A в гене ND 4, G 3460 A в гене ND 1, G 15257 A в гене цитохрома b. Мутация G 11778 A является наиболее частой и обуславливает более 50% случаев болезни Лебера в европейских популяциях и около 90% случаев у японцев; на втором месте по частоте (15 -25%) мутация G 3460 A. Другие мутации, ассоциированные с болезнью Лебера, сочетаясь с этими и другими мутациями, синергично увеличивают или ослабляют течение болезни: T 3394 C и T 4216 C в гене ND 1, A 4917 G и G 5244 A в гене ND 2, G 7444 A в гене СO 1, G 13708 A в гене ND 5, G 15812 A в гене cyt b, T 14484 C в гене ND 6. Феномен синергизма иллюстрируется следующим примером: мутация ND 5 -G 13708 A найдена у 8% больных и у 5% контроля; мутации ND 5 -G 13708 A + cyt b-G 15257 A найдены у 8% больных и у 0, 3% в контроле; мутации ND 5 -G 13708 A + cyt b-G 15257 A + cyt b. G 15812 A найдены у 4% больных и у 0, 1% контроля; наконец, мутации в ND 5 -G 13708 A + cyt b-G 15257 A + cyt b. G 15812 A + ND 2 - G 5244 A в гетероплазмическом состоянии найдены у 4% больных и отсутствуют в контроле. Тип наследования: материнский Эпидемиология: В Северно-западной Англии частота LHON в популяции составляет 1: 31 000, в Голландии 1: 39 000, в Финляндии - 1: 50 000. Патогенез: Нарушения при атрофии зрительных нервов Лебера ограничиваются преимущественно ганглиозными клетками сетчатки с сохраненным пигментным эпителием и слоя фоторецепторов. При заболевании обнаруживают аксональную дегенерацию, демиелинизацию и атрофию зрительного пути: от зрительного нерва до латеральных коленчатых тел. Показано, что при болезни происходит ухудшение транспорта глутамата с нарушением работы митохондрий, что приводит к гибели и апоптозу ганглиозных клеток сетчатки. Однако, избирательное повреждение отдельных волокон сетчатки пока до конца не изучено.

Клинические проявления: Заболевание характеризуется острой или подострой безболезненной потерей зрения, вызванное билатеральной атрофией зрительного нерва. Возраст начала заболевания - от 8 до 60 лет, но, обычно, - на третьем десятилетии жизни. Как правило, вначале заболевания снижается острота зрения на один глаз, затем через небольшой промежуток времени (в среднем 6 -8 недель) присоединяются изменения второго зрительного нерва. Боли при движении глазных яблок не характерны для данного синдрома и чаще встречаются при остром неврите зрительного нерва. У большинства больных клинические проявления ограничиваются патологией зрительного нерва. Но в некоторых родословных атрофия зрительных нервов сочетается с симптомами, присущими митохондриальным болезням (нарушение сердечной проводимости, экстрапирамидные нарушения, судороги, сахарный диабет). Те или иные неврологические симптомы отмечены у 45 -60% лиц с LHON. Одним из относительно часто встречающихся симптомов является тремор, он встречается у 20% больных. При дифференциальной диагностике LHON должно проводиться его отграничение от ювенильных и поздних форм наследственнодегенеративных болезней центральной нервной системы.

Диагностика: При синдроме LHON ДНК-диагностика является единственным надежным диагностическим методом, поскольку в отличие от ряда других митохондриальных заболеваний LHON не имеет морфологических и биохимических маркеров.

Синдром Лея ( ПОДОСТРАЯ НЕКРОТИЗИРУЮЩАЯ ЭНЦЕФАЛОМИОПАТИЯ) LEIGH SYNDROME; LS; NECROTIZING ENCEPHALOPATHY, INFANTILE SUBACUTE, OF LEIGH; SNE; LEIGH SYNDROME DUE TO MITOCHONDRIAL COMPLEX I DEFICIENCY, INCLUDED; LEIGH SYNDROME DUE TO MITOCHONDRIAL COMPLEX III DEFICIENCY, INCLUDED; LEIGH SYNDROME DUE TO MITOCHONDRIAL COMPLEX IV DEFICIENCY, INCLUDED; LEIGH SYNDROME DUE TO MITOCHONDRIAL COMPLEX V DEFICIENCY, INCLUDED Мутации: Для данного синдрома характерна выраженная генетическая гетерогенность. К развитию СЛ приводят мутации мт. ДНК (гены, кодирующие субъединицы АТФ-азы или т. РНК), мутации ядерных генов, кодирующих полипептиды КДЦМ (NDUFS 4, NDUFS 5, NDUFS 6, NDUFS 7, NDUFS 8, NDUFV 1, SDHA), мутации ядерных генов, контролирующими сборку КДЦМ на митохондриальной мембране (SURF 1, COX 10, COX 15, SCO 2, BCS 1 L). В 20% случаев синдром Ли обусловлен мутациями T 8993 C или T 8993 G в гене АТФазы6 мт. ДНК. Уровень мутантной мт. ДНК в клетках фибробластов и лимфобластов этих пациентов очень высок (>90%) и даже у здоровых матерей пациентов может достигать 50 -75%. Тип наследования: аутосомно-рецессивный или митохондриальный Эпидемиология: относится к наиболее частым митохондриальным заболеваниям, точная частота неизвестна. Патогенез: Дефекты любого из этих генов вызывают нарушения функции КДЦМ, что приводит к основным проявлениям заболевания

Клинические проявления: В подавляющем большинстве случаев начало заболевания приходится на первые годы жизни. Во многих случаях, неврологические нарушения при синдроме Ли появляются исподволь, постепенно, только в редких случаях остро. При манифестации заболевания на первом году жизни происходит утрата ранее приобретенных психомоторных навыков, развивается диффузная мышечная гипотония, появляются нарушения вскармливания (слабость сосания, нарушения глотания, отказ от еды, необъяснимые рвоты), повышенная возбудимость или сонливость, беспричинный крик, эпилептические судороги, преимущественно миоклонического характера. При начале заболевания на втором году жизни ведущими синдромами являются задержка двигательного развития, мозжечковые расстройства (шаткость при ходьбе, дизартрия), и больные дети начинают постепенно утрачивать ранее приобретенные навыки. В последующем присоединяются генерализованные эпилептические приступы, часто развиваются дыхательные расстройства (эпизоды гипер-/апноэ, особенно во время инфекционных заболеваний, стридорозное дыхание), наружная офтальмоплегия, спонтанный нистагм, бульбарный синдром и экстрапирамидные расстройства в виде дистонии и хореиформных гиперкинезов. Течение синдрома Ли неуклонно прогрессирующее, в некоторых случаях, заболевание протекает волнообразно, эпизоды ухудшения состояния совпадают с течением инфекционных заболеваний.

Диагностика: При МРТ головного мозга выявляют билатеральные, симметричные изменения в области таламуса, моста, продолговатого мозга, базальных ганглиев и спинного мозга в виде повышения интенсивности сигнала в T 2 W изображении и FLAIR. При ЭНМГ регистрируют снижение скорости проведения по периферическим нервам, свидетельствующие о демиелинизации.

Синдром Кернс-Сейера KEARNS-SAYRE SYNDROME; KSS; OPHTHALMOPLEGIA, PIGMENTARY DEGENERATION OF RETINA, AND CARDIOMYOPATHY; OCULOCRANIOSOMATIC SYNDROME; OPHTHALMOPLEGIA-PLUS SYNDROME; MITOCHONDRIAL CYTOPATHY OPHTHALMOPLEGIA, PROGRESSIVE EXTERNAL, WITH RAGGED-RED FIBERS; CHRONIC PROGRESSIVE EXTERNAL OPHTHALMOPLEGIA WITH MYOPATHY; CPEO WITH RAGGED-RED FIBER Генетика: Этот синдром может быть обусловлен как мутациями мт. ДНК (чаще делеции или точковые мутации мт. ДНК), так и мутациями ядерного генома. Делеции мт. ДНК разных размеров (2, 0 -8, 5 кб), локализованные наиболее часто в регионе размером 11 кб от гена АТФазы 8 до ND 5, находят в большинстве тканей у подавляющего числа пациентов. В 70% случаев делеции маркированы короткими прямыми повторами нуклеотидных последовательностей. Тип наследования: большинство случаев спорадические Эпидемиология: Частота заболевания не известна Патогенез: Синдром Кернс-Сейера обусловлен крупными перестройками мт. ДНК (делеции, дупликации) как единичными, так и множественными. Наиболее распространенной является делеция 4977 п. н. (del 4977), которая встречается примерно в 40%-50% случаев. Другие делеции различного размера (от 2000 -10000 пн), как правило, уникальны для каждой семьи. В 70% случаев делеции маркированы короткими прямыми повторами и локализованы в области мт. ДНК 8300 -15400 пн. Единичные крупные перестройки мт. ДНК чаще возникают de novo и семейные случаи заболеваний встречаются крайне редко.

Клинические проявления: Заболевание дебютирует в детском возрасте. Наиболее часто заболевание манифестирует повышенной утомляемостью, мышечной слабостью, птозом, отставанием роста, которые обычно не привлекают серьезного внимания. Классическая клиническая картина синдрома описывается триадой симптомов: 1) манифестация до 20 лет; 2) прогрессирующая наружная офтальмоплегия; 3) пигментная дегенерация сетчатки. К основной триаде симптомов при данном синдроме присоединяется часто один или более из следующих симптомов: высокое содержание белка в ЦСЖ, блокада сердечной проводимости, и мозжечковая симптоматика в виде атаксии, дизартрии. Птоз, как правило, двусторонний и нередко сочетается с прогрессирующей офтальмоплегий. Наряду с глазными симптомами характерным явлется миопатический синдром, который первоначально наблюдается в лицевой мускулатуре, далее распространяеется на мышцы туловища и нижних конечностей. В результате поражения мышц гортани, глотки возникает изменения тембра голоса, поперхивания при еде, утомляемость при длительной речевой нагрузке. К категории частых, но неспецифических симптомов относятся: деменция, нейросенсорная тугоухость, снижение остроты зрения, эндокринопатии (сахарный диабет, недостаточность гормона роста, гипопаратиреоз).

Диагностика: У всех пациентов выявляют повышение лактата в крови и ЦСЖ, как в покое, так и после физической нагрузки. При ЭНМГ - регистрируют первичномышечные изменения и признаки полиневропатии. При нейрорадиологических исследованиях часто визуализируют МР-признаки поражения белого вещества в сочетании с атрофией мозжечка, коры головного мозга и мозжечка. Для ДНК-диагностики синдрома KSS мышечная ткань является предпочтительным материалом для исследования, так как процент мутантных молекул в клетках крови может быть незначительным.

Синдром Пирсона Мутация: 3 p 21 в гене LAMB 2 Тип наследования: Синдром Пирсона характеризуется врожденным нефротическим синдромом, вызванным диффузным мезангиальным склерозом и специфическими аномалиями глаза, в том числе типичным нереактивным сужением зрачка (микрокория), а также дополнительными аномалиями хрусталика и роговицы. Недавно в качестве основного генетического дефекта при таком состоянии были идентифицированы рецессивные мутации гена LAMB 2 на хромосоме 3 р21. Ген LAMB 2 кодирует белок ламинин β 2, один из компонентов трехмерных ламининов в почках, которые образуют перекрестную связь между базолатеральной мембраной подоцита и клубочковой базальной мембраной. Большинство аллелей, связанных с заболеванием и идентифицированных при синдроме Пирсона, представляли собой усекающие мутации, в результате которых происходит утрата экспрессии ламинина β 2 в почках. Экспрессия ламинина β 2 в глазах у здоровых участников контрольной группы была ярче всего выражена во внутриглазных мышцах, что предсказуемо соответствует характерной гипоплазии мерцательных и зрачковых мышц, наблюдаемой у больных пациентов. В ходе последующих исследований генотипа и фенотипа было установлено, что некоторые мутации гена LAMB 2, особенно гипоморфные миссенс-мутации, можно ассоциировать с фенотипным спектром, намного более широким, чем предполагалось ранее, в том числе изолированный врожденный нефротический синдром или врожденный нефротический синдром с незначительными изменениями глаза, непохожими на те, что отмечаются при синдроме Пирсона. Ультразвуковое исследование четырех последовательных эмбрионов в семье с синдромом Пирсона, а также положительные результаты анализа на мутации LAMB 2 постоянно указывали на явное повышение эхогенности почек и различную степень пиелоэктазии к 15 неделе беременности. Плацента была заметно увеличена. В одном случае зафиксирована водянка плода, вызванная тяжелой гипальбуминемией, что удалось установить в результате кордоцентеза. Еще у одного плода выявлена анэнцефалия. Развитие олигогидрамниона указывало на снижение почечной функции еще до родов. Исходя из проведенных исследований можно сделать вывод, что анализ мутаций LAMB 2 также следует проводить в случае изолированного врожденного нефротического синдрома, если не были обнаружены мутации NPHS 1, NPHS 2 или WTI, а также при пренатальном начале нефротического заболевания с типичными эхоструктурными находками в почках и с развивающимся олигогидрамнионом.

Спасибо за внимание!!!
Митохондриальные болезни.pptx