c0422a24fb5ef9bc8c9bab238fea1658.ppt
- Количество слайдов: 28

Митохондриальная трансляция Импорт биомакромолекул в митохондрии Митохондриальные болезни и их лечение Каменский Петр Андреевич pkame@list. ru
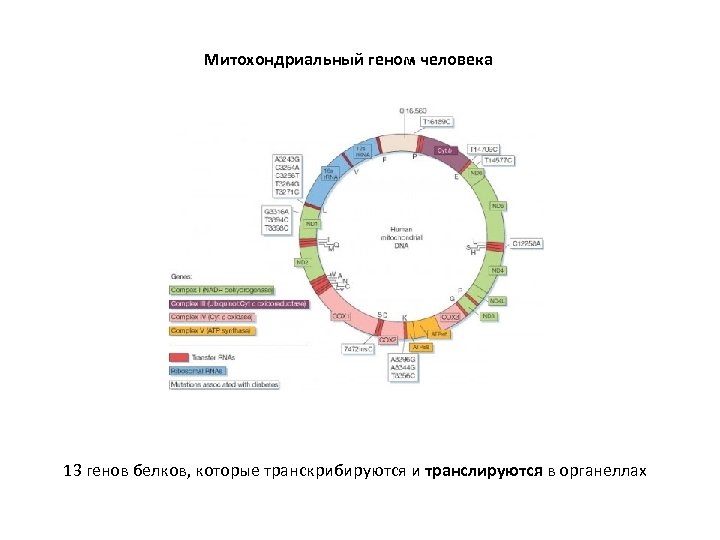
Митохондриальный геном человека 13 генов белков, которые транскрибируются и транслируются в органеллах
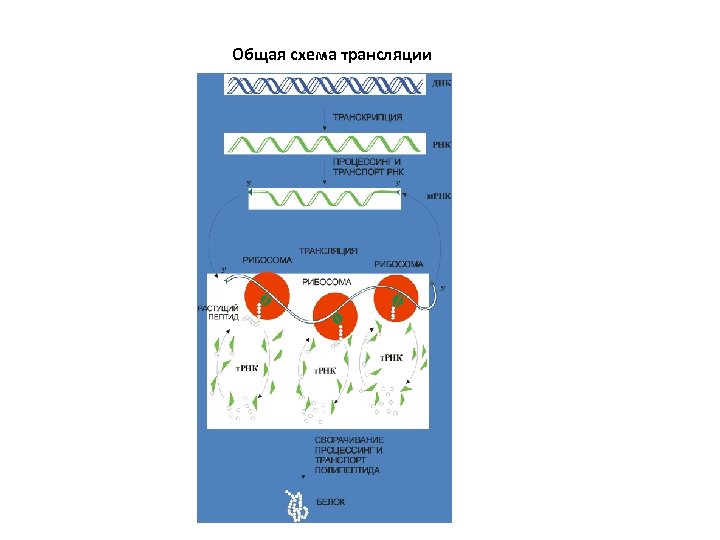
Общая схема трансляции
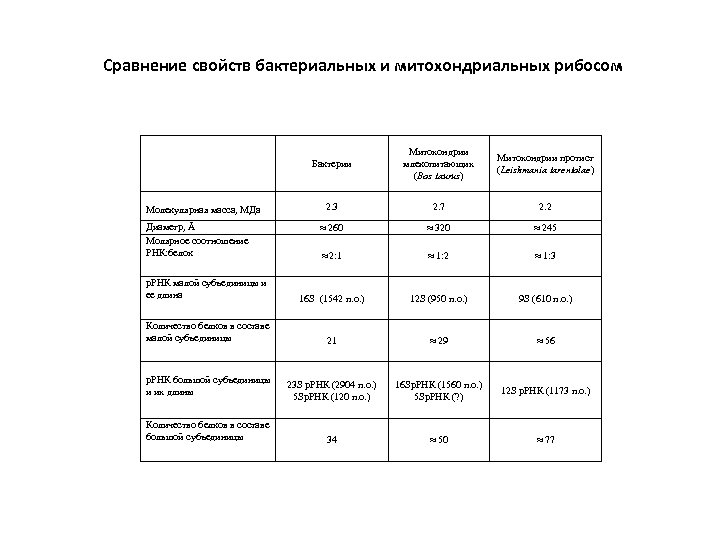
Сравнение свойств бактериальных и митохондриальных рибосом Бактерии Митохондрии млекопитающих (Bos taurus) Митохондрии протист (Leishmania tarentolae) 2. 3 2. 7 2. 2 ≈ 260 ≈ 320 ≈ 245 ≈ 2: 1 ≈ 1: 2 ≈ 1: 3 р. РНК малой субъединицы и ее длина 16 S (1542 п. о. ) 12 S (950 п. о. ) 9 S (610 п. о. ) Количество белков в составе малой субъединицы 21 ≈ 29 ≈ 56 р. РНК большой субъединицы и их длины 23 S р. РНК (2904 п. о. ) 5 Sр. РНК (120 п. о. ) 16 Sр. РНК (1560 п. о. ) 5 Sр. РНК (? ) 12 S р. РНК (1173 п. о. ) Количество белков в составе большой субъединицы 34 ≈ 50 ≈ 77 Молекулярная масса, МДа Диаметр, Å Молярное соотношение РНК: белок
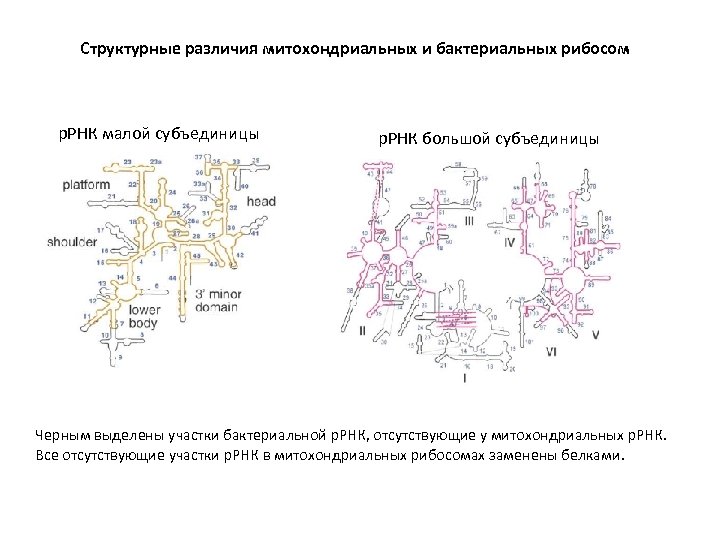
Структурные различия митохондриальных и бактериальных рибосом р. РНК малой субъединицы р. РНК большой субъединицы Черным выделены участки бактериальной р. РНК, отсутствующие у митохондриальных р. РНК. Все отсутствующие участки р. РНК в митохондриальных рибосомах заменены белками.

Структурные различия митохондриальных и бактериальных рибосом Уникальная воротообразная структура в составе большой субъединицы для входа м. РНК.

Стадии процесса трансляции 1. Инициация (рибосома связывается с сигнальными участками м. РНК и «узнает» стартовый кодон) 2. Элонгация (рибосома последовательно считывает кодоны м. РНК, присоединяя соответствующие новые аминокислоты к растущей полипептидной цепи) 3. Терминация (рибосома, дойдя до стоп-кодона, «узнает» его, в результате чего синтезированный белок высвобождается из рибосомы)
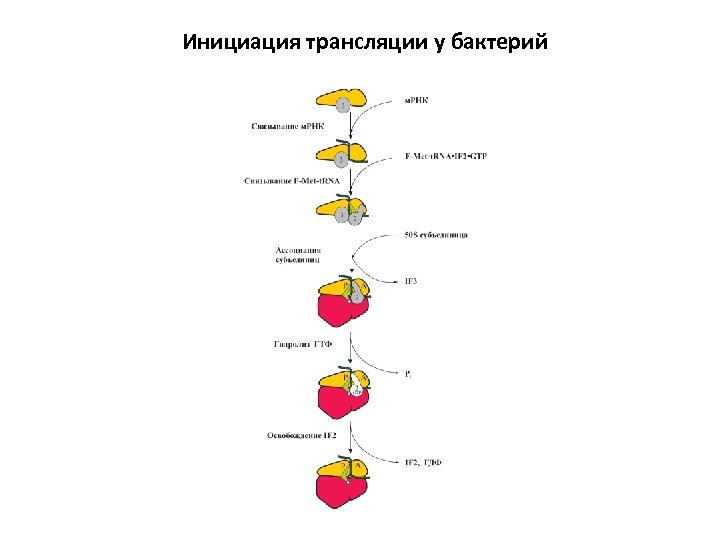
Инициация трансляции у бактерий

Основные отличия митохондриальной инициации от бактериальной 1. В митохондриях отсутствует IF 1; его роль, по-видимому, выполняет дополнительный домен белка IF 2. 2. Митохондриальные м. РНК лишены длинных 5’-некодирующих областей; более того, добавление дополнительных нуклеотидов в 5’-НКО резко снижает эффективность образования инициаторных комплексов. NB: мито-м. РНК дрожжей, напротив, содержат длинные 5’-НКО. 3. В митохондриях млекопитающих имеется всего одна метиониновая т. РНК, способная играть роль как инициаторной, так и элонгаторной т. РНК 4. Фактор IF 3 в митохондриях имеется, однако чрезвычайно сильно отличается от бактериальных гомологов. Возможно, этот белок функционирует несколько не так, как в бактериальной системе. Он также может обладать рядом дополнительных функций.
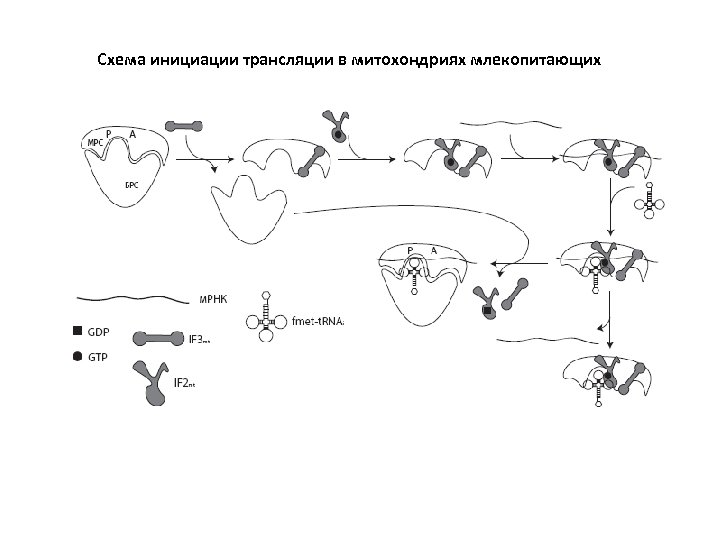
Схема инициации трансляции в митохондриях млекопитающих
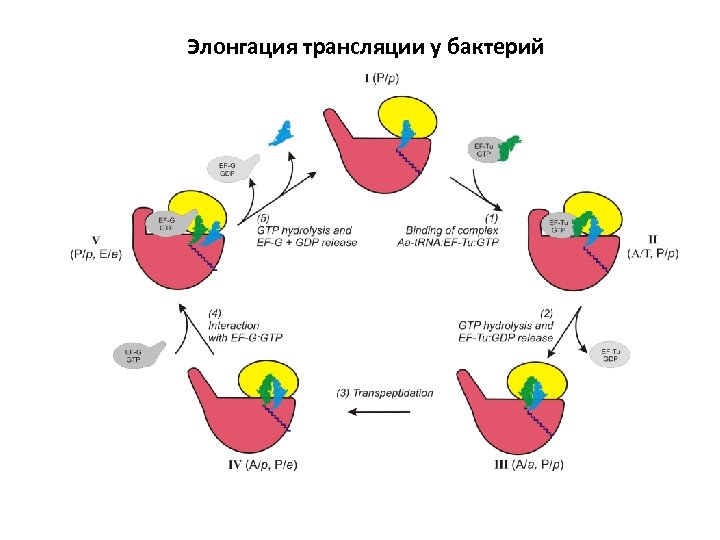
Элонгация трансляции у бактерий

Основные отличия митохондриальной элонгации от бактериальной 1. По всей видимости, в миторибосомах отсутствует Е-сайт 2. EF-Tu и EF-Ts присутствуют в митохондриях в эквимолярных концентрациях (в бактериях – 8: 1) 3. Митохондриальный EF-Ts структурно организован принципиально иначе, чем бактериальный ортолог NB: в митохондриях S. cerevisiae такого белка вообще нет 4. У бактерий один и тот же EF-G работает и в элонгации, и в терминации. В митохондриях для этого имеются два разных белка.
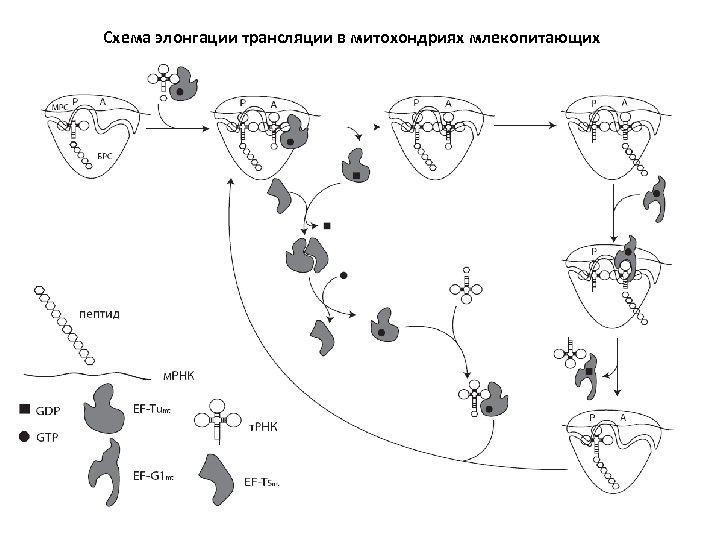
Схема элонгации трансляции в митохондриях млекопитающих
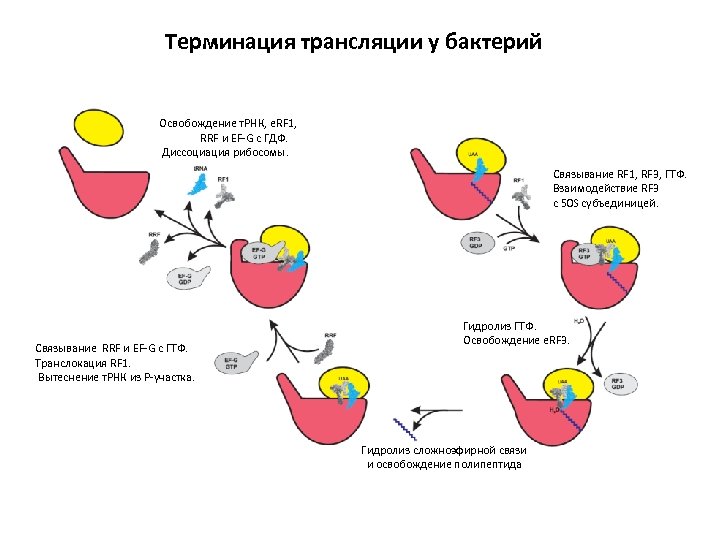
Терминация трансляции у бактерий Освобождение т. РНК, e. RF 1, RRF и EF-G с ГДФ. Диссоциация рибосомы. Связывание RF 1, RF 3, ГТФ. Взаимодействие RF 3 с 50 S субъединицей. Связывание RRF и EF-G с ГТФ. Транслокация RF 1. Вытеснение т. РНК из Р-участка. Гидролиз ГТФ. Освобождение e. RF 3. Гидролиз сложноэфирной связи и освобождение полипептида

Основные отличия митохондриальной терминации от бактериальной 1. У бактерий один и тот же EF-G работает и в элонгации, и в терминации. В митохондриях для этого имеются два разных белка. 2. Нестандартный набор стоп-кодонов? Ранее считалось, что в митохондриях человека используются нестандартные стопкодоны. Однако недавно было показано, что на самом деле там имеет место сдвиг рамки считывания на один нуклеотид, в результате чего стоп-кодон становится стандартным).
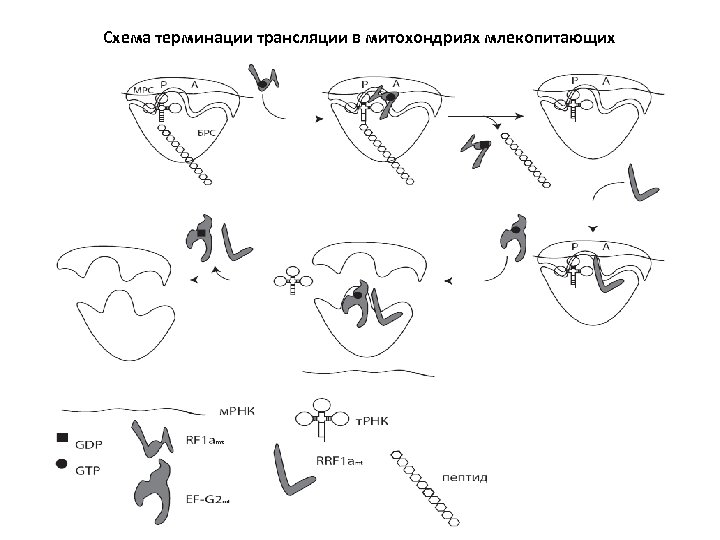
Схема терминации трансляции в митохондриях млекопитающих

Импорт биологических макромолекул в митохондрии 1. Импорт белков в митохондрии 2. Импорт РНК в митохондрии

Импорт белков в митохондрии
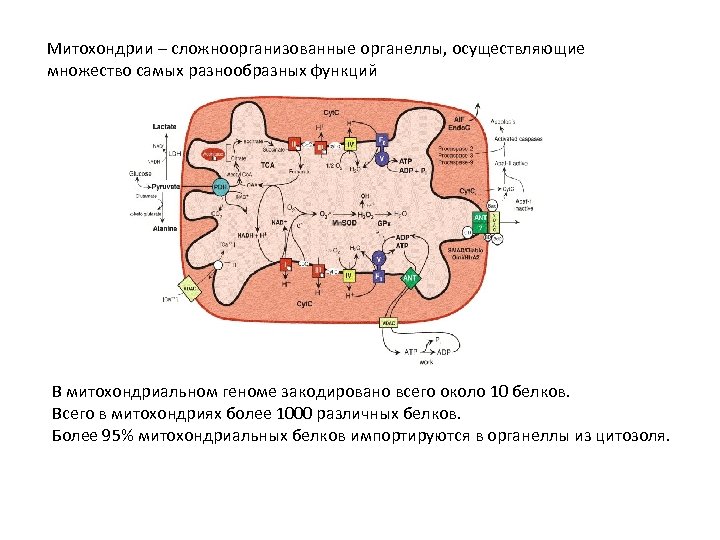
Митохондрии – сложноорганизованные органеллы, осуществляющие множество самых разнообразных функций В митохондриальном геноме закодировано всего около 10 белков. Всего в митохондриях более 1000 различных белков. Более 95% митохондриальных белков импортируются в органеллы из цитозоля.
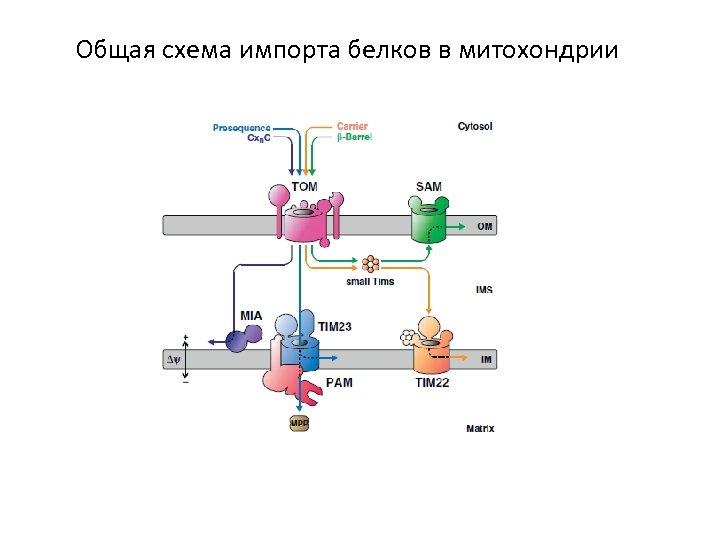
Общая схема импорта белков в митохондрии
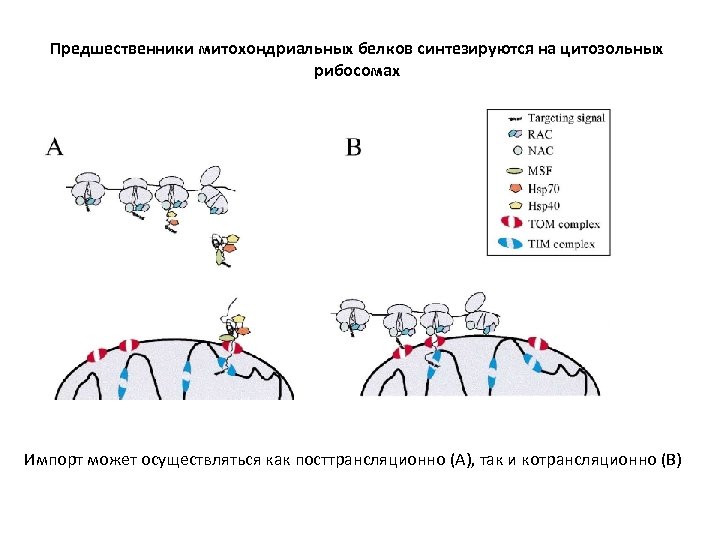
Предшественники митохондриальных белков синтезируются на цитозольных рибосомах Импорт может осуществляться как посттрансляционно (А), так и котрансляционно (В)
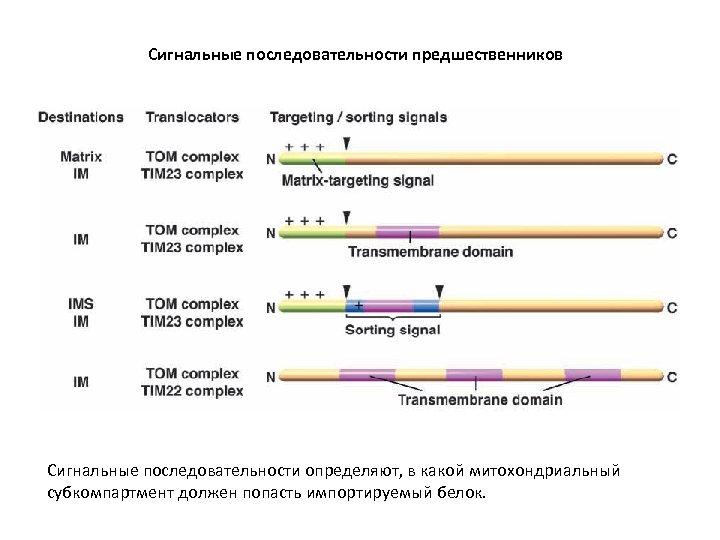
Сигнальные последовательности предшественников Сигнальные последовательности определяют, в какой митохондриальный субкомпартмент должен попасть импортируемый белок.
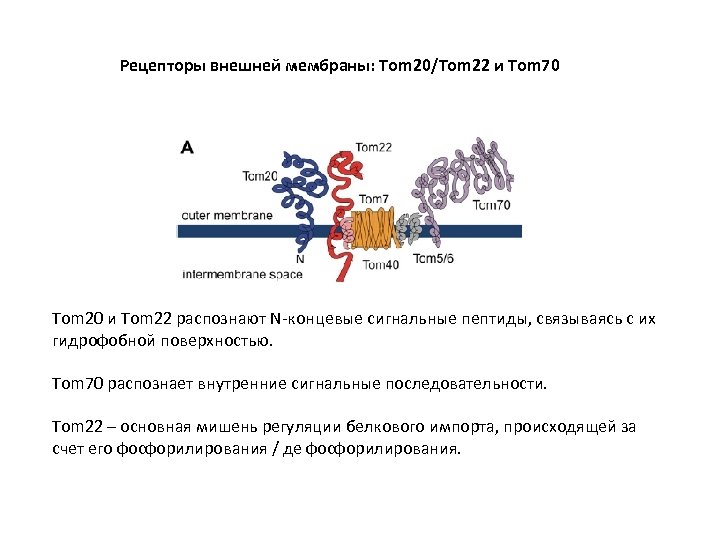
Рецепторы внешней мембраны: Tom 20/Tom 22 и Tom 70 Tom 20 и Tom 22 распознают N-концевые сигнальные пептиды, связываясь с их гидрофобной поверхностью. Tom 70 распознает внутренние сигнальные последовательности. Tom 22 – основная мишень регуляции белкового импорта, происходящей за счет его фосфорилирования / де фосфорилирования.
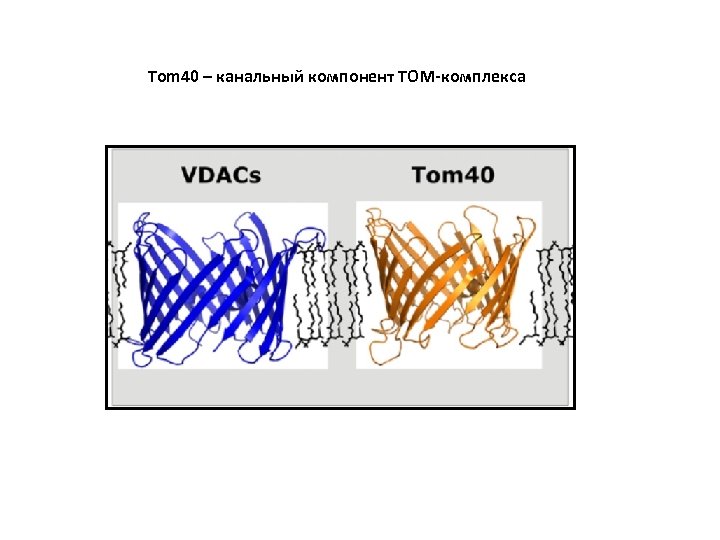
Tom 40 – канальный компонент TOM-комплекса
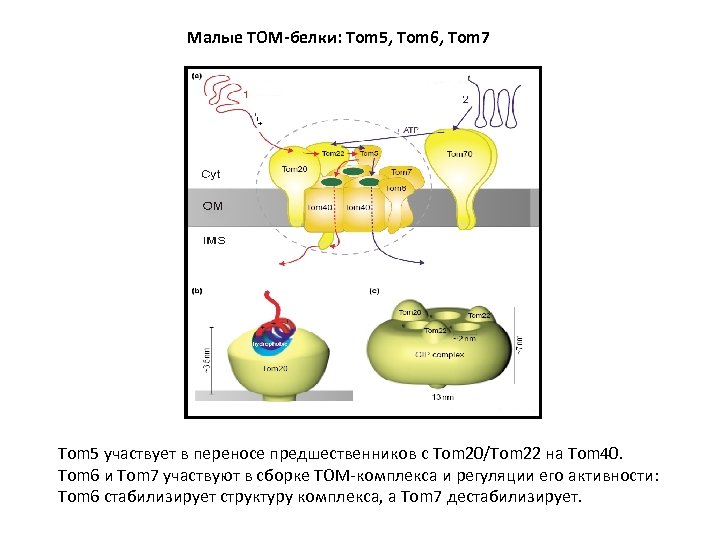
Малые TOM-белки: Tom 5, Tom 6, Tom 7 Tom 5 участвует в переносе предшественников с Tom 20/Tom 22 на Tom 40. Tom 6 и Tom 7 участвуют в сборке TOM-комплекса и регуляции его активности: Tom 6 стабилизирует структуру комплекса, а Tom 7 дестабилизирует.
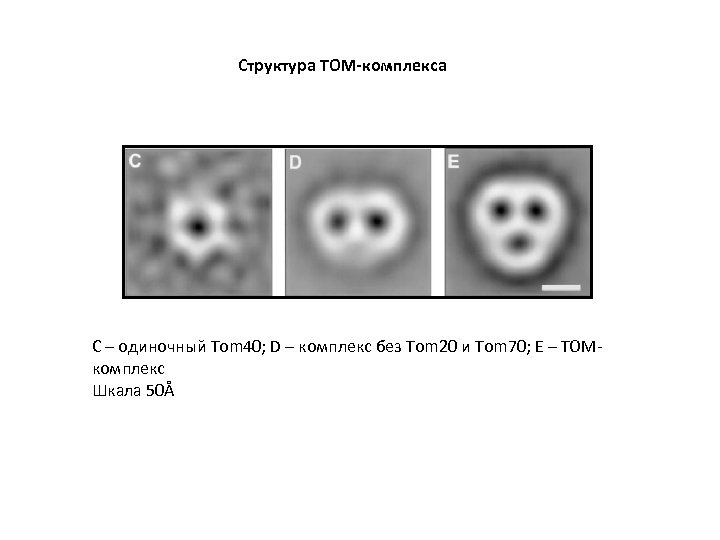
Структура TOM-комплекса С – одиночный Tom 40; D – комплекс без Tom 20 и Tom 70; E – TOMкомплекс Шкала 50Å
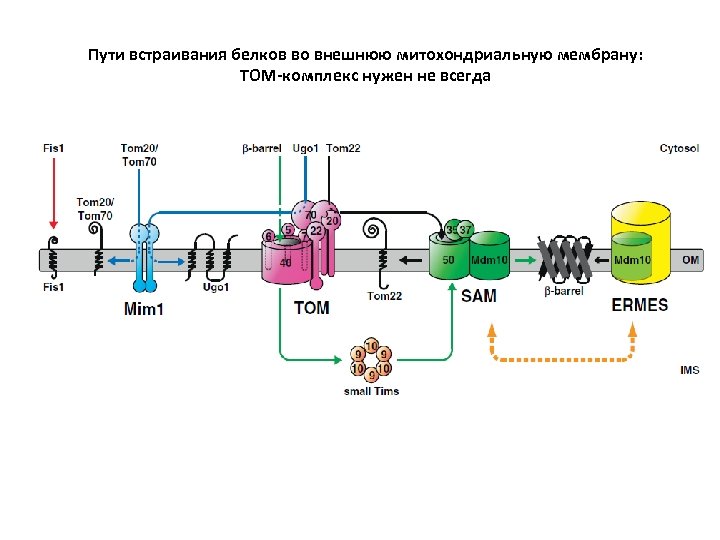
Пути встраивания белков во внешнюю митохондриальную мембрану: TOM-комплекс нужен не всегда
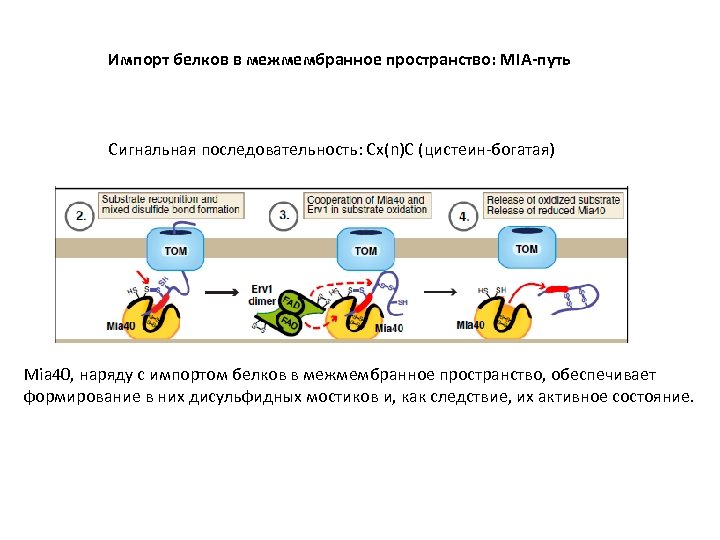
Импорт белков в межмембранное пространство: MIA-путь Сигнальная последовательность: Сх(n)C (цистеин-богатая) Mia 40, наряду с импортом белков в межмембранное пространство, обеспечивает формирование в них дисульфидных мостиков и, как следствие, их активное состояние.
c0422a24fb5ef9bc8c9bab238fea1658.ppt