МАН (2).ppt
- Количество слайдов: 23

Министерство образования и науки Автономной Республики Крым МАЛАЯ АКАДЕМИЯ НАУК ШКОЛЬНИКОВ КРЫМА «ИСКАТЕЛЬ» Секция Судакский Биологии филиал Повышение эффективности получения и использования кислородно-водородной смеси в качестве топлива Работу выполнила: Ибрагимова Фериде ученица 10 -В класса Судакской общеобразовательной Школы № 2 Научный руководитель: Крылова Н. В. учитель биологии Судакской общеобразовательной Школы № 2 Доцент, к. т. н. Верещагин В. А. Судак-2014

СОДЕРЖАНИЕ § Введение. . . . . . 3 § Раздел 1. . . . . . 5 1. 1. Бензин. . . . . . . 5 1. 2. Дизельное топливо. . . . . 6 1. 3. Этанол. . . . . . . 7 1. 4. Выводы по главе и постановка задачи на исследование. . . . 9 § Раздел 2. . . . . . 10 2. 1. Альтернативные источники (Н 2 и О 2). . . 10 2. 2. Способы получения альтернативных источников. . . . 10 § ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ. . . 13 § Обзор работ: состояние исследований. . . 13 § Способы получения исходных продуктов. . . . . 14 § Достигнутые параметры. . . . . 18 § Оценка массовых и весогабаритных параметров. . . . 21

ВВЕДЕНИЕ Актуальной задачей энергетического машиностроения, транспортных средств различного назначения является определение и создание топлива экологически чистого, способного выделять энергию за малое время, имеющее высокое теплосодержание (энтальпию), широко распространенного в природе и сравнительно дешевого. Таким источником энергии является водородно-кислородная смесь. Запасы этих веществ практически неисчерпаемы (вода, атмосфера и т. д. ) В данной работе рассматривается известное нам состояние вопроса по получению и использованию смеси, оцениваются возможности и перспективы развития этого направления, даются предположения и рекомендации по проведению исследования.

§ Проблема: обеспечение экологической безопасности населения при использовании транспортных систем. § Цель: определение и создание топлива с помощью ВЭС экологически чистого на основе кислородноводородной смеси. § Для достижения цели были поставлены следующие задачи: 1. Ознакомиться с материалом по изучаемой проблеме. 2. Обработка информации. 3. Нахождение путей решения проблемы. 4. Разработка схемы и устройства с помощью ВЭС системы получения и использования кислородноводородного топлива. § Метод исследования: анализ полученной информации, опрос специалистов, моделирование, физико-химические оценки параметрам.

Раздел 1. Бензин Бензи н — горючая смесь лёгких углеводородов с температурой кипения от 33 до 205 °C (в зависимости от примесей). Плотность около 0, 71 г/см³. Теплотворная способность примерно 10 200 ккал/кг (46 МДж/кг, 34, 5 МДж/литр). Температура замерзания − 71 °C в случае использования специальных присадок. Получение Долгое время бензин получали путём ректификации (перегонки) и отбора фракций нефти, выкипающих в определённых температурных пределах (до 100 °C — бензин I сорта, до 110 °C — бензин специальный, до 130 °C — бензин II сорта). В первой половине XX века для повышения октанового числа начали применять крекинг и риформинг, которые преобразуют линейные цепочки нормальных алканов — основной составляющей прямогонного бензина — в разветвлённые алканы и ароматические соединения соответственно. Применение В конце XIX века единственным способом применения бензина было использование его в качестве антисептического средства и топлива для примусов. В основном из нефти отгоняли только керосин, а всё остальное утилизировали. После появления двигателя внутреннего сгорания, работающего по циклу Отто, бензин стал одним из главных продуктов нефтепереработки. Однако по мере распространения дизельных двигателей на первый план стало выходить дизельное топливо, благодаря более высокому КПД. Бензин применяется как топливо для карбюраторных и инжекторных двигателей, высокоимпульсное ракетное топливо (Синтин), при производстве парафина, как растворитель, как горючий материал, сырье для нефтехимии прямогонный бензин или бензин газовый стабильный (БГС).

Дизельное топливо (устар. соляр, разг. солярка, соляра) — жидкий продукт, использующийся как топливо в дизельном двигателе внутреннего сгорания. Обычно под этим термином понимают топливо, получающееся из керосиново-газойлевых фракций прямой перегонки нефти. Название «солярка» происходит из немецкого Solaröl (солнечное масло) — так ещё в 1857 году называли более тяжёлую фракцию, образующуюся при перегонке нефти. Фракция названа так в связи с желтоватым цветом. Применение Основные потребители дизельного топлива — железнодорожный транспорт, грузовой автотранспорт, водный транспорт, военная техника, дизельные электрогенераторы, сельскохозяйственная техника, а также в последнее время и легковой дизельный автотранспорт. Кроме дизельных двигателей, остаточное дизельное топливо (соляровое масло) зачастую используется в качестве котельного топлива, для пропитывания кож, в смазочно-охлаждающих средствах и закалочных жидкостях, при механической и термической обработке металлов. Основная характеристика топлива Различают дистиллятное маловязкое — для быстроходных, и высоковязкое, остаточное, для тихоходных (тракторных, судовых, стационарных и др. ) двигателей. Дистиллятное состоит из гидроочищенных керосино-газойлевых фракций прямой перегонки и до 1/5 из газойлей каткрекинга и коксования. Вязкое топливо для тихоходных двигателей является смесью мазутов с керосиново-газойлевыми фракциями. Теплота сгорания дизельного топлива в среднем составляет 42624 к. Дж/кг (10180 ккал/кг).

Этанол Этано л (эти ловый спирт, метилкарбино л, ви нный спирт или алкого ль, часто в просторечии просто «спирт» ) — одноатомный спирт с формулой CH 5 OH (эмпирическая формула C 2 H 6 O), другой вариант: CH 3 -CH 2 -OH, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость. Действующий компонент алкогольных напитков, являющийся депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека. Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его). Получение Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена): Брожение Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п. ) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её схему можно выразить уравнением: C 6 H 12 O 6 → 2 C 2 H 5 OH + 2 CO 2. Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции. Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.

Гидратация этилена В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам: прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест: CH 2=CH 2 + H 2 O → C 2 H 5 OH. гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80— 90 °С и давлении 3, 5 МПа): CH 2=CH 2 + H 2 SO 4 → CH 3 -CH 2 -OSO 2 OH (этилсерная кислота). CH 3 -CH 2 -OSO 2 OH + H 2 O → C 2 H 5 OH + H 2 SO 4. Эта реакция осложняется образованием диэтилового эфира. Применение Топливо Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» ), двигателей внутреннего сгорания в чистом виде. Ограниченно в силу своей гигроскопичности (отслаивается) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-третбутилового эфира, более независимого от ископаемой органики, чем МТБЭ.

Выводы по главе и постановка задачи на исследование

Раздел 2 Альтернативные источники (Н 2 и О 2) Способы получения альтернативных источников. Водородно-кислородная смесь – это такой источник энергии, который способен выделять энергию за малое время, имеющий высокое теплосодержание (энтальпию), широко распространенный в природе и сравнительно дешевый. Далее мы видим таблицу, полученную от работников ВЭС, по работе Судакской ВЭС за 2006 год. То есть, по ней видно, откуда мы можем брать и перерабатывать водород для нашего топлива. (См. таблицу 1)
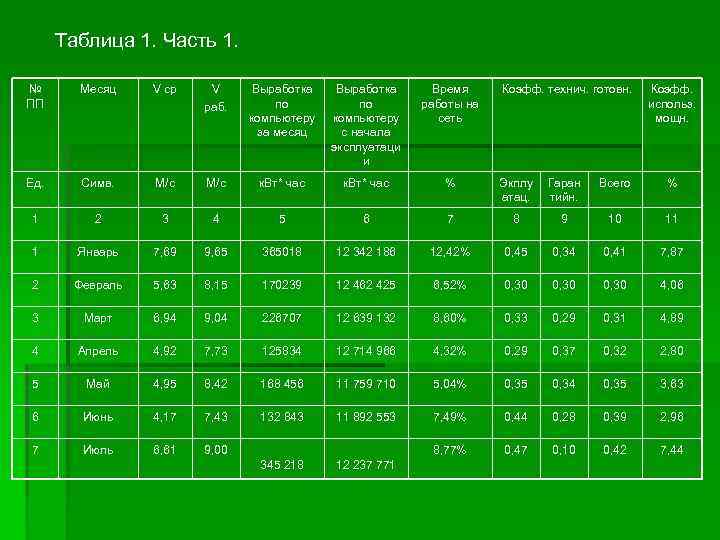
Таблица 1. Часть 1. № ПП Месяц V ср V раб. Выработка по компьютеру за месяц Выработка по компьютеру с начала эксплуатаци и Время работы на сеть Ед. Симв. М/с к. Вт* час % Экплу атац. Гаран тийн. Всего % 1 2 3 4 5 6 7 8 9 10 11 1 Январь 7, 69 9, 65 365018 12 342 186 12, 42% 0, 45 0, 34 0, 41 7, 87 2 Февраль 5, 63 8, 15 170239 12 462 425 6, 52% 0, 30 4, 06 3 Март 6, 94 9, 04 226707 12 639 132 8, 60% 0, 33 0, 29 0, 31 4, 89 4 Апрель 4, 92 7, 73 125834 12 714 966 4, 32% 0, 29 0, 37 0, 32 2, 80 5 Май 4, 95 8, 42 168 456 11 759 710 5, 04% 0, 35 0, 34 0, 35 3, 63 6 Июнь 4, 17 7, 43 132 843 11 892 553 7, 49% 0, 44 0, 28 0, 39 2, 96 7 Июль 6, 61 9, 00 8, 77% 0, 47 0, 10 0, 42 7, 44 345 218 12 237 771 Коэфф. технич. готовн. Коэфф. использ. мощн.

Таблица 1. Часть 2. № ПП Месяц V ср. V раб. Выработка по компьютер у за месяц Выработка по компьютеру с начала эксплуатаци и Время работы на сеть Ед. Симв. М/с к. Вт* час % Эксп луат. Гара нт. Всего % 1 2 3 4 5 6 7 8 9 10 11 8 Август 4, 90 7, 32 112 508 12 350 279 4, 30% 0, 52 0, 19 0, 48 2, 43 9 Сентябрь 5, 12 7, 61 162 802 12 513 081 6, 46% 0, 52 0, 13 0, 47 3, 63 10 Октябрь 5, 80 7, 64 226 189 12 739 270 8, 77% 0, 46 0, 20 0, 43 4, 88 11 Ноябрь 5, 31 8, 70 204 810 12 944 080 7, 56% 0, 41 0, 28 0, 40 4, 56 12 Декабрь 5, 44 8, 21 245 185 13 189 265 8, 46% 0, 42 0, 33 0, 41 5, 29 5, 62 8, 24 2 485 809 13 189 265 7, 39% 0, 42 0, 26 0, 39 4, 54 Всего Ст. НСС О. В. Белов Начальник Судакской ВЭС А. Г. Лещенко Коэфф. технич. готовн. Коэф ф. испо льз. мощн.

ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ Обзор работ: состояние исследований. Проблема создания водородно-кислородного топлива включает решение двух основных задач: § получение (и хранение) водорода и кислорода; § Организация термохимической реакции с максимальной эффективностью энерговыделения. Среди наиболее удовлетворительных способов получения интересующих нас газов выделяют: фотосинтез, размножение биомасс, химические реакции (растворение Zn в H 2 SO 4 или Al в Na. OH), термохимические (при прохождении паров H 2 O через железные стружки или ? высокой температуры), электрохимические (электролиз водных растворов), плазмохимические и криогенные. Рассмотрим кратко возможности указанных способов и пути их улучшения.

Способы получения исходных продуктов. § А) Фотообразование свободного водорода. Происходит при фотосинтезе в биообъёмах при определенных условиях. Например, в одноклеточных водорослях в анаэробных условиях (Гоффман). В технических лабораториях ? ? влияют в изолированных хлоропластах при освещении и в присутствии гидрогенезы [ «Будущее науки» , М, 3, 1979 г. , с. 158]. Утверждается достаточно высокая эффективность преобразования энергии света. Учитывая значительный радиационный энергобаланс в Крыму: (2. 510: 2500) МДж/м²×год [ «Климат и опасные гидрометеоявления в Крыму» под ред. Логвинова, Гидрометеоиздат , 1982 г. ] данный способ требует внимания.

§ Б) Переработка биомассы в горючие газы, в том числе и водород. За счет интенсифицированного разложения (гниения) биомассы, например, от отходов коровника на 300 голов можно получить энергию до 60 к. Вт. Стоимость проекта 200 тыс. $. § В) Термохимические явления. Имеют место в металлургии. Водород образуется при пропускании паров воды через раскалённые среды, эффективность процесса: 5% от массы воды. Отличается высокой продуктивностью, не требует сепарации газов.

§ Г) Электролиз водных растворов. Наиболее отработанный и распространенный. Производится в основном в щелочных растворах (KOH или Na. OH) ввиду агрессивности кислотных. Способ основан на электрохимической реакции на электродах с выделением на них Н 2 и О 2: Н 2 О = Н 2+ О 2 на катоде: Н 2 О+2 e− = 2 ОН− +Н 2 на аноде: 2 ОН−− 2 e− =Н 2 О+ О 2 для щелочных сред. В промышленности применяют около 100 типов электролизёров. На наш взгляд наиболее эффективны электросистемы разложения вода типа «Де Норд» и «Ф-В» . Позволяют получать газы высокой степени чистоты (не менее 99, 5%) при расходе электроэнергии 5. 84 к. Вт×ч на 1 м³ водорода. В качестве электролита использовался водный раствор КОН (16 -20%). Значительный интерес представляет схема электроразложения Н 2 О в электролизёре с твёрдым электролитом (Zr. O 2) при t~850 °C. (См. рис. 1).

Рисунок 1. Ячейка электролизёра.

Достигнутые параметры. § а) при плотности тока j=10 А/дм 2 (U~0, 9 В) коэффициент исследования воды был Ги~28%, выделялось водорода GH 2=6, 6 л/час, кислорода GО 2=3, 2 л/час при расходе электроэнергии Р=2, 4 к. Вт×час на 1 м³ Н 2. § б) при j=60 А/дм 3 (U~1, 7 В), Ги~84%, GH 2=41, 6 л/час, GО 2=21 л/час, Р=4 к. Вт×час на 1 м³ Н 2. Если вместо паров Н 2 использовалась вода, то Р=6 к. Вт×час. Утверждается, что Р может быть уменьшена до Р=2 к. Вт×час/ м³ путём внешних воздействий (магнитными полями, ультразвуком и т. п. ) или увеличением j. § в) Получение Н 2 и О 2 в газовых разрядах. Известны 2 крайних разновидности этого явления: диэлектрический нагрев и термическая диссоциация паров воды между обкладками конденсатора, подсоединенного к ВЧ-генератору; газовый разряд с образованием плазмы и последующим извлечением ионов Н 2 и О 2 в разные стороны (рис. 2).
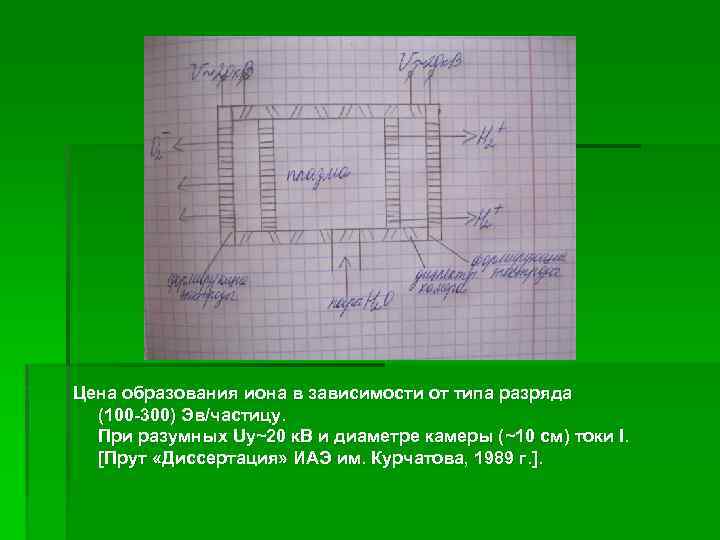
Цена образования иона в зависимости от типа разряда (100 -300) Эв/частицу. При разумных Uy~20 к. В и диаметре камеры (~10 см) токи I. [Прут «Диссертация» ИАЭ им. Курчатова, 1989 г. ].

При горении водорода выделяется энергия Q=68 к. Дж/моль=14 м. /кг, которая может быть использована для совершения механической работы (например, в камере двигателя внутреннего сгорания). Кроме этого, преобразование химической энергии Н 2 и О 2 непосредственно в электрическую-топливные элементы (ТЭ). Н 2=2 Н++2 е- - на аноде О 2+2 Н 2 О+4 е-=4 ОН- - на катоде К. П. Д. процессов преобразования для достаточно “чистой” системы и не требующей энергозатрат достигает ~ (80 -90)%. [Эрдей-Груз, «Химические источники энергии» , Мир, 1979 г. ]. Поэтому основные расходы (экономические) связаны с получением исходных продуктов Н 2 и О 2. Оценки показывают, что при одинаковом энерговыделении стоимость бензина в (3 -4) раза меньше стоимости получения газов электролизом (Р~3 к. Вт×час/м³, стоимость 1 л бензина 2 грн, электроэнергии 0, 2 грн/к. Вт×час). Однако соображения экологии, неограниченость ресурсов по объёму и расположению могут быть решающими в выборе топлива. Кроме этого, есть пути снижения Р, в том числе предложенные и авторами работы, основанные на резонансном возбуждении степеней свободы молекул Н 2 О, предварительной инжекции свободных электронов в камеру, возбуждению в среде коллективных колебаний.
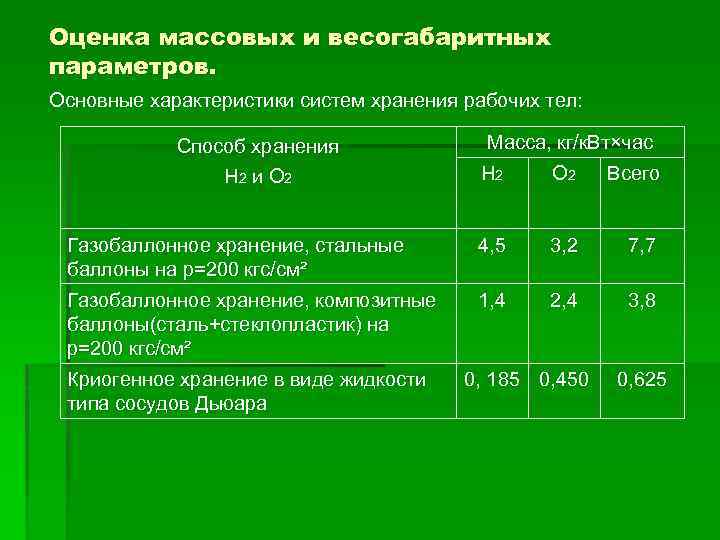
Оценка массовых и весогабаритных параметров. Основные характеристики систем хранения рабочих тел: Способ хранения Н 2 и О 2 Масса, кг/к. Вт×час Н 2 О 2 Всего Газобаллонное хранение, стальные баллоны на р=200 кгс/см² 4, 5 3, 2 7, 7 Газобаллонное хранение, композитные баллоны(сталь+стеклопластик) на р=200 кгс/см² 1, 4 2, 4 3, 8 Криогенное хранение в виде жидкости типа сосудов Дьюара 0, 185 0, 450 0, 625

Т. о. газобаллонная система по своим параметрам намного хуже криогенной системы хранения Н 2 и О 2. По расходу рабочего тела достигнуты следующие параметры: средний удельный расход реагентов 0, 4 кг/к. Вт×час, удельной энергоёмкости 1000 Вт×час/кг (для ТЭ), что значит ?

Спасибо за внимание!
МАН (2).ppt