Микросомальное окисление.ppt
- Количество слайдов: 49
 Микросомальное окисление u. Характеристика микросом u. Микросомальное окисление u. Характеристика цитохромов u. Оценка микросомального окисления u. Метаболизм чужеродных соединений u. Микросомальное окисление в норме и при патологии
Микросомальное окисление u. Характеристика микросом u. Микросомальное окисление u. Характеристика цитохромов u. Оценка микросомального окисления u. Метаболизм чужеродных соединений u. Микросомальное окисление в норме и при патологии
 Микросомы – фрагменты эндоплазматического ретикулума Функции микросом Синтез белка в рибосомах u Включение ацетата в молекулу холестерина u Биосинтез гликозамингликанов, фосфолипидов, триглицеридов u Метаболизм ксенобиотиков u
Микросомы – фрагменты эндоплазматического ретикулума Функции микросом Синтез белка в рибосомах u Включение ацетата в молекулу холестерина u Биосинтез гликозамингликанов, фосфолипидов, триглицеридов u Метаболизм ксенобиотиков u
 Микросомы - фрагменты эндоплазматического ретикулума u Получают при центрифугировании в градиенте плотности сахарозы при 105000 g в течение 1 часа u К микросомам относятся две подфракции: 1) шероховатый ЭПР - при высокой концентрации сахарозы 2) гладкий ЭПР - при низкой концентрации сахарозы u ШЭР содержит рибосомы, способен к синтезу белка, гликозилированию и синтезу мембран u ГЭР содержит ферменты цепи переноса электронов, осуществляет процесс микросомального окисления и метаболизм ксенобиотиков u Маркерный фермент – глюкозо-6 -фосфатаза
Микросомы - фрагменты эндоплазматического ретикулума u Получают при центрифугировании в градиенте плотности сахарозы при 105000 g в течение 1 часа u К микросомам относятся две подфракции: 1) шероховатый ЭПР - при высокой концентрации сахарозы 2) гладкий ЭПР - при низкой концентрации сахарозы u ШЭР содержит рибосомы, способен к синтезу белка, гликозилированию и синтезу мембран u ГЭР содержит ферменты цепи переноса электронов, осуществляет процесс микросомального окисления и метаболизм ксенобиотиков u Маркерный фермент – глюкозо-6 -фосфатаза
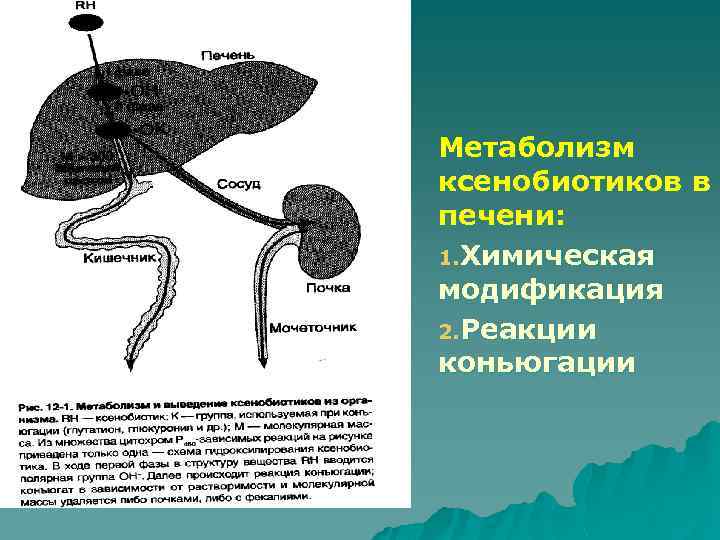 Метаболизм ксенобиотиков в печени: 1. Химическая модификация 2. Реакции коньюгации
Метаболизм ксенобиотиков в печени: 1. Химическая модификация 2. Реакции коньюгации
 NADPH –зависимая цепь
NADPH –зависимая цепь
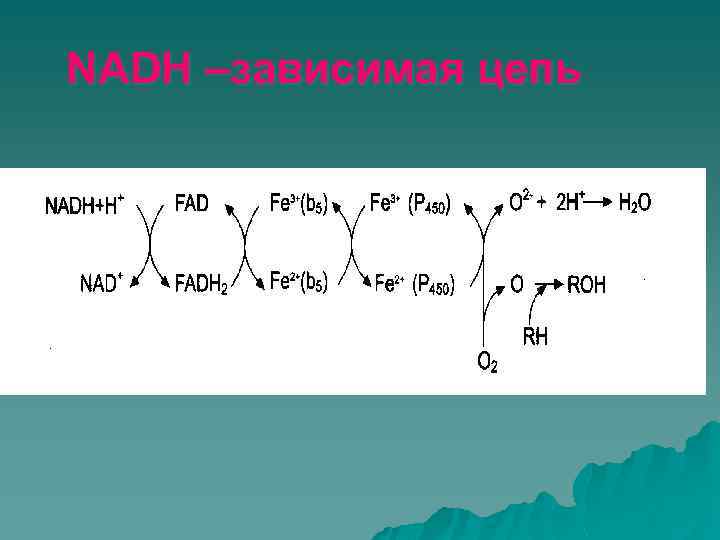 NADH –зависимая цепь
NADH –зависимая цепь
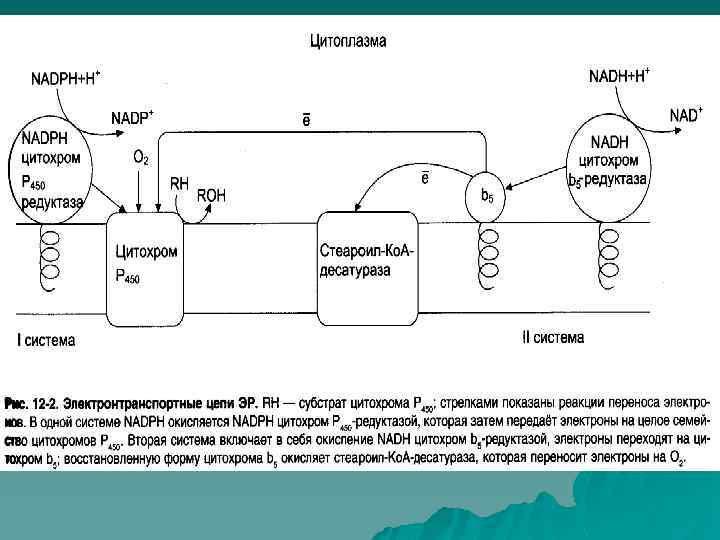
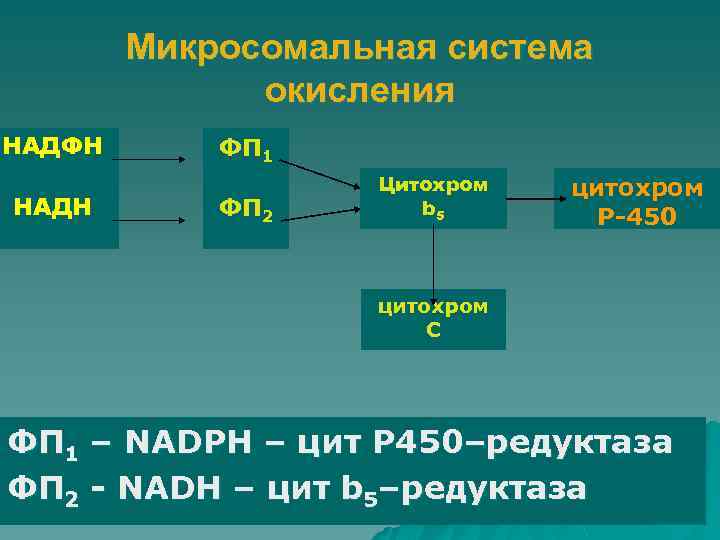 Микросомальная система окисления НАДФН НАДН ФП 1 ФП 2 Цитохром b 5 цитохром P-450 цитохром С ФП 1 – NADPH – цит P 450–редуктаза ФП 2 - NADH – цит b 5–редуктаза
Микросомальная система окисления НАДФН НАДН ФП 1 ФП 2 Цитохром b 5 цитохром P-450 цитохром С ФП 1 – NADPH – цит P 450–редуктаза ФП 2 - NADH – цит b 5–редуктаза

 Гидроксилирование осуществляется по монооксигеназному типу: SH + НАДФН + О 2 + Н+ SOH + H 2 O + НАДФ+ SH – окисляемый субстрат НАДФН – донор электронов SOH – гидроксилированный продукт
Гидроксилирование осуществляется по монооксигеназному типу: SH + НАДФН + О 2 + Н+ SOH + H 2 O + НАДФ+ SH – окисляемый субстрат НАДФН – донор электронов SOH – гидроксилированный продукт
 Цитохром Р-450 Цитохром P-450 -комплекс белка с гемом (фосфолипидпротогемсульфидпротеиновый комплекс), гидрофобный белок, локализованный внутри мембраны (45 – 55 к. Dа) u Простетическая группа по типу гема протопорфирина IX содержит ион Fe 3+ в гидрофобной полости, активном центре цитохрома P-450. u Fe 3+ в поле лиганда сильно искажено, что регистрируется необычным для него спектром поглощения в области 450 нм u u
Цитохром Р-450 Цитохром P-450 -комплекс белка с гемом (фосфолипидпротогемсульфидпротеиновый комплекс), гидрофобный белок, локализованный внутри мембраны (45 – 55 к. Dа) u Простетическая группа по типу гема протопорфирина IX содержит ион Fe 3+ в гидрофобной полости, активном центре цитохрома P-450. u Fe 3+ в поле лиганда сильно искажено, что регистрируется необычным для него спектром поглощения в области 450 нм u u
 Цитохром Р 450 имеет участки связывания для кислорода и субстрата (ксенобиотика) u В восстановленной форме, присоединяя СО, образует спектральный комплекс с максимумом поглощения при 450 нм u Чем больше цитохрома P-450 содержится в мембране, тем в лучшем состоянии она находится. Стареющие мембраны имеют цитохром Р-420 (неактивная форма) u
Цитохром Р 450 имеет участки связывания для кислорода и субстрата (ксенобиотика) u В восстановленной форме, присоединяя СО, образует спектральный комплекс с максимумом поглощения при 450 нм u Чем больше цитохрома P-450 содержится в мембране, тем в лучшем состоянии она находится. Стареющие мембраны имеют цитохром Р-420 (неактивная форма) u
 CYP – обозначение, принятое в современной номенклатуре u u CYP 3 А 4 –выделен из ЭПР клеток печени человека с умеренно гидрофобными свойствами Способен метаболизировать не менее 50% лекарственных веществ, имеющихся в настоящее время на фармакологическом рынке u Реакции, осуществляемые CYP, не подчиняются кинетике Михаэлиса-Ментен В гидрофобном окологемовом кармане CYP 3 А 4 одновременно могут связываться две молекулы субстрата, по-разному расположенные в активном центре u Происходит расширение области активного центра (до 80% дополнительного объема) u
CYP – обозначение, принятое в современной номенклатуре u u CYP 3 А 4 –выделен из ЭПР клеток печени человека с умеренно гидрофобными свойствами Способен метаболизировать не менее 50% лекарственных веществ, имеющихся в настоящее время на фармакологическом рынке u Реакции, осуществляемые CYP, не подчиняются кинетике Михаэлиса-Ментен В гидрофобном окологемовом кармане CYP 3 А 4 одновременно могут связываться две молекулы субстрата, по-разному расположенные в активном центре u Происходит расширение области активного центра (до 80% дополнительного объема) u
 Значение u CYP 3 А 4, обладая широкой субстратной специфичностью и гетеротропной кооперативностью, может метаболизировать лекарства с непредсказуемыми последствиями при одновременном использовании разных лекарственных средств
Значение u CYP 3 А 4, обладая широкой субстратной специфичностью и гетеротропной кооперативностью, может метаболизировать лекарства с непредсказуемыми последствиями при одновременном использовании разных лекарственных средств
 Митохондриальные цитохромы u CYP 11 А, CYP 11 В 1 и CYP 11 В 2 – в коре надпочечников, участвуют в биосинтезе стероидных гормонов, способны продуцировать АФК u. В ткани печени и почек катализируют реакции биосинтеза жирных кислот из холестерола и образования провитамина D 3
Митохондриальные цитохромы u CYP 11 А, CYP 11 В 1 и CYP 11 В 2 – в коре надпочечников, участвуют в биосинтезе стероидных гормонов, способны продуцировать АФК u. В ткани печени и почек катализируют реакции биосинтеза жирных кислот из холестерола и образования провитамина D 3
 Цитохром b 5 u u u Цитохром b 5 представляет собой гемопротеид м. м. 11– 13 к. Да, локализован на поверхности мембраны ЭР, имеет короткий спирализованный домен в липидном бислое содержит 1 моль Fe 3+ протопорфирина IX на 1 моль апофермента в окисленной форме цитохром b 5 имеет максимумом поглощения при 412– 426 нм
Цитохром b 5 u u u Цитохром b 5 представляет собой гемопротеид м. м. 11– 13 к. Да, локализован на поверхности мембраны ЭР, имеет короткий спирализованный домен в липидном бислое содержит 1 моль Fe 3+ протопорфирина IX на 1 моль апофермента в окисленной форме цитохром b 5 имеет максимумом поглощения при 412– 426 нм
 Оценка микросомального окисления u. В экспериметальных исследованиях выделяют микросомальную фракцию при 105000 g, 1 час u Записывают дифференциальный спектр в присутствии СО (восстановленный цитохром Р-450) u Добавляют индукторы: фенобарбитал, метилхолантрен
Оценка микросомального окисления u. В экспериметальных исследованиях выделяют микросомальную фракцию при 105000 g, 1 час u Записывают дифференциальный спектр в присутствии СО (восстановленный цитохром Р-450) u Добавляют индукторы: фенобарбитал, метилхолантрен
 Субстраты гидроксилирования u u I типа – гексобарбитал, амидопирин, фенобарбитал – максимум поглощения 390 нм, минимум 420 -425 нм II типа – анилин, метилхолантрен – максимум поглощения 425 -435 нм, минимум 390 -400 нм
Субстраты гидроксилирования u u I типа – гексобарбитал, амидопирин, фенобарбитал – максимум поглощения 390 нм, минимум 420 -425 нм II типа – анилин, метилхолантрен – максимум поглощения 425 -435 нм, минимум 390 -400 нм
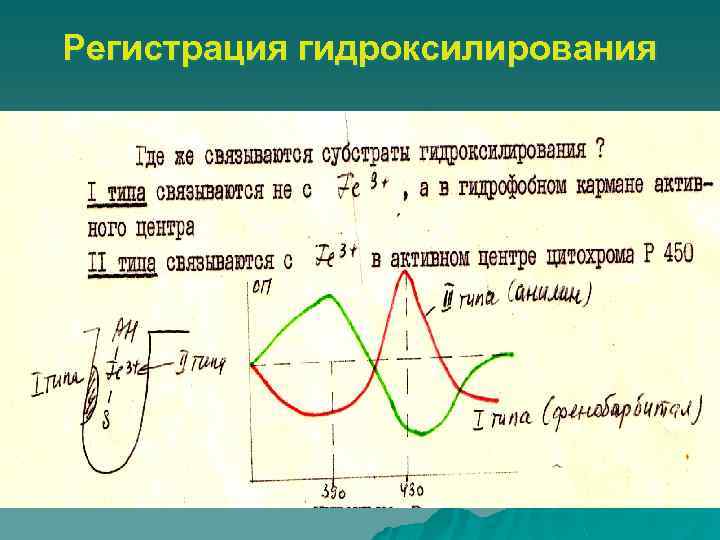 Регистрация гидроксилирования
Регистрация гидроксилирования
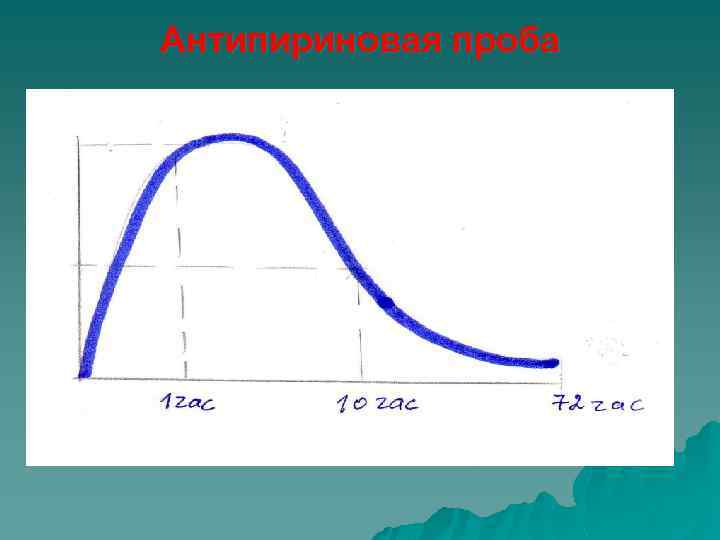 Антипириновая проба
Антипириновая проба
 Механизм гидроксилирования Схема Эстабрука 1)Связывание окисленной формы цитохрома P-450 с субстратом (Fe 3+ – S); 2) Восстановление образовавшегося комплекса в НАДФНспецифичной цепи переноса электронов (Fe 2+ – S); 3) Образование тройного комплекса: восстановленная форма цитохрома P-450 – S – O 2; 4) Активирование молекулярного кислорода в этом комплексе путем его восстановления (Fe 2+ – S – O 2· –); 5) Распад комплекса на окисленный цитохром P-450, окисленный субстрат и гидроксил (Fe 3+, SOH, OH–).
Механизм гидроксилирования Схема Эстабрука 1)Связывание окисленной формы цитохрома P-450 с субстратом (Fe 3+ – S); 2) Восстановление образовавшегося комплекса в НАДФНспецифичной цепи переноса электронов (Fe 2+ – S); 3) Образование тройного комплекса: восстановленная форма цитохрома P-450 – S – O 2; 4) Активирование молекулярного кислорода в этом комплексе путем его восстановления (Fe 2+ – S – O 2· –); 5) Распад комплекса на окисленный цитохром P-450, окисленный субстрат и гидроксил (Fe 3+, SOH, OH–).
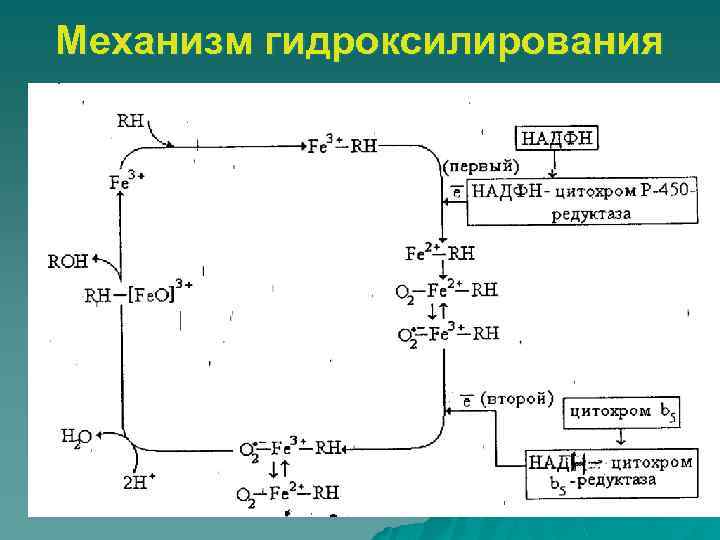 Механизм гидроксилирования
Механизм гидроксилирования

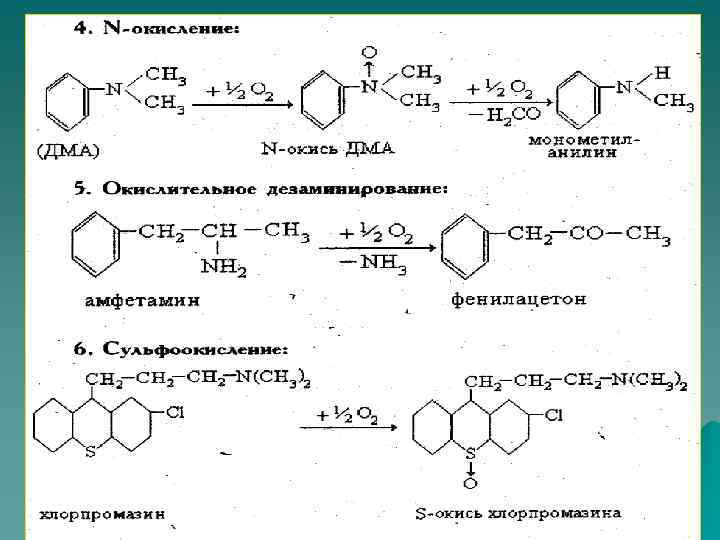
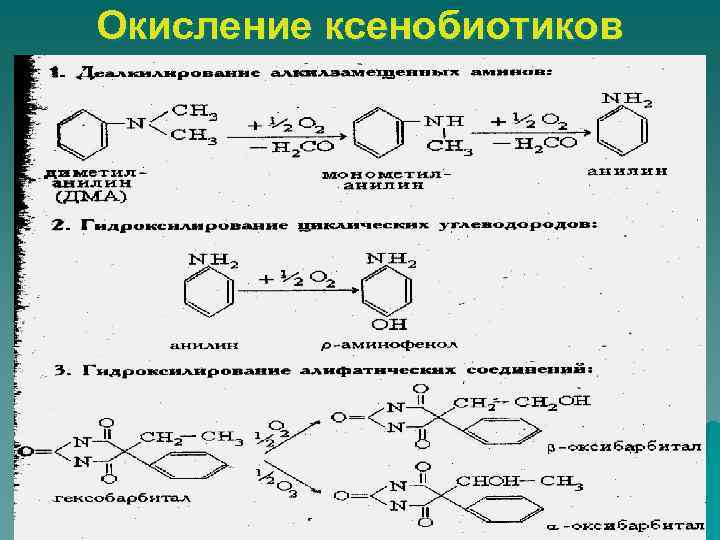 Окисление ксенобиотиков
Окисление ксенобиотиков
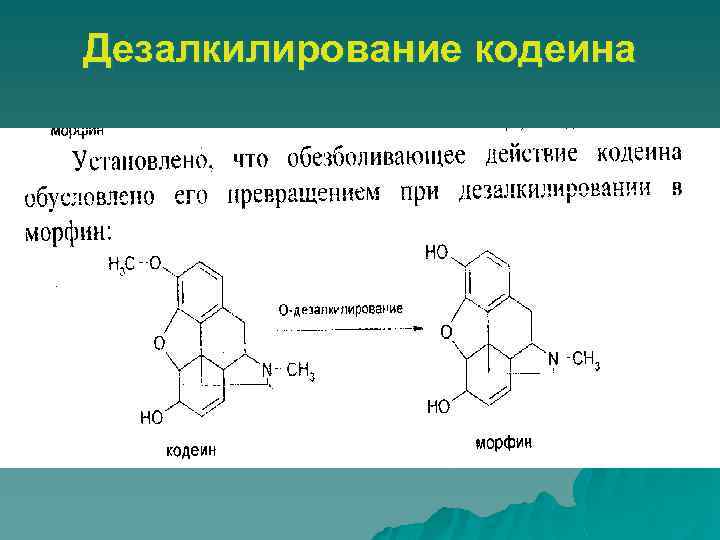 Дезалкилирование кодеина
Дезалкилирование кодеина
 Гидроксилирование ароматических соединений
Гидроксилирование ароматических соединений
 Гидроксилирование алифатических соединений
Гидроксилирование алифатических соединений
 Окисление природных субстратов
Окисление природных субстратов
 дроксилирование стероидных гормонов, холестерола и гема печени - стероидные гормоны в 2β-, 6β-, 7α-, 16αоложениях; холестерол в 7α-положении. кисление гема в билирубин. В реакции спользуются НАДФН и О 2; от гема отщепляется железо, образуется биливердин, который затем осстанавливается в билирубин. ерекисное окисление ненасыщенных жирных кислот существляется в НАДФН-специфичной цепи. Редокс-цепь ЭПР осуществляет биосинтез ростагландинов через образование ндопероксидов, промежуточных соединений
дроксилирование стероидных гормонов, холестерола и гема печени - стероидные гормоны в 2β-, 6β-, 7α-, 16αоложениях; холестерол в 7α-положении. кисление гема в билирубин. В реакции спользуются НАДФН и О 2; от гема отщепляется железо, образуется биливердин, который затем осстанавливается в билирубин. ерекисное окисление ненасыщенных жирных кислот существляется в НАДФН-специфичной цепи. Редокс-цепь ЭПР осуществляет биосинтез ростагландинов через образование ндопероксидов, промежуточных соединений
 Окисление этанола При хроническом алкоголизме окисление этанола на цитохроме Р-450 происходит более активно u в крови накапливается ацетальдегид и ацетат СН 3 – СН 2 ОН + НАДФН + Н+ + О 2 → СН 3 – СНО + НАДФ+ + Н 2 О → СН 3 СООН u Наблюдается искажение действия лекарств u Развивается толерантность к u
Окисление этанола При хроническом алкоголизме окисление этанола на цитохроме Р-450 происходит более активно u в крови накапливается ацетальдегид и ацетат СН 3 – СН 2 ОН + НАДФН + Н+ + О 2 → СН 3 – СНО + НАДФ+ + Н 2 О → СН 3 СООН u Наблюдается искажение действия лекарств u Развивается толерантность к u
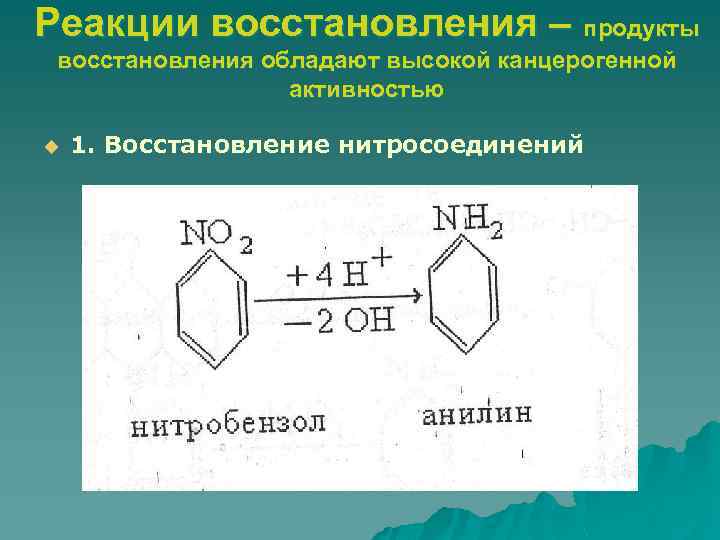 Реакции восстановления – продукты восстановления обладают высокой канцерогенной активностью u 1. Восстановление нитросоединений
Реакции восстановления – продукты восстановления обладают высокой канцерогенной активностью u 1. Восстановление нитросоединений
 Реакции восстановления u 2. Восстановительное дегалоидирование
Реакции восстановления u 2. Восстановительное дегалоидирование

 Реакции коньюгации u u u вторая фаза биотрансформации лекарственных средств и ксенобиотиков Химические соединения, которые при действии монооксигеназ получили реакционноспособные группы (OH, COOH, NH 2, SH- и др) вступают в реакции с эндогенными соединениями: глюкуроновая кислота, сульфаты, ацетил-, метил-, глицин Сульфаниламиды коньгируют с остатком уксусной кислоты Ароматические спирты, кислоты – с глюкуроновой кислотой , глицином, глутамином. u Путем коньюгации у человека метаболизируют салицилаты, алкалоиды опия, барбитураты, амидопирин, глюкокортикоиды. u Коньюгация приводит к повышению их растворимости в воде, что облегчает выведение коньюгатов из организма
Реакции коньюгации u u u вторая фаза биотрансформации лекарственных средств и ксенобиотиков Химические соединения, которые при действии монооксигеназ получили реакционноспособные группы (OH, COOH, NH 2, SH- и др) вступают в реакции с эндогенными соединениями: глюкуроновая кислота, сульфаты, ацетил-, метил-, глицин Сульфаниламиды коньгируют с остатком уксусной кислоты Ароматические спирты, кислоты – с глюкуроновой кислотой , глицином, глутамином. u Путем коньюгации у человека метаболизируют салицилаты, алкалоиды опия, барбитураты, амидопирин, глюкокортикоиды. u Коньюгация приводит к повышению их растворимости в воде, что облегчает выведение коньюгатов из организма
 Индукторы цитохрома Р-450 u Лекарственные препараты: фенобарбитал, анальгетики (амидопирин), противовоспалительные средства (бутадион), антигистаминные (димедрол), транквилизаторы (седуксен) u Стероиды (тестостерон, гидрокортизон, преднизолон) u Инсектициды (ДДТ) u Канцерогены (метилхолантрен)
Индукторы цитохрома Р-450 u Лекарственные препараты: фенобарбитал, анальгетики (амидопирин), противовоспалительные средства (бутадион), антигистаминные (димедрол), транквилизаторы (седуксен) u Стероиды (тестостерон, гидрокортизон, преднизолон) u Инсектициды (ДДТ) u Канцерогены (метилхолантрен)
 «Эффект Митридата» uцарь Митридат советовал принимать небольшие дозы яда, чтобы избежать острого отравления
«Эффект Митридата» uцарь Митридат советовал принимать небольшие дозы яда, чтобы избежать острого отравления
 Ингибиторы цитохрома Р-450 u Обратимые – эфиры, спирты, кетоны, антиоксиданты, производные бензола, алкиламины u Необратимые – алканы, олефины, меркаптиды, ионы металлов, ингибиторы белкового синтеза, тетрахлорметан
Ингибиторы цитохрома Р-450 u Обратимые – эфиры, спирты, кетоны, антиоксиданты, производные бензола, алкиламины u Необратимые – алканы, олефины, меркаптиды, ионы металлов, ингибиторы белкового синтеза, тетрахлорметан
 Тетрахлорметан
Тетрахлорметан
 Химические канцерогены Полициклические углеводороды Бензпирен бензантрацен Нитрозамины Диметилнитрозамин Диэтилнитрозамин Алкилирующие агенты Циклофосфамид Диэтилстильбестрол Природные агенты Актиномицин Д Афлатоксин В Неорганические соединения Арсенат, асбест, кадмий, хром, бериллий
Химические канцерогены Полициклические углеводороды Бензпирен бензантрацен Нитрозамины Диметилнитрозамин Диэтилнитрозамин Алкилирующие агенты Циклофосфамид Диэтилстильбестрол Природные агенты Актиномицин Д Афлатоксин В Неорганические соединения Арсенат, асбест, кадмий, хром, бериллий
 нитрозамины
нитрозамины
 Афлатоксины
Афлатоксины
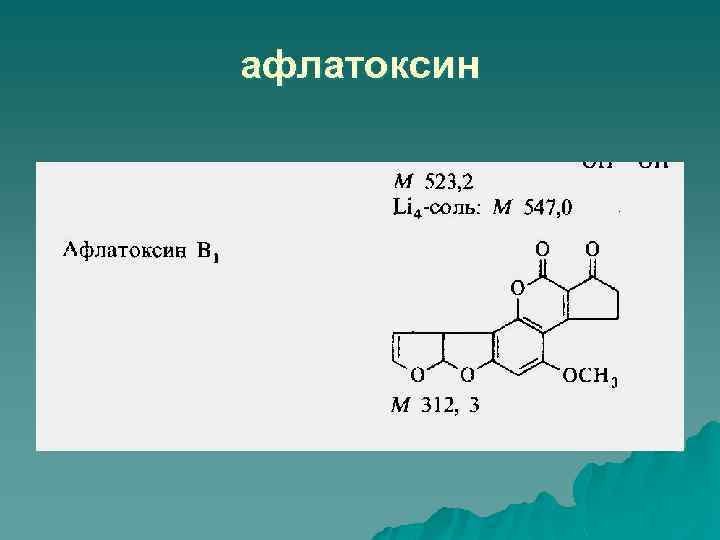 афлатоксин
афлатоксин
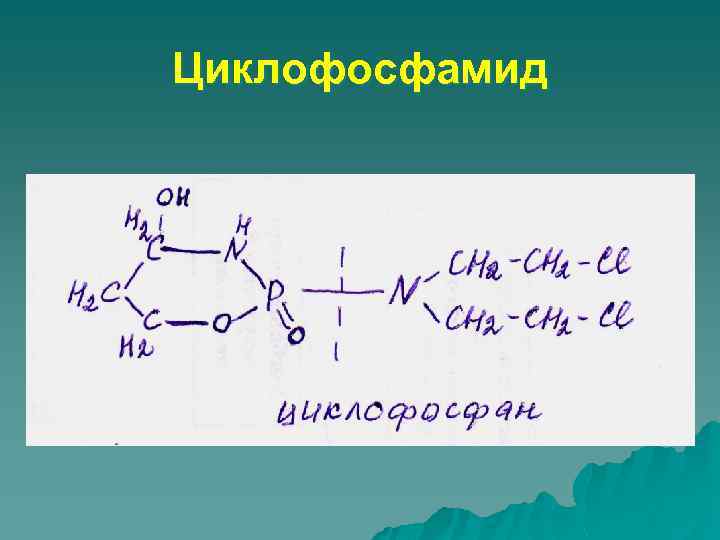 Циклофосфамид
Циклофосфамид
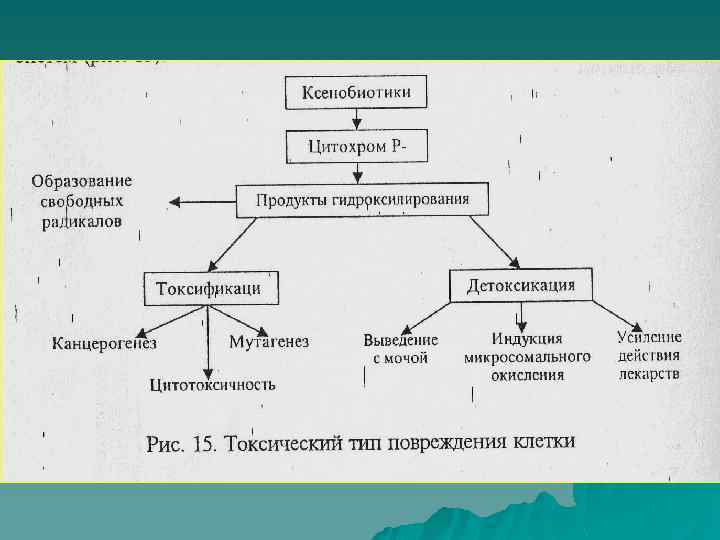
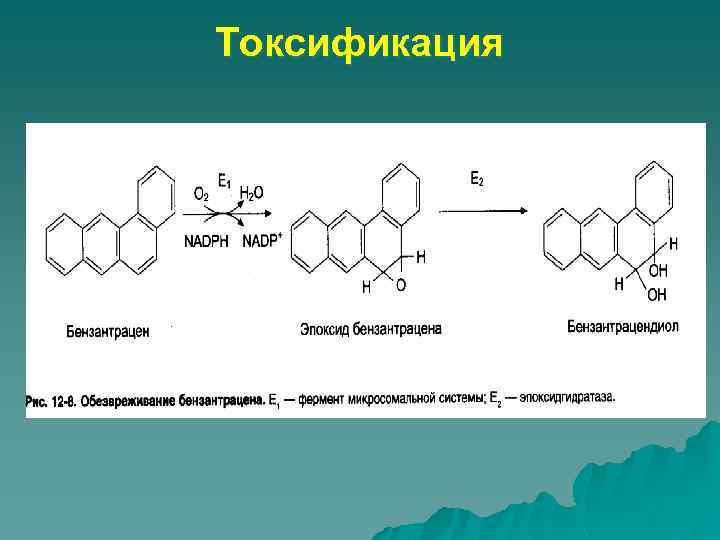 Токсификация
Токсификация
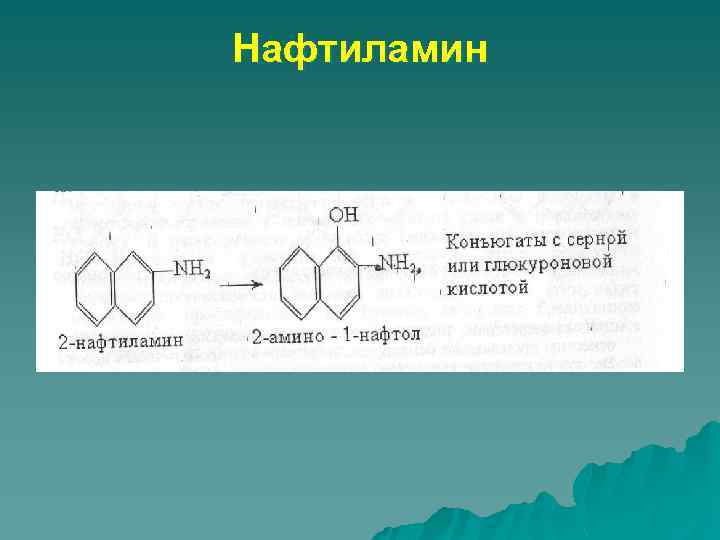 Нафтиламин
Нафтиламин
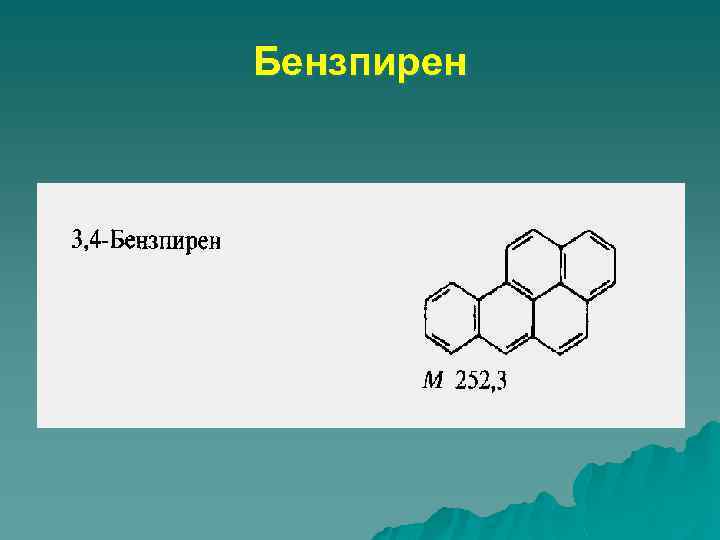 Бензпирен
Бензпирен
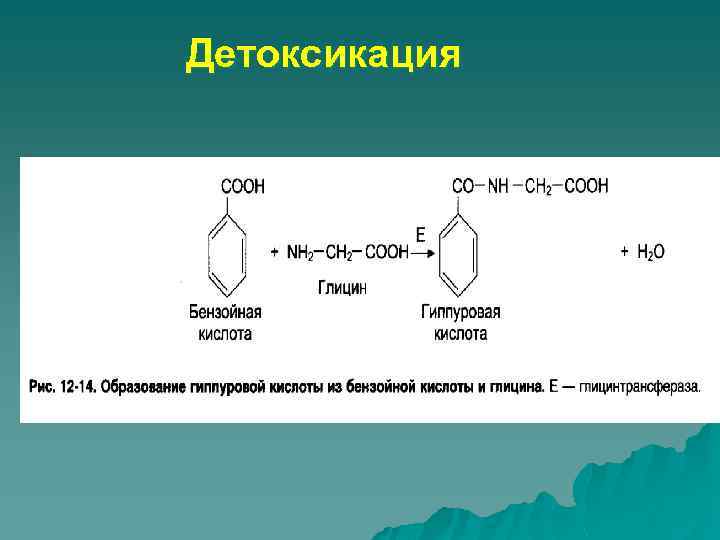 Детоксикация
Детоксикация