доклад_Сапченко.ppt
- Количество слайдов: 31

Микропористые карбоксилаты цинка – сорбционные, сенсорные свойства и соединения включения на их основе С. А. Сапченко Институт неорганической химии им. А. В. Николаева СО РАН
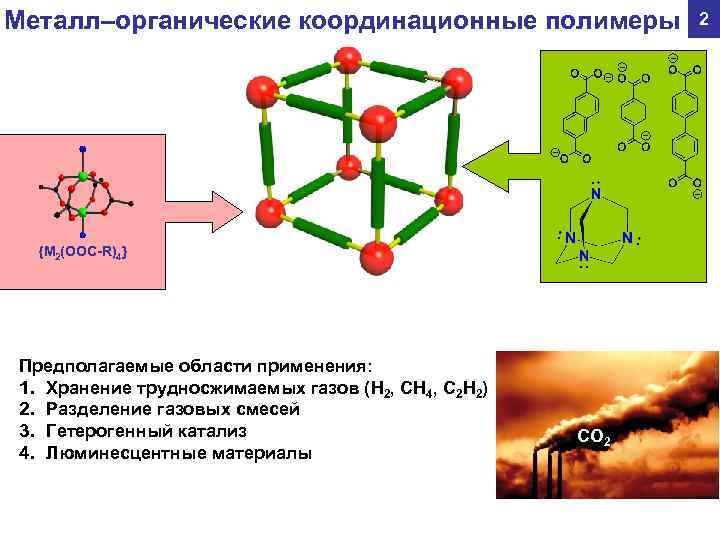
Металл–органические координационные полимеры 2 {M 2(OOC-R)4} Предполагаемые области применения: 1. Хранение трудносжимаемых газов (H 2, CH 4, C 2 H 2) 2. Разделение газовых смесей 3. Гетерогенный катализ CO 2 4. Люминесцентные материалы
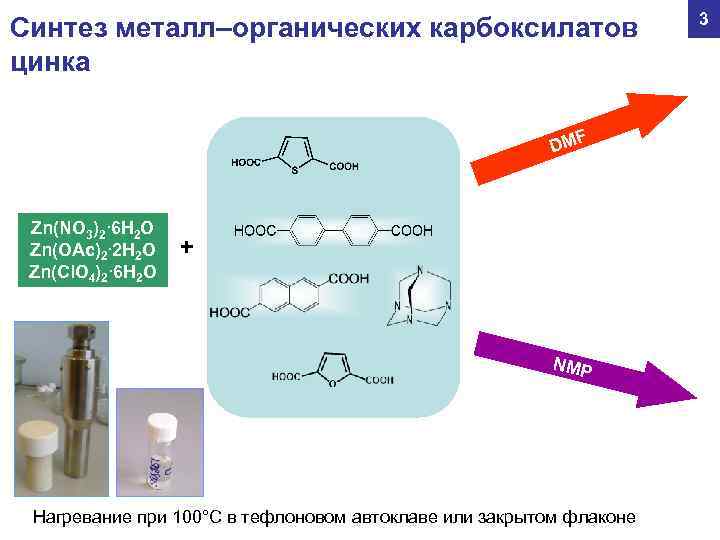
3 Синтез металл–органических карбоксилатов цинка F DM Zn(NO 3)2∙ 6 H 2 O Zn(OAc)2∙ 2 H 2 O + Zn(Cl. O 4)2∙ 6 H 2 O NMP Нагревание при 100°С в тефлоновом автоклаве или закрытом флаконе
![Синтез, строение и свойства слоистого координационного полимера [Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 Синтез, строение и свойства слоистого координационного полимера [Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-4.jpg)
Синтез, строение и свойства слоистого координационного полимера [Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 H 2 O H 2 tdc = NMP =
![[Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 H 2 O: синтез и структура 5 ur, [Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 H 2 O: синтез и структура 5 ur,](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-5.jpg)
[Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 H 2 O: синтез и структура 5 ur, NMP, 25 мл Zn(NO 3)2· 6 H 2 O + H 2 tdc [Zn 2(nmp)2(tdc)2]· 2 NMP· 0. 5 H 2 O 100°С, 1 сут 300 мг 170 мг Выход 17% Тетрагональная P 4/ncc, а = 20. 3027(5) Å, с = 20. 1273(7) Å 6× 6 Å Zn Вдоль оси с Вдоль оси b ur = tdc 2 - = NMP = Сапченко С. А с соавт. , Коорд. химия, 2013, 1.
![Синтез, строение и свойства [Zn 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 4 H 2 O и Синтез, строение и свойства [Zn 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 4 H 2 O и](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-6.jpg)
Синтез, строение и свойства [Zn 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 4 H 2 O и [Cd 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 2 H 2 O H 2 tdc = ur =
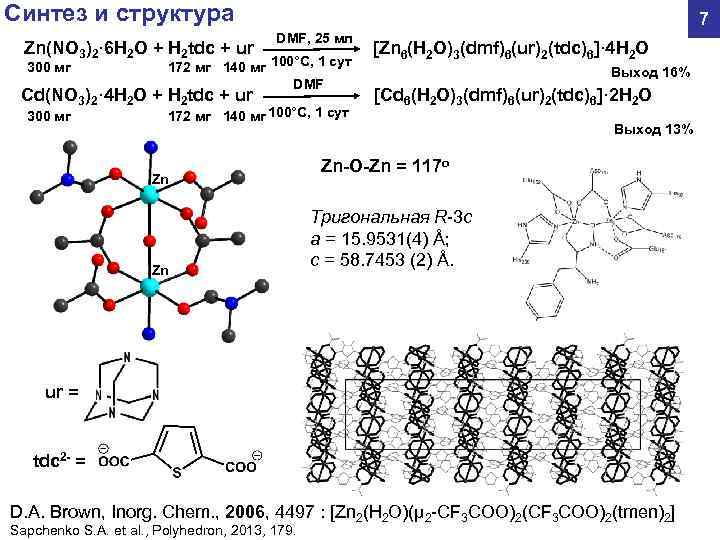
Синтез и структура 7 DMF, 25 мл Zn(NO 3)2· 6 H 2 O + H 2 tdc + ur [Zn 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 4 H 2 O 300 мг 172 мг 140 мг 100°С, 1 сут Выход 16% DMF Cd(NO 3)2· 4 H 2 O + H 2 tdc + ur [Cd 6(H 2 O)3(dmf)6(ur)2(tdc)6]· 2 H 2 O 300 мг 172 мг 140 мг 100°С, 1 сут Выход 13% Zn-O-Zn = 117 o Zn Тригональная R-3 c a = 15. 9531(4) Å; Zn c = 58. 7453 (2) Å. ur = tdc 2 - = D. A. Brown, Inorg. Chem. , 2006, 4497 : [Zn 2(H 2 O)(μ 2 -CF 3 COO)2(tmen)2] Sapchenko S. A. et al. , Polyhedron, 2013, 179.
![Термическая стабильность 8 [Zn 6(H 2 O)3(dmf)6(tdc)6(ur)2]· 4 H 2 O [Сd 6(H 2 Термическая стабильность 8 [Zn 6(H 2 O)3(dmf)6(tdc)6(ur)2]· 4 H 2 O [Сd 6(H 2](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-8.jpg)
Термическая стабильность 8 [Zn 6(H 2 O)3(dmf)6(tdc)6(ur)2]· 4 H 2 O [Сd 6(H 2 O)3(dmf)6(tdc)6(ur)2]· 2 H 2 O
![Синтез, строение и свойства [Zn 11(Н 2 О)2(ur)4(bpdc)11]· 7 DMF H 2 bpdc Синтез, строение и свойства [Zn 11(Н 2 О)2(ur)4(bpdc)11]· 7 DMF H 2 bpdc](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-9.jpg)
Синтез, строение и свойства [Zn 11(Н 2 О)2(ur)4(bpdc)11]· 7 DMF H 2 bpdc = ur =
![[Zn 11(H 2 O)2(ur)4(bpdc)11]· 7 DMF: синтез и структура 10 DMF, 25 мл Zn(Cl. [Zn 11(H 2 O)2(ur)4(bpdc)11]· 7 DMF: синтез и структура 10 DMF, 25 мл Zn(Cl.](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-10.jpg)
[Zn 11(H 2 O)2(ur)4(bpdc)11]· 7 DMF: синтез и структура 10 DMF, 25 мл Zn(Cl. O 4)2· 6 H 2 O + H 2 bpdc + ur [Zn 11(H 2 O)2(ur)4(bpdc)11]· 7 DMF 300 мг 240 мг 280 мг 3 сут, 100 ºC Моноклинная P 2/c 8Å Zn 7 x 9 Å Zn Zn H 2 bpdc = Доступный объем 59%
![[Zn 11(Н 2 О)2(ur)4(bpdc)11]: сорбция СО, СО 2, С 2 Н 2 11 Активация: [Zn 11(Н 2 О)2(ur)4(bpdc)11]: сорбция СО, СО 2, С 2 Н 2 11 Активация:](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-11.jpg)
[Zn 11(Н 2 О)2(ur)4(bpdc)11]: сорбция СО, СО 2, С 2 Н 2 11 Активация: (обмен C 6 H 12 + 50 ºC, вакуум) N 2, 77 K H 2, 77 K S(BET) = 550 м 2/г 1. 1 масс. % Н 2, 1 атм, 77 К 273 K 298 K
![[Zn 11(H 2 O)2(ur)4(bpdc)11]: факторы селективности 12 273 K 298 K SF(CO 2/CO) 32. [Zn 11(H 2 O)2(ur)4(bpdc)11]: факторы селективности 12 273 K 298 K SF(CO 2/CO) 32.](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-12.jpg)
[Zn 11(H 2 O)2(ur)4(bpdc)11]: факторы селективности 12 273 K 298 K SF(CO 2/CO) 32. 3 15. 8 SF(C 2 H 2/CO 2) 1. 7 1. 9 SF(C 2 H 2/CO) 54. 1 29. 6 C 2 H 2/CO 2 CO 2/CO Sapchenko S. A. et al. , Chem. Commun. , 2015, 13918.
![Синтез, строение и свойства [Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О ur = H Синтез, строение и свойства [Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О ur = H](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-13.jpg)
Синтез, строение и свойства [Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О ur = H 2 ndc =
![[Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О : синтез и структура 14 DMF, 20 мл [Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О : синтез и структура 14 DMF, 20 мл](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-14.jpg)
[Zn 4(dmf)(ndc)4(ur)2]· 5 DMF∙Н 2 О : синтез и структура 14 DMF, 20 мл Zn(OAc)2· 2 H 2 O + H 2 ndc + ur [Zn 4(dmf)(ndc)4(ur)2]· 5 DMF·H 2 O 100°С, 3 сут 220 мг 216 мг 140 мг Выход: 42% Zn 9Å Zn Сингония моноклинная, P 21/n ur = H 2 ndc = Доступный объем 43% Sapchenko S. A et al. , Dalton Trans. , 2011, 2196
![[Zn 4(dmf)(ndc)4(ur)2] 15 1. СH 2 Cl 2, 3 сут 2. 70°С, вакуум b [Zn 4(dmf)(ndc)4(ur)2] 15 1. СH 2 Cl 2, 3 сут 2. 70°С, вакуум b](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-15.jpg)
[Zn 4(dmf)(ndc)4(ur)2] 15 1. СH 2 Cl 2, 3 сут 2. 70°С, вакуум b c P 21/n Сс а = 24, 8414(6) Å а = 12, 2527(2) Å b = 31, 1031(8) Å b = 31, 2515(5) Å c = 12, 3400(3) Å c = 24, 7184(4) Å β = 97, 318(1)° β = 97, 023(1)° V = 9456, 8(4) Å3 V = 9394, 0(3) Å3 2Θ
![[Zn 4(dmf)(ndc)4(ur)2]: сорбция азота и водорода 16 0. 9 нм S (БЭТ) = 820 [Zn 4(dmf)(ndc)4(ur)2]: сорбция азота и водорода 16 0. 9 нм S (БЭТ) = 820](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-16.jpg)
[Zn 4(dmf)(ndc)4(ur)2]: сорбция азота и водорода 16 0. 9 нм S (БЭТ) = 820 м 2 г-1 77 К 1. 5 нм 3. 6 нм ■ Сорбция при 77 К □ Десорбция при 77 К 0. 92 вес. % Н 2 ● Сорбция при 87 К 1 атм, 77 К ○ Десорбция при 87 К
![[Zn 4(dmf)(ndc)4(ur)2]: сорбция СО, СО 2, С 2 Н 2 17 273 K 298 [Zn 4(dmf)(ndc)4(ur)2]: сорбция СО, СО 2, С 2 Н 2 17 273 K 298](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-17.jpg)
[Zn 4(dmf)(ndc)4(ur)2]: сорбция СО, СО 2, С 2 Н 2 17 273 K 298 K
![[Zn 4(dmf)(ndc)4(ur)2]: факторы селективности 18 273 K 298 K SF(CO 2/CO) 15. 3 11. [Zn 4(dmf)(ndc)4(ur)2]: факторы селективности 18 273 K 298 K SF(CO 2/CO) 15. 3 11.](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-18.jpg)
[Zn 4(dmf)(ndc)4(ur)2]: факторы селективности 18 273 K 298 K SF(CO 2/CO) 15. 3 11. 2 SF(C 2 H 2/CO 2) 2. 1 2. 0 SF(C 2 H 2/CO) 31. 5 22. 1 C 2 H 2/CO 2 CO 2/CO Sapchenko S. A. et al. , Chem. Commun. , 2015, 13918.
![[Zn 4(dmf)(ndc)4(ur)2]: каталитическая активность 19 + H 2 O № Условия реакции Растворитель Результат [Zn 4(dmf)(ndc)4(ur)2]: каталитическая активность 19 + H 2 O № Условия реакции Растворитель Результат](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-19.jpg)
[Zn 4(dmf)(ndc)4(ur)2]: каталитическая активность 19 + H 2 O № Условия реакции Растворитель Результат 1 1: 2, 5%, 117 мг Ca. Cl 2 (Ar) диоксан (5 мл) 8%, 7 ч (фильтрование после 17 ч. ) 8%, 38 ч 2 1: 2, 10%, 40 мг Ca. Cl 2 (Ar) диоксан (5 мл) 24% 24 ч 3 1: 10, 10%, 62 мг Ca. Cl 2 (Ar), 40°С диоксан (5 мл) 95%, 9 ч
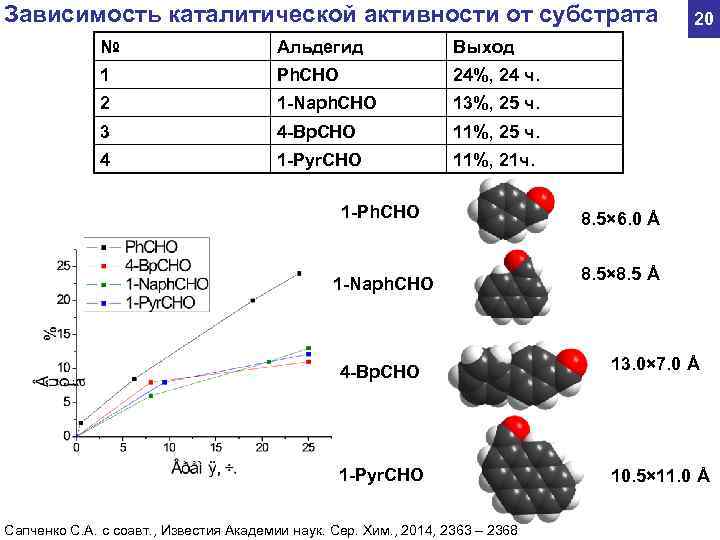
Зависимость каталитической активности от субстрата 20 № Альдегид Выход 1 Ph. CHO 24%, 24 ч. 2 1 -Naph. CHO 13%, 25 ч. 3 4 -Bp. CHO 11%, 25 ч. 4 1 -Pyr. CHO 11%, 21 ч. 1 -Ph. CHO 8. 5× 6. 0 Å 8. 5× 8. 5 Å 1 -Naph. CHO 4 -Bp. CHO 13. 0× 7. 0 Å 1 -Pyr. CHO 10. 5× 11. 0 Å Сапченко С. А. с соавт. , Известия Академии наук. Сер. Хим. , 2014, 2363 – 2368
![Соединения включения на основе [Zn 4(dmf)(ndc)4(ur)2] 21 С 6 Н 6 2 сут Cc Соединения включения на основе [Zn 4(dmf)(ndc)4(ur)2] 21 С 6 Н 6 2 сут Cc](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-21.jpg)
Соединения включения на основе [Zn 4(dmf)(ndc)4(ur)2] 21 С 6 Н 6 2 сут Cc P 21/n 16 ч С 6 Н 5 СН 3 16 ч [Zn 4(dmf)(ndc)4(ur)2]∙ 4 С 6 Н 5 СН 3
![[Zn 4(dmf)(ndc)4(ur)2] ∙ 4 Fe(C 5 H 5)2 22 Fe(C 5 H 5)2 16 [Zn 4(dmf)(ndc)4(ur)2] ∙ 4 Fe(C 5 H 5)2 22 Fe(C 5 H 5)2 16](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-22.jpg)
[Zn 4(dmf)(ndc)4(ur)2] ∙ 4 Fe(C 5 H 5)2 22 Fe(C 5 H 5)2 16 ч, 100°С Элемент Найдено Рассчитано C 55, 7% 55, 8% H 4, 4% 4, 3% N 5, 69%
![Люминесцентные свойства [Zn 4(dmf)(ndc)4(ur)2] и 23 соединений включения на его основе Предполагаемый механизм тушения Люминесцентные свойства [Zn 4(dmf)(ndc)4(ur)2] и 23 соединений включения на его основе Предполагаемый механизм тушения](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-23.jpg)
Люминесцентные свойства [Zn 4(dmf)(ndc)4(ur)2] и 23 соединений включения на его основе Предполагаемый механизм тушения А + hν → A* А* + Fe(Cp)2 → A + Fe(Cp)2* ΔE(Fe(Cp)2*) = 21 800 см-1 ΔЕ(А*) = 23250 см-1 1 – [Zn 4(dmf)(ur)2(ndc)4]· 5 DMF·H 2 O 2 – [Zn 4(dmf)(ur)2(ndc)4] λex= 370 нм 3 – [Zn 4(dmf)(ur)2(ndc)4]· 6 C 6 H 6 4 – [Zn 4(dmf)(ur)2(ndc)4]· 2. 5 C 6 H 5 NO 2 5 – [Zn 4(dmf)(ur)2(ndc)4]· 4 Fe(Cp)2 Sapchenko S. A et al. , Dalton Trans. , 2011, 2196
![[Zn 4(S 4 N 4)(ndc)4(ur)2]: синтез и строение 24 Me 2 CO, 2 мл [Zn 4(S 4 N 4)(ndc)4(ur)2]: синтез и строение 24 Me 2 CO, 2 мл](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-24.jpg)
[Zn 4(S 4 N 4)(ndc)4(ur)2]: синтез и строение 24 Me 2 CO, 2 мл [Zn 4(dmf)(ur)2(ndc)4] + S 4 N 4 [Zn 4(S 4 N 4)(ur)2(ndc)4]·x. Me 2 CO 212 мг 27 мг α β α Cc C 2/c β α β α β α α: d ~ 9 Å, основные центры N β: d ~ 4. 5 Å, кислотные центры Zn
![Ступенчатая активация [Zn 4(dmf)(ur)2(ndc)4]· 5 DMF·H 2 O 25 Me 2 CO [Zn 4(dmf)(ur)2(ndc)4]· Ступенчатая активация [Zn 4(dmf)(ur)2(ndc)4]· 5 DMF·H 2 O 25 Me 2 CO [Zn 4(dmf)(ur)2(ndc)4]·](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-25.jpg)
Ступенчатая активация [Zn 4(dmf)(ur)2(ndc)4]· 5 DMF·H 2 O 25 Me 2 CO [Zn 4(dmf)(ur)2(ndc)4]· 5 DMF·H 2 O [Zn 4(dmf)(ur)2(ndc)4]·x. Me 2 CO 1. CH 2 Cl 2 2. вакуум C 6 H 6 [Zn 4(dmf)(ur)2(ndc)4]· 6 C 6 H 6 S 4 N 4 + Me 2 CO C 6 H 6 [Zn 4(S 4 N 4)(ur)2(ndc)4]·x. Me 2 CO [Zn 4(S 4 N 4)(ur)2(ndc)4]· 6 C 6 H 6 Me 2 CO вакуум [Zn 4(Me 2 CO)(ur)2(ndc)4]·x. Me 2 CO [Zn 4 (ur)2(ndc)4] C 6 H 6 [Zn 4(½C 6 H 6+½H 2 O)(ur)2(ndc)4]· 6 C 6 H 6
![[Zn 4(ur)2(ndc)4]: сорбция N 2 26 SBET, м 2/г V при p/p 0 = [Zn 4(ur)2(ndc)4]: сорбция N 2 26 SBET, м 2/г V при p/p 0 =](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-26.jpg)
[Zn 4(ur)2(ndc)4]: сорбция N 2 26 SBET, м 2/г V при p/p 0 = 1, мл/г [Zn 4(ur)2(ndc)4] 1113 324 [Zn 4(dmf)(ur)2(ndc)4] 820 290
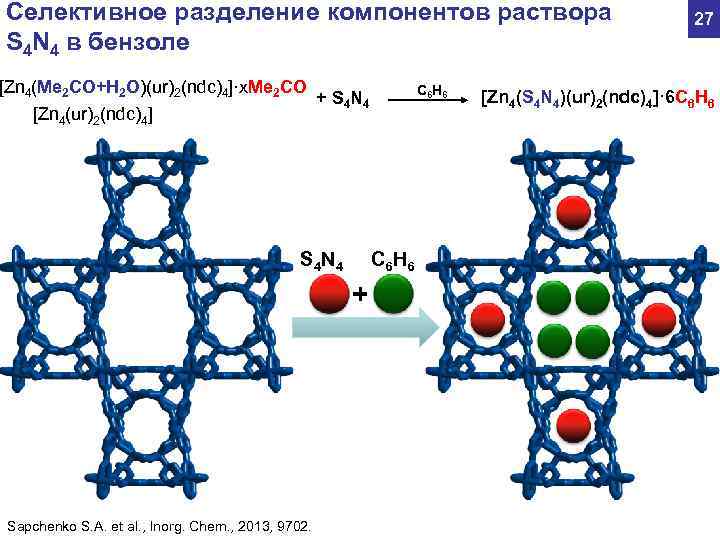
Селективное разделение компонентов раствора 27 S 4 N 4 в бензоле [Zn 4(Me 2 CO+H 2 O)(ur)2(ndc)4]·x. Me 2 CO C 6 H 6 + S 4 N 4 [Zn 4(S 4 N 4)(ur)2(ndc)4]· 6 C 6 H 6 [Zn 4(ur)2(ndc)4] S 4 N 4 C 6 H 6 + Sapchenko S. A. et al. , Inorg. Chem. , 2013, 9702.
![Синтез, строение и свойства [H 4 Zn 4(H 2 O)2(ur)(fdc)6] ur = H Синтез, строение и свойства [H 4 Zn 4(H 2 O)2(ur)(fdc)6] ur = H](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-28.jpg)
Синтез, строение и свойства [H 4 Zn 4(H 2 O)2(ur)(fdc)6] ur = H 2 fdc =
![[H 4 Zn 4(H 2 O)2(ur)(fdc)6]: синтез и структура 29 50 мкл NEt 3, [H 4 Zn 4(H 2 O)2(ur)(fdc)6]: синтез и структура 29 50 мкл NEt 3,](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-29.jpg)
[H 4 Zn 4(H 2 O)2(ur)(fdc)6]: синтез и структура 29 50 мкл NEt 3, 25 мл NMP Zn(NO 3)2· 6 H 2 O + H 2 fdc + ur [H 4 Zn 4(H 2 O)2(ur)(fdc)6]·G 300 мг 160 мг 140 мг 100°С, 1 сутки Кубическая сингония, F 4132 ur = H 2 fdc =
![Реакции катионного обмена 30 NMP [H 4 Zn 4(H 2 O)2(ur)(fdc)6]·G + MNO 3 Реакции катионного обмена 30 NMP [H 4 Zn 4(H 2 O)2(ur)(fdc)6]·G + MNO 3](https://present5.com/presentation/3/-104014181_425109427.pdf-img/-104014181_425109427.pdf-30.jpg)
Реакции катионного обмена 30 NMP [H 4 Zn 4(H 2 O)2(ur)(fdc)6]·G + MNO 3 [M 4 Zn 4(H 2 O)2(ur)(fdc)6]·G M+ = Li+, Na+, K+, Rb+, Cs+, NH 4+ λex= 430 нм

Спасибо за внимание!
доклад_Сапченко.ppt