Межмолекулярное взаимодействие.ppt
- Количество слайдов: 12

Межмолекулярное взаимодействие

Молекулы способны к взаимодействию между собой. Это взаимодействие обусловливает переход вещества из одного агрегатного состояния в другое. Силы межмолекулярного взаимодействия (силы Ван-дер. Ваальса) имеют электрическую природу, проявляются на больших расстояниях и характеризуются отсутствием насыщаемости.
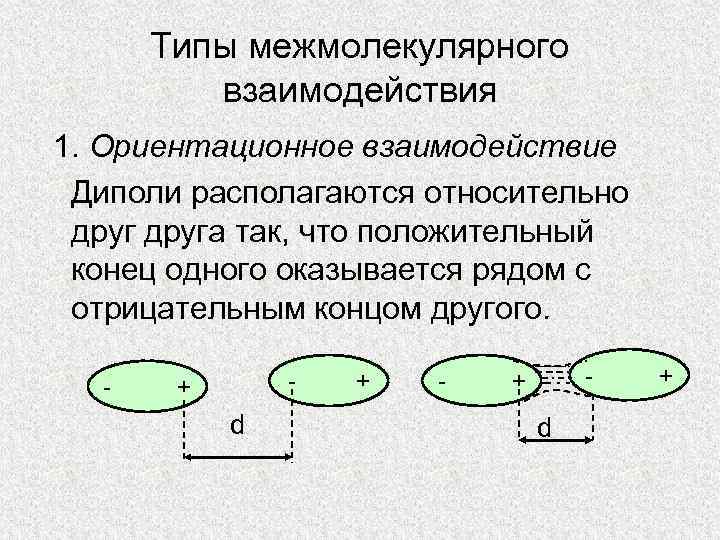
Типы межмолекулярного взаимодействия 1. Ориентационное взаимодействие Диполи располагаются относительно друга так, что положительный конец одного оказывается рядом с отрицательным концом другого. - - + d +

2. Индукционное взаимодействие Электростатическое взаимодействие полярной и неполярной молекулы. Под действием полярной молекулы в неполярной возникает наведенный диполь. Энергия этого взаимодействия определяется электрическим моментом диполярной молекулы и поляризуемостью неполярной молекулы.
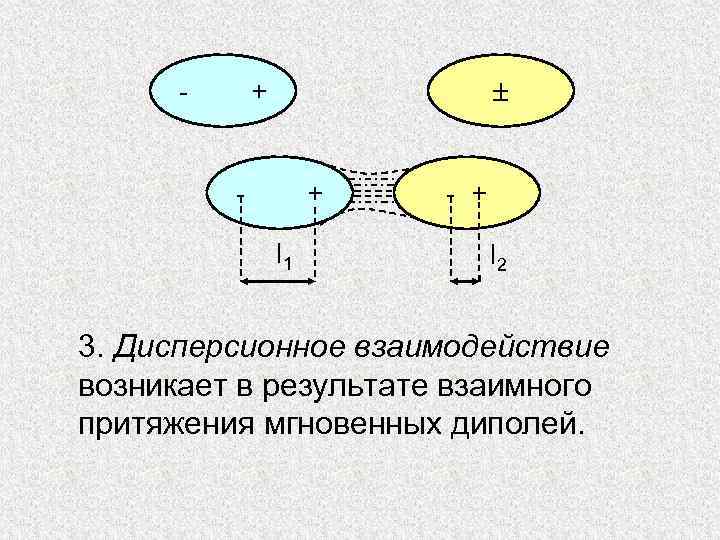
- + l 1 - + l 2 3. Дисперсионное взаимодействие возникает в результате взаимного притяжения мгновенных диполей.

Эти диполи возникают в неполярных молекулах в любой момент времени вследствие несовпадения электрических центров тяжести электронного облака и ядер, вызванного их независимыми колебаниями. Мгновенные диполи в системе взаимодействующих частиц возникают синхронно, взаимосогласованно.

Дисперсионное взаимодействие наиболее универсальное и проявляется между любыми молекулами. Благодаря ему возможен перевод в жидкое или твердое состояние веществ, состоящих из неполярных молекул (H 2, N 2, O 2, He, Ar). Энергия этого взаимодействия определяется поляризуемостью молекул.
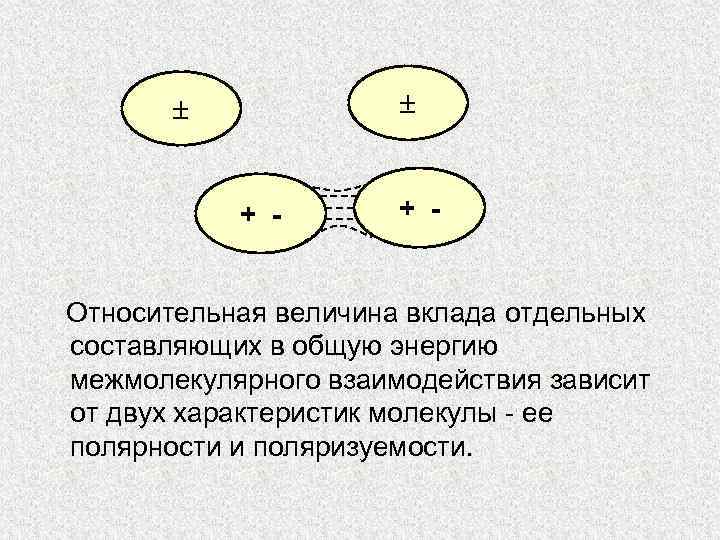
+ - Относительная величина вклада отдельных составляющих в общую энергию межмолекулярного взаимодействия зависит от двух характеристик молекулы - ее полярности и поляризуемости.

Водородная связь Она осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы: НХ, где X - атом одного из наиболее электроотрицательных элементов - F, О, N, реже Сl или S.

B отличие от обычного диполь-дипольного взаимодействия, механизм возникновения водородной связи в значительной степени обусловлен и донорно-акцепторным взаимодействием, где донором является атом электроотрицательного элемента одной молекулы, а акцептором - атом водорода другой. Поэтому водородная связь обладает свойствами направленности и насыщаемости.

Энергия водородной связи примерно на порядок ниже энергии химической связи, но в несколько раз выше энергии межмолекулярного взаимодействия. Наличие водородной связи существенно влияет на физические и химические свойства веществ. В частности, аномально высокие температуры плавления и кипения H 2 O, HF, NH 3 объясняются образованием ассоциатов за счет водородной связи.
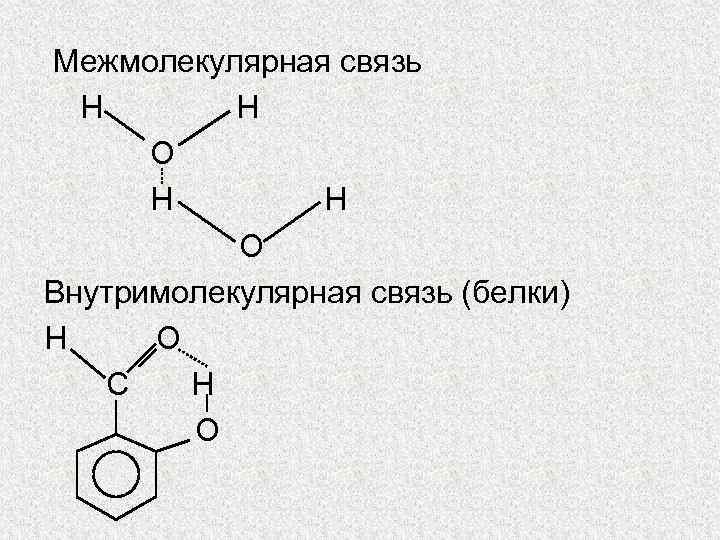
Межмолекулярная связь Н Н О Внутримолекулярная связь (белки) Н О С Н О
Межмолекулярное взаимодействие.ppt