Шевелев. Регуляция транскрипции2010.ppt
- Количество слайдов: 16
 Механизмы регуляции транскрипции у эукариот Ю. Я. Шевелев Зав. Лабораторией анализа регуляции генов ИМГ РАН 1. Посадка транскрипционных факторов на промотор. 2. Дальнодействующие регуляторы транскрипции (энхансеры, сайленсеры, инсуляторы). 3. Регуляция на уровне хроматина (степень компактизации, модификации гистонов, расположение нуклеосом). 4. Компартментализация хроматина в ядре.
Механизмы регуляции транскрипции у эукариот Ю. Я. Шевелев Зав. Лабораторией анализа регуляции генов ИМГ РАН 1. Посадка транскрипционных факторов на промотор. 2. Дальнодействующие регуляторы транскрипции (энхансеры, сайленсеры, инсуляторы). 3. Регуляция на уровне хроматина (степень компактизации, модификации гистонов, расположение нуклеосом). 4. Компартментализация хроматина в ядре.
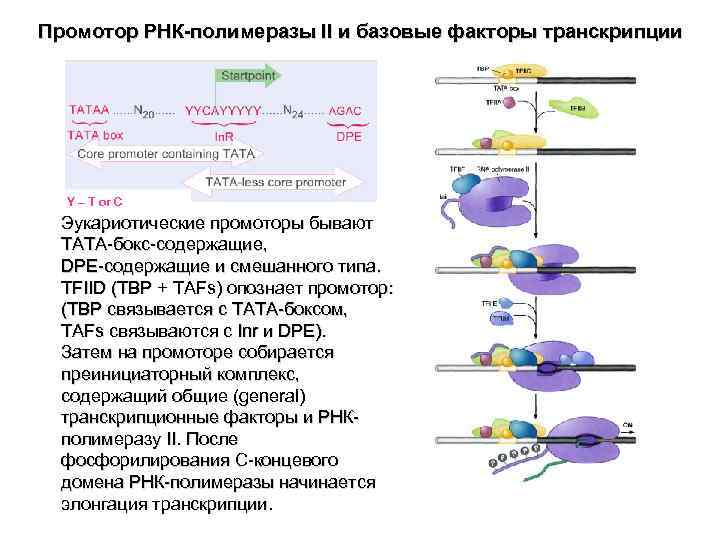 Промотор РНК-полимеразы II и базовые факторы транскрипции Y – T or C Эукариотические промоторы бывают TATA-бокс-содержащие, DPE-содержащие и смешанного типа. TFIID (TBP + TAFs) опознает промотор: (TBP связывается с TATA-боксом, TAFs связываются с Inr и DPE). Затем на промоторе собирается преинициаторный комплекс, содержащий общие (general) транскрипционные факторы и РНК- полимеразу II. После фосфорилирования C-концевого домена РНК-полимеразы начинается элонгация транскрипции.
Промотор РНК-полимеразы II и базовые факторы транскрипции Y – T or C Эукариотические промоторы бывают TATA-бокс-содержащие, DPE-содержащие и смешанного типа. TFIID (TBP + TAFs) опознает промотор: (TBP связывается с TATA-боксом, TAFs связываются с Inr и DPE). Затем на промоторе собирается преинициаторный комплекс, содержащий общие (general) транскрипционные факторы и РНК- полимеразу II. После фосфорилирования C-концевого домена РНК-полимеразы начинается элонгация транскрипции.
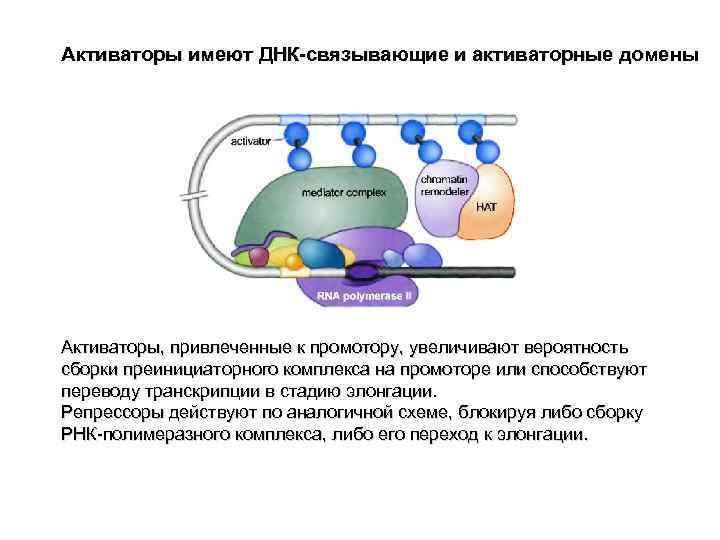 Активаторы имеют ДНК-связывающие и активаторные домены Активаторы, привлеченные к промотору, увеличивают вероятность сборки преинициаторного комплекса на промоторе или способствуют переводу транскрипции в стадию элонгации. Репрессоры действуют по аналогичной схеме, блокируя либо сборку РНК-полимеразного комплекса, либо его переход к элонгации.
Активаторы имеют ДНК-связывающие и активаторные домены Активаторы, привлеченные к промотору, увеличивают вероятность сборки преинициаторного комплекса на промоторе или способствуют переводу транскрипции в стадию элонгации. Репрессоры действуют по аналогичной схеме, блокируя либо сборку РНК-полимеразного комплекса, либо его переход к элонгации.
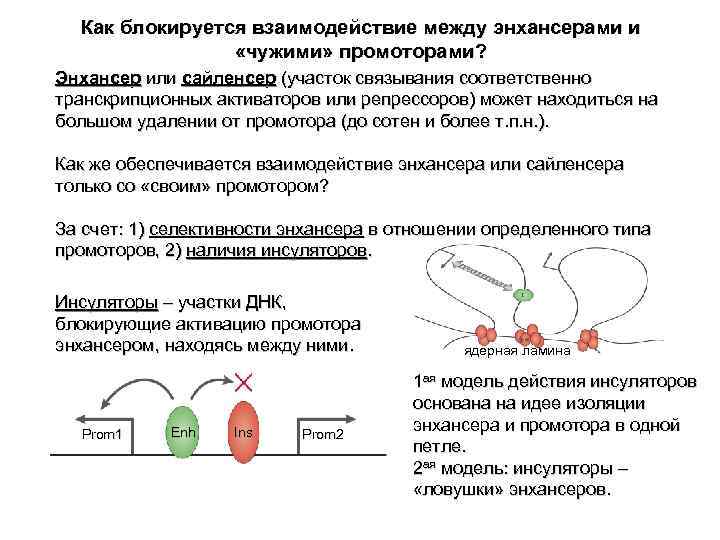 Как блокируется взаимодействие между энхансерами и «чужими» промоторами? Энхансер или сайленсер (участок связывания соответственно транскрипционных активаторов или репрессоров) может находиться на большом удалении от промотора (до сотен и более т. п. н. ). Как же обеспечивается взаимодействие энхансера или сайленсера только со «своим» промотором? За счет: 1) селективности энхансера в отношении определенного типа промоторов, 2) наличия инсуляторов. Инсуляторы – участки ДНК, блокирующие активацию промотора энхансером, находясь между ними. ядерная ламина 1 ая модель действия инсуляторов основана на идее изоляции Prom 1 Enh Ins Prom 2 энхансера и промотора в одной петле. 2 ая модель: инсуляторы – «ловушки» энхансеров.
Как блокируется взаимодействие между энхансерами и «чужими» промоторами? Энхансер или сайленсер (участок связывания соответственно транскрипционных активаторов или репрессоров) может находиться на большом удалении от промотора (до сотен и более т. п. н. ). Как же обеспечивается взаимодействие энхансера или сайленсера только со «своим» промотором? За счет: 1) селективности энхансера в отношении определенного типа промоторов, 2) наличия инсуляторов. Инсуляторы – участки ДНК, блокирующие активацию промотора энхансером, находясь между ними. ядерная ламина 1 ая модель действия инсуляторов основана на идее изоляции Prom 1 Enh Ins Prom 2 энхансера и промотора в одной петле. 2 ая модель: инсуляторы – «ловушки» энхансеров.
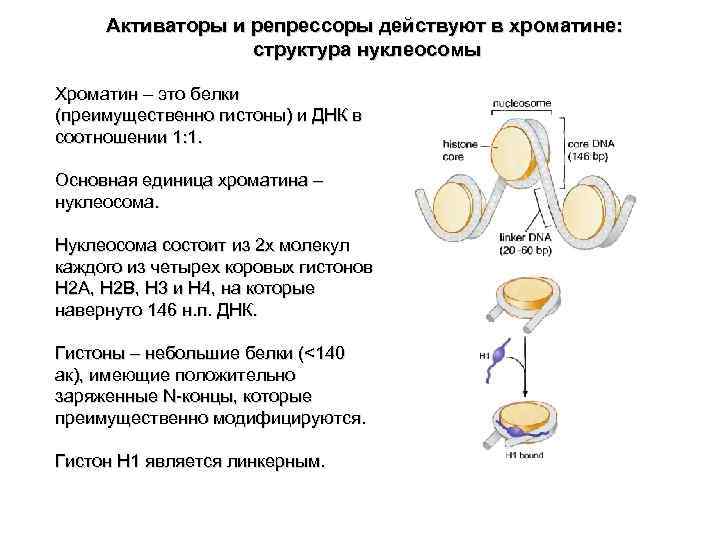 Активаторы и репрессоры действуют в хроматине: структура нуклеосомы Хроматин – это белки (преимущественно гистоны) и ДНК в соотношении 1: 1. Основная единица хроматина – нуклеосома. Нуклеосома состоит из 2 х молекул каждого из четырех коровых гистонов H 2 A, H 2 B, H 3 и H 4, на которые навернуто 146 н. п. ДНК. Гистоны – небольшие белки (<140 ак), имеющие положительно заряженные N-концы, которые преимущественно модифицируются. Гистон H 1 является линкерным.
Активаторы и репрессоры действуют в хроматине: структура нуклеосомы Хроматин – это белки (преимущественно гистоны) и ДНК в соотношении 1: 1. Основная единица хроматина – нуклеосома. Нуклеосома состоит из 2 х молекул каждого из четырех коровых гистонов H 2 A, H 2 B, H 3 и H 4, на которые навернуто 146 н. п. ДНК. Гистоны – небольшие белки (<140 ак), имеющие положительно заряженные N-концы, которые преимущественно модифицируются. Гистон H 1 является линкерным.
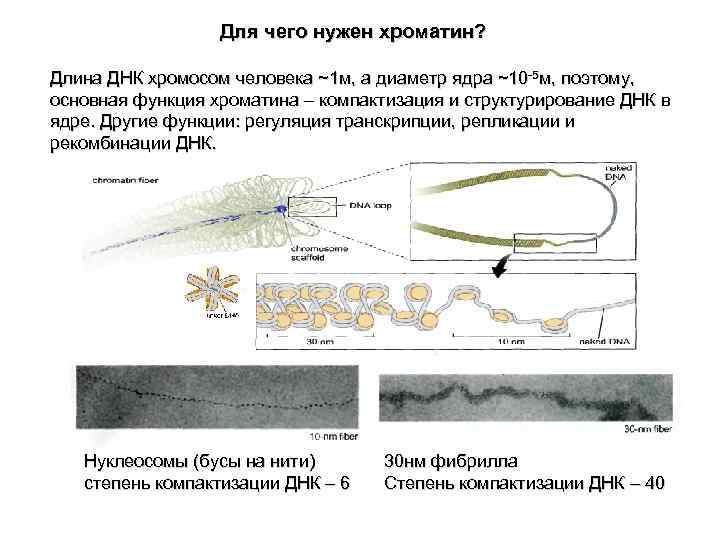 Для чего нужен хроматин? Длина ДНК хромосом человека ~1 м, а диаметр ядра ~10 -5 м, поэтому, основная функция хроматина – компактизация и структурирование ДНК в ядре. Другие функции: регуляция транскрипции, репликации и рекомбинации ДНК. Нуклеосомы (бусы на нити) 30 нм фибрилла степень компактизации ДНК – 6 Степень компактизации ДНК – 40
Для чего нужен хроматин? Длина ДНК хромосом человека ~1 м, а диаметр ядра ~10 -5 м, поэтому, основная функция хроматина – компактизация и структурирование ДНК в ядре. Другие функции: регуляция транскрипции, репликации и рекомбинации ДНК. Нуклеосомы (бусы на нити) 30 нм фибрилла степень компактизации ДНК – 6 Степень компактизации ДНК – 40
 Хроматиновые домены Хромосомы подразделяют на эухроматин и гетерохроматин. Гетерохроматин более компактизован и находится в прицентромерных и теломерных областях хромосом. Подавляющее большинство генов находится в эухроматине. Эухроматин поделен на хроматиновые домены размером 20 -200 т. п. о. с большей или меньшей степенью упаковки ДНК. Высокая компактизация обычно соответствует транскрипционно неактивным в данном типе клеток генам. Например, ген овальбумина и гомологичные ему гены X и Y входят в единый 100 т. п. н. домен «открытого» хроматина в яйцеводе кур, который находится в более компактизованном состоянии в печени, селезенке и эритроцитах, где эти гены не экспрессируются. По краям доменов иногда находят инсуляторы.
Хроматиновые домены Хромосомы подразделяют на эухроматин и гетерохроматин. Гетерохроматин более компактизован и находится в прицентромерных и теломерных областях хромосом. Подавляющее большинство генов находится в эухроматине. Эухроматин поделен на хроматиновые домены размером 20 -200 т. п. о. с большей или меньшей степенью упаковки ДНК. Высокая компактизация обычно соответствует транскрипционно неактивным в данном типе клеток генам. Например, ген овальбумина и гомологичные ему гены X и Y входят в единый 100 т. п. н. домен «открытого» хроматина в яйцеводе кур, который находится в более компактизованном состоянии в печени, селезенке и эритроцитах, где эти гены не экспрессируются. По краям доменов иногда находят инсуляторы.
 Изоформы (варианты) гистонов H 3. 3 вариант отличается 4 ак от H 3, связан с активно экспрессирующимися генами, внедряется в хроматин в отсутствие репликации, формирует нуклеосомы, слабее связанные с ДНК. Модификации гистонов ацетилирование – деацетилирование лизина и аргинина, метилирование лизина и аргинина, фосфорилирование – дефосфорилирование серина и треонина, убиквитинилирование – деубиквитинилирование лизина, и др. Ацетилирование гистонов приводит к менее прочным контактам ДНК с гистонами, т. е. к «разрыхлению» хроматина.
Изоформы (варианты) гистонов H 3. 3 вариант отличается 4 ак от H 3, связан с активно экспрессирующимися генами, внедряется в хроматин в отсутствие репликации, формирует нуклеосомы, слабее связанные с ДНК. Модификации гистонов ацетилирование – деацетилирование лизина и аргинина, метилирование лизина и аргинина, фосфорилирование – дефосфорилирование серина и треонина, убиквитинилирование – деубиквитинилирование лизина, и др. Ацетилирование гистонов приводит к менее прочным контактам ДНК с гистонами, т. е. к «разрыхлению» хроматина.
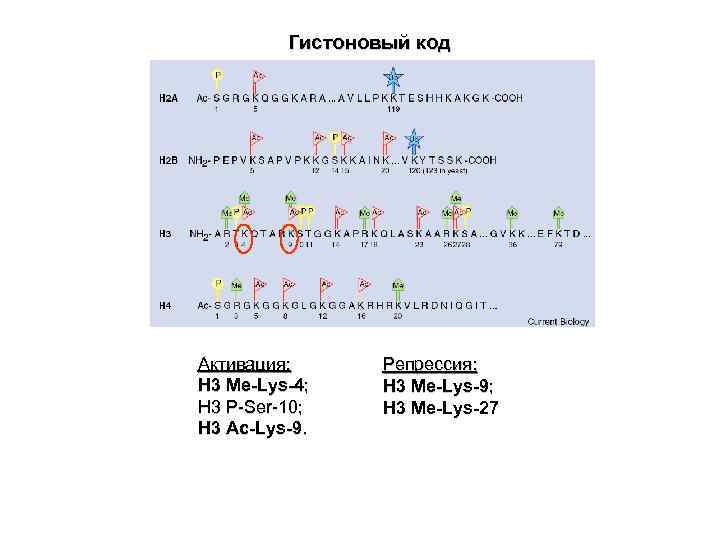 Гистоновый код Активация: Репрессия: H 3 Me-Lys-4; H 3 Me-Lys-9; H 3 P-Ser-10; H 3 Me-Lys-27 H 3 Ac-Lys-9.
Гистоновый код Активация: Репрессия: H 3 Me-Lys-4; H 3 Me-Lys-9; H 3 P-Ser-10; H 3 Me-Lys-27 H 3 Ac-Lys-9.
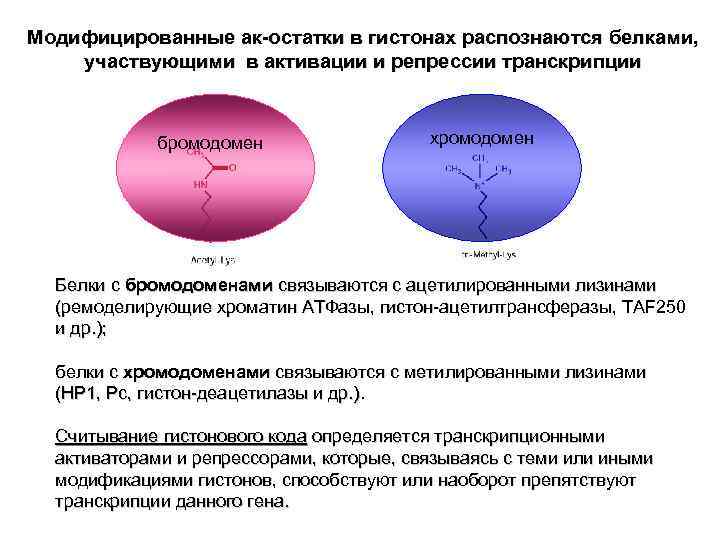 Модифицированные ак-остатки в гистонах распознаются белками, участвующими в активации и репрессии транскрипции бромодомен хромодомен Белки с бромодоменами связываются с ацетилированными лизинами (ремоделирующие хроматин АТФазы, гистон-ацетилтрансферазы, TAF 250 и др. ); белки с хромодоменами связываются с метилированными лизинами (HP 1, Pc, гистон-деацетилазы и др. ). Считывание гистонового кода определяется транскрипционными активаторами и репрессорами, которые, связываясь с теми или иными модификациями гистонов, способствуют или наоборот препятствуют транскрипции данного гена.
Модифицированные ак-остатки в гистонах распознаются белками, участвующими в активации и репрессии транскрипции бромодомен хромодомен Белки с бромодоменами связываются с ацетилированными лизинами (ремоделирующие хроматин АТФазы, гистон-ацетилтрансферазы, TAF 250 и др. ); белки с хромодоменами связываются с метилированными лизинами (HP 1, Pc, гистон-деацетилазы и др. ). Считывание гистонового кода определяется транскрипционными активаторами и репрессорами, которые, связываясь с теми или иными модификациями гистонов, способствуют или наоборот препятствуют транскрипции данного гена.
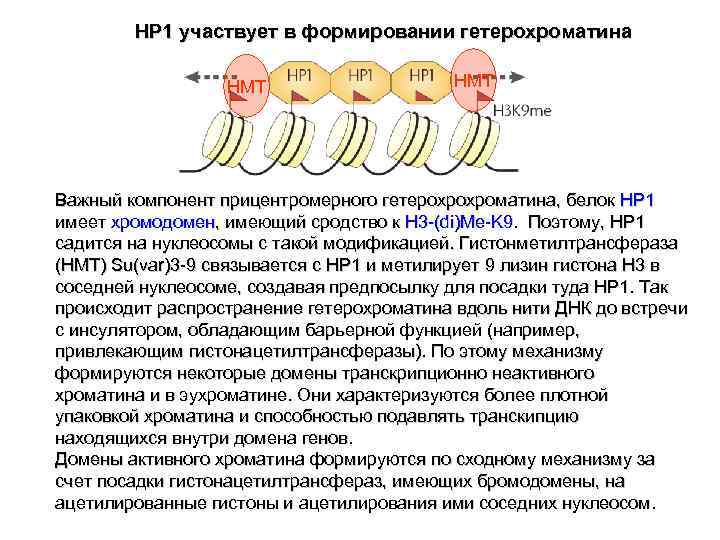 HP 1 участвует в формировании гетерохроматина HMT Важный компонент прицентромерного гетерохрохроматина, белок HP 1 имеет хромодомен, имеющий сродство к H 3 -(di)Me-K 9. Поэтому, HP 1 садится на нуклеосомы с такой модификацией. Гистонметилтрансфераза (HMT) Su(var)3 -9 связывается с HP 1 и метилирует 9 лизин гистона H 3 в соседней нуклеосоме, создавая предпосылку для посадки туда HP 1. Так происходит распространение гетерохроматина вдоль нити ДНК до встречи с инсулятором, обладающим барьерной функцией (например, привлекающим гистонацетилтрансферазы). По этому механизму формируются некоторые домены транскрипционно неактивного хроматина и в эухроматине. Они характеризуются более плотной упаковкой хроматина и способностью подавлять транскипцию находящихся внутри домена генов. Домены активного хроматина формируются по сходному механизму за счет посадки гистонацетилтрансфераз, имеющих бромодомены, на ацетилированные гистоны и ацетилирования ими соседних нуклеосом.
HP 1 участвует в формировании гетерохроматина HMT Важный компонент прицентромерного гетерохрохроматина, белок HP 1 имеет хромодомен, имеющий сродство к H 3 -(di)Me-K 9. Поэтому, HP 1 садится на нуклеосомы с такой модификацией. Гистонметилтрансфераза (HMT) Su(var)3 -9 связывается с HP 1 и метилирует 9 лизин гистона H 3 в соседней нуклеосоме, создавая предпосылку для посадки туда HP 1. Так происходит распространение гетерохроматина вдоль нити ДНК до встречи с инсулятором, обладающим барьерной функцией (например, привлекающим гистонацетилтрансферазы). По этому механизму формируются некоторые домены транскрипционно неактивного хроматина и в эухроматине. Они характеризуются более плотной упаковкой хроматина и способностью подавлять транскипцию находящихся внутри домена генов. Домены активного хроматина формируются по сходному механизму за счет посадки гистонацетилтрансфераз, имеющих бромодомены, на ацетилированные гистоны и ацетилирования ими соседних нуклеосом.
 Хроматин-ремоделирующие комплексы Свойства: содержат ДНК-зависимую АТФазу; нарушают контакты ДНК с гистонами (несмотря на наличие в нуклеосоме около 120 мест контакта между гистоновым октамером и ДНК, нарушение даже двух из них в определенных местах приводит к сильному изменению подвижности ДНК относительно октамера); сдвигают гистоновый октамер относительно ДНК (скольжение). Функции: освобождают регуляторные участки ДНК (например, промоторы, энхансеры и сайленсеры) от нуклеосом, чтобы обеспечить возможность (или невозможность) контакта транскрипционных факторов с ДНК; заменяют основные гистоны на их варианты.
Хроматин-ремоделирующие комплексы Свойства: содержат ДНК-зависимую АТФазу; нарушают контакты ДНК с гистонами (несмотря на наличие в нуклеосоме около 120 мест контакта между гистоновым октамером и ДНК, нарушение даже двух из них в определенных местах приводит к сильному изменению подвижности ДНК относительно октамера); сдвигают гистоновый октамер относительно ДНК (скольжение). Функции: освобождают регуляторные участки ДНК (например, промоторы, энхансеры и сайленсеры) от нуклеосом, чтобы обеспечить возможность (или невозможность) контакта транскрипционных факторов с ДНК; заменяют основные гистоны на их варианты.
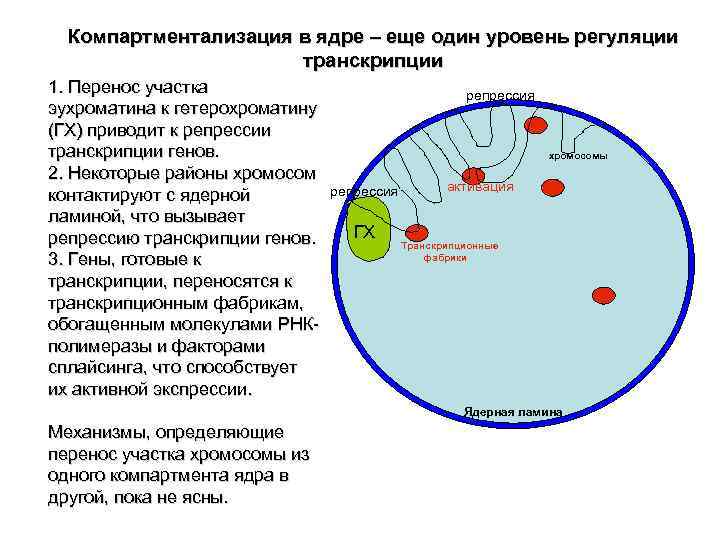 Компартментализация в ядре – еще один уровень регуляции транскрипции 1. Перенос участка репрессия эухроматина к гетерохроматину (ГХ) приводит к репрессии транскрипции генов. хромосомы 2. Некоторые районы хромосом репрессия активация контактируют с ядерной ламиной, что вызывает репрессию транскрипции генов. ГХ Транскрипционные 3. Гены, готовые к фабрики транскрипции, переносятся к транскрипционным фабрикам, обогащенным молекулами РНК- полимеразы и факторами сплайсинга, что способствует их активной экспрессии. Ядерная ламина Механизмы, определяющие перенос участка хромосомы из одного компартмента ядра в другой, пока не ясны.
Компартментализация в ядре – еще один уровень регуляции транскрипции 1. Перенос участка репрессия эухроматина к гетерохроматину (ГХ) приводит к репрессии транскрипции генов. хромосомы 2. Некоторые районы хромосом репрессия активация контактируют с ядерной ламиной, что вызывает репрессию транскрипции генов. ГХ Транскрипционные 3. Гены, готовые к фабрики транскрипции, переносятся к транскрипционным фабрикам, обогащенным молекулами РНК- полимеразы и факторами сплайсинга, что способствует их активной экспрессии. Ядерная ламина Механизмы, определяющие перенос участка хромосомы из одного компартмента ядра в другой, пока не ясны.
 Влияния хроматина на транскрипцию Белки- модификаторы вносят необходимые модификации в гистоны, что вызывает «разрыхление» или наоборот « компактизацию » хроматина. Кроме того, в зависимости от типа и сочетания модификаций и их положения в молекулах гистонов с модификацированными нуклеосомами связываются те или иные транскрипционные факторы, которые способствуют или наоборот препятствуют транскрипции. Регуляторные участки ДНК (промоторы, энхансеры , инсуляторы и др. ) должны быть доступны для связывания c транскрипционными факторами, для чего комплексы ремоделинга освобождают их от нуклеосом. Состояние хроматина определяет положение района хромосом в ядре: нахождение гена вблизи периферии ядра приводит к репрессии его транскрипции, в то время как перенос гена к транскрипционным фабрикам, находящимся внутри ядра, – к его активной экспрессии.
Влияния хроматина на транскрипцию Белки- модификаторы вносят необходимые модификации в гистоны, что вызывает «разрыхление» или наоборот « компактизацию » хроматина. Кроме того, в зависимости от типа и сочетания модификаций и их положения в молекулах гистонов с модификацированными нуклеосомами связываются те или иные транскрипционные факторы, которые способствуют или наоборот препятствуют транскрипции. Регуляторные участки ДНК (промоторы, энхансеры , инсуляторы и др. ) должны быть доступны для связывания c транскрипционными факторами, для чего комплексы ремоделинга освобождают их от нуклеосом. Состояние хроматина определяет положение района хромосом в ядре: нахождение гена вблизи периферии ядра приводит к репрессии его транскрипции, в то время как перенос гена к транскрипционным фабрикам, находящимся внутри ядра, – к его активной экспрессии.
 Метилирование ДНК по CG динуклеотидам осуществляют ДНК- метилтрансферазы; найдены ферменты, осуществляющие деметилирование. В соматических клетках позвоночных 60%-90% всех CG динуклеотидов метилированы; в большинстве участков генома все CG динуклеотиды метилированы, однако имеются т. н. CG островки – скопления слабо метилированных CG динуклеотидов в регуляторных участках (например, промоторах) генов. С Cm. G в промоторных CG островках связываются белки-репрессоры, имеющие метил-связывающие домены, что приводит к подавлению транскрипции гена. Поэтому, чем выше степень метилирования промоторных CG островков, тем вероятнее отсутствие транскрипции гена. Метилирование CG островков – эпигенетическая модификация ДНК, передающая информацию о репрессии гена в ряду клеточных делений.
Метилирование ДНК по CG динуклеотидам осуществляют ДНК- метилтрансферазы; найдены ферменты, осуществляющие деметилирование. В соматических клетках позвоночных 60%-90% всех CG динуклеотидов метилированы; в большинстве участков генома все CG динуклеотиды метилированы, однако имеются т. н. CG островки – скопления слабо метилированных CG динуклеотидов в регуляторных участках (например, промоторах) генов. С Cm. G в промоторных CG островках связываются белки-репрессоры, имеющие метил-связывающие домены, что приводит к подавлению транскрипции гена. Поэтому, чем выше степень метилирования промоторных CG островков, тем вероятнее отсутствие транскрипции гена. Метилирование CG островков – эпигенетическая модификация ДНК, передающая информацию о репрессии гена в ряду клеточных делений.
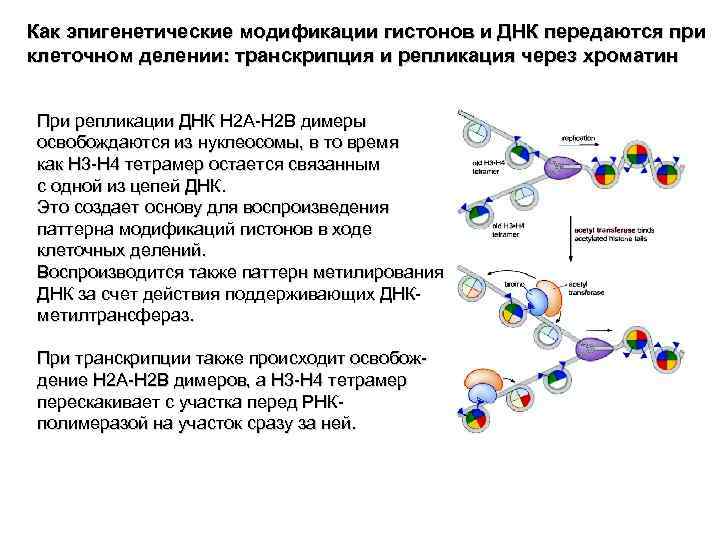 Как эпигенетические модификации гистонов и ДНК передаются при клеточном делении: транскрипция и репликация через хроматин При репликации ДНК H 2 A-H 2 B димеры освобождаются из нуклеосомы, в то время как H 3 -H 4 тетрамер остается связанным с одной из цепей ДНК. Это создает основу для воспроизведения паттерна модификаций гистонов в ходе клеточных делений. Воспроизводится также паттерн метилирования ДНК за счет действия поддерживающих ДНК- метилтрансфераз. При транскрипции также происходит освобож- дение H 2 A-H 2 B димеров, а H 3 -H 4 тетрамер перескакивает с участка перед РНК- полимеразой на участок сразу за ней.
Как эпигенетические модификации гистонов и ДНК передаются при клеточном делении: транскрипция и репликация через хроматин При репликации ДНК H 2 A-H 2 B димеры освобождаются из нуклеосомы, в то время как H 3 -H 4 тетрамер остается связанным с одной из цепей ДНК. Это создает основу для воспроизведения паттерна модификаций гистонов в ходе клеточных делений. Воспроизводится также паттерн метилирования ДНК за счет действия поддерживающих ДНК- метилтрансфераз. При транскрипции также происходит освобож- дение H 2 A-H 2 B димеров, а H 3 -H 4 тетрамер перескакивает с участка перед РНК- полимеразой на участок сразу за ней.


