Механизм мышечного сокращения.pptx
- Количество слайдов: 11
 МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ , РОЛЬ КАЛЬЦИЯ.
МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ , РОЛЬ КАЛЬЦИЯ.
 Мышечное сокращение – реакция мышечных клеток на воздействие гормона, проявляющая в уменьшениидлины клетки. Эта жизненно важная функция организма , связанная с оборонительными , дыхательными, пищевыми , половыми процессами.
Мышечное сокращение – реакция мышечных клеток на воздействие гормона, проявляющая в уменьшениидлины клетки. Эта жизненно важная функция организма , связанная с оборонительными , дыхательными, пищевыми , половыми процессами.
 Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц ). Миофибриллы –структуры толщиной 1 -2 мкм , состоящие из саркомеров –структур длиной около 2, 5 мкм , состоящих из актиновых и миозиновых (толстых и тонких )фрагментов и Z-дисков , соединенных с актиновыми филаментами.
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц ). Миофибриллы –структуры толщиной 1 -2 мкм , состоящие из саркомеров –структур длиной около 2, 5 мкм , состоящих из актиновых и миозиновых (толстых и тонких )фрагментов и Z-дисков , соединенных с актиновыми филаментами.
 Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca 2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50%
Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca 2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50%
 Схема, показывающая мышцы в расслабленном(выше)и сокращенном (ниже) положениях.
Схема, показывающая мышцы в расслабленном(выше)и сокращенном (ниже) положениях.
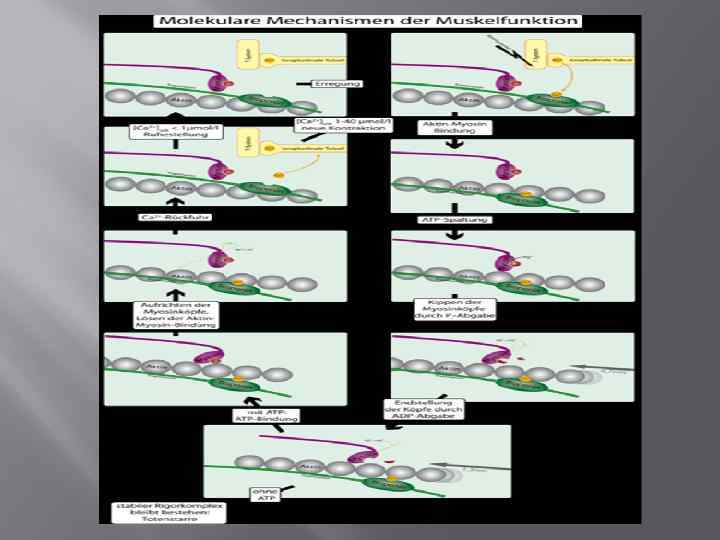
 Скольжение миозина относительно актина 1. Свободная головка миозина связывается с АТФ и гидролизует его до АДФ и фосфата и остаётся связанной с ними. (Обратимый процесс — энергия, выделившаяся в результате гидролиза, запасается в изменённой конформации миозина). 2. Головки слабо связываются со следующей субъединицей актина, фосфат отделяется, и это приводит к прочному связыванию головки миозина с актиновым филаментом. Эта реакция уже необратима. 3. Головка претерпевает конформационное изменение, производящее подтягивание толстого филамента к Z-диску (или, что эквивалентно, свободных концов тонких филаментов друг к другу). 4. Отделяется АДФ, за счёт этого головка отделяется от актинового филамента. Присоединяется новая молекула АТФ.
Скольжение миозина относительно актина 1. Свободная головка миозина связывается с АТФ и гидролизует его до АДФ и фосфата и остаётся связанной с ними. (Обратимый процесс — энергия, выделившаяся в результате гидролиза, запасается в изменённой конформации миозина). 2. Головки слабо связываются со следующей субъединицей актина, фосфат отделяется, и это приводит к прочному связыванию головки миозина с актиновым филаментом. Эта реакция уже необратима. 3. Головка претерпевает конформационное изменение, производящее подтягивание толстого филамента к Z-диску (или, что эквивалентно, свободных концов тонких филаментов друг к другу). 4. Отделяется АДФ, за счёт этого головка отделяется от актинового филамента. Присоединяется новая молекула АТФ.
 Цикл повторяется до уменьшения концентрации ионов Ca 2+ Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актинзависимая АТФаза. Так каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
Цикл повторяется до уменьшения концентрации ионов Ca 2+ Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актинзависимая АТФаза. Так каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
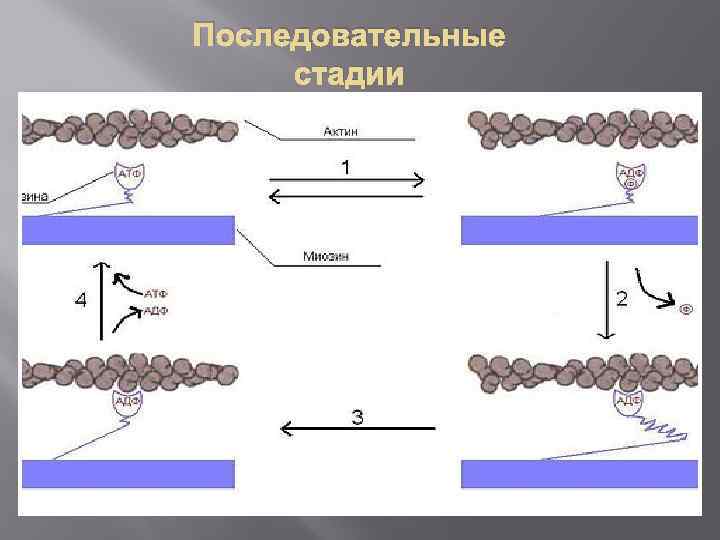 Последовательные стадии
Последовательные стадии
 Механизм сокращения мышц с учетом тропонина и тропомиозина Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T, I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca 2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.
Механизм сокращения мышц с учетом тропонина и тропомиозина Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T, I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca 2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.
 Роль кальция в процессе сокращения Кальций активен в саркоплазме при такой низкой (10 -6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10 -6 М. Самые первые доказательства физиологической роли Са 2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы. Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са 2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са 2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са 2+.
Роль кальция в процессе сокращения Кальций активен в саркоплазме при такой низкой (10 -6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10 -6 М. Самые первые доказательства физиологической роли Са 2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы. Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са 2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са 2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са 2+.


