Методы иссл. белка.ppt
- Количество слайдов: 28

Методы выделения и исследования структуры белка
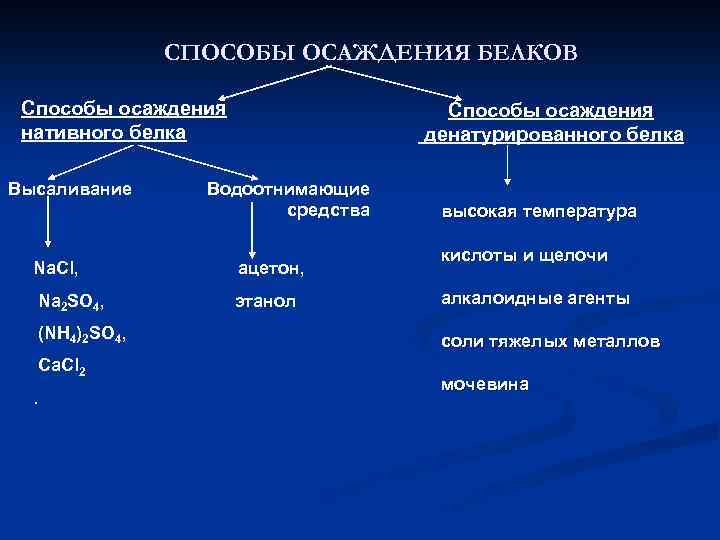
СПОСОБЫ ОСАЖДЕНИЯ БЕЛКОВ Способы осаждения нативного белка Высаливание Способы осаждения денатурированного белка Водоотнимающие средства Na. Cl, ацетон, Na 2 SO 4, этанол (NH 4)2 SO 4, Ca. Cl 2. высокая температура кислоты и щелочи алкалоидные агенты соли тяжелых металлов мочевина

Факторы, вызывающие денатурацию белков денатурирующие агенты механизмы действия реагента высокая температура (выше 60° C) разрушение гидрофобных и водородных связей (слабых взаимодействий) кислоты и щелочи изменение диссоциации ионогенных групп, разрыв водородных связей алкалоидные агенты (пикриновая кислота, танин) образование солеобразных соединений между алкалоидами (основаниями) и белком соли тяжелых металлов образование нерастворимых солей белков и ионов тяжелых металлов мочевина разрушение внутримолекулярных водородных связей в результате образования водородных связей с мочевиной

Гель-проникающая хроматография или гель-фильтрация Белки фракционируются по размеру частиц: малые молекулы образца могут проникатиь внутрь гранул геля, вследствие этого протекают через колонку медленнее; крупные молекулы протекают в промежутки между гранулами геля и проходят через колонку быстрее.
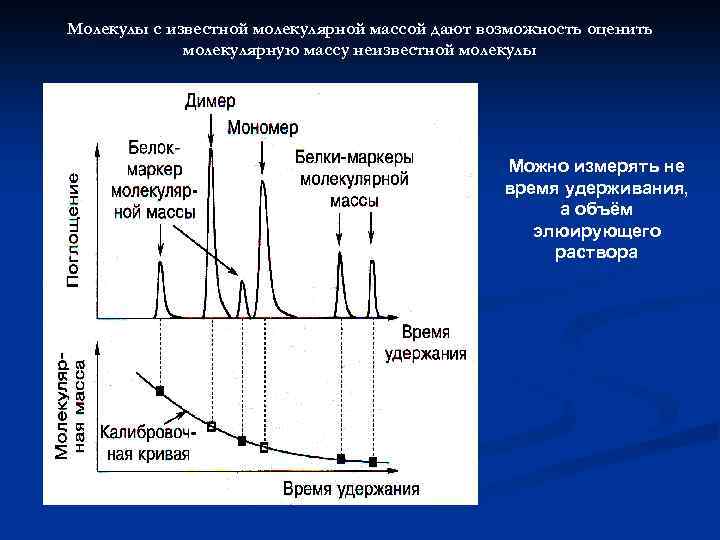
Молекулы с известной молекулярной массой дают возможность оценить молекулярную массу неизвестной молекулы Можно измерять не время удерживания, а объём элюирующего раствора

Ионообменная хроматография (ИОХ) Диэтиламиноэтил Карбоксиметил
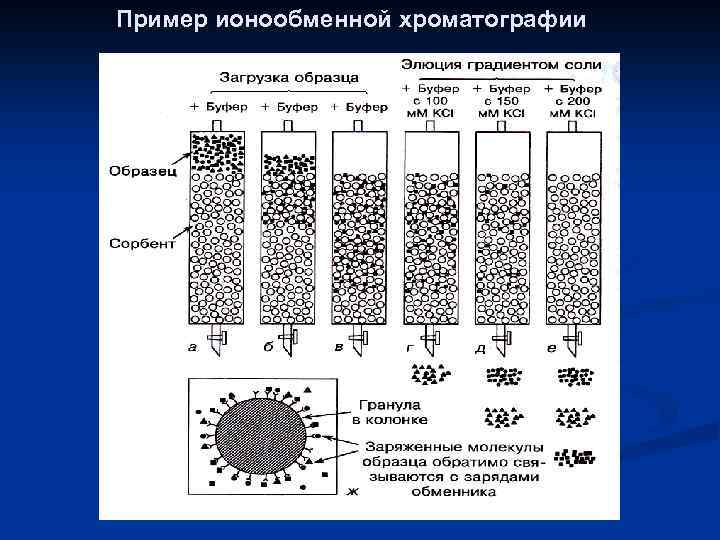
Пример ионообменной хроматографии
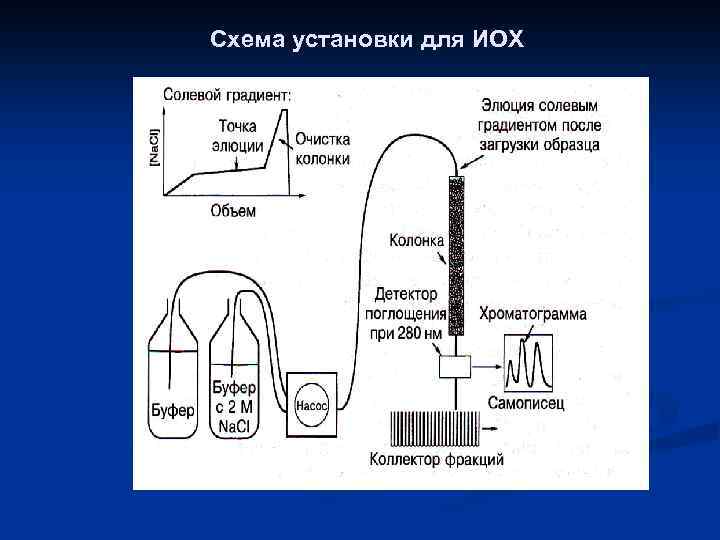
Схема установки для ИОХ

Аффинная хроматография (хроматография по биоспецифическому сродству) Антиген – антитело Лектин – углевод Фермент - субстрат
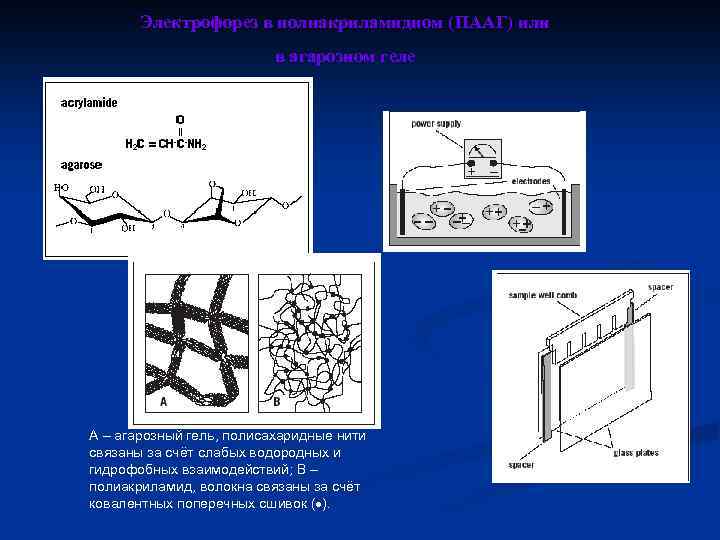
Электрофорез в полиакриламидном (ПААГ) или в агарозном геле А – агарозный гель, полисахаридные нити связаны за счёт слабых водородных и гидрофобных взаимодействий; В – полиакриламид, волокна связаны за счёт ковалентных поперечных сшивок ( ).

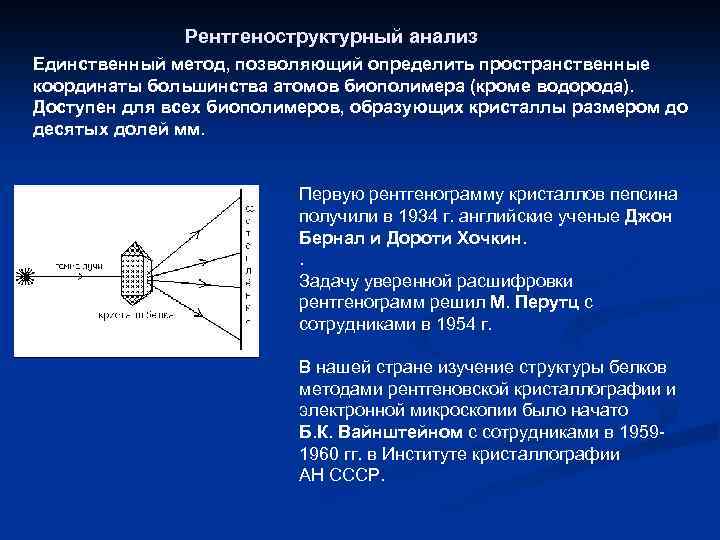
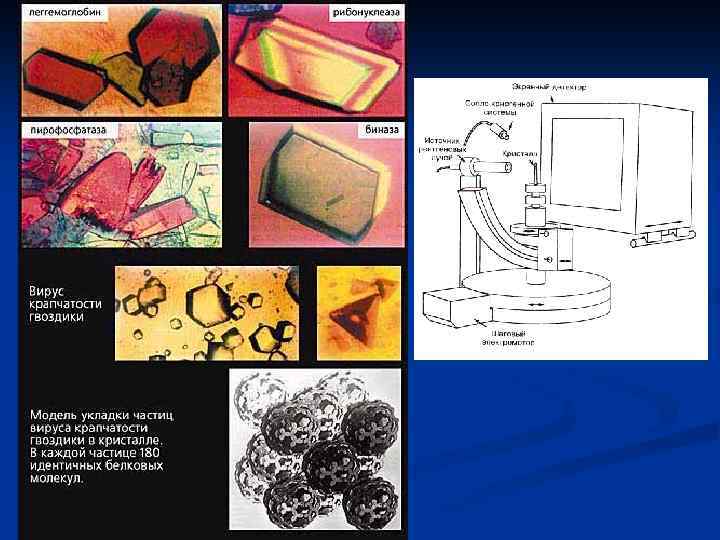
Рентгеноструктурный анализ Единственный метод, позволяющий определить пространственные координаты большинства атомов биополимера (кроме водорода). Доступен для всех биополимеров, образующих кристаллы размером до десятых долей мм. Первую рентгенограмму кристаллов пепсина получили в 1934 г. английские ученые Джон Бернал и Дороти Хочкин. . Задачу уверенной расшифровки рентгенограмм решил М. Перутц с сотрудниками в 1954 г. В нашей стране изучение структуры белков методами рентгеновской кристаллографии и электронной микроскопии было начато Б. К. Вайнштейном с сотрудниками в 19591960 гг. в Институте кристаллографии АН СССР.
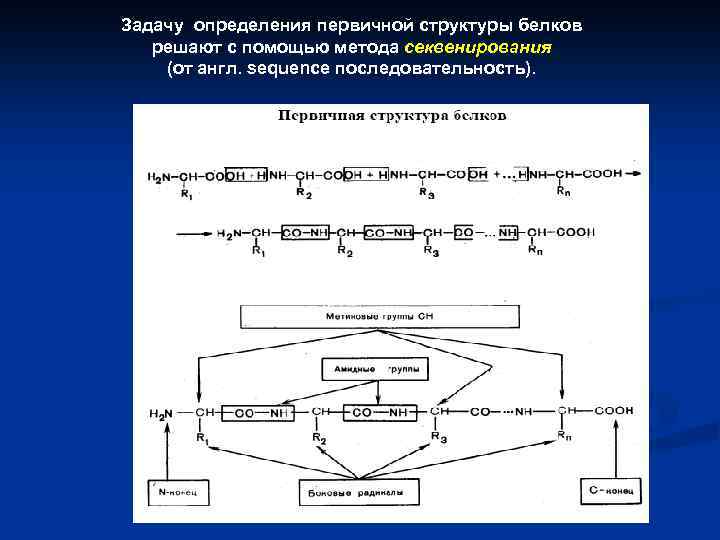
Задачу определения первичной структуры белков решают с помощью метода секвенирования (от англ. sequence последовательность).

Определение первичной последовательности белка сводится к следующим основным этапам 1. 2. 3. 4. 5. 6. Определение молекулярной массы белка. Определение аминокислотного состава белка. Определение N и C- концевых аминокислот. Химическое или ферментативное расщепление полипептидной цепи на несколько фрагментов. Секвенирование каждого из полученных фрагментов. Сборка полной структуры белка из установленных структур его фрагментов.

Расщепление: n n n ферментами : трипсин - гидролизует химотрипсин триптофана. пептидные связи между лизином после остатков ароматических аминокислот - фенилаланина, химическими веществами: бромциан, расщепляющий белок по остаткам метионина. n и аргинином. тирозина и
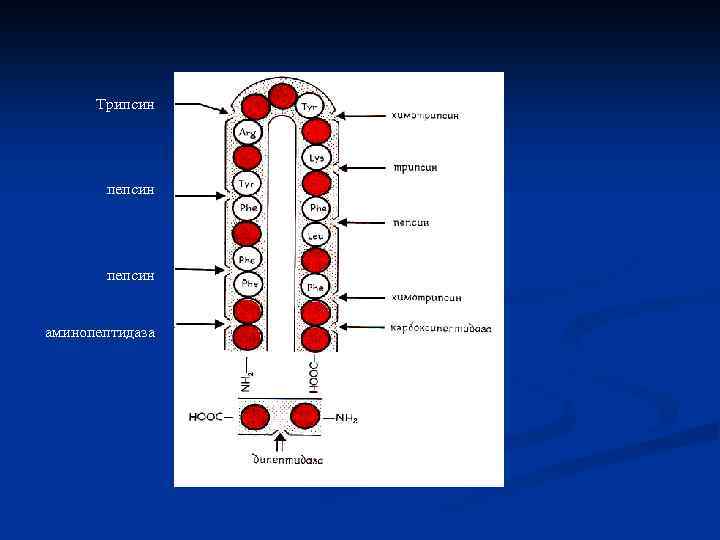
Трипсин пепсин аминопептидаза

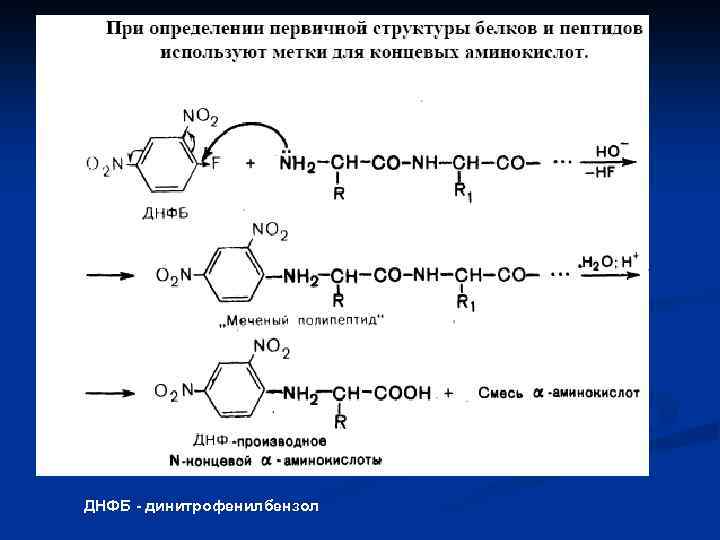
ДНФБ - динитрофенилбензол
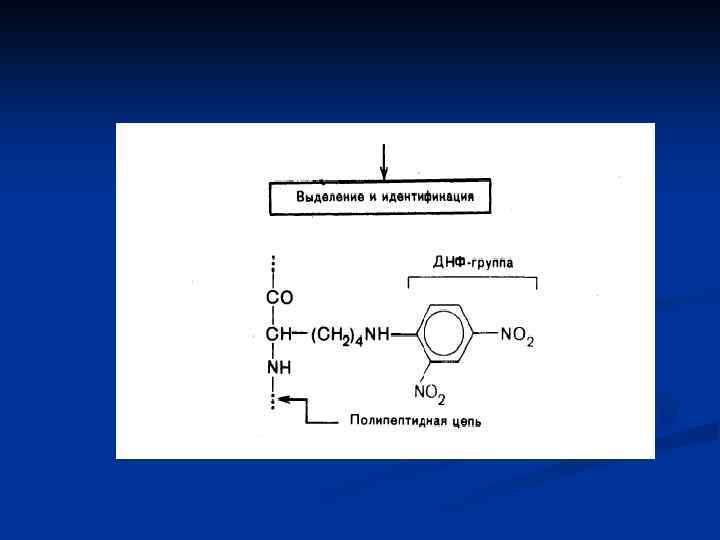
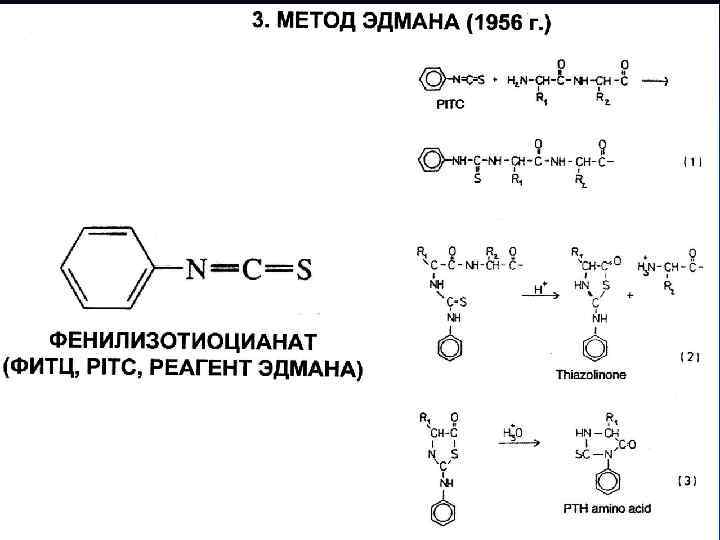
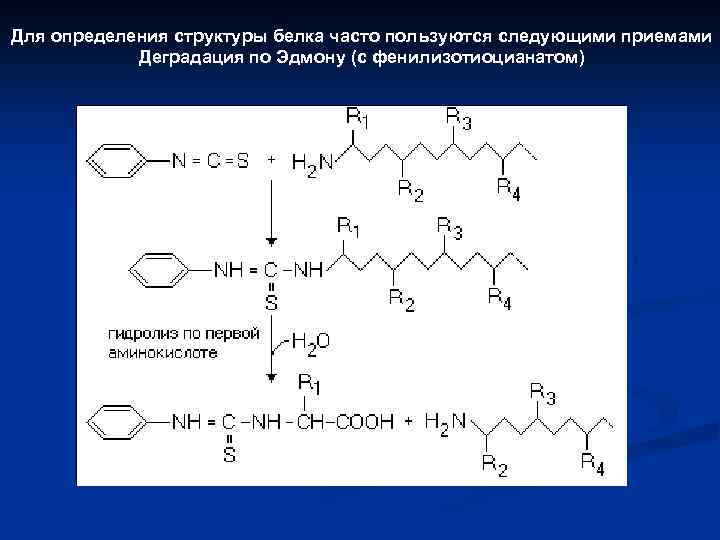
Для определения структуры белка часто пользуются следующими приемами Деградация по Эдмону (с фенилизотиоцианатом)
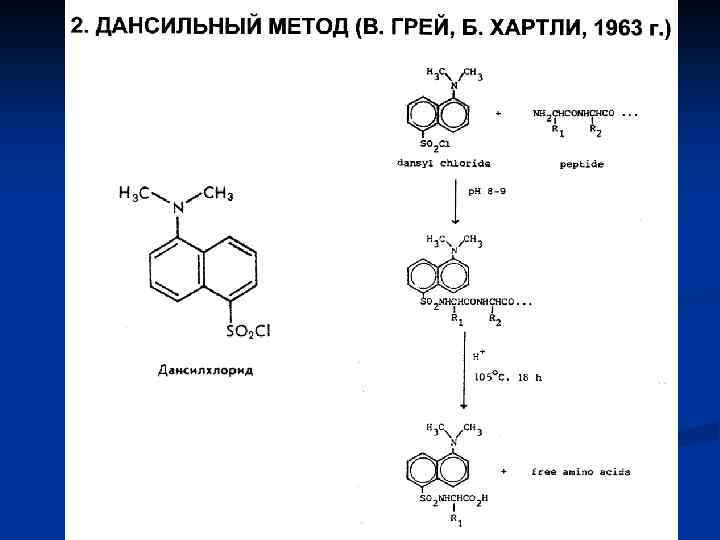
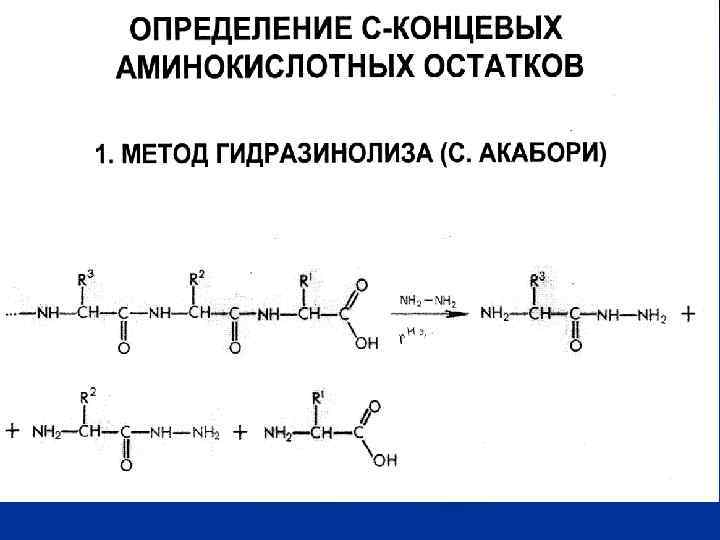
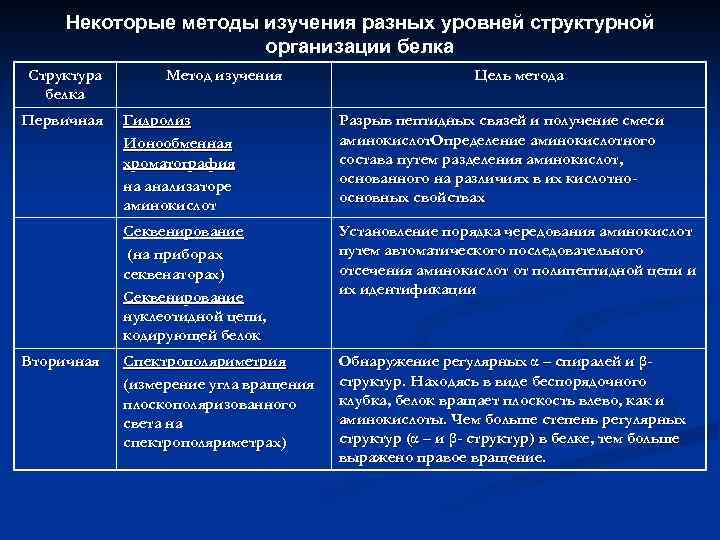
Некоторые методы изучения разных уровней структурной организации белка Структура белка Первичная Метод изучения Цель метода Разрыв пептидных связей и получение смеси аминокислот. Определение аминокислотного состава путем разделения аминокислот, основанного на различиях в их кислотноосновных свойствах Секвенирование (на приборах секвенаторах) Секвенирование нуклеотидной цепи, кодирующей белок Вторичная Гидролиз Ионообменная хроматография на анализаторе аминокислот Установление порядка чередования аминокислот путем автоматического последовательного отсечения аминокислот от полипептидной цепи и их идентификации Спектрополяриметрия (измерение угла вращения плоскополяризованного света на спектрополяриметрах) Обнаружение регулярных α – спиралей и βструктур. Находясь в виде беспорядочного клубка, белок вращает плоскость влево, как и аминокислоты. Чем больше степень регулярных структур (α – и β- структур) в белке, тем больше выражено правое вращение.
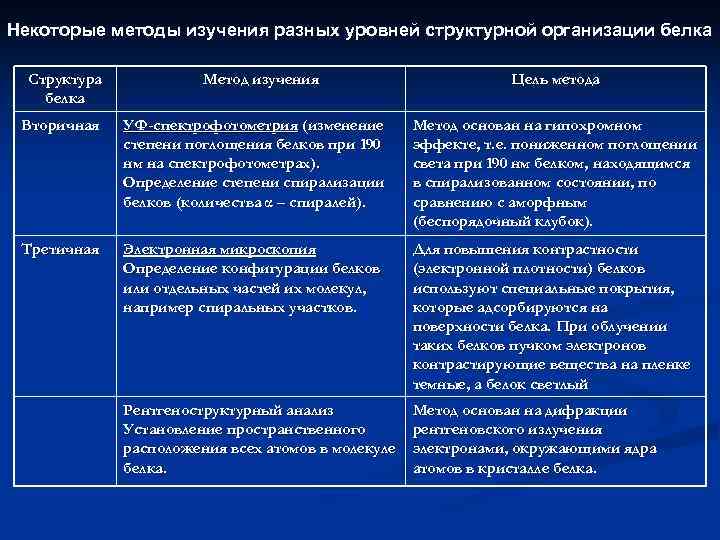
Некоторые методы изучения разных уровней структурной организации белка Структура белка Метод изучения Цель метода Вторичная УФ-спектрофотометрия (изменение степени поглощения белков при 190 нм на спектрофотометрах). Определение степени спирализации белков (количества α – спиралей). Метод основан на гипохромном эффекте, т. е. пониженном поглощении света при 190 нм белком, находящимся в спирализованном состоянии, по сравнению с аморфным (беспорядочный клубок). Третичная Электронная микроскопия Определение конфигурации белков или отдельных частей их молекул, например спиральных участков. Для повышения контрастности (электронной плотности) белков используют специальные покрытия, которые адсорбируются на поверхности белка. При облучении таких белков пучком электронов контрастирующие вещества на пленке темные, а белок светлый Рентгеноструктурный анализ Установление пространственного расположения всех атомов в молекуле белка. Метод основан на дифракции рентгеновского излучения электронами, окружающими ядра атомов в кристалле белка.
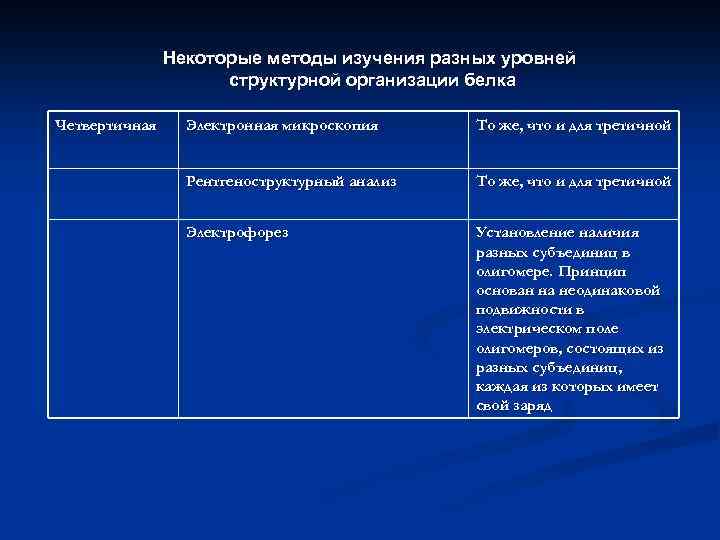
Некоторые методы изучения разных уровней структурной организации белка Четвертичная Электронная микроскопия То же, что и для третичной Рентгеноструктурный анализ То же, что и для третичной Электрофорез Установление наличия разных субъединиц в олигомере. Принцип основан на неодинаковой подвижности в электрическом поле олигомеров, состоящих из разных субъединиц, каждая из которых имеет свой заряд
Методы иссл. белка.ppt