Лекция 18-2012 Конц и разд.ppt
- Количество слайдов: 18
 МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ 1. Классификация методов. 2. Количественные характеристики процессов разделения и концентрирования. 3. Экстракция.
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ 1. Классификация методов. 2. Количественные характеристики процессов разделения и концентрирования. 3. Экстракция.
 Концентрирование применяют, если методы анализа недостаточно чувствительны. Разделение применяют, если методы анализа недостаточно селективны. Методы разделения и концентрирования направлены на достижение разных целей. Но реализуются они однотипными способами. И в случае концентрирования, и в случае разделения происходит перераспределение компонентов пробы между двумя фазами.
Концентрирование применяют, если методы анализа недостаточно чувствительны. Разделение применяют, если методы анализа недостаточно селективны. Методы разделения и концентрирования направлены на достижение разных целей. Но реализуются они однотипными способами. И в случае концентрирования, и в случае разделения происходит перераспределение компонентов пробы между двумя фазами.
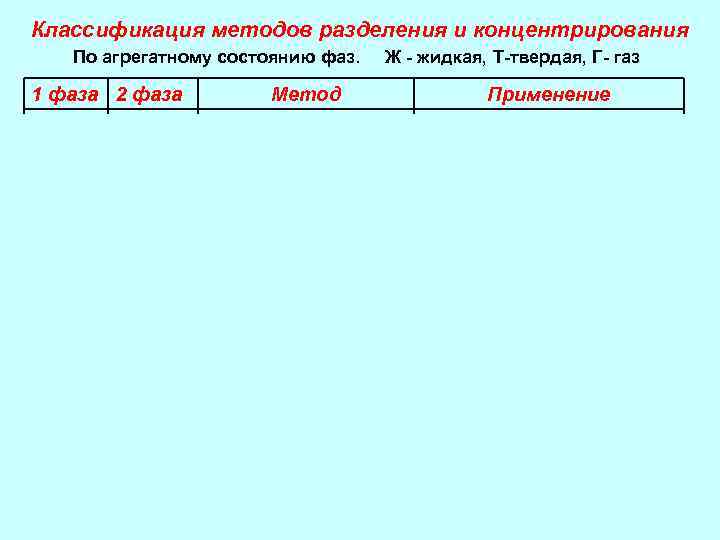 Классификация методов разделения и концентрирования По агрегатному состоянию фаз. 1 фаза 2 фаза Ж, Т Ж Г Г Ж Ж - жидкая, Т-твердая, Г- газ Метод экстракция Адсорбция, ионный обмен, тонкослойная хроматография (ТСХ) Т Ж Т Абсорбция, адсорбция, Газовая хроматография (ГХ) Применение повсеместно Выделение орг. в-в. Разделение ионов. Судмедэкспертиза, Анализ фармпрепарартов Анализ лекарств, пищевых продуктов, нефтепродуктов, анализ воздуха
Классификация методов разделения и концентрирования По агрегатному состоянию фаз. 1 фаза 2 фаза Ж, Т Ж Г Г Ж Ж - жидкая, Т-твердая, Г- газ Метод экстракция Адсорбция, ионный обмен, тонкослойная хроматография (ТСХ) Т Ж Т Абсорбция, адсорбция, Газовая хроматография (ГХ) Применение повсеместно Выделение орг. в-в. Разделение ионов. Судмедэкспертиза, Анализ фармпрепарартов Анализ лекарств, пищевых продуктов, нефтепродуктов, анализ воздуха
 Классификация методов разделения и концентрирования - По кратности установления равновесия между фазами Однократно Многократно Экстракция Хроматография, ионный обмен - По относительному содержанию компонентов Абсолютное концентирование без изменения соотношения концентраций компонентов Относительное концентрирвание С изменением соотношения концентраций компонентов Выпаривание Экстракция, Сорбция, хроматография
Классификация методов разделения и концентрирования - По кратности установления равновесия между фазами Однократно Многократно Экстракция Хроматография, ионный обмен - По относительному содержанию компонентов Абсолютное концентирование без изменения соотношения концентраций компонентов Относительное концентрирвание С изменением соотношения концентраций компонентов Выпаривание Экстракция, Сорбция, хроматография
 Количественные характеристики процессов разделения и концентрирования Коэффициент распределения: Степень извлечения (R, в долях или в %) Коэффициент концентрирования (N) Коэффициент разделения
Количественные характеристики процессов разделения и концентрирования Коэффициент распределения: Степень извлечения (R, в долях или в %) Коэффициент концентрирования (N) Коэффициент разделения
 Экстракция – распределение веществ между двумя фазами, одна из которой - жидкость. Экстракция в быту…. -настои, отвары (овощные, фруктовые, мясные и рыбные бульоны) …. в анализе -извлечение определяемых компонентов из твердых образцов – почвы, растения, продукты питания, биологические материалы, пластики, и т. п. -извлечение из жидких образцов – питьевая, речная, сточная воды, соки, биологические жидкости и т. п. В анализе, как правило, ведут извлечение из водной фазы в органическую
Экстракция – распределение веществ между двумя фазами, одна из которой - жидкость. Экстракция в быту…. -настои, отвары (овощные, фруктовые, мясные и рыбные бульоны) …. в анализе -извлечение определяемых компонентов из твердых образцов – почвы, растения, продукты питания, биологические материалы, пластики, и т. п. -извлечение из жидких образцов – питьевая, речная, сточная воды, соки, биологические жидкости и т. п. В анализе, как правило, ведут извлечение из водной фазы в органическую
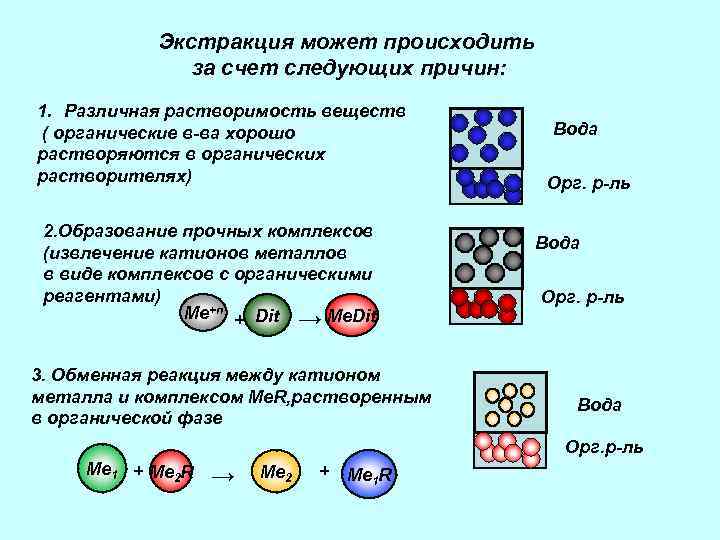 Экстракция может происходить за счет следующих причин: 1. Различная растворимость веществ ( органические в-ва хорошо растворяются в органических растворителях) 2. Образование прочных комплексов (извлечение катионов металлов в виде комплексов с органическими реагентами) Ме+n + Dit → Ме. Dit 3. Обменная реакция между катионом металла и комплексом Me. R, растворенным в органической фазе Вода Орг. р-ль Ме 1 + Ме 2 R → Ме 2 + Me 1 R
Экстракция может происходить за счет следующих причин: 1. Различная растворимость веществ ( органические в-ва хорошо растворяются в органических растворителях) 2. Образование прочных комплексов (извлечение катионов металлов в виде комплексов с органическими реагентами) Ме+n + Dit → Ме. Dit 3. Обменная реакция между катионом металла и комплексом Me. R, растворенным в органической фазе Вода Орг. р-ль Ме 1 + Ме 2 R → Ме 2 + Me 1 R
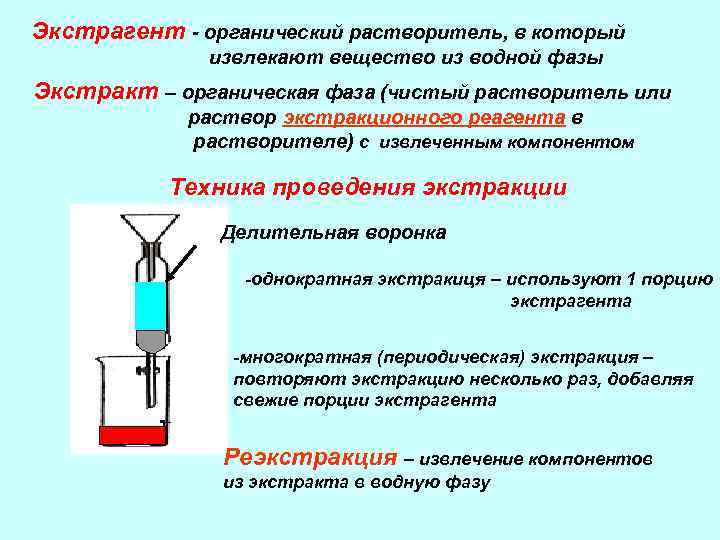 Экстрагент - органический растворитель, в который извлекают вещество из водной фазы Экстракт – органическая фаза (чистый растворитель или раствор экстракционного реагента в растворителе) с извлеченным компонентом Техника проведения экстракции Делительная воронка -однократная экстракиця – используют 1 порцию экстрагента -многократная (периодическая) экстракция – повторяют экстракцию несколько раз, добавляя свежие порции экстрагента Реэкстракция – извлечение компонентов из экстракта в водную фазу
Экстрагент - органический растворитель, в который извлекают вещество из водной фазы Экстракт – органическая фаза (чистый растворитель или раствор экстракционного реагента в растворителе) с извлеченным компонентом Техника проведения экстракции Делительная воронка -однократная экстракиця – используют 1 порцию экстрагента -многократная (периодическая) экстракция – повторяют экстракцию несколько раз, добавляя свежие порции экстрагента Реэкстракция – извлечение компонентов из экстракта в водную фазу
 Требования к экстрагенту 1. Не должен смешиваться с водой 2. Плотность экстрагента должна как можно больше отличаться от плотности воды 3. Должен быть селективным 4. Должен иметь как можно более высокую температуру кипения (летучесть паров – минимальна) 5. Должен быть дешевым, не токсичным, легко очищаться Часто применяемые экстрагенты: хлороформ(СHСl 3), тетрахлорметан (ССl 4), н-алканы, изобутиловый спирт Экстракционные реагенты: Дитизон, оксихинолин, ацетилацетон
Требования к экстрагенту 1. Не должен смешиваться с водой 2. Плотность экстрагента должна как можно больше отличаться от плотности воды 3. Должен быть селективным 4. Должен иметь как можно более высокую температуру кипения (летучесть паров – минимальна) 5. Должен быть дешевым, не токсичным, легко очищаться Часто применяемые экстрагенты: хлороформ(СHСl 3), тетрахлорметан (ССl 4), н-алканы, изобутиловый спирт Экстракционные реагенты: Дитизон, оксихинолин, ацетилацетон
 Экстракционное равновесие Закон распределения (Бертло и Юнгфлейш) При отсутствии побочных реакций отношение равновесных концентраций вещества Х в обеих фазах есть величина постоянная для данной системы, не зависящая от общей концентрации Х Константа распределения: SX –растворимость Х в 1 -ой и 2 -ой фазах Если в одной из фаз вещество Х находится в нескольких формах: Коэффициент распределения: αj – мольная доля j-ой формы КDj – константа распределения j-ой формы
Экстракционное равновесие Закон распределения (Бертло и Юнгфлейш) При отсутствии побочных реакций отношение равновесных концентраций вещества Х в обеих фазах есть величина постоянная для данной системы, не зависящая от общей концентрации Х Константа распределения: SX –растворимость Х в 1 -ой и 2 -ой фазах Если в одной из фаз вещество Х находится в нескольких формах: Коэффициент распределения: αj – мольная доля j-ой формы КDj – константа распределения j-ой формы
 Cтепень извлечения Степень извлечения (R, в долях или в %) Степень извлечения за m экстракций: Степень извлечения за однократную экстракцию: Rm = 1 - (1 – R)m (2) Число экстракций: (1) (3)
Cтепень извлечения Степень извлечения (R, в долях или в %) Степень извлечения за m экстракций: Степень извлечения за однократную экстракцию: Rm = 1 - (1 – R)m (2) Число экстракций: (1) (3)
 Пример Какова степень извлечения цинка в виде комплекса с дитизоном, если объем водной фазы – 500 мл, органической – 25 мл, D = 50? Сколько экстракций следует провести, чтобы извлечь цинк не менее, чем на 99, 9% ? R=0, 7 Rm = 0, 999
Пример Какова степень извлечения цинка в виде комплекса с дитизоном, если объем водной фазы – 500 мл, органической – 25 мл, D = 50? Сколько экстракций следует провести, чтобы извлечь цинк не менее, чем на 99, 9% ? R=0, 7 Rm = 0, 999
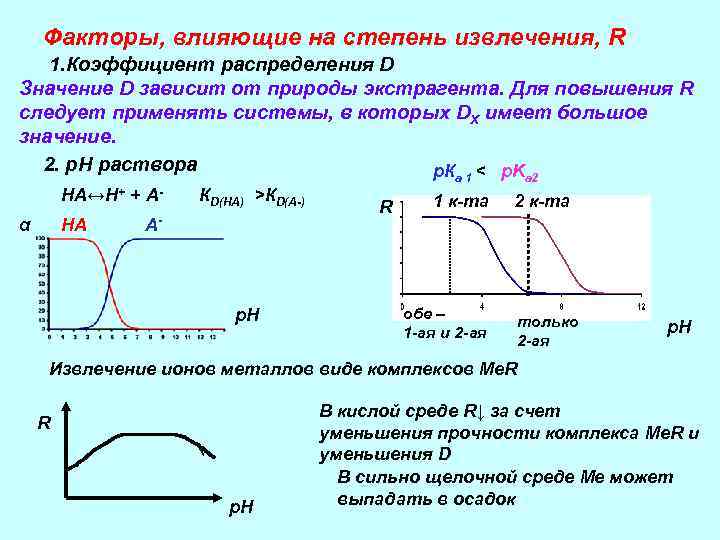 Факторы, влияющие на степень извлечения, R 1. Коэффициент распределения D Значение D зависит от природы экстрагента. Для повышения R следует применять системы, в которых DХ имеет большое значение. 2. р. Н раствора p. К < p. K a 1 НА↔Н+ α НА + А- КD(НА) >КD(А-) А- р. Н R 1 к-та a 2 2 к-та обе – 1 -ая и 2 -ая только 2 -ая р. Н Извлечение ионов металлов виде комплексов Ме. R R р. Н В кислой среде R↓ за счет уменьшения прочности комплекса Me. R и уменьшения D В сильно щелочной среде Me может выпадать в осадок
Факторы, влияющие на степень извлечения, R 1. Коэффициент распределения D Значение D зависит от природы экстрагента. Для повышения R следует применять системы, в которых DХ имеет большое значение. 2. р. Н раствора p. К < p. K a 1 НА↔Н+ α НА + А- КD(НА) >КD(А-) А- р. Н R 1 к-та a 2 2 к-та обе – 1 -ая и 2 -ая только 2 -ая р. Н Извлечение ионов металлов виде комплексов Ме. R R р. Н В кислой среде R↓ за счет уменьшения прочности комплекса Me. R и уменьшения D В сильно щелочной среде Me может выпадать в осадок
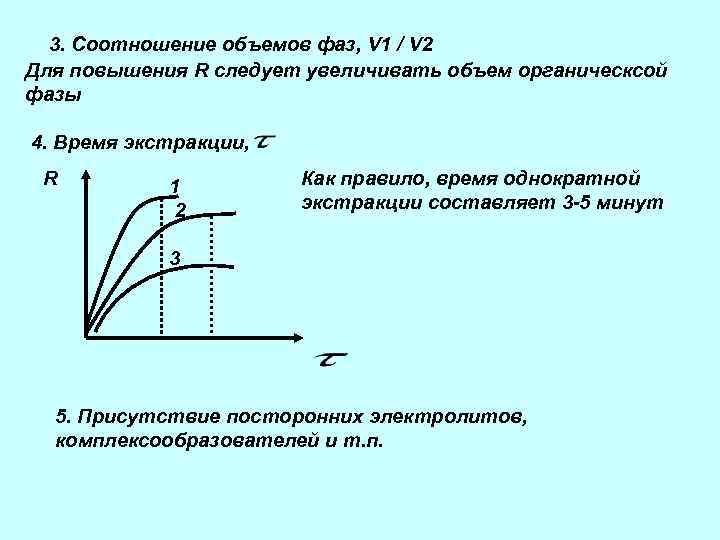 3. Соотношение объемов фаз, V 1 / V 2 Для повышения R следует увеличивать объем органическсой фазы 4. Время экстракции, R 1 2 Как правило, время однократной экстракции составляет 3 -5 минут 3 5. Присутствие посторонних электролитов, комплексообразователей и т. п.
3. Соотношение объемов фаз, V 1 / V 2 Для повышения R следует увеличивать объем органическсой фазы 4. Время экстракции, R 1 2 Как правило, время однократной экстракции составляет 3 -5 минут 3 5. Присутствие посторонних электролитов, комплексообразователей и т. п.
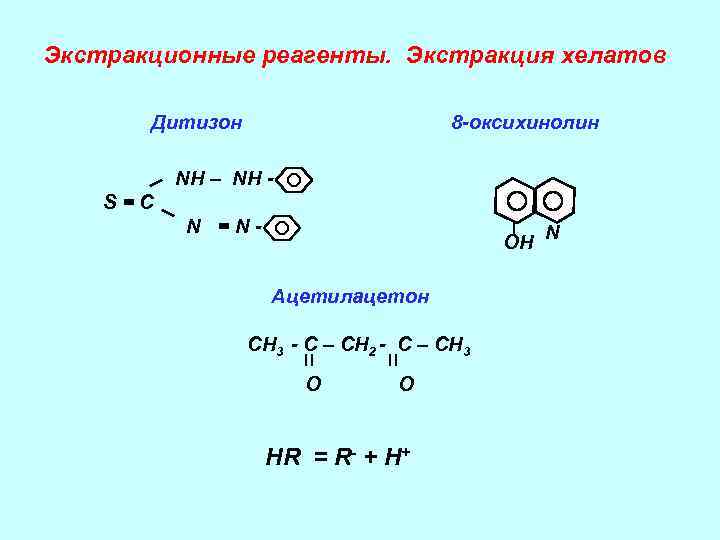 Экстракционные реагенты. Экстракция хелатов Дитизон 8 -оксихинолин NH – NH S=C N =N- ОН N Ацетилацетон СН 3 - С – СН 2 - С – СН 3 О О НR = R- + H+
Экстракционные реагенты. Экстракция хелатов Дитизон 8 -оксихинолин NH – NH S=C N =N- ОН N Ацетилацетон СН 3 - С – СН 2 - С – СН 3 О О НR = R- + H+
 Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) 0 (4)
Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) 0 (4)
 (4) Из (4) следует: 1. Коэффициент распределения тем больше, чем выше р. Н раствора и чем больше концентрация реагента 2. Экстракцию следует вести в слабощелочной среде, а реэкстракцию – в кислой. При реэкстракции комплекс Ме. R разрушается и Ме переходит в кислую водную фазу. 3. Варьируя р. Н водной фазы, можно повысить избирательность разделения катионов металлов
(4) Из (4) следует: 1. Коэффициент распределения тем больше, чем выше р. Н раствора и чем больше концентрация реагента 2. Экстракцию следует вести в слабощелочной среде, а реэкстракцию – в кислой. При реэкстракции комплекс Ме. R разрушается и Ме переходит в кислую водную фазу. 3. Варьируя р. Н водной фазы, можно повысить избирательность разделения катионов металлов
 Применение экстракции в анализе -для индивидуального и группового концентрирования микропримесей - для отделения мешающих макрокомпонентов пробы - для очистки реактивов и растворителей. Достоинства -универсальность - селективность - высокие коэффициенты концентрирования ( более 100) - простота методик, их доступность и низкая стоимость Недостатки - Длительность и трудоемкость - экстрагенты токсичны и пожароопасны.
Применение экстракции в анализе -для индивидуального и группового концентрирования микропримесей - для отделения мешающих макрокомпонентов пробы - для очистки реактивов и растворителей. Достоинства -универсальность - селективность - высокие коэффициенты концентрирования ( более 100) - простота методик, их доступность и низкая стоимость Недостатки - Длительность и трудоемкость - экстрагенты токсичны и пожароопасны.


