РАЗДЕЛЕНИЕ И КОНЦЕНТРИРОВАНИЕ.ppt
- Количество слайдов: 25
 МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРО ВАНИЯ
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРО ВАНИЯ
 Пусть имеется однофазная система I, образованная двумя ком понентами. M 1 и М 2, причем компонент M 1 мешает обнаружению компонента М 2. Физические и физико химические методы разделения на фазы При физических и физико химических методах разделения исходную фазу 1 системы I приводят в соприкосновение с другой фазой 2, не смешивающейся с первой (обычно фаза 1 — жидкость). Для достижения равновесия обе фазы тщательно смешивают, повторяя эту операцию несколько раз. Один или несколько компонентов системы I при этом переходят в фазу 2.
Пусть имеется однофазная система I, образованная двумя ком понентами. M 1 и М 2, причем компонент M 1 мешает обнаружению компонента М 2. Физические и физико химические методы разделения на фазы При физических и физико химических методах разделения исходную фазу 1 системы I приводят в соприкосновение с другой фазой 2, не смешивающейся с первой (обычно фаза 1 — жидкость). Для достижения равновесия обе фазы тщательно смешивают, повторяя эту операцию несколько раз. Один или несколько компонентов системы I при этом переходят в фазу 2.
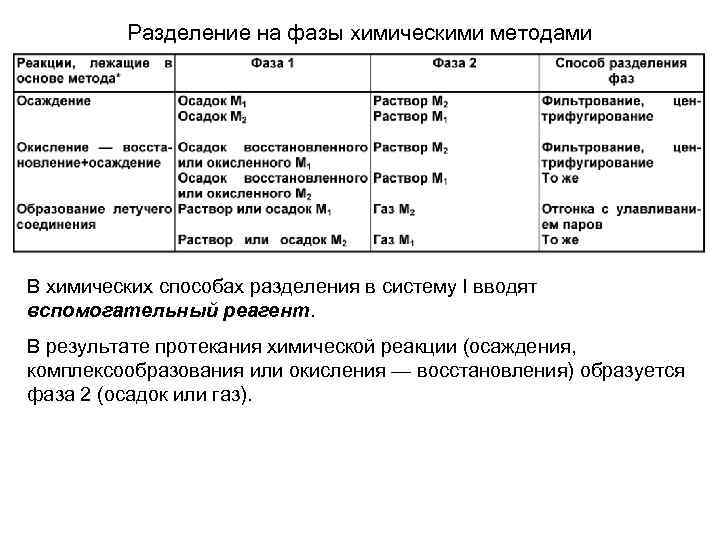 Разделение на фазы химическими методами В химических способах разделения в систему I вводят вспомогательный реагент. В результате протекания химической реакции (осаждения, комплексообразования или окисления — восстановления) образуется фаза 2 (осадок или газ).
Разделение на фазы химическими методами В химических способах разделения в систему I вводят вспомогательный реагент. В результате протекания химической реакции (осаждения, комплексообразования или окисления — восстановления) образуется фаза 2 (осадок или газ).
 ОСАЖДЕНИЕ КАК МЕТОД РАЗДЕЛЕНИЯ В процессе осаждения происходит образование новой фазы— осадка малорастворимого соединения. При этом определяемый компонент М 1 (исходное количество m 0) распределяется между двумя фазами: часть его m. II переходит в осадок, а другая часть m. I остается в состоянии динамического равновесия в исходной фазе—в растворе, из которого проводилось осаждение. Эффективность разделения характеризуется отношением: Наибольшее допустимое содержание компонента M 1 в исходном растворе после разделения 0, 1%. В осадок не должно перейти более 0, 1% мешающего компонента М 2. Если эти условия выполняются, разделение методом осаждения можно считать полным.
ОСАЖДЕНИЕ КАК МЕТОД РАЗДЕЛЕНИЯ В процессе осаждения происходит образование новой фазы— осадка малорастворимого соединения. При этом определяемый компонент М 1 (исходное количество m 0) распределяется между двумя фазами: часть его m. II переходит в осадок, а другая часть m. I остается в состоянии динамического равновесия в исходной фазе—в растворе, из которого проводилось осаждение. Эффективность разделения характеризуется отношением: Наибольшее допустимое содержание компонента M 1 в исходном растворе после разделения 0, 1%. В осадок не должно перейти более 0, 1% мешающего компонента М 2. Если эти условия выполняются, разделение методом осаждения можно считать полным.
 Разделение веществ методом осаждения может быть осуществлено следующими способами: 1. Определяемый компонент M 1 и мешающий М 2 находятся в растворе. Путем осаждения переводят один из компонентов в другую фазу — осадок. 2. Компоненты M 1 и М 2 находятся в осадке. Путем растворения переводят один из компонентов в другую фазу — раствор. 3. Комбинированный способ: если оба компонента находятся в растворе, сначала M 1 и М 2 осаждают из общей смеси, затем один из них переводят в раствор, а другой остается в осадке. Если мешающим является не один компонент, выбирают один из следующих приемов разделения: v подбирают селективный осадитель отделение определяемого компонента, (мешающие компоненты остаются в р ре); v подбирают групповой (или общий) осадитель отделение всех мешающих компонентов (определяемый компонент остается в р ре); v осаждают совместно определяемый и все мешающие компоненты, затем обрабатывают осадок растворителем, переводящим определяемый компонент в раствор (мешающие компоненты остаются в осадке).
Разделение веществ методом осаждения может быть осуществлено следующими способами: 1. Определяемый компонент M 1 и мешающий М 2 находятся в растворе. Путем осаждения переводят один из компонентов в другую фазу — осадок. 2. Компоненты M 1 и М 2 находятся в осадке. Путем растворения переводят один из компонентов в другую фазу — раствор. 3. Комбинированный способ: если оба компонента находятся в растворе, сначала M 1 и М 2 осаждают из общей смеси, затем один из них переводят в раствор, а другой остается в осадке. Если мешающим является не один компонент, выбирают один из следующих приемов разделения: v подбирают селективный осадитель отделение определяемого компонента, (мешающие компоненты остаются в р ре); v подбирают групповой (или общий) осадитель отделение всех мешающих компонентов (определяемый компонент остается в р ре); v осаждают совместно определяемый и все мешающие компоненты, затем обрабатывают осадок растворителем, переводящим определяемый компонент в раствор (мешающие компоненты остаются в осадке).
 ЭКСТРАКЦИЯ В основе экстракции лежит процесс избирательного извлечения одного или нескольких компонентов смеси жидких или твердых веществ с помощью органического растворителя, не смешивающегося с водой. Разделение осуществляется благодаря различной растворимости компонентов в водном растворе и в органическом растворителе. Разделение осуществляют следующим образом: после добавления всех необходимых химических веществ водный раствор и экстрагент помещают в делительную воронку или специальный аппарат—экстрактор, смесь встряхивают в течение определенного времени, затем оставляют до полного расслоения жидкостей и нижнюю фазу сливают. Аналитическое определение можно проводить непосредственно в экстракте либо после выделения анализируемых объектов из экстракта путем выпаривания, перегонки, кристаллизации.
ЭКСТРАКЦИЯ В основе экстракции лежит процесс избирательного извлечения одного или нескольких компонентов смеси жидких или твердых веществ с помощью органического растворителя, не смешивающегося с водой. Разделение осуществляется благодаря различной растворимости компонентов в водном растворе и в органическом растворителе. Разделение осуществляют следующим образом: после добавления всех необходимых химических веществ водный раствор и экстрагент помещают в делительную воронку или специальный аппарат—экстрактор, смесь встряхивают в течение определенного времени, затем оставляют до полного расслоения жидкостей и нижнюю фазу сливают. Аналитическое определение можно проводить непосредственно в экстракте либо после выделения анализируемых объектов из экстракта путем выпаривания, перегонки, кристаллизации.
 ДЕЛИТЕЛЬНАЯ ВОРОНКА
ДЕЛИТЕЛЬНАЯ ВОРОНКА
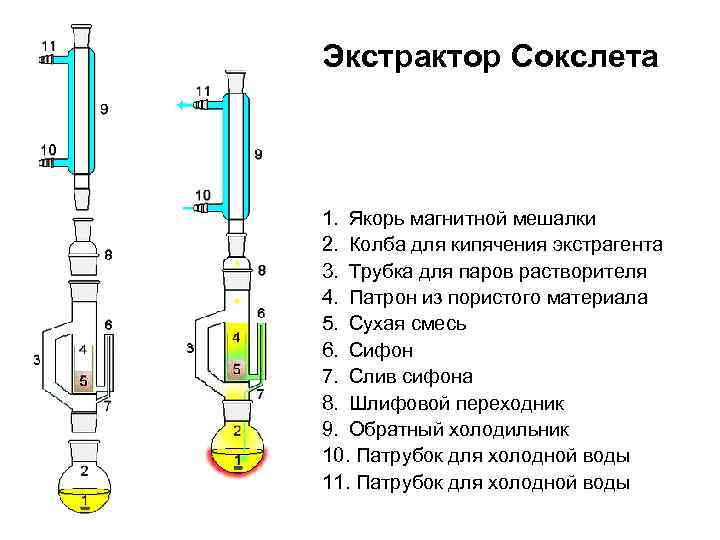 Экстрактор Сокслета 1. Якорь магнитной мешалки 2. Колба для кипячения экстрагента 3. Трубка для паров растворителя 4. Патрон из пористого материала 5. Сухая смесь 6. Сифон 7. Слив сифона 8. Шлифовой переходник 9. Обратный холодильник 10. Патрубок для холодной воды 11. Патрубок для холодной воды
Экстрактор Сокслета 1. Якорь магнитной мешалки 2. Колба для кипячения экстрагента 3. Трубка для паров растворителя 4. Патрон из пористого материала 5. Сухая смесь 6. Сифон 7. Слив сифона 8. Шлифовой переходник 9. Обратный холодильник 10. Патрубок для холодной воды 11. Патрубок для холодной воды
 Жидкость жидкостная экстракция описывается законом распределения Нернста: Ka. D = a 1/a 2 где Ka. D — константа распределения; a 1 и а 2 — активности вещества в первой и второй фазах соответственно. Для достаточно разбавленных растворов активности в уравнении распределения можно заменить равновесными концентрациями: Kс. D = [A 1][A 2]. Часто величина Кc. D приблизительно равна отношению растворимостей вещества в каждом из растворителей.
Жидкость жидкостная экстракция описывается законом распределения Нернста: Ka. D = a 1/a 2 где Ka. D — константа распределения; a 1 и а 2 — активности вещества в первой и второй фазах соответственно. Для достаточно разбавленных растворов активности в уравнении распределения можно заменить равновесными концентрациями: Kс. D = [A 1][A 2]. Часто величина Кc. D приблизительно равна отношению растворимостей вещества в каждом из растворителей.
 Экстракция может осложняться процессами полимеризации, сольватации, ионизации и другими в обеих фазах, поэтому вместо KD используют коэффициент распределения, показывающий отношение суммарных концентраций всех форм экстрагируемого в ва в одной фазе к суммарной концентрации всех его форм в другой фазе: Dc = (см)орг. / (см) вод. Коэффициент распределения зависит от р. Н раствора, константы распределения и др.
Экстракция может осложняться процессами полимеризации, сольватации, ионизации и другими в обеих фазах, поэтому вместо KD используют коэффициент распределения, показывающий отношение суммарных концентраций всех форм экстрагируемого в ва в одной фазе к суммарной концентрации всех его форм в другой фазе: Dc = (см)орг. / (см) вод. Коэффициент распределения зависит от р. Н раствора, константы распределения и др.
 Зная KD и Dc, можно определить: v какой объем органического растворителя потребуется для экстракции вещества из определенного объема водной фазы и v сколько раз надо провести операцию экстрагирования. Необходимое соотношение объемов водной и органической фаз и число повторных экстракций могут быть рассчитаны по формуле: где Vвод и Vopг — объем водной и органической фаз соответст венно; R — степень экстракции (извлечения). Объем органической фазы, необходимый для достижения заданной степени извлечения, определяют по уравнению:
Зная KD и Dc, можно определить: v какой объем органического растворителя потребуется для экстракции вещества из определенного объема водной фазы и v сколько раз надо провести операцию экстрагирования. Необходимое соотношение объемов водной и органической фаз и число повторных экстракций могут быть рассчитаны по формуле: где Vвод и Vopг — объем водной и органической фаз соответст венно; R — степень экстракции (извлечения). Объем органической фазы, необходимый для достижения заданной степени извлечения, определяют по уравнению:
 МЕТОДЫ КОНЦЕНТРИРОВАНИЯ При определении микрокомпонентов можно выделить задачи: v использование очень малых навесок или объемов пробы при значительных содержаниях в них определяемых компонентов и v анализ больших по массе или объему проб для установления содержания в них следовых количеств веществ. Для решения первой задачи помимо указанных физических методов анализа пригодны методы ультрамикроанализа, в том числе ультрамикрохимический анализ. Для решения второй задачи в качестве предварительной операции используют концентрирование. Оно необходимо в тех случаях, когда нужно увеличить концентрации микрокомпонентов для последующего анализа или отделить следовые количества определяемых компонентов от основных (матрицы) или других микрокомпонентов.
МЕТОДЫ КОНЦЕНТРИРОВАНИЯ При определении микрокомпонентов можно выделить задачи: v использование очень малых навесок или объемов пробы при значительных содержаниях в них определяемых компонентов и v анализ больших по массе или объему проб для установления содержания в них следовых количеств веществ. Для решения первой задачи помимо указанных физических методов анализа пригодны методы ультрамикроанализа, в том числе ультрамикрохимический анализ. Для решения второй задачи в качестве предварительной операции используют концентрирование. Оно необходимо в тех случаях, когда нужно увеличить концентрации микрокомпонентов для последующего анализа или отделить следовые количества определяемых компонентов от основных (матрицы) или других микрокомпонентов.
 Концентрирование всегда связано с разделением и перераспределением веществ по различным фазам, поэтому все методы, пригодные для разделения, используют и для концентрирования. Они, как правило, сочетаются с физико химическими или физическими методами анализа, но в неко торых случаях определение заканчивают гравиметрическими или титриметрическими методами. При выборе метода концентрирования руководствуются: природой объекта и его химическим составом, последующим методом анализа, продолжительностью проведения всех опе раций, обеспеченностью необходимым оборудованием и т. п. Различают групповое и индивидуальное концентрирование: v При групповом концентрировании за одну операцию выделяют совместно несколько микрокомпонентов; v При индивидуальном — из образца выделяют один микрокомпонент за одну операцию или за несколько последова тельных операции. Концентрирование осуществляют либо удалением основы, либо выделением микрокомпонентов.
Концентрирование всегда связано с разделением и перераспределением веществ по различным фазам, поэтому все методы, пригодные для разделения, используют и для концентрирования. Они, как правило, сочетаются с физико химическими или физическими методами анализа, но в неко торых случаях определение заканчивают гравиметрическими или титриметрическими методами. При выборе метода концентрирования руководствуются: природой объекта и его химическим составом, последующим методом анализа, продолжительностью проведения всех опе раций, обеспеченностью необходимым оборудованием и т. п. Различают групповое и индивидуальное концентрирование: v При групповом концентрировании за одну операцию выделяют совместно несколько микрокомпонентов; v При индивидуальном — из образца выделяют один микрокомпонент за одну операцию или за несколько последова тельных операции. Концентрирование осуществляют либо удалением основы, либо выделением микрокомпонентов.
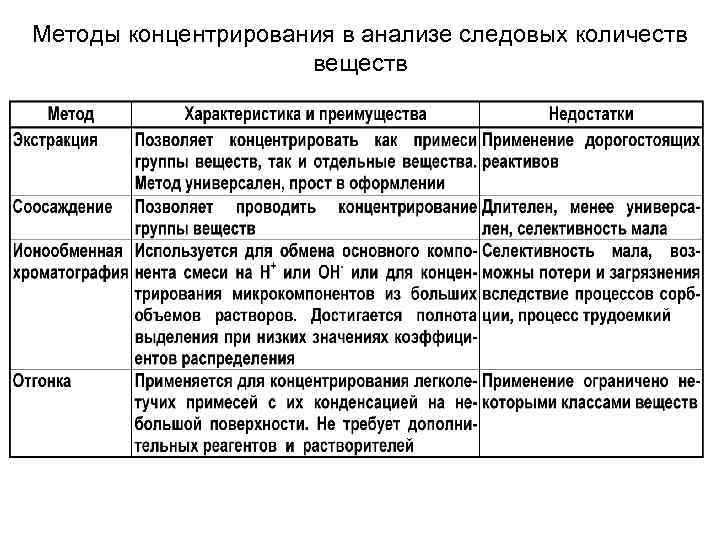 Методы концентрирования в анализе следовых количеств веществ
Методы концентрирования в анализе следовых количеств веществ
 Методы концентрирования характеризуются степенью извлечения R (%) и коэффициентом концентрирования К: где gмикр и g'микр — количество микрокомпонента до и после разделения; gосн и g'осн — количества основного компонента до и после разделения. Метод концентрирования считают удовлетворительным, если R≈100%, а К составляет 10 n. Коэффициент концентрирования K, показывающий, во сколько раз изменилось отношение абсолютных количеств или концентраций микроэлемента и основы в концентрате по сравнению с теми же параметрами в исходной пробе, может служить дополнительным критерием при выборе метода концентрирования. Так, экстракция, как правило, дает меньшие значения К (до 50) по сравнению с ионным обменом и соосаждением с коллектором, где К может достигать 103.
Методы концентрирования характеризуются степенью извлечения R (%) и коэффициентом концентрирования К: где gмикр и g'микр — количество микрокомпонента до и после разделения; gосн и g'осн — количества основного компонента до и после разделения. Метод концентрирования считают удовлетворительным, если R≈100%, а К составляет 10 n. Коэффициент концентрирования K, показывающий, во сколько раз изменилось отношение абсолютных количеств или концентраций микроэлемента и основы в концентрате по сравнению с теми же параметрами в исходной пробе, может служить дополнительным критерием при выборе метода концентрирования. Так, экстракция, как правило, дает меньшие значения К (до 50) по сравнению с ионным обменом и соосаждением с коллектором, где К может достигать 103.
 СООСАЖДЕНИЕ КАК МЕТОД КОНЦЕНТРИРОВАНИЯ Соосаждением называют захват осадком (коллектором) посторонних ионов, которые сами по себе в данных условиях осадков не образуют. Соосаждение — это распределение микрокомпонентов, вызванное выделением коллектора в твердую фазу; оно представляет собой одновременный переход микро и макрокомпонентов в формирующуюся твердую фазу осадка. Известны следующие механизмы включения микрокомпонента в твердую фазу: v адсорбция, v образование смешанных химических соединений или изоморфных смешанных кристаллов, v окклюзия. При соосаждении может преобладать какой либо один из указанных процессов, но чаще всего наблюдается сочетание различных механизмов соосаждения.
СООСАЖДЕНИЕ КАК МЕТОД КОНЦЕНТРИРОВАНИЯ Соосаждением называют захват осадком (коллектором) посторонних ионов, которые сами по себе в данных условиях осадков не образуют. Соосаждение — это распределение микрокомпонентов, вызванное выделением коллектора в твердую фазу; оно представляет собой одновременный переход микро и макрокомпонентов в формирующуюся твердую фазу осадка. Известны следующие механизмы включения микрокомпонента в твердую фазу: v адсорбция, v образование смешанных химических соединений или изоморфных смешанных кристаллов, v окклюзия. При соосаждении может преобладать какой либо один из указанных процессов, но чаще всего наблюдается сочетание различных механизмов соосаждения.
 Разделять фазы можно следующими способами: v флотацией, v седиментацией, v центрифугированием, v магнитной сепарацией, v селективным растворением, v испарением и т. д. СОРБЦИЯ Адсорбция — это захват ионов, полярных молекул и других примесей поверхностью осадка. Этот процесс объясняется наличи ем на поверхности твердой фазы свободного силового поля, созда ваемого электростатически неуравновешенными периферийными частицами. Химическое соосаждение связано с образованием химических соединений между примесями в растворе и веществом твердой фазы или адсорбированными на ней примесями. Изоморфное соосаждение (сокристаллизация) — это явление образования общей кристаллической решетки смешанных кристаллов двумя или более различными по составу веществами. Окклюзия — это захват примесей раствора внутрь образующегося осадка, а не только его поверхностью. На практике различные виды соосаждения могут сочетаться, протекать последовательно, осложняться вторичными процессами.
Разделять фазы можно следующими способами: v флотацией, v седиментацией, v центрифугированием, v магнитной сепарацией, v селективным растворением, v испарением и т. д. СОРБЦИЯ Адсорбция — это захват ионов, полярных молекул и других примесей поверхностью осадка. Этот процесс объясняется наличи ем на поверхности твердой фазы свободного силового поля, созда ваемого электростатически неуравновешенными периферийными частицами. Химическое соосаждение связано с образованием химических соединений между примесями в растворе и веществом твердой фазы или адсорбированными на ней примесями. Изоморфное соосаждение (сокристаллизация) — это явление образования общей кристаллической решетки смешанных кристаллов двумя или более различными по составу веществами. Окклюзия — это захват примесей раствора внутрь образующегося осадка, а не только его поверхностью. На практике различные виды соосаждения могут сочетаться, протекать последовательно, осложняться вторичными процессами.
 ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ Разделение и анализ веществ хроматографическими методами основаны на распределении веществ между двумя фазами, из которых одна неподвижная (стационарная), а другая — подвижная, продвигающаяся вдоль первой. Обычно неподвижная фаза—это сорбент с развитой поверхностью, а подвижная фаза — поток жидкости или газа. Хроматографические методы классифицируют по нескольким параметрам: v по механизму разделения компонентов анализируемой смеси (адсорбционная, распределительная, ионообменная, осадочная и др. ); v по агрегатному состоянию подвижной фазы (газовая, жидкостная); v по типу стационарной фазы и ее геометрическому располо жению (колоночная, тонкослойная, хроматография на бумаге); v по способу перемещения разделяемой смеси в колонке (элюентная, фронтальная, вытеснительная).
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ Разделение и анализ веществ хроматографическими методами основаны на распределении веществ между двумя фазами, из которых одна неподвижная (стационарная), а другая — подвижная, продвигающаяся вдоль первой. Обычно неподвижная фаза—это сорбент с развитой поверхностью, а подвижная фаза — поток жидкости или газа. Хроматографические методы классифицируют по нескольким параметрам: v по механизму разделения компонентов анализируемой смеси (адсорбционная, распределительная, ионообменная, осадочная и др. ); v по агрегатному состоянию подвижной фазы (газовая, жидкостная); v по типу стационарной фазы и ее геометрическому располо жению (колоночная, тонкослойная, хроматография на бумаге); v по способу перемещения разделяемой смеси в колонке (элюентная, фронтальная, вытеснительная).
 Основные параметры в хроматографических методах: характеристики удерживания, эффективность и степень разделения. Удерживаемый объем и время удерживания — это объем элюента, и время, требующиеся для удаления из колонки данного вещества. Эти величины зависят от свойств сорбента, скорости передвижения подвижной фазы, ее объема, от коэффициента распределения Кр: Кр = cтв/сж, где Ств — общая концентрация растворенного вещества в стационарной фазе; Сж — концентрация вещества в подвижной фазе. Для оценки эффективности разделения на колонке введено понятие теоретических тарелок. H = L/N, где L - длина колонки; N - число теоретических тарелок. Степень разделения двух компонентов 1 и 2 определяется критерием разделения R, зависящим от времени удерживания ( ti ) и ширины зон, занимаемых компонентами на сорбенте ( ti ):
Основные параметры в хроматографических методах: характеристики удерживания, эффективность и степень разделения. Удерживаемый объем и время удерживания — это объем элюента, и время, требующиеся для удаления из колонки данного вещества. Эти величины зависят от свойств сорбента, скорости передвижения подвижной фазы, ее объема, от коэффициента распределения Кр: Кр = cтв/сж, где Ств — общая концентрация растворенного вещества в стационарной фазе; Сж — концентрация вещества в подвижной фазе. Для оценки эффективности разделения на колонке введено понятие теоретических тарелок. H = L/N, где L - длина колонки; N - число теоретических тарелок. Степень разделения двух компонентов 1 и 2 определяется критерием разделения R, зависящим от времени удерживания ( ti ) и ширины зон, занимаемых компонентами на сорбенте ( ti ):
 ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ В основе ионообменной хроматографии лежит обратимый стехио метрический обмен ионов анализируемого раствора на подвижные ионы — противоионы сорбентов, называемые ионообменниками (или ионитами). В качестве ионитов используют природные или синтетические смолы — твердые, нерастворимые в воде высоко молекулярные кислоты и их соли, содержащие в своем составе активные группы. Ионообменники подразделяются на катиониты RSO 3 H+ (где R — сложный органический радикал), способные к обмену иона водорода на катионы, и аниониты RNH 3+OH , способные к обмену группы ОН на анионы. Схема катионного обмена: RSO 3 H+ + M+ ⇄ RSO 3 M+ + H+ Схема анионного обмена: RNH 3+OH + A ⇄ RNH 3+A + OH Техника выполнения ионного обмена чаще всего колоночная. Колонку заполняют ионообменником и пропускают через нее с определенной скоростью анализируемый раствор.
ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ В основе ионообменной хроматографии лежит обратимый стехио метрический обмен ионов анализируемого раствора на подвижные ионы — противоионы сорбентов, называемые ионообменниками (или ионитами). В качестве ионитов используют природные или синтетические смолы — твердые, нерастворимые в воде высоко молекулярные кислоты и их соли, содержащие в своем составе активные группы. Ионообменники подразделяются на катиониты RSO 3 H+ (где R — сложный органический радикал), способные к обмену иона водорода на катионы, и аниониты RNH 3+OH , способные к обмену группы ОН на анионы. Схема катионного обмена: RSO 3 H+ + M+ ⇄ RSO 3 M+ + H+ Схема анионного обмена: RNH 3+OH + A ⇄ RNH 3+A + OH Техника выполнения ионного обмена чаще всего колоночная. Колонку заполняют ионообменником и пропускают через нее с определенной скоростью анализируемый раствор.
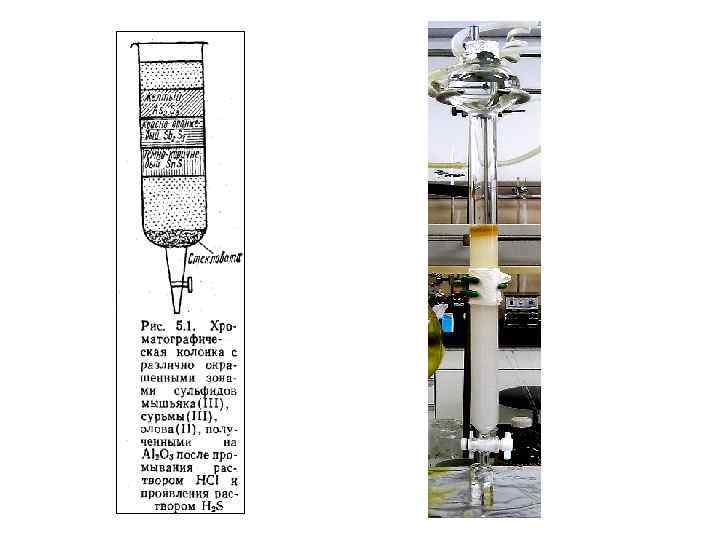
 Сорбция ионов зависит от природы и структуры ионита, природы анализируемых веществ, условий проведения эксперимента (температуры, р. Н среды и др. ). Для большинства практических расчетов можно принять, что равновесие между ионитом и раствором подчиняется закону действующих масс. Например, для реакции обмена ионов А и В р. Атв + g. Вж ⇄ р. Аж + q. Bтв (индексы «тв» и «ж» соответствуют ионам, поглощенным сорбентом, и ионам в растворе) где Кc — кажущаяся константа равновесия. Каждый ионит способен поглощать определенное количество ионов, т. е. обладает определенной емкостью.
Сорбция ионов зависит от природы и структуры ионита, природы анализируемых веществ, условий проведения эксперимента (температуры, р. Н среды и др. ). Для большинства практических расчетов можно принять, что равновесие между ионитом и раствором подчиняется закону действующих масс. Например, для реакции обмена ионов А и В р. Атв + g. Вж ⇄ р. Аж + q. Bтв (индексы «тв» и «ж» соответствуют ионам, поглощенным сорбентом, и ионам в растворе) где Кc — кажущаяся константа равновесия. Каждый ионит способен поглощать определенное количество ионов, т. е. обладает определенной емкостью.
 Различают статическую обменную емкость (СОЕ) — количество миллиэквивалентов иона, поглощенное за определенное время 1 г сухого ионита, и динамическую обменную емкость (ДОЕ) — количество ионов, поглощен ных слоем ионита высотой 20 см и поперечным сечением 1 см 2 при скорости пропускания 0, 5 дм 3 ч. Эффект поглощения данного иона характеризуется коэффициентом распределения: D = Ствm/(Сж. V), где Ств и Сж — концентрации ионов в соответствующих фазах; m — масса ионита, г; V— объем подвижной фазы, см 3. На степень разделения влияют химические и физические факторы. К химическим факторам относятся: а) значение р. Н раствора; б) природа разделяемых ионов (их заряд, атомная масса, ионный радиус), в) склонность ионов к гидратации, г) природа ионита и др.
Различают статическую обменную емкость (СОЕ) — количество миллиэквивалентов иона, поглощенное за определенное время 1 г сухого ионита, и динамическую обменную емкость (ДОЕ) — количество ионов, поглощен ных слоем ионита высотой 20 см и поперечным сечением 1 см 2 при скорости пропускания 0, 5 дм 3 ч. Эффект поглощения данного иона характеризуется коэффициентом распределения: D = Ствm/(Сж. V), где Ств и Сж — концентрации ионов в соответствующих фазах; m — масса ионита, г; V— объем подвижной фазы, см 3. На степень разделения влияют химические и физические факторы. К химическим факторам относятся: а) значение р. Н раствора; б) природа разделяемых ионов (их заряд, атомная масса, ионный радиус), в) склонность ионов к гидратации, г) природа ионита и др.
 Физические факторы — это скорость протекания раствора через колонку, размер зерен ионита, высота колонки, температура раствора и др. Для достижения эффективного разделения важно выбрать оптимальную массу ионита. Если известен коэффициент распределения D и емкость данного ионита а, то можно подсчитать, какое численное значение отношения массы ионита в граммах к объему анализируемого раствора в см 3 (m/V) обеспечит уменьшение концентрации иона Мn+ в растворе от начального значения Со до требуемого значения Скон: где р и q—стехиометрические коэффициенты в уравнении ионного обмена.
Физические факторы — это скорость протекания раствора через колонку, размер зерен ионита, высота колонки, температура раствора и др. Для достижения эффективного разделения важно выбрать оптимальную массу ионита. Если известен коэффициент распределения D и емкость данного ионита а, то можно подсчитать, какое численное значение отношения массы ионита в граммах к объему анализируемого раствора в см 3 (m/V) обеспечит уменьшение концентрации иона Мn+ в растворе от начального значения Со до требуемого значения Скон: где р и q—стехиометрические коэффициенты в уравнении ионного обмена.
 СПАСИБО ЗА ВНИМАНИЕ !!!
СПАСИБО ЗА ВНИМАНИЕ !!!


