Молеклярный практикум(1).pptx
- Количество слайдов: 39
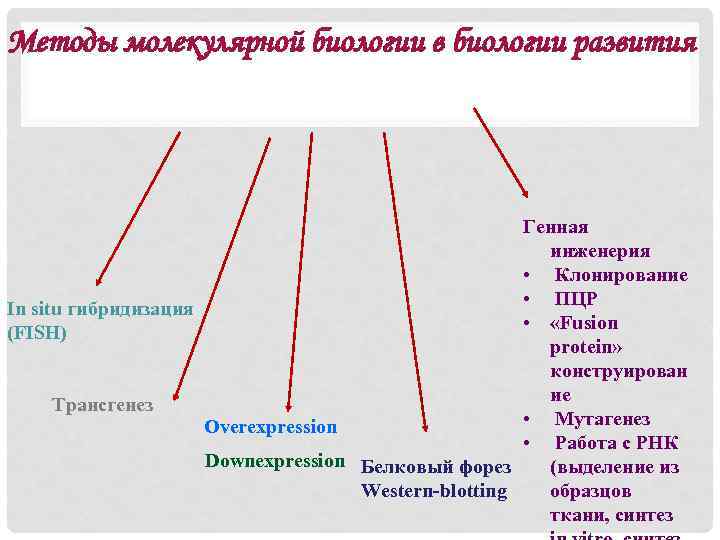
Методы молекулярной биологии в биологии развития Генная инженерия • Клонирование • ПЦР In situ гибридизация • «Fusion (FISH) protein» конструирован ие Трансгенез • Мутагенез Overexpression • Работа с РНК Downexpression Белковый форез (выделение из образцов Western-blotting ткани, синтез

Генная инженерия – это совокупность методов, приемов и технологий манипуляций с рекомбинантной ДНК, позволяющих получать нуклеотидные последовательности, гены и рекомбинантные белки с требуемыми свойствами для реализации научноисследовательских и практических задач. Способность быстро размножаться и наличие просто устроенного генотипа, который можно легко видоизменять, сделало Escherichia coli одним из модельных микроорганизмов, наиболее широко используемых в генной инженерии. Используемые штаммы: • • • наращивание клеточной биомассы для выделения плазмидной ДНК, клонирование, введение точечных мутаций (штаммы DH 5 a, XL 1 Blue, DH 10 b); экспрессия рекомбинантных белков (штаммы BL 21(DE 3), Rosetta, Origami) получение неметилированной ДНК при амплификации (JM 110) Основной принцип использования штаммов E. coli в генно-инженерных целях заключается в их трансформации, т. е. внедрении в клетку того или иного штамма кольцевой молекулы ДНК (плазмиды).
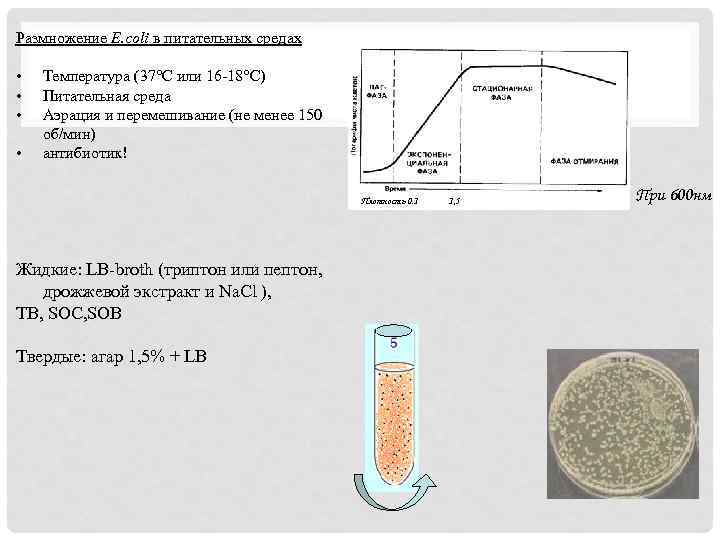
Размножение E. coli в питательных средах • • Температура (37°С или 16 -18°С) Питательная среда Аэрация и перемешивание (не менее 150 об/мин) антибиотик! Плотность 0. 1 Жидкие: LB-broth (триптон или пептон, дрожжевой экстракт и Na. Cl ), TB, SOC, SOB Твердые: агар 1, 5% + LB 1, 5 При 600 нм
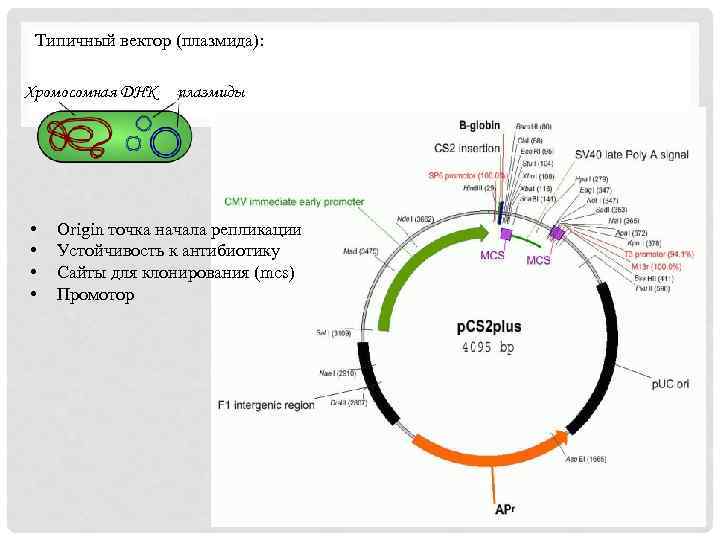
Типичный вектор (плазмида): Хромосомная ДНК • • плазмиды Origin точка начала репликации Устойчивость к антибиотику Сайты для клонирования (mcs) Промотор
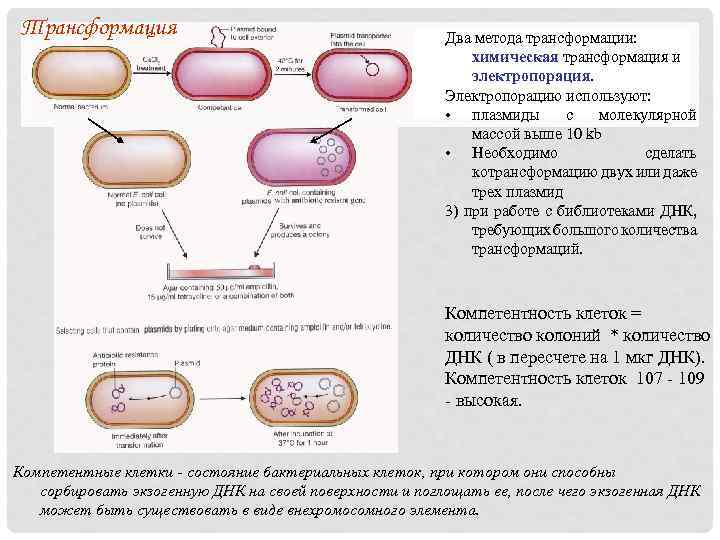
Трансформация Два метода трансформации: химическая трансформация и электропорация. Электропорацию используют: • плазмиды с молекулярной массой выше 10 kb • Необходимо сделать котрансформацию двух или даже трех плазмид 3) при работе с библиотеками ДНК, требующих большого количества трансформаций. Компетентность клеток = количество колоний * количество ДНК ( в пересчете на 1 мкг ДНК). Компетентность клеток 107 - 109 - высокая. Компетентные клетки - состояние бактериальных клеток, при котором они способны сорбировать экзогенную ДНК на своей поверхности и поглощать ее, после чего экзогенная ДНК может быть существовать в виде внехромосомного элемента.
ТРАНСФОРМАЦИЯ С ПОМОЩЬЮ НАНОФИБРИЛ МИНЕРАЛОВ • В 2001 г Yoshida N - трансформация с помощью минеральных нанофибрил (FEMS Microbiol lett) • В 2010 г Wilharm с соавторами усовершенствовал метод, использовали нанофибрилы сепоилита ( силикат магния )( J Microbiol Meth) • Есть также работы с использованием углеродных нанотрубочек CNTs( Rojas-Chapana et al, 2005 Lab Chip ) • Tan H 2010 J Int Mol Sci не нужны компетентные клетки и инкубации • Можно использовать для трансформации грамположительных бактерий и растений

Выделение плазмид Разработано несколько методов выделения Р. Они различаются по чистоте конечного продукта, скорости выделения. Большинство методов выделения плазмид основаны на том, что последние имеют ковалентно замкнутую кольцевую форму и гораздо меньшие размеры, чем бактериальная хромосома. Бактериальные клетки собирают центрифугированием и лизируют (часто ЭДТА и лизоцим) для разрушения клеточной стенки. Фрагменты клеток и бактериальной хромосомы после лизиса удаляют центрифугированием. В основе щелочного метода - в щелочных условиях (при р. Н ~ 12) происходит денатурация только линейных молекул ДНК, плазмидные же не денатурируют. При нейтрализации клеточного экстракта в присутствии солей высокой концентрации денатурированная хромосомная ДНК выпадает в осадок, поскольку реассоциация длинных линейных одноцепочечных молекул ДНК происходит в этих условиях одновременно во множестве участков с образованием нерастворимых комплексов. Клеточная РНК и белки тоже осаждаются.
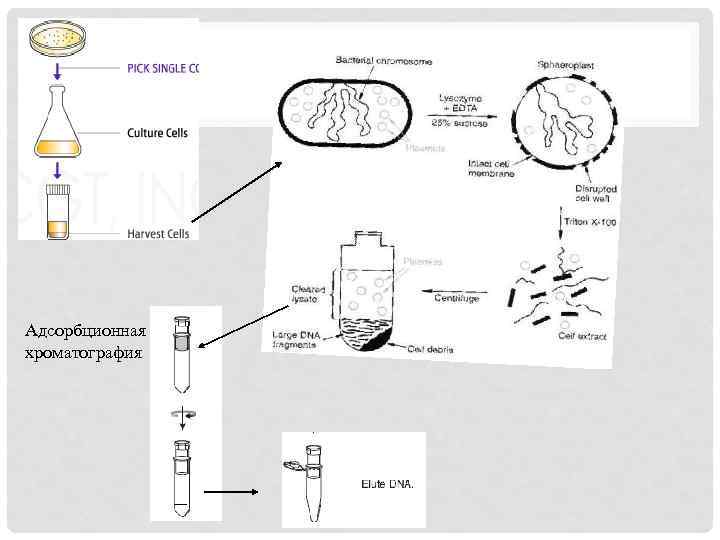
Адсорбционная хроматография
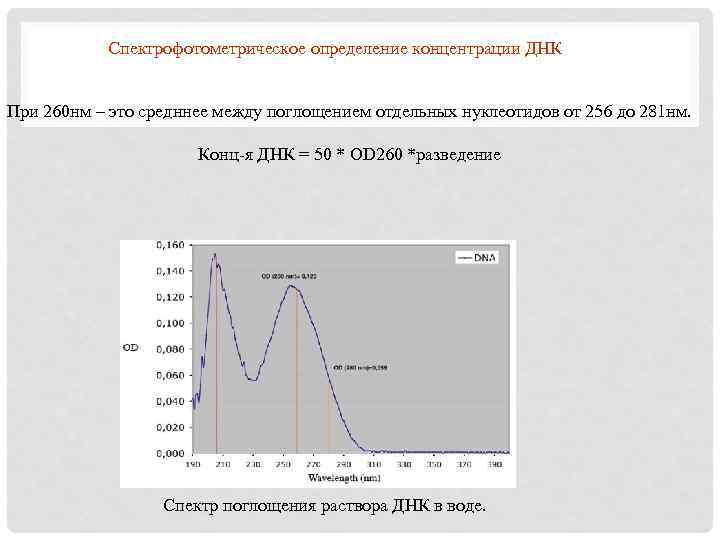
Спектрофотометрическое определение концентрации ДНК При 260 нм – это средннее между поглощением отдельных нуклеотидов от 256 до 281 нм. Конц-я ДНК = 50 * OD 260 *разведение Спектр поглощения раствора ДНК в воде.
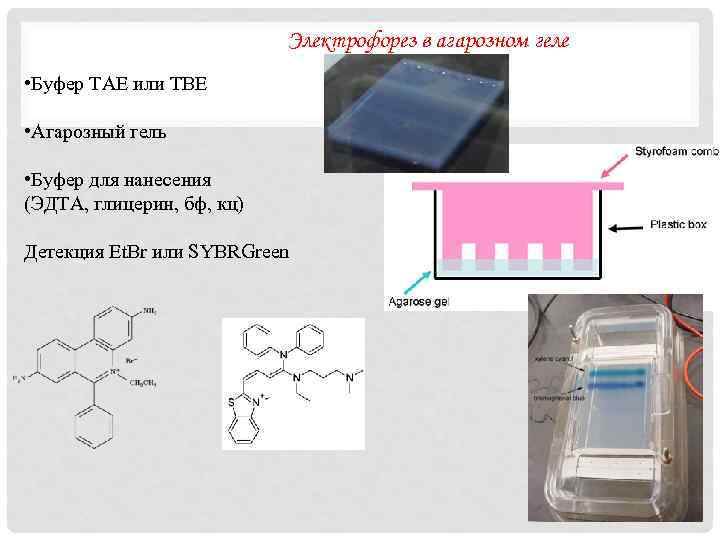
Электрофорез в агарозном геле • Буфер TAE или TBE • Агарозный гель • Буфер для нанесения (ЭДТА, глицерин, бф, кц) Детекция Et. Br или SYBRGreen
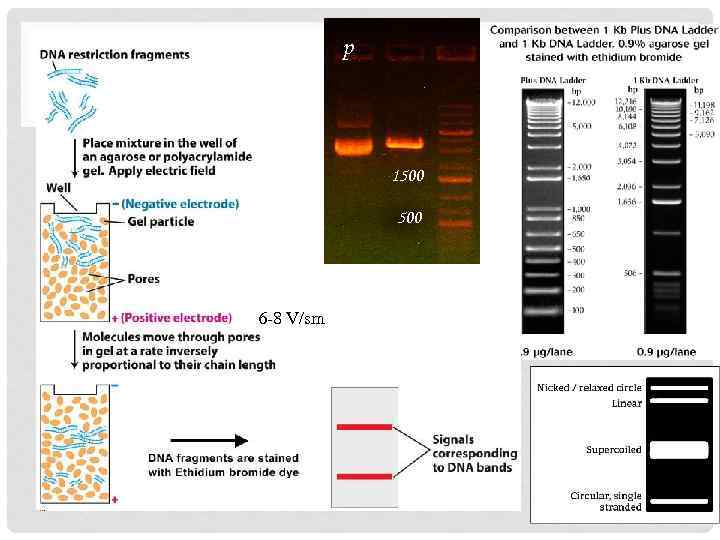
p 1500 6 -8 V/sm

Молекулярное клонирование определяют как способ создания рекомбинантных ДНК, основанный на встраивании кодирующих нуклеотидных последовательностей (генов, к. ДНК, регуляторных элементов) в самореплицирующиеся кольцевые молекулы ДНК (вектора) с использованием модифицирующих ферментов. Вектор - искусственно созданную кольцевую двуцепочечную молекулу ДНК, способную к репликации в бактериальной клетке и служащую для доставки того или иного гена в клетку. Основные инструменты генно-инженерных манипуляций - ДНКмодифицирующие ферменты. Наиболее часто используют рестриктазы (ферменты, специфически расщепляющие двуцепочечную ДНК), ДНК-лигазы (ферменты, «сшивающие» концы двуцепочечной ДНК) и ДНК-полимеразы (ферменты, синтезирующие и амплифицирующие ДНК).
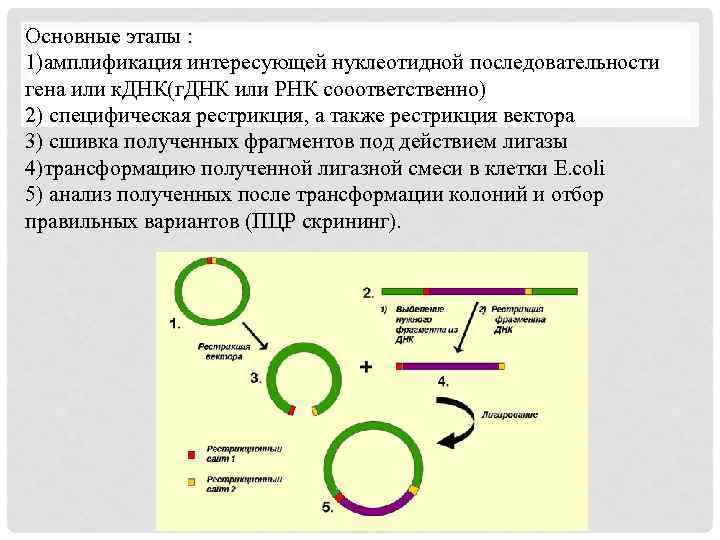
Основные этапы : 1)амплификация интересующей нуклеотидной последовательности гена или к. ДНК(г. ДНК или РНК сооответственно) 2) специфическая рестрикция, а также рестрикция вектора 3) сшивка полученных фрагментов под действием лигазы 4)трансформацию полученной лигазной смеси в клетки E. coli 5) анализ полученных после трансформации колоний и отбор правильных вариантов (ПЦР скрининг).
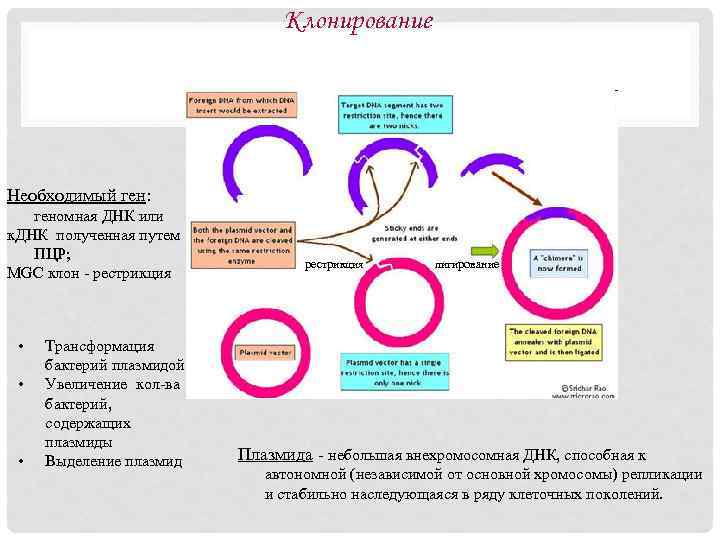
Клонирование Необходимый ген: геномная ДНК или к. ДНК полученная путем ПЦР; MGC клон - рестрикция • • • Трансформация бактерий плазмидой Увеличение кол-ва бактерий, содержащих плазмиды Выделение плазмид рестрикция лигирование Плазмида - небольшая внехромосомная ДНК, способная к автономной (независимой от основной хромосомы) репликации и стабильно наследующаяся в ряду клеточных поколений.

Лианеризация ДНК, рестриктазы Рестриктная реакция – это специфическое расщепление двуцепочечной ДНК в определенном участке под действием ферментов рестриктаз (рестрикционные эндонуклеазы). Рестриктазы (эндодезоксирибонуклеазы рестрикции) - ферменты класса гидролаз, катализирующие гидролиз фосфодиэфирных связей ДНК. Cайт узнавания таких рестриктаз (рестриктный сайт) представляет собой палиндромную (зеркально симметричную) последовательность длиной 6 – 12 пар оснований. Bam. HI TGTGCTCTATCAAATTTGGATCCTGCTG ACACGAGATAGTTTAAACCTAGGACGAC

По принятой номенклатуре рестриктазы обычно обозначают сокращенным названием их продуцента, в котором первая буква-начальная буква назв. рода, две следующие-начальные буквы назв. вида и последующие - обозначение штамма и номера выделенной из него рестриктазы, Hind. III—третья рестриктаза из Наеmоphilus influenzae. Рестриктазы подразделяют на 3 класса: 1 - принадлежат ферменты (Есо. К из Escherichia coli К 12), узнающие специфическую последовательность сайта, но разрывающие нить ДНК в произвольной точке. 2 - ферменты (Eco. RI), расщепляющие ДНК в строго определенной точке по отношению к сайту узнавания. Все Mg 2+ зависимые. 3 - ферменты промежуточного типа (Eco. PI), разрывающие нить ДНК в нескольких точках на разном удалении от сайта узнавания.
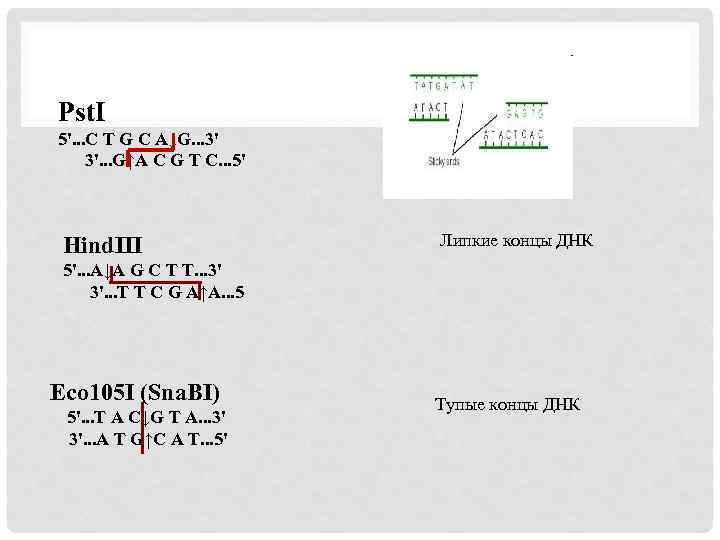
Pst. I 5'. . . C T G C A↓G. . . 3' 3'. . . G↑A C G T C. . . 5' Hind. III Липкие концы ДНК 5'. . . A↓A G C T T. . . 3' 3'. . . T T C G A↑A. . . 5 Eco 105 I (Sna. BI) 5'. . . T A C↓G T A. . . 3' 3'. . . A T G↑C A T. . . 5' Тупые концы ДНК

Рестриктазы с одинаковыми сайтами узнавания – изошизомеры, но это разные ферменты. Bcu. I (Spe. I) 5'. . . A↓C T A G T. . . 3' 3'. . . T G A T C↑A. . . 5' Гетерошизомер - фермент, узнающий такую же последовательность, но разрезающий её по-другому. Sma I GGG ↓ CCC Xma I G↓GGCCC ССС ↑ GGG C CCGG ↑G Буферные растворы для проведения рестриктной реакции созданы на основе трис-HCl p. H 7. 5 – 8. 5, в их состав также входят ионы магния и BSA для стабилизации структуры фермента. Разная температура реакции рестрикции 37 и 55. Для разрезания необходимо разное количество букв для «посадки» фермента ( от 2 до 7). Сайты узнавания рестриктаз могут быть 2, 6, 8, 12 буквенными Mbo. I ▼GATC Not. I GC▼GGCCGC CTAG▲ CGCCGG▲CG Хранение. Инактивация, время активности
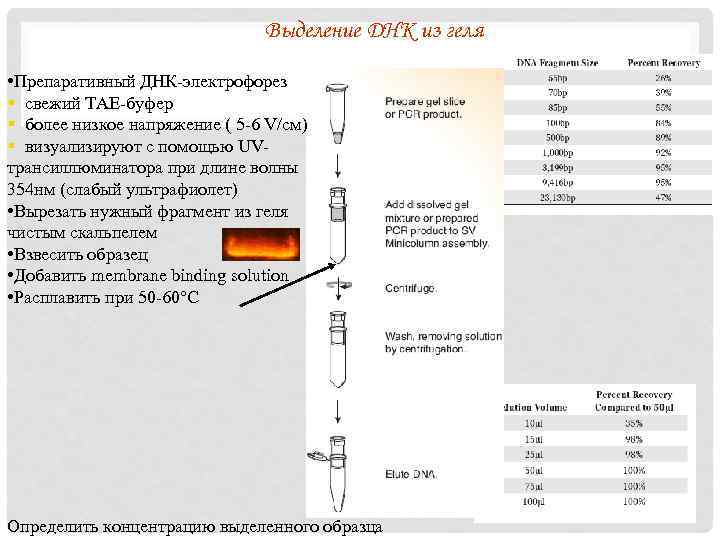
Выделение ДНК из геля • Препаративный ДНК-электрофорез § свежий TAE-буфер § более низкое напряжение ( 5 -6 V/см) § визуализируют с помощью UVтрансиллюминатора при длине волны 354 нм (слабый ультрафиолет) • Вырезать нужный фрагмент из геля чистым скальпелем • Взвесить образец • Добавить membrane binding solution • Расплавить при 50 -60°С Определить концентрацию выделенного образца
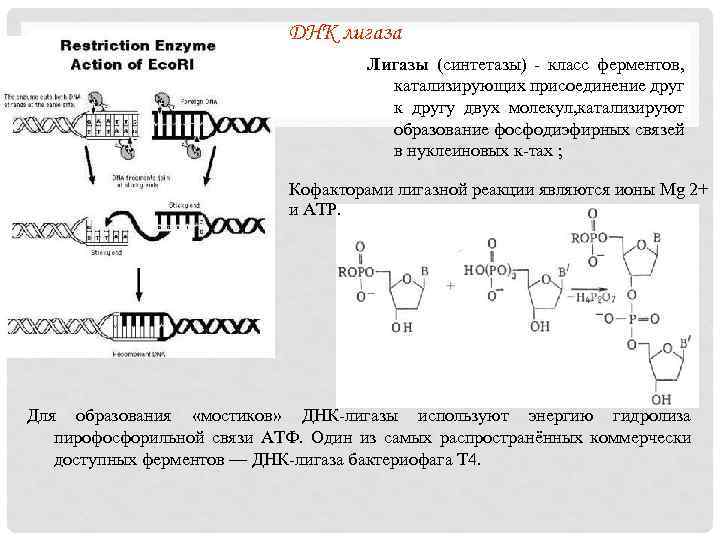
ДНК лигаза Лигазы (синтетазы) - класс ферментов, катализирующих присоединение друг к другу двух молекул, катализируют образование фосфодиэфирных связей в нуклеиновых к-тах ; Кофакторами лигазной реакции являются ионы Mg 2+ и ATP. Для образования «мостиков» ДНК-лигазы используют энергию гидролиза пирофосфорильной связи АТФ. Один из самых распространённых коммерчески доступных ферментов — ДНК-лигаза бактериофага Т 4.

Молярное соотношение встраиваемого фрагмента по отношению к вектору должно быть 3 -5 к 1 случае лигирования по «липким» концам, и 6 -10 к 1 в случае лигирования по «тупым» концам. Количество фермента, вносимого в реакцию, обычно составляет от 1 до 10 единиц. Реакцию проводят в течение 1 -2 часов при комнатной температуре ( в среднем 25°С) или 3 -5 часов при 14 -16°С либо при +4°С в течение ночи. Перед трансформацией лигазу обязательно инактивировать, мешает прохождению ДНК в бактерии. При проведении лигазной реакции необходимо поставить несколько контрольных проб на полноту прохождения предшествующей ей рестриктной реакции. Содержимое этих проб трансформируют вместе с содержимым опытной пробы, и по соотношению количества колоний, выросших на опытных и контрольных чашках, оценивают результат.
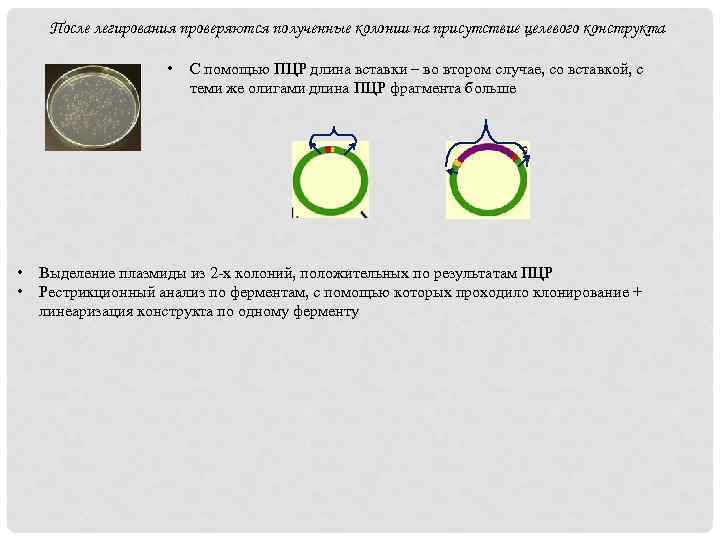
После легирования проверяются полученные колонии на присутствие целевого конструкта • • • С помощью ПЦР длина вставки – во втором случае, со вставкой, с теми же олигами длина ПЦР фрагмента больше Выделение плазмиды из 2 -х колоний, положительных по результатам ПЦР Рестрикционный анализ по ферментам, с помощью которых проходило клонирование + линеаризация конструкта по одному ферменту
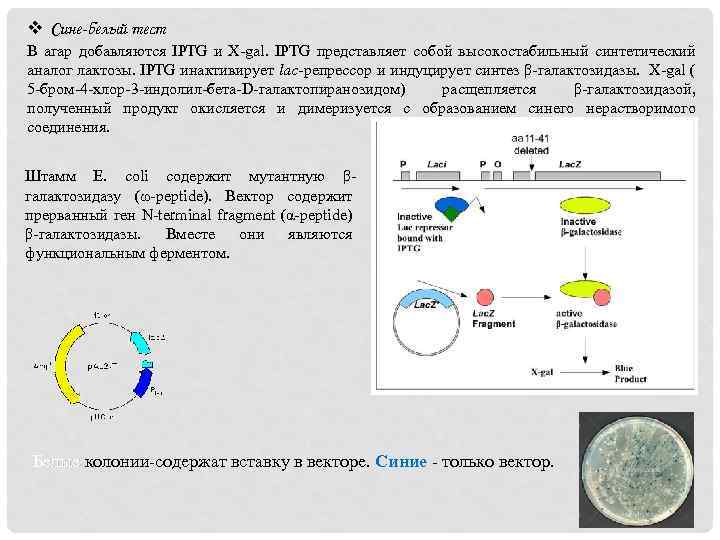
v Сине-белый тест В агар добавляются IPTG и X-gal. IPTG представляет собой высокостабильный синтетический аналог лактозы. IPTG инактивирует lac-репрессор и индуцирует синтез β-галактозидазы. X-gal ( 5 -бром-4 -хлор-3 -индолил-бета-D-галактопиранозидом) расщепляется β-галактозидазой, полученный продукт окисляется и димеризуется с образованием синего нерастворимого соединения. Штамм E. coli содержит мутантную βгалактозидазу (ω-peptide). Вектор содержит прерванный ген N-terminal fragment (α-peptide) β-галактозидазы. Вместе они являются функциональным ферментом. Белые колонии-содержат вставку в векторе. Синие - только вектор. Белые
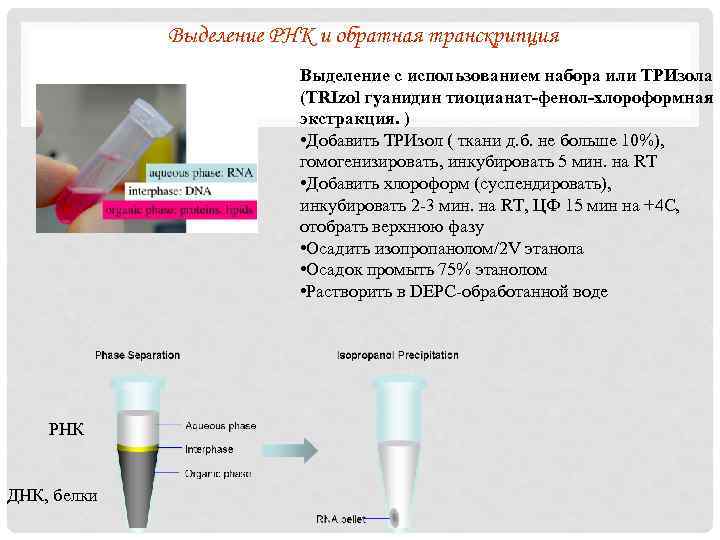
Выделение РНК и обратная транскрипция Выделение с использованием набора или ТРИзола (TRIzol гуанидин тиоцианат-фенол-хлороформная экстракция. ) • Добавить ТРИзол ( ткани д. б. не больше 10%), гомогенизировать, инкубировать 5 мин. на RT • Добавить хлороформ (суспендировать), инкубировать 2 -3 мин. на RT, ЦФ 15 мин на +4 С, отобрать верхнюю фазу • Осадить изопропанолом/2 V этанола • Осадок промыть 75% этанолом • Растворить в DEPC-обработанной воде РНК ДНК, белки
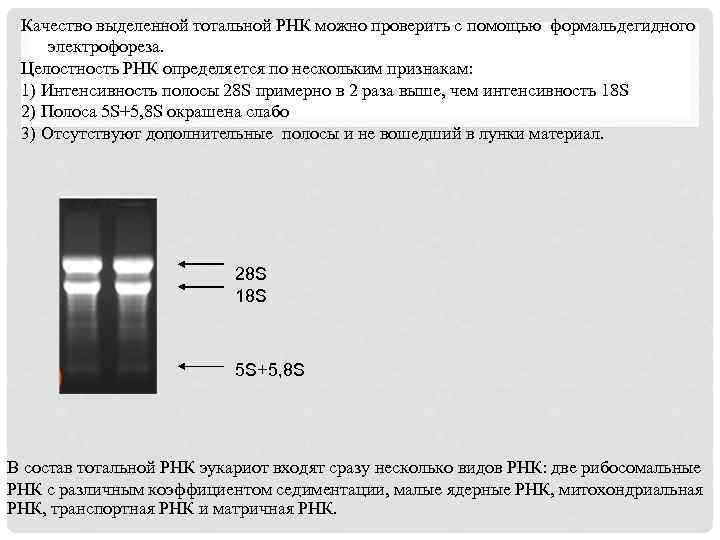
Качество выделенной тотальной РНК можно проверить с помощью формальдегидного электрофореза. Целостность РНК определяется по нескольким признакам: 1) Интенсивность полосы 28 S примерно в 2 раза выше, чем интенсивность 18 S 2) Полоса 5 S+5, 8 S окрашена слабо 3) Отсутствуют дополнительные полосы и не вошедший в лунки материал. 28 S 18 S 5 S+5, 8 S В состав тотальной РНК эукариот входят сразу несколько видов РНК: две рибосомальные РНК с различным коэффициентом седиментации, малые ядерные РНК, митохондриальная РНК, транспортная РНК и матричная РНК.
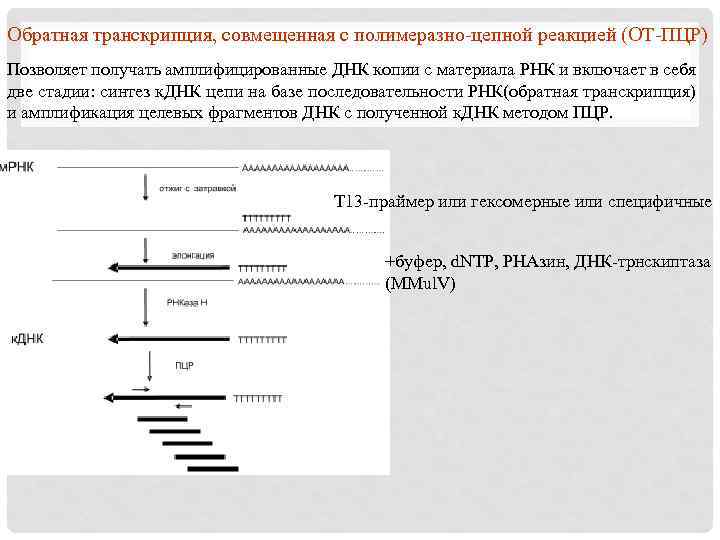
Обратная транскрипция, совмещенная с полимеразно-цепной реакцией (ОТ-ПЦР) Позволяет получать амплифицированные ДНК копии с материала РНК и включает в себя две стадии: синтез к. ДНК цепи на базе последовательности РНК(обратная транскрипция) и амплификация целевых фрагментов ДНК с полученной к. ДНК методом ПЦР. Т 13 -праймер или гексомерные или специфичные +буфер, d. NTP, РНАзин, ДНК-трнскиптаза (MMul. V)

ПЦР Метод позволяющий сделать множество копий нужного участка ДНК. Метод очень чувствительный. Применение: v Изучение экспрессии генов v Скрининг колоний v Синтез вставки гена с к. ДНК, геномной ДНК v Введение мутаций v Диагностика заболеваний (наследственных, инфекционых) Этапы: I. Общая Денатурация ДНК 1 -2 мин (разрушение водородных связей между нуклеотидами двуцепочечной матричной ДНК ) II. 1. Денатурация ДНК образца - 92 -95 С, время 15 -30 сек. Расплетение двойной спирали ДНК.

2. Отжиг - 49 -65°С, время 30 сек. Присоединение праймеров к ДНК (создавая «затравку» для синтеза нуклеотидной цепи под действием полимеразы). Праймеры (олигонуклеотиды) - короткие, химически синтезированные ДНК –молекулы (20 -30 пн), которые необходимы для начала работы ДНК -полимеразы. Во время отжига температура понижается и праймеры получают возможность комплементарно спариться с матрицей. Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер -матрица, при которой половина ДНК-матриц образует комплекс с праймером (50 -60 С). Упрощенная формула для подсчета Tm по его нуклеотидной последовательности Tm(плавление праймеров)=(G+C)*4 + (A+T)*2

3. Элонгация – синтез ограниченного фрагмента ДНК под действием ДНК-полимеразы. 72 С, время 30 сек-2 мин, зависит от длины амплифицируемого участка. Taq-полимераза скорость 1 kb за 1 минуту. PFU-полимераза 0, 5 kb за 1 минуту III. Общая элонгация - ДНК-полимераза достраивает концы у синтезированных молекул ДНК. 72°C в течение 5 -7 минут.
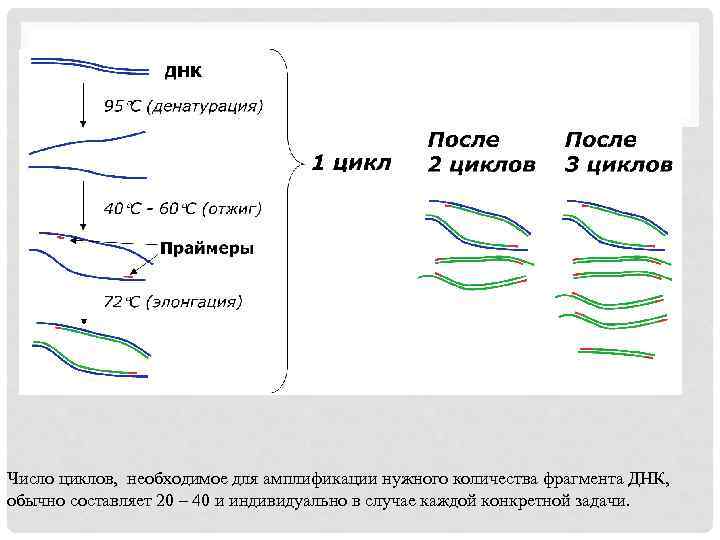
Число циклов, необходимое для амплификации нужного количества фрагмента ДНК, обычно составляет 20 – 40 и индивидуально в случае каждой конкретной задачи.

Компоненты реакции ПЦР: • буфер реакции (ионы магния Mg 2+) (50 м. М трис-HCl p. H 8. 6, 50 м. М KCl, 1% Tween – 20 или Тритон X-100). • матрица от 1 до 20 нг (в случае геномной ДНК млекопитающих от 0. 1 до 1 мкг). • «прямой» и «обратный» праймеры • смесь нуклеотидов d. NTP эквимолярная смесь четырех видов нуклеотидов • ДНК-полимераза. Taq -однf из самых «быстрых» ДНК-полимераз (синтезирует 40 -50 пар оснований в секунду). Негативные свойства: отсутствие 3’- 5’экзонуклеазной активности (proof-reading activity), неспособность осуществлять синтез фрагментов ДНК длиной более 4 kb (низкая процессивность), неспецифическое встраивание аденозина после окончания синтеза 3’ цепи. Pfu полимераза. Процессивность Pfu-полимеразы еще ниже, чем в случае Taqполимеразы, обладает 3’- 5’экзонуклеазной активностью.
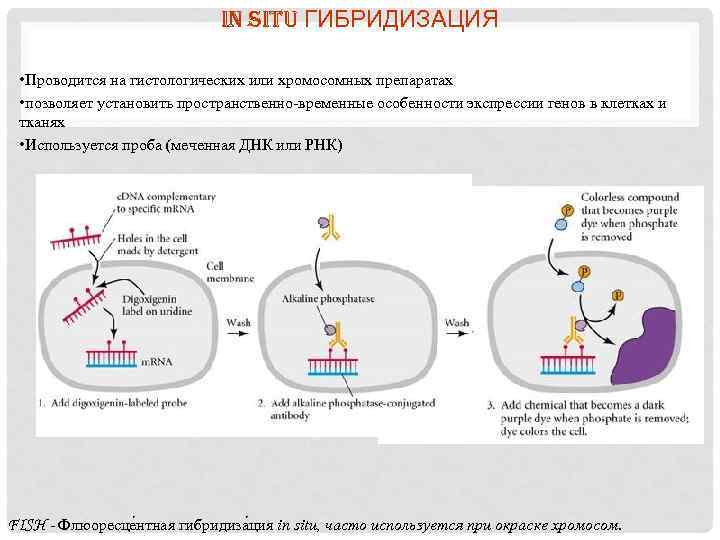
IN SITU ГИБРИДИЗАЦИЯ • Проводится на гистологических или хромосомных препаратах • позволяет установить пространственно-временные особенности экспрессии генов в клетках и тканях • Используется проба (меченная ДНК или РНК) FISH - Флюоресце нтная гибридиза ция in situ, часто используется при окраске хромосом.

Основные этапы: процедуру разработал на целых зародышах в 1991 г Harland Ø Подготовка матрицы: линеаризация плазмиды с целевым геном, очистка синтез antisense РНК зонда ( буфер, ДТТ, нуклеотиды(A, G, C, dig-U), ДНК матрица, ингибитор РНКаз, РНК-полимераза (T 7, sp 6))-37°C обработка зонда ДНКазой, переосаждение Ø Эмбрионы фиксируют в буфере MEMFA 1 h RT(0. 1 M MOPS p. H 7. 5 2 m. M EGTA 1 m. M Mg. SO 4 3. 7% Formaldehyde) переводят в 96% этанол(можно хранить при -20°С) Ø Регидротация и перевод в раствор PTw (PBS-Tween) Ø Обработки протеиназой К и уксусным ангидридом, повторная фиксация в параформальдегиде Ø Предгибридизация 60°С 4 -6 в гибридизационном буфере Ø Гибридизация с зондом ночь 60°С Ø Забивка в молоке 1 h инкубация в молоке с овечьей сывороткой 1 h в том же растворе связывание с антителами к дигоксигенину, конъюгированными щелочной фосфатазой ночь Ø Цветная реакция в буфере, содержащем хромогенные субстраты (в темноте) Ø Фиксация в MEMFA, обесцвечивание эмбрионов
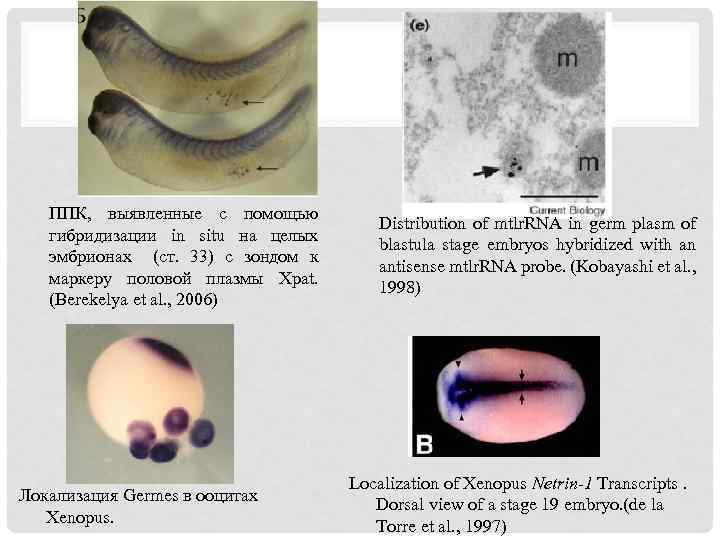
ППК, выявленные с помощью гибридизации in situ на целых эмбрионах (ст. 33) с зондом к маркеру половой плазмы Xpat. (Berekelya et al. , 2006) Локализация Germes в ооцитах Xenopus. Distribution of mtlr. RNA in germ plasm of blastula stage embryos hybridized with an antisense mtlr. RNA probe. (Kobayashi et al. , 1998) Localization of Xenopus Netrin-1 Transcripts. Dorsal view of a stage 19 embryo. (de la Torre et al. , 1997)
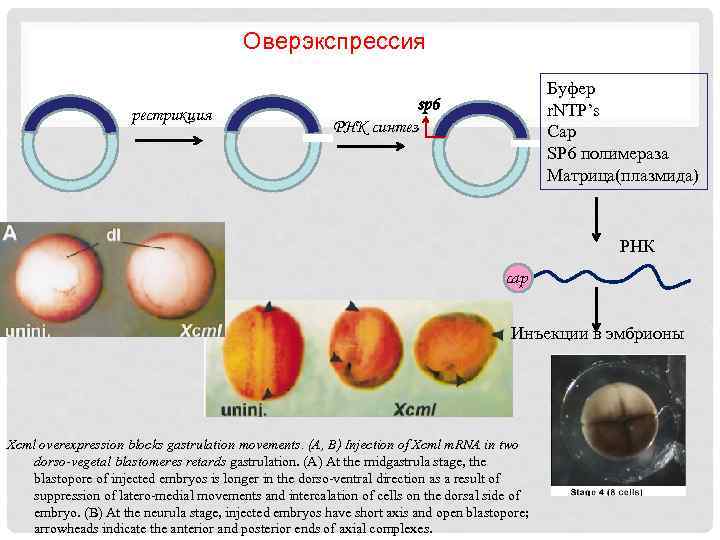
Оверэкспрессия рестрикция Буфер r. NTP’s Cap SP 6 полимераза Матрица(плазмида) sp 6 РНК синтез РНК cap Cap Инъекции в эмбрионы Xcml overexpression blocks gastrulation movements. (A, B) Injection of Xcml m. RNA in two dorso-vegetal blastomeres retards gastrulation. (A) At the midgastrula stage, the blastopore of injected embryos is longer in the dorso-ventral direction as a result of suppression of latero-medial movements and intercalation of cells on the dorsal side of embryo. (B) At the neurula stage, injected embryos have short axis and open blastopore; arrowheads indicate the anterior and posterior ends of axial complexes.
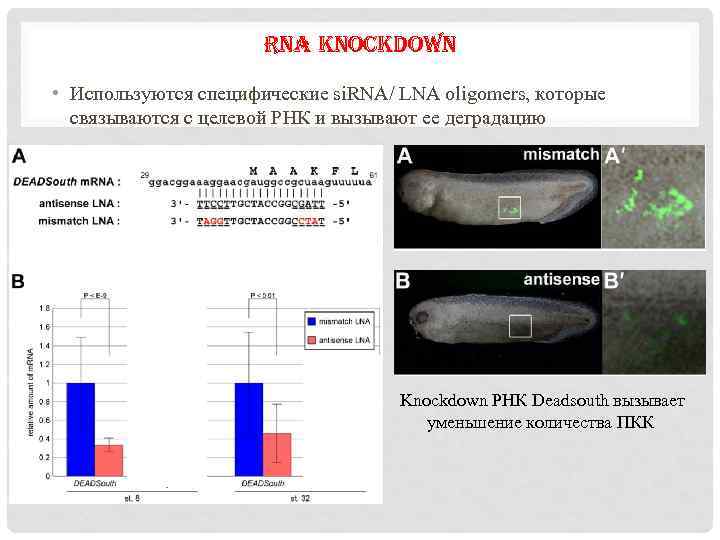
RNA KNOCKDOWN • Используются специфические si. RNA/ LNA oligomers, которые связываются с целевой РНК и вызывают ее деградацию Knockdown РНК Deadsouth вызывает уменьшение количества ПКК
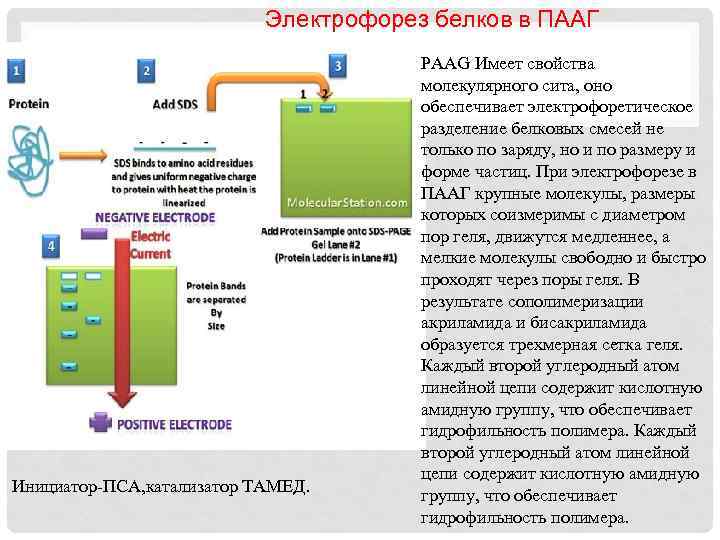
Электрофорез белков в ПААГ Инициатор-ПСА, катализатор ТАМЕД. PAAG Имеет свойства молекулярного сита, оно обеспечивает электрофоретическое разделение белковых смесей не только по заряду, но и по размеру и форме частиц. При электрофорезе в ПААГ крупные молекулы, размеры которых соизмеримы с диаметром пор геля, движутся медленнее, а мелкие молекулы свободно и быстро проходят через поры геля. В результате сополимеризации акриламида и бисакриламида образуется трехмерная сетка геля. Каждый второй углеродный атом линейной цепи содержит кислотную амидную группу, что обеспечивает гидрофильность полимера.
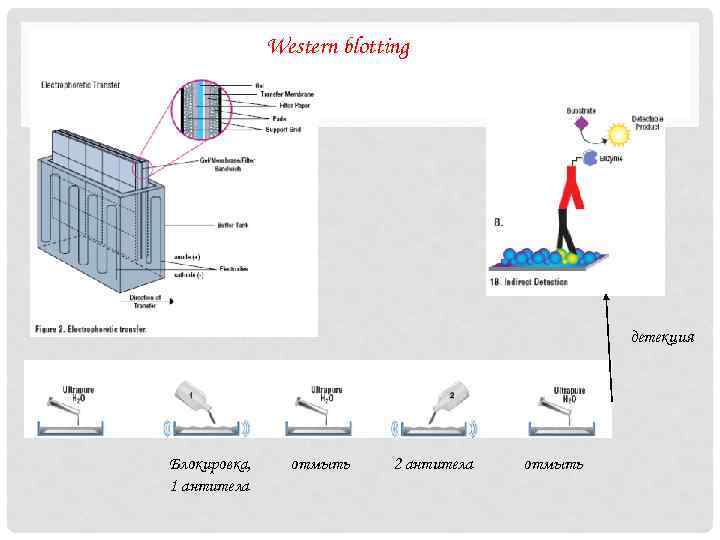
Western blotting детекция Блокировка, 1 антитела отмыть 2 антитела отмыть
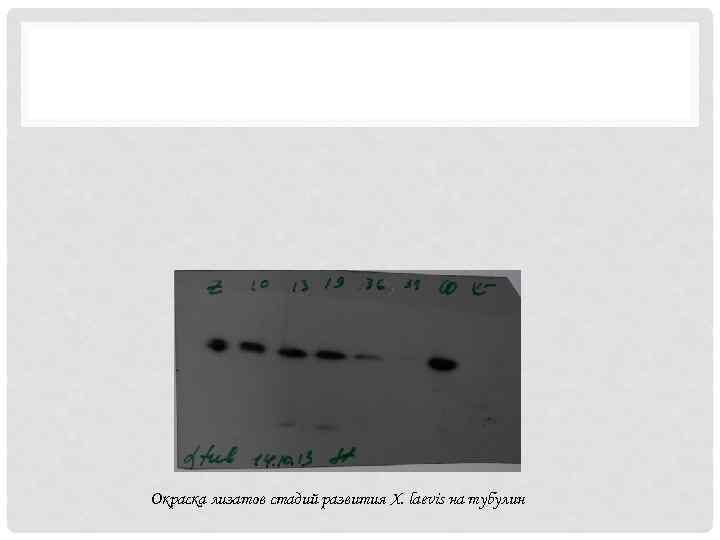
Окраска лизатов стадий развития X. laevis на тубулин
Молеклярный практикум(1).pptx