МЕТОДЫ КОНТРОЛЯ СТЕРИЛЬНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ.pptx
- Количество слайдов: 16
 МЕТОДЫ КОНТРОЛЯ СТЕРИЛЬНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
МЕТОДЫ КОНТРОЛЯ СТЕРИЛЬНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
 Стерильность – это отсутствие живых микроорганизмов. Для стерильных лекарственных форм наличие микроорганизмов, даже в малом количестве, может стать летальным, учитывая беспрепятственное попадание микроорганизмов в кровь или на слизистые оболочки организма, при условии ослабленного иммунитета человек. Цель испытания на стерильность – подтверждение полного отсутствия жизнеспособных бактерий и грибов в ЛС. Рекомендациями Международной Федерации фармацевтов и ГФ стерильными должны быть следующие лекарственные препараты: - ЛС для парентерального применения (инъекции, инфузии и т. д. ); - глазные ЛС (капли, мази, пленки и т. д. ); - ЛС для новорожденных; - ЛС для введения в полость тела, где в нормальном состоянии отсутствует микрофлора; - субстанции и вспомогательные вещества, используемые при получении стерильных ЛС, которые не подвергаются стерилизации в процессе производства.
Стерильность – это отсутствие живых микроорганизмов. Для стерильных лекарственных форм наличие микроорганизмов, даже в малом количестве, может стать летальным, учитывая беспрепятственное попадание микроорганизмов в кровь или на слизистые оболочки организма, при условии ослабленного иммунитета человек. Цель испытания на стерильность – подтверждение полного отсутствия жизнеспособных бактерий и грибов в ЛС. Рекомендациями Международной Федерации фармацевтов и ГФ стерильными должны быть следующие лекарственные препараты: - ЛС для парентерального применения (инъекции, инфузии и т. д. ); - глазные ЛС (капли, мази, пленки и т. д. ); - ЛС для новорожденных; - ЛС для введения в полость тела, где в нормальном состоянии отсутствует микрофлора; - субстанции и вспомогательные вещества, используемые при получении стерильных ЛС, которые не подвергаются стерилизации в процессе производства.
 Испытание на стерильность проводится в асептических условиях, в боксах
Испытание на стерильность проводится в асептических условиях, в боксах
 Стерильность готовых ЛС проверяется следующими микробиологическими методами: - метод прямого посева; - метод мембранной фильтрации. И в том, и в другом случае используют питательные среды: - жидкая тиогликолевая среда для выявления анаэробных и аэробных бактерий; - жидкая среда на основе гидролизата казеина и соевых бобов (среда Сабуро) для выявления грибов и аэробных бактерий. Питательные среды готовятся из отдельных ингредиентов в соответствии с ГФ, а также из коммерческой дегидратированной среды в соответствии с прилагаемыми инструкциями.
Стерильность готовых ЛС проверяется следующими микробиологическими методами: - метод прямого посева; - метод мембранной фильтрации. И в том, и в другом случае используют питательные среды: - жидкая тиогликолевая среда для выявления анаэробных и аэробных бактерий; - жидкая среда на основе гидролизата казеина и соевых бобов (среда Сабуро) для выявления грибов и аэробных бактерий. Питательные среды готовятся из отдельных ингредиентов в соответствии с ГФ, а также из коммерческой дегидратированной среды в соответствии с прилагаемыми инструкциями.
 Каждая партия приготовленных питательных сред (5% от количества в партии) подлежит проверке на пригодность, которая заключается в проверке на стерильность и проверке ростовых свойств. Проверка стерильности питательных сред После стерилизации питательных сред образец каждой партии термостатируют в течение 14 суток при температуре 30 -35° С для тиогликолевой среды и 20 -25 ° С для среды Сабуро. По истечение заданного срока в питательных средах должны отсутствовать визуально определяемые признаки роста микроорганизмов. Проверка ростовых свойств Для этого используются следующие микроорганизмы: тиогликолевая среда: Staphylococcus aureus, Pseudomonas aeruginosa, Clostridium sporogenes; среда Сабуро: Bacillus subtilis, Candida albicans, Aspergillus brasiliensis. Небольшое количество каждого из этих микроорганизмов (не более 100 КОЕ) вносят в питательную среду и инкубируют до 3 -х дней при 30 -35 °С ( для тиогликолевой среды) и до 5 -ти суток при 20 -25 ° С (для среды Сабуро). Среды являются пригодными при условии четкого, визуально наблюдаемого роста микроорганизмов.
Каждая партия приготовленных питательных сред (5% от количества в партии) подлежит проверке на пригодность, которая заключается в проверке на стерильность и проверке ростовых свойств. Проверка стерильности питательных сред После стерилизации питательных сред образец каждой партии термостатируют в течение 14 суток при температуре 30 -35° С для тиогликолевой среды и 20 -25 ° С для среды Сабуро. По истечение заданного срока в питательных средах должны отсутствовать визуально определяемые признаки роста микроорганизмов. Проверка ростовых свойств Для этого используются следующие микроорганизмы: тиогликолевая среда: Staphylococcus aureus, Pseudomonas aeruginosa, Clostridium sporogenes; среда Сабуро: Bacillus subtilis, Candida albicans, Aspergillus brasiliensis. Небольшое количество каждого из этих микроорганизмов (не более 100 КОЕ) вносят в питательную среду и инкубируют до 3 -х дней при 30 -35 °С ( для тиогликолевой среды) и до 5 -ти суток при 20 -25 ° С (для среды Сабуро). Среды являются пригодными при условии четкого, визуально наблюдаемого роста микроорганизмов.
 До проведения испытания на стерильность следует определить, обладает ли исследуемый образец антимикробным действием, которое может существенно повлиять на результаты испытания. Для этого, определенное количество исследуемого ЛС помещают в тиогликолевую среду и в среду Сабуро. Добавляют микробную взвесь и инкубируют: 1 -ю среду при 30 -35 °С – двое суток, 2 -ю среду при 20 -25 °С – трое суток. Параллельно проводят контроль: в питательные среды вместо данного ЛС вносят аналогичное количество дистиллированной воды или соответствующего растворителя. Затем сравнивают рост тест-микроорганизмов в контрольных и опытных посевах при визуальном просмотре. Если результаты одинаковые, ЛС не обладает антимикробным действием. А если неодинаковые, то есть, в контроле наблюдают рост тест-микроорганизма, а в опыте рост отсутствует, считают, что исследуемый образец обладает бактериостатическим или фунгистатическим действием. Если испытуемое ЛС обладает антимикробной активностью, испытание выполняют после нейтрализации подходящим нейтрализующим агентом, который не угнетает рост микроорганизмов (например, пара-аминобензойная кислота для сульфаниламидов, пенициллиназа для пенициллинов и цефалоспоринов и т. д. ), либо путем разведения в достаточном количестве питательной среды. Иногда эти способы комбинируют. Если все методы неэффективны, а ЛС растворимо, используют метод мембранной фильтрации.
До проведения испытания на стерильность следует определить, обладает ли исследуемый образец антимикробным действием, которое может существенно повлиять на результаты испытания. Для этого, определенное количество исследуемого ЛС помещают в тиогликолевую среду и в среду Сабуро. Добавляют микробную взвесь и инкубируют: 1 -ю среду при 30 -35 °С – двое суток, 2 -ю среду при 20 -25 °С – трое суток. Параллельно проводят контроль: в питательные среды вместо данного ЛС вносят аналогичное количество дистиллированной воды или соответствующего растворителя. Затем сравнивают рост тест-микроорганизмов в контрольных и опытных посевах при визуальном просмотре. Если результаты одинаковые, ЛС не обладает антимикробным действием. А если неодинаковые, то есть, в контроле наблюдают рост тест-микроорганизма, а в опыте рост отсутствует, считают, что исследуемый образец обладает бактериостатическим или фунгистатическим действием. Если испытуемое ЛС обладает антимикробной активностью, испытание выполняют после нейтрализации подходящим нейтрализующим агентом, который не угнетает рост микроорганизмов (например, пара-аминобензойная кислота для сульфаниламидов, пенициллиназа для пенициллинов и цефалоспоринов и т. д. ), либо путем разведения в достаточном количестве питательной среды. Иногда эти способы комбинируют. Если все методы неэффективны, а ЛС растворимо, используют метод мембранной фильтрации.
 Минимальное количество единиц продукции для испытания Количество единиц продукции в производственной серии Минимальное количество единиц продукции для каждой среды (если не обосновано или неразрешено использование других количеств) ЛС для парентерального применения - не более 100 контейнеров 10% или 4 контейнера, в зависимости от того, что больше - 100 -500 контейнеров 10 контейнеров - более 500 контейнеров 2% или 20 контейнеров, в зависимости от того, что меньше Офтальмологические и другие неинъекционные ЛС - не более 200 контейнеров 5% или 2 контейнера, в зависимости от того, что больше - более 200 контейнеров 10 контейнеров
Минимальное количество единиц продукции для испытания Количество единиц продукции в производственной серии Минимальное количество единиц продукции для каждой среды (если не обосновано или неразрешено использование других количеств) ЛС для парентерального применения - не более 100 контейнеров 10% или 4 контейнера, в зависимости от того, что больше - 100 -500 контейнеров 10 контейнеров - более 500 контейнеров 2% или 20 контейнеров, в зависимости от того, что меньше Офтальмологические и другие неинъекционные ЛС - не более 200 контейнеров 5% или 2 контейнера, в зависимости от того, что больше - более 200 контейнеров 10 контейнеров
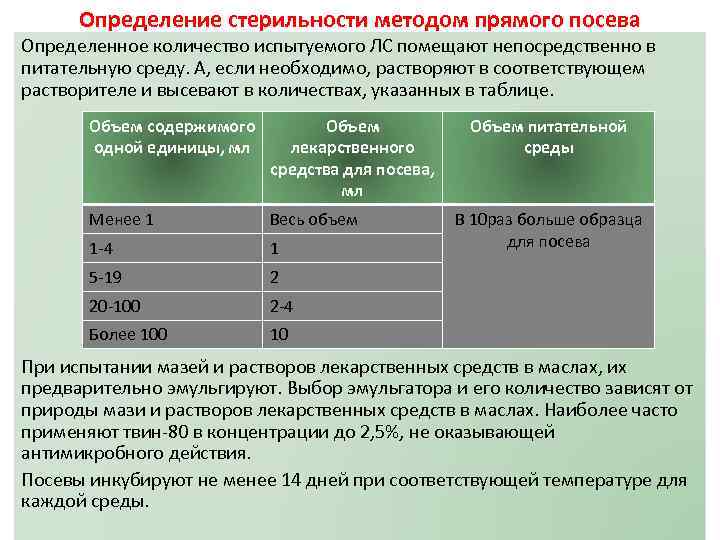 Определение стерильности методом прямого посева Определенное количество испытуемого ЛС помещают непосредственно в питательную среду. А, если необходимо, растворяют в соответствующем растворителе и высевают в количествах, указанных в таблице. Объем содержимого одной единицы, мл Объем лекарственного средства для посева, мл Менее 1 Весь объем 1 -4 1 5 -19 2 20 -100 2 -4 Более 100 Объем питательной среды 10 В 10 раз больше образца для посева При испытании мазей и растворов лекарственных средств в маслах, их предварительно эмульгируют. Выбор эмульгатора и его количество зависят от природы мази и растворов лекарственных средств в маслах. Наиболее часто применяют твин-80 в концентрации до 2, 5%, не оказывающей антимикробного действия. Посевы инкубируют не менее 14 дней при соответствующей температуре для каждой среды.
Определение стерильности методом прямого посева Определенное количество испытуемого ЛС помещают непосредственно в питательную среду. А, если необходимо, растворяют в соответствующем растворителе и высевают в количествах, указанных в таблице. Объем содержимого одной единицы, мл Объем лекарственного средства для посева, мл Менее 1 Весь объем 1 -4 1 5 -19 2 20 -100 2 -4 Более 100 Объем питательной среды 10 В 10 раз больше образца для посева При испытании мазей и растворов лекарственных средств в маслах, их предварительно эмульгируют. Выбор эмульгатора и его количество зависят от природы мази и растворов лекарственных средств в маслах. Наиболее часто применяют твин-80 в концентрации до 2, 5%, не оказывающей антимикробного действия. Посевы инкубируют не менее 14 дней при соответствующей температуре для каждой среды.
 Определение стерильности методом мембранной фильтрации При определении стерильности ЛС, обладающих выраженным антимикробным действием, и ЛС, разлитых в емкости более 100 мл, используют метод мембранной фильтрации. Кроме того, этот метод предпочтительнее использовать при испытании мазей и растворов в маслах. Испытание ЛС на стерильность проводят с использованием фильтрационной установки. Фильтровальную установку в собранном виде стерилизуют. Стерилизацию можно осуществлять различными способами (ионизирующее излучение, окись этилена и т. п. ). Суть метода: мембранный фильтр с соответствующими размерами пор устанавливают в фильтрационную систему и фильтруют пробу. При этом микроорганизмы, имеющиеся в исследуемой пробе осаждаются на поверхности мембранного фильтра. Ингибиторы роста могут быть устранены при помощи ополаскивания стерильной водой. Сразу же после этого мембранный фильтр помещают на питательную среду и инкубируют в течение 7 дней.
Определение стерильности методом мембранной фильтрации При определении стерильности ЛС, обладающих выраженным антимикробным действием, и ЛС, разлитых в емкости более 100 мл, используют метод мембранной фильтрации. Кроме того, этот метод предпочтительнее использовать при испытании мазей и растворов в маслах. Испытание ЛС на стерильность проводят с использованием фильтрационной установки. Фильтровальную установку в собранном виде стерилизуют. Стерилизацию можно осуществлять различными способами (ионизирующее излучение, окись этилена и т. п. ). Суть метода: мембранный фильтр с соответствующими размерами пор устанавливают в фильтрационную систему и фильтруют пробу. При этом микроорганизмы, имеющиеся в исследуемой пробе осаждаются на поверхности мембранного фильтра. Ингибиторы роста могут быть устранены при помощи ополаскивания стерильной водой. Сразу же после этого мембранный фильтр помещают на питательную среду и инкубируют в течение 7 дней.
 К мембранным фильтрам предъявляются следующие требования: - микроструктура мембраны и размеры пор (0, 45 -0, 65 мкм) должны максимально способствовать прорастанию удерживаемых на мембране микроорганизмов; - высокая пористость, позволяющая быстро фильтровать образцы, в том числе и вязкие; - материал мембраны не должен содержать токсичные для микроорганизмов вещества – применяют инертные материалы (эфир целлюлозы); - мембраны должны быть стерильно упакованы и готовы к немедленному использованию. Для удобства подсчета колоний фильтры изготавливают с нанесенной сеточкой. Мембранный фильтр с нанесенной сеточкой Микрофотография бактерий на мембранном фильтре
К мембранным фильтрам предъявляются следующие требования: - микроструктура мембраны и размеры пор (0, 45 -0, 65 мкм) должны максимально способствовать прорастанию удерживаемых на мембране микроорганизмов; - высокая пористость, позволяющая быстро фильтровать образцы, в том числе и вязкие; - материал мембраны не должен содержать токсичные для микроорганизмов вещества – применяют инертные материалы (эфир целлюлозы); - мембраны должны быть стерильно упакованы и готовы к немедленному использованию. Для удобства подсчета колоний фильтры изготавливают с нанесенной сеточкой. Мембранный фильтр с нанесенной сеточкой Микрофотография бактерий на мембранном фильтре
 Испытания проводятся с помощью фильтровальных установок открытого и закрытого типа с применением вакуумных насосов. Установка открытого типа состоит из гребенки, фильтродержателей с воронками, мембранных фильтров, вакуумного насоса, стеклянных колбприемников фильтрата. В установках открытого типа мембраны целиком переносят питательную среду или в асептических условиях делят ее на две равные части, каждую из которых помещают в тиогликолевую среду и среду Сабуро и инкубируют.
Испытания проводятся с помощью фильтровальных установок открытого и закрытого типа с применением вакуумных насосов. Установка открытого типа состоит из гребенки, фильтродержателей с воронками, мембранных фильтров, вакуумного насоса, стеклянных колбприемников фильтрата. В установках открытого типа мембраны целиком переносят питательную среду или в асептических условиях делят ее на две равные части, каждую из которых помещают в тиогликолевую среду и среду Сабуро и инкубируют.
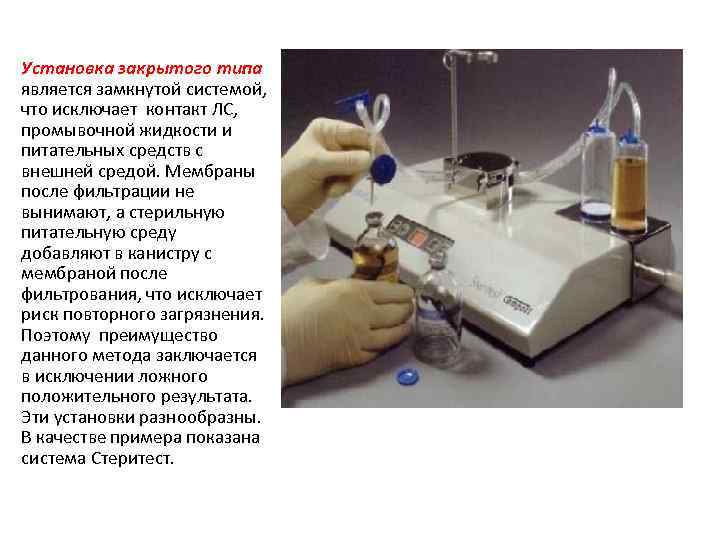 Установка закрытого типа является замкнутой системой, что исключает контакт ЛС, промывочной жидкости и питательных средств с внешней средой. Мембраны после фильтрации не вынимают, а стерильную питательную среду добавляют в канистру с мембраной после фильтрования, что исключает риск повторного загрязнения. Поэтому преимущество данного метода заключается в исключении ложного положительного результата. Эти установки разнообразны. В качестве примера показана система Стеритест.
Установка закрытого типа является замкнутой системой, что исключает контакт ЛС, промывочной жидкости и питательных средств с внешней средой. Мембраны после фильтрации не вынимают, а стерильную питательную среду добавляют в канистру с мембраной после фильтрования, что исключает риск повторного загрязнения. Поэтому преимущество данного метода заключается в исключении ложного положительного результата. Эти установки разнообразны. В качестве примера показана система Стеритест.
 Сравнительная характеристика методов определения стерильности ЛС Прямой посев Преимущества: - простой, экономичный и быстрый метод; - возможность проверки на стерильность нефильтруемых образцов. Недостатки: - низкая чувствительность из-за ограниченного объема образца; - проблема с антимикробным действием. Мембранная фильтрация Преимущества: - дает возможность исследовать большие объемы ЛС; - более чувствителен благодаря концентрированию или удержания на мембране даже единичных клеток (1 КОЕ на образец); - высокая надежность выявления нестерильности антимикробных препаратов из-за отсутствия разбавления, что имеет место при устранении антимикробного действия; - позволяет сократить время инкубации посевов (экономия рабочего времени); - экономия питательных сред; - устраняет антимикробные действия препарата, которые при прямом посеве могут исказить результаты определения; - количественное определение микроорганизмов. Недостатки: - закупоривание мембраны и невозможность исследования нефильтруемых образцов.
Сравнительная характеристика методов определения стерильности ЛС Прямой посев Преимущества: - простой, экономичный и быстрый метод; - возможность проверки на стерильность нефильтруемых образцов. Недостатки: - низкая чувствительность из-за ограниченного объема образца; - проблема с антимикробным действием. Мембранная фильтрация Преимущества: - дает возможность исследовать большие объемы ЛС; - более чувствителен благодаря концентрированию или удержания на мембране даже единичных клеток (1 КОЕ на образец); - высокая надежность выявления нестерильности антимикробных препаратов из-за отсутствия разбавления, что имеет место при устранении антимикробного действия; - позволяет сократить время инкубации посевов (экономия рабочего времени); - экономия питательных сред; - устраняет антимикробные действия препарата, которые при прямом посеве могут исказить результаты определения; - количественное определение микроорганизмов. Недостатки: - закупоривание мембраны и невозможность исследования нефильтруемых образцов.
 Интерпретация результатов на стерильность Посевы просматривают в рассеянном свете ежедневно и по окончании периода инкубации. Наличие роста микроорганизмов в питательных средах оценивают визуально по появлению мутности, пленки, осадка и других макроскопических изменений. Выявленный рост микроорганизмов необходимо подтвердить микроскопированием мазков, окрашенных по Граму. Испытуемый препарат считают удовлетворяющим требованиям испытания на стерильность при отсутствии роста микроорганизмов. При обнаружении роста хотя бы в одной пробирке (колбе, флаконе) его подтверждают микроскопированием и повторяют испытание на таком же количестве образцов, как и в первый раз. При отсутствии роста микроорганизмов при повторном посеве испытуемый препарат считают удовлетворяющим требованию испытания на стерильность. В случае роста микроорганизмов при повторном посеве, морфологически сходных с микроорганизмами, выявленными в первичном посеве, испытуемый препарат считают нестерильным. Если при повторном посеве наблюдается рост микроорганизмов, отличающихся по морфологии от первоначально выделенных, испытание повторяют в третий раз на удвоенном количестве образцов. При отсутствии роста микроорганизмов после инкубации посевов в третьем испытании испытуемый препарат считают удовлетворяющим требованиям на стерильность. При наличии роста хотя бы в одной пробирке испытуемый препарат считают нестерильным.
Интерпретация результатов на стерильность Посевы просматривают в рассеянном свете ежедневно и по окончании периода инкубации. Наличие роста микроорганизмов в питательных средах оценивают визуально по появлению мутности, пленки, осадка и других макроскопических изменений. Выявленный рост микроорганизмов необходимо подтвердить микроскопированием мазков, окрашенных по Граму. Испытуемый препарат считают удовлетворяющим требованиям испытания на стерильность при отсутствии роста микроорганизмов. При обнаружении роста хотя бы в одной пробирке (колбе, флаконе) его подтверждают микроскопированием и повторяют испытание на таком же количестве образцов, как и в первый раз. При отсутствии роста микроорганизмов при повторном посеве испытуемый препарат считают удовлетворяющим требованию испытания на стерильность. В случае роста микроорганизмов при повторном посеве, морфологически сходных с микроорганизмами, выявленными в первичном посеве, испытуемый препарат считают нестерильным. Если при повторном посеве наблюдается рост микроорганизмов, отличающихся по морфологии от первоначально выделенных, испытание повторяют в третий раз на удвоенном количестве образцов. При отсутствии роста микроорганизмов после инкубации посевов в третьем испытании испытуемый препарат считают удовлетворяющим требованиям на стерильность. При наличии роста хотя бы в одной пробирке испытуемый препарат считают нестерильным.
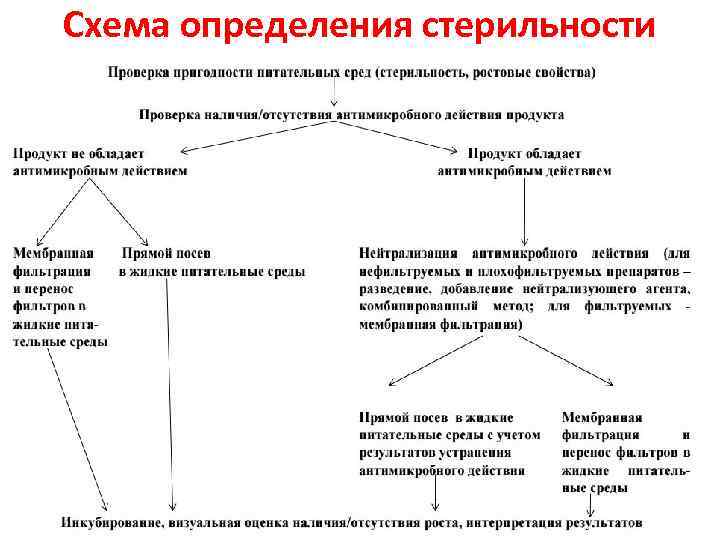 Схема определения стерильности
Схема определения стерильности
 Спасибо за внимание!
Спасибо за внимание!


