МЕТОДЫ ИЗУЧЕНИЯ МЕМБРАН КЛЕТОК


МЕТОДЫ ИЗУЧЕНИЯ МЕМБРАН КЛЕТОК Иванова Мария Б-402

ДЛЯ ИССЛЕДОВАНИЯ МОЛЕКУЛЯРНОГО СОСТАВА И СТРУКТУРЫ МЕМБРАН ИХ ВЫДЕЛЯЮТ ИЗ КЛЕТОК ПУТЕМ РАЗРУШЕНИЯ И ОТДЕЛЕНИЯ ЦЕНТРИФУГИРОВАНИЕМ. ДЛЯ БОЛЕЕ ПОЛНОГО РАЗДЕЛЕНИЯ ЦЕНТРИФУГИРОВАНИЕ ПРОВОДЯТ НЕСКОЛЬКО РАЗ.

КАК ИЗВЕСТНО, СВЕТОВОЙ МИКРОСКОП НЕ ПОЗВОЛЯЕТ РАССМОТРЕТЬ ДЕТАЛИ ОБЪЕКТА МЕНЬШЕ ПРИМЕРНО ПОЛОВИНЫ ДЛИНЫ ВОЛНЫ СВЕТА (ОКОЛО 200 НМ). В СВЕТОВОМ МИКРОСКОПЕ МОЖНО РАЗГЛЯДЕТЬ ОТДЕЛЬНЫЕ КЛЕТКИ, ОДНАКО ОН СОВЕРШЕННО НЕ ПРИГОДЕН ДЛЯ ИЗУЧЕНИЯ БИОЛОГИЧЕСКИХ МЕМБРАН, ТОЛЩИНА КОТОРЫХ В 20 РАЗ МЕНЬШЕ ПРЕДЕЛА РАЗРЕШЕНИЯ СВЕТОВОГО МИКРОСКОПА, ПОЭТОМУ ИСПОЛЬЗУЮТ МЕТОДЫ ЭЛЕКТРОННОЙ МИКРОСКОПИИ.

Электронная микроскопия позволила определить толщину клеточных мембран (примерно 6 -12 нм) Растровая электронная микроскопия –РЭМ. Она имеет большую глубину фокуса и сравнительно высокую разрешающую способность, что позволяет получить объемное (трехмерное) изображение клеток и топографию их поверхности. Благодаря РЭМ, впервые удалось увидеть клеточную поверхность и обнаружить, что она обладает определенным рельефом, образованным различного рода выростами – микроворсинками, складками, сферическими выбуханиями. Совокупность этих образований составляет топографию клеточной поверхности, являющейся индивидуальной и вместе с тем весьма изменчивой характеристикой клетки

ДАННЫЕ РЭМ ПОЗВОЛИЛИ УСТАНОВИТЬ, ЧТО ТОПОГРАФИЯ ПОВЕРХНОСТИ ПРЕТЕРПЕВАЕТ СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ ПРИ РАЗЛИЧНЫХ СОСТОЯНИЯХ КЛЕТКИ, НАПРИМЕР: ПРИ НАХОЖДЕНИИ ЕЁ В РАЗЛИЧНЫХ ФАЗАХ КЛЕТОЧНОГО ЦИКЛА ИЛИ ПРИ ТРАНСФОРМАЦИИ КЛЕТОК, ПРИ ВОЗДЕЙСТВИИ РАЗЛИЧНЫХ ХИМИЧЕСКИХ АГЕНТОВ

Некоторую информацию о расположении мембранных белков далиновый методыэлектронной микроскопии, ставшие теперь уже "классическими, - методы замораживания-скалывания. В этом случае препараты быстро замораживают, не подвергая их при этом каким-либо повреждающим воздействиям, как при получении тонких срезов. Наиболее характерные структуры, наблюдаемые при изучении мембран методом замораживания-скалывания, - это многочисленные внутримембранные частицы диаметром от 80 до 100 А, лежащие в плоскости мембранных сколов. Обычно они расположены хаотично, но иногда образуют группы. Многочисленные исследования показали, что эти частицы, возможно, являются мембранными белками. Любопытно, что при электронной микроскопии тонких срезов подобные структуры не обнаруживаются. Реплики, полученные от двух половинок расщепленной мембраны, не всегда бывают топологически комплементарными. Это означает, что некоторые частицы связаны только с одной из половин мембраны. Данные, полученные методом замораживания-скалывания, широко использовались Сингером и Николсоном при создании жидкостно-мозаичной модели мембран, поскольку они убедительно показывали, что глобулярные белки находятся не только на поверхности мембраны, но и внутри бислоя.
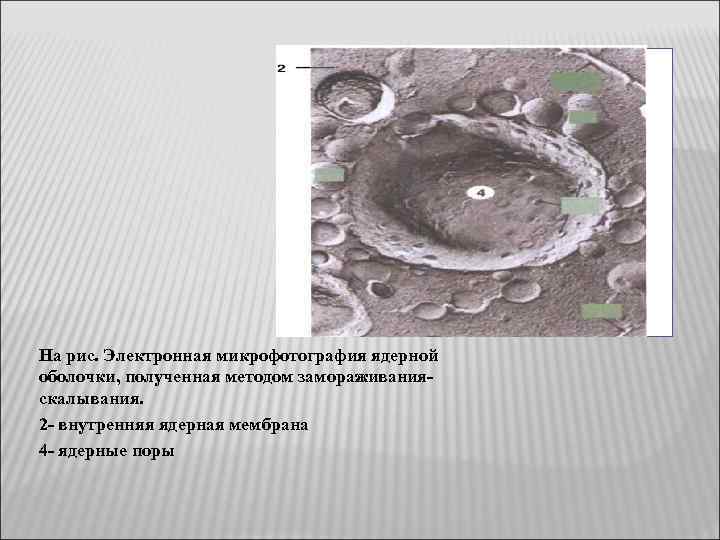
На рис. Электронная микрофотография ядерной оболочки, полученная методом замораживания- скалывания. 2 - внутренняя ядерная мембрана 4 - ядерные поры

Одним из наиболее точных методов исследования структуры молекул, составляющих мембрану клетки, является метод рентгеноструктурного анализа, основанный на дифракции рентгеновских лучей. Как правило, это явление наблюдается в тех случаях, когда на пути лучей встречаются препятствия, сравнимые по размеру с длиной волны луча. Если на исследуемый объект направляют параллельный пучок рентгеновских лучей, а за объектом помещают фотопленку, то на ней фиксируется дифракционная картина. На рентгенограмме наблюдается множество пятен, образующихся в результате интерференции лучей.

Анализрентгенограммы дает сведения о структуре объекта на молекулярном уровне. Ценность метода заключается в том, что появляется возможность, во-первых, изучить пространственное расположение молекул, точно измерить расстояние между ними, оценить их внутримолекулярную структуру, во- вторых, определить структуру молекулярных компонентов мембраны в не фиксированных клеточных препаратах.

С помощью электронного микроскопа и рентгеноструктурного анализа удалось показать общность строения поверхностных клеточных мембран эритроцитов, нервных и мышечных клеток, бактерий, плазмалеммы растительных клеток и др. с мембранами субклеточных структур — эндоплазматической сети, митохондрий, клеточных ядер, лизосом, хлоропластов и др.

Данная модель вируса иммунодефицита человека построена при помощи методов рентгеноструктурного анализа и ядерного магнитного резонанса. В ней воссозданы установленные к настоящему времени точные пространственные структуры 17 белков вирусного и клеточного происхождения в различных конформациях (с учетом межбелковых взаимодействий), а также структуры трансмембранных участков ряда белков и их гликозилированных форм. Для моделирования мембраны вирусной частицы использовано около 160 тысяч молекул липидов 8 видов в соотношениях, характерных для реальной частицы ВИЧ.

Слева белок ICAM-1, который частицы ВИЧ захватывают из хозяйской клетки, а справа вирусный белок оболочки, который связывается с клеточными рецепторами на стадии заражения

Следующим традиционным методом исследования состояния мембран является ядерный магнитный резонанс. В основе ЯМР-спектроскопии лежит физическое явление поглощения электромагнитных волн ядрами атомов, обладающими магнитным моментом. При биологических исследованиях часто используют С 13, Н, Р 31. Структура ЯМР- спектров зависит от величины дипольных взаимодействий между данным ядром и соседними ядрами, неоднородностью магнитного поля и т. д. Процессы релаксации, связанные с дипольными взаимодействиями, служат мерой, характеризующей "подвижность" отдельных атомов и молекул.

Метод ЯМР позволяет получать информацию с высокой точностью об избирательном поведении отдельных частей молекул белков и липидов, составляющих биологическую мембрану. Методы спектроскопии ЯМР позволяют изучать взаимодействия белков с другими белками, ДНК, ионами металлов и низкомолекулярными лигандами. ЯМР применяют для установления строения липидных мембран и их проницаемости. В настоящее время имеются спектры ЯМР многих белков, что делает возможным наблюдение за структурными изменениями, сопровождающими их функционирование, а также изучение состояния воды в биологических мембранах.

Метод электронного парамагнитного резонанса широко используется для исследований в области молекулярной и клеточной биофизики. Это явление было открыто русским физиком Е. К. Завойским в 1944 г. В дальнейшем оно послужило основой для создания метода спектроскопии ЭПР, который успешно применяют при изучении структуры молекул, содержащих парамагнитные частицы, а также кинетики изменений положения частицы при модификации конформации самой молекулы или ее соседей. В биологических объектах наиболее распространенными парамагнитными частицами являются свободные радикалы и ионы. Парамагнитными бывают ионы переходных металлов - Fe, Со, Ni, Сu.

Метод ЭПР дает возможность наблюдать их окислительно- восстановительные превращения и судить об изменении конформации включающих их комплексов. С помощью ЭПР исследуют также триплетные состояния, возникающие, например, в ходе фотобиологических реакций. Очень большое значение для мембранологии имеет использование спиновых зондов и меток, когда в исследуемую систему вводят стабильные свободные радикалы, по изменению характеристик спектров ЭПР которых судят о структурно-динамическом состоянии молекул мембраны.

Метод локальной фиксации потенциала, patch-clamp (англ. patch — фрагмент, clamp здесь — фиксация) — электрофизиологическая методика для изучения свойств ионных каналов, состоящая в том, что фрагмент клеточной мембраны изолируется с помощью специальной микропипетки. Эта методика даёт возможность экспериментатору контролировать разность потенциалов между сторонами мембраны, а также помещать её в среду с определённым химическим составом. В этих хорошо контролируемых условиях измеряют ионные токи, проходящие через мембрану, что, в конечном итоге, позволяет делать выводы о том, как ионные каналы реагируют на электрическое и химическое воздействие.

Метод настолько чувствителен, что позволяет наблюдать поведение и химические превращения единичных молекул, взаимодействующих с мембраной. Разработаны экспериментальные протоколы, позволяющие измерять характеристики ионных каналов оптимальным образом. Немецкие исследователи Эрвин Неер и Берт Сакман, разработавшие эту методику, получили Нобелевскую премию в 1991 году
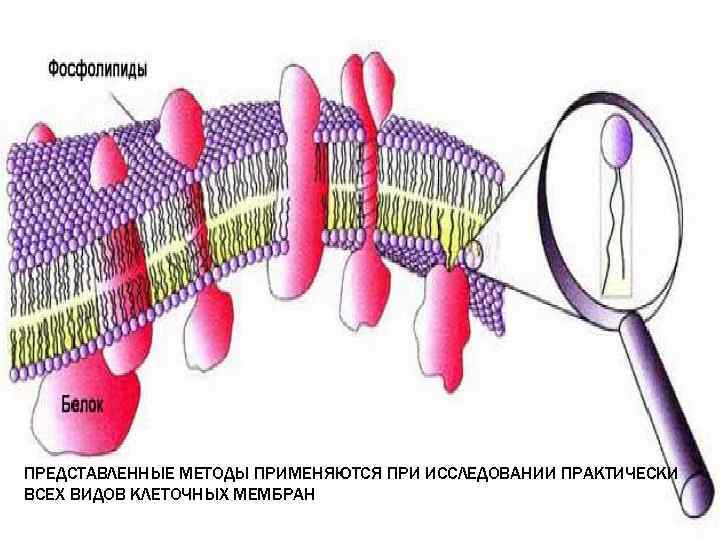
ПРЕДСТАВЛЕННЫЕ МЕТОДЫ ПРИМЕНЯЮТСЯ ПРИ ИССЛЕДОВАНИИ ПРАКТИЧЕСКИ ВСЕХ ВИДОВ КЛЕТОЧНЫХ МЕМБРАН

Спасибо за внимание

