 Методы исследования двойного электрического слоя
Методы исследования двойного электрического слоя
 Методы исследования можно разделить на две группы: • с использованием постоянного тока; • с использованием переменного тока. К первой группе относятся: • метод капиллярного электрометра, • метод поверхностной твердости, • метод краевого угла смачивания, • метод кривых заряжения.
Методы исследования можно разделить на две группы: • с использованием постоянного тока; • с использованием переменного тока. К первой группе относятся: • метод капиллярного электрометра, • метод поверхностной твердости, • метод краевого угла смачивания, • метод кривых заряжения.
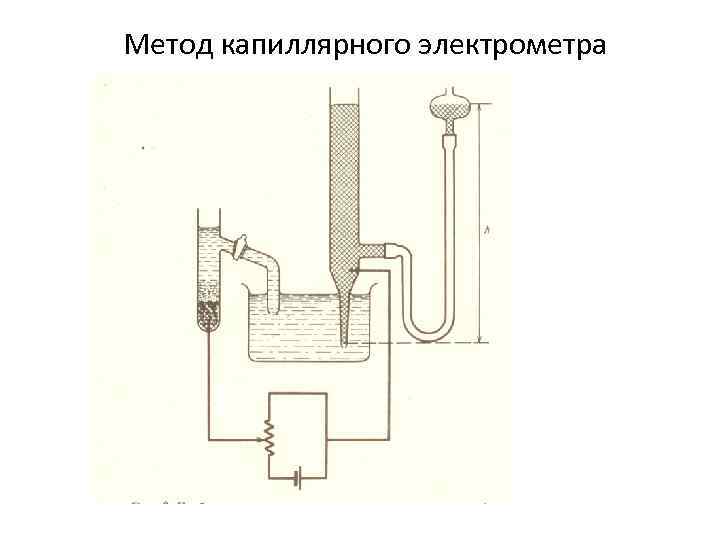 Метод капиллярного электрометра
Метод капиллярного электрометра
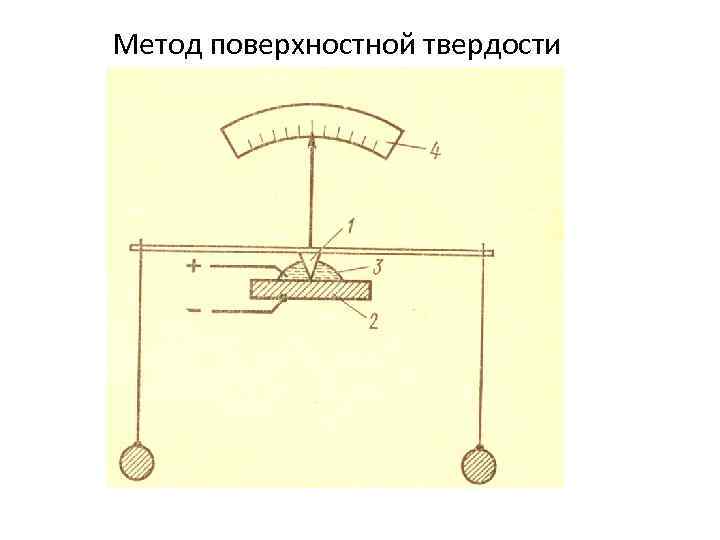 Метод поверхностной твердости
Метод поверхностной твердости
 Метод краевого угла смачивания В условиях равновесия капли на поверхности где σ10 – поверхностное натяжение на границе металл-капля жидкости; σ02 – поверхностное натяжение на границе капля жидкостираствор; σ21 - поверхностное натяжение на границе металл-раствор; Θ – краевой угол смачивания.
Метод краевого угла смачивания В условиях равновесия капли на поверхности где σ10 – поверхностное натяжение на границе металл-капля жидкости; σ02 – поверхностное натяжение на границе капля жидкостираствор; σ21 - поверхностное натяжение на границе металл-раствор; Θ – краевой угол смачивания.
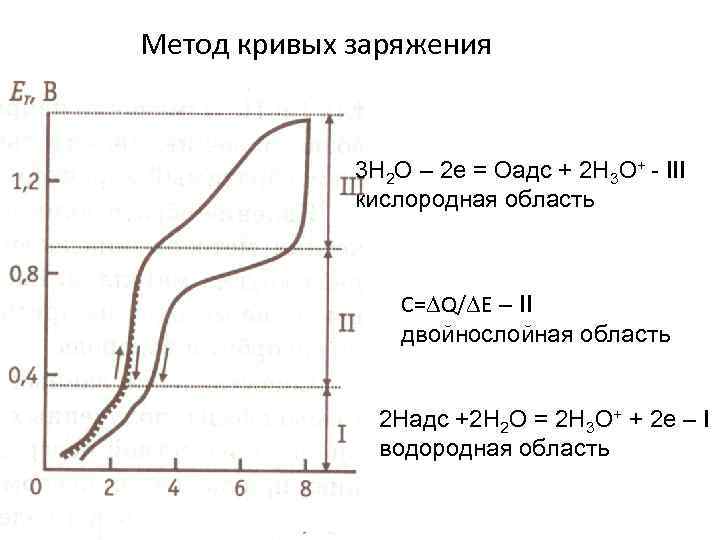 Метод кривых заряжения 3 Н 2 О – 2 е = Оадс + 2 Н 3 О+ - III кислородная область C= Q/ Е – II двойнослойная область 2 Надс +2 Н 2 О = 2 Н 3 О+ + 2 е – I водородная область
Метод кривых заряжения 3 Н 2 О – 2 е = Оадс + 2 Н 3 О+ - III кислородная область C= Q/ Е – II двойнослойная область 2 Надс +2 Н 2 О = 2 Н 3 О+ + 2 е – I водородная область
 К методам с использованием переменного тока относятся: • метод непосредственного измерения емкости ДЭС; • метод эстанса.
К методам с использованием переменного тока относятся: • метод непосредственного измерения емкости ДЭС; • метод эстанса.
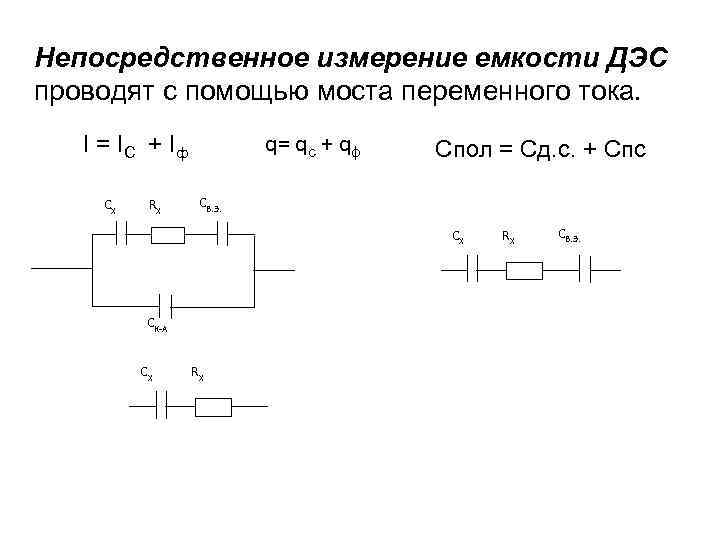 Непосредственное измерение емкости ДЭС проводят с помощью моста переменного тока. q= qс + qф I = IС + Iф СХ RX Спол = Сд. с. + Спс СВ. Э. СХ СК-А СХ RX RX СВ. Э.
Непосредственное измерение емкости ДЭС проводят с помощью моста переменного тока. q= qс + qф I = IС + Iф СХ RX Спол = Сд. с. + Спс СВ. Э. СХ СК-А СХ RX RX СВ. Э.
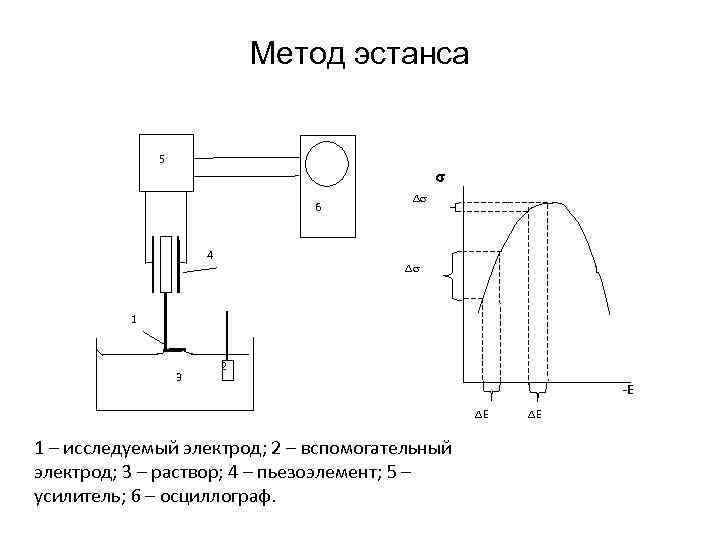 Метод эстанса 5 6 4 1 3 2 -Е Е 1 – исследуемый электрод; 2 – вспомогательный электрод; 3 – раствор; 4 – пьезоэлемент; 5 – усилитель; 6 – осциллограф. Е
Метод эстанса 5 6 4 1 3 2 -Е Е 1 – исследуемый электрод; 2 – вспомогательный электрод; 3 – раствор; 4 – пьезоэлемент; 5 – усилитель; 6 – осциллограф. Е
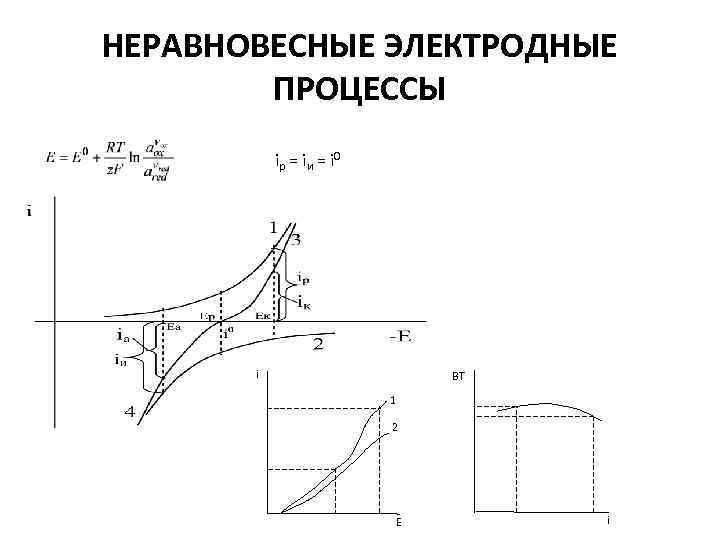 НЕРАВНОВЕСНЫЕ ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ iр = iи = i 0 i ВТ 1 2 E i
НЕРАВНОВЕСНЫЕ ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ iр = iи = i 0 i ВТ 1 2 E i
 , Стадии электрохимического процесса. Причины и виды поляризации Электрод а, В платина 0, 1 железо 0, 7 цинк 1, 28 кадмий 1, 45 свинец 1, 5
, Стадии электрохимического процесса. Причины и виды поляризации Электрод а, В платина 0, 1 железо 0, 7 цинк 1, 28 кадмий 1, 45 свинец 1, 5
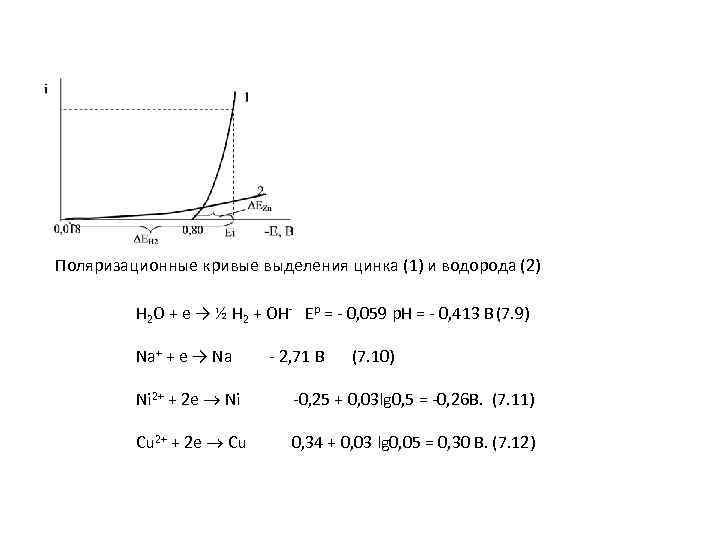 Поляризационные кривые выделения цинка (1) и водорода (2) H 2 O + e → ½ H 2 + OH- Ep = - 0, 059 p. H = - 0, 413 B (7. 9) Na+ + e → Na - 2, 71 B (7. 10) Ni 2+ + 2 e Ni -0, 25 + 0, 03 lg 0, 5 = -0, 26 В. (7. 11) Cu 2+ + 2 e Cu 0, 34 + 0, 03 lg 0, 05 = 0, 30 В. (7. 12)
Поляризационные кривые выделения цинка (1) и водорода (2) H 2 O + e → ½ H 2 + OH- Ep = - 0, 059 p. H = - 0, 413 B (7. 9) Na+ + e → Na - 2, 71 B (7. 10) Ni 2+ + 2 e Ni -0, 25 + 0, 03 lg 0, 5 = -0, 26 В. (7. 11) Cu 2+ + 2 e Cu 0, 34 + 0, 03 lg 0, 05 = 0, 30 В. (7. 12)
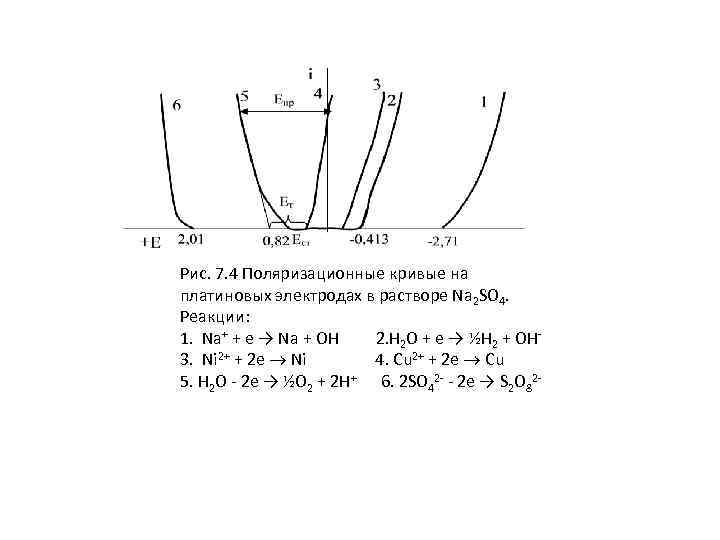 Рис. 7. 4 Поляризационные кривые на платиновых электродах в растворе Na 2 SO 4. Реакции: 1. Na+ + e → Na + ОН 2. Н 2 O + e → ½H 2 + OH- 3. Ni 2+ + 2 e Ni 4. Cu 2+ + 2 e Cu 5. H 2 O - 2 e → ½O 2 + 2 H+ 6. 2 SO 42 - - 2 e → S 2 O 82
Рис. 7. 4 Поляризационные кривые на платиновых электродах в растворе Na 2 SO 4. Реакции: 1. Na+ + e → Na + ОН 2. Н 2 O + e → ½H 2 + OH- 3. Ni 2+ + 2 e Ni 4. Cu 2+ + 2 e Cu 5. H 2 O - 2 e → ½O 2 + 2 H+ 6. 2 SO 42 - - 2 e → S 2 O 82
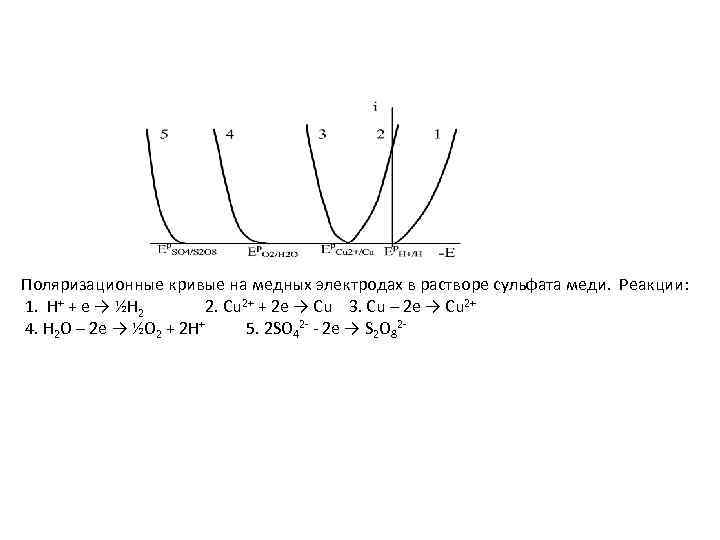 Поляризационные кривые на медных электродах в растворе сульфата меди. Реакции: 1. H+ + e → ½H 2 2. Cu 2+ + 2 e → Cu 3. Cu – 2 e → Cu 2+ 4. H 2 O – 2 e → ½O 2 + 2 H+ 5. 2 SO 42 - - 2 e → S 2 O 82
Поляризационные кривые на медных электродах в растворе сульфата меди. Реакции: 1. H+ + e → ½H 2 2. Cu 2+ + 2 e → Cu 3. Cu – 2 e → Cu 2+ 4. H 2 O – 2 e → ½O 2 + 2 H+ 5. 2 SO 42 - - 2 e → S 2 O 82
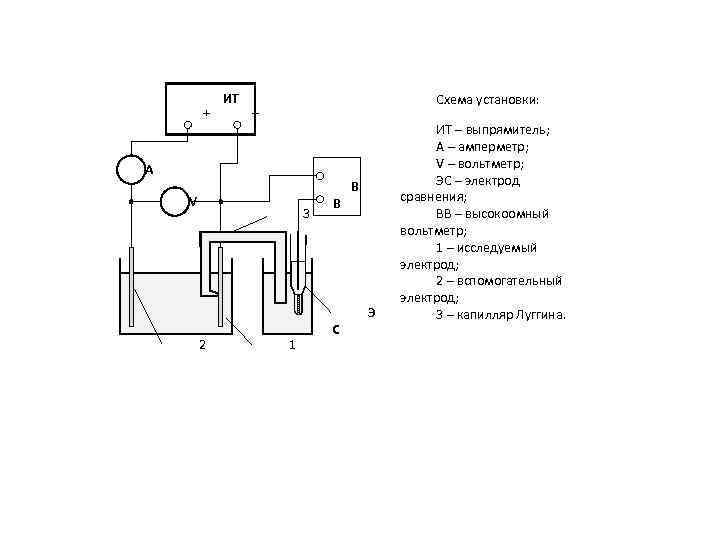 + ИТ Схема установки: – А V 3 2 1 В С В Э ИТ – выпрямитель; А – амперметр; V – вольтметр; ЭС – электрод сравнения; ВВ – высокоомный вольтметр; 1 – исследуемый электрод; 2 – вспомогательный электрод; 3 – капилляр Луггина.
+ ИТ Схема установки: – А V 3 2 1 В С В Э ИТ – выпрямитель; А – амперметр; V – вольтметр; ЭС – электрод сравнения; ВВ – высокоомный вольтметр; 1 – исследуемый электрод; 2 – вспомогательный электрод; 3 – капилляр Луггина.