Методы генетики человека









































Лекция 3. Методв генетики человека.ppt
- Количество слайдов: 50
 Методы генетики человека План 1. Человек как объект генетики 2. Генеалогический метод 3. Близнецовый метод (Генетика алкоголизма) 4. Цитогенетический метод 5. Биохимические методы 6. Методы локализации генов в хромосомах
Методы генетики человека План 1. Человек как объект генетики 2. Генеалогический метод 3. Близнецовый метод (Генетика алкоголизма) 4. Цитогенетический метод 5. Биохимические методы 6. Методы локализации генов в хромосомах
 1. Человек как объект генетики Как объект для изучения закономерностей наследования признаков человек очень неудобный объект по следующим причинам: 1. Невозможность проведения направленных контролируемых скрещиваний; 2. Длительный период развития; 3. Малое число потомков. В генетике животных и растений первым этапом в изучении наследования признака является гибридологический анализ, принципы которого разработаны Г. Менделем. К сожалению в генетике человека гибридологический метод в его классической форме неприменим, прежде всего из за невозможности проведе ния направленных скрещиваний. Поэтому исследователи пользуются данными, предоставляемыми самой жизнью.
1. Человек как объект генетики Как объект для изучения закономерностей наследования признаков человек очень неудобный объект по следующим причинам: 1. Невозможность проведения направленных контролируемых скрещиваний; 2. Длительный период развития; 3. Малое число потомков. В генетике животных и растений первым этапом в изучении наследования признака является гибридологический анализ, принципы которого разработаны Г. Менделем. К сожалению в генетике человека гибридологический метод в его классической форме неприменим, прежде всего из за невозможности проведе ния направленных скрещиваний. Поэтому исследователи пользуются данными, предоставляемыми самой жизнью.
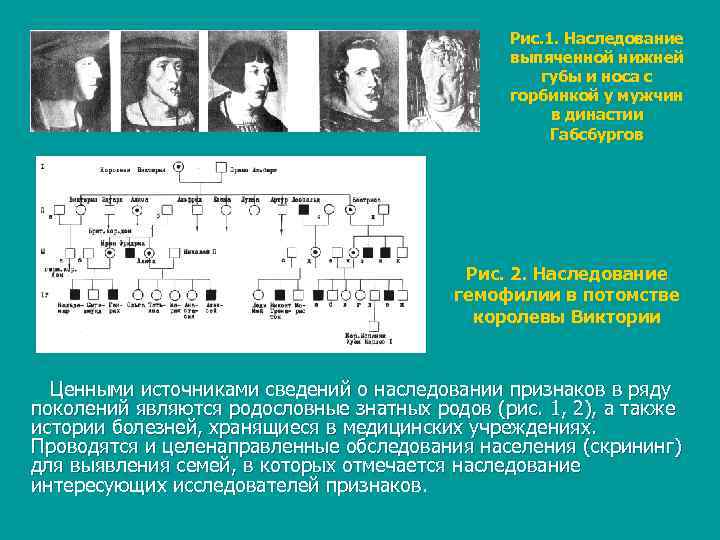
 Рис. 1. Наследование выпяченной нижней губы и носа с горбинкой у мужчин в династии Габсбургов Рис. 2. Наследование гемофилии в потомстве королевы Виктории Ценными источниками сведений о наследовании признаков в ряду поколений являются родословные знатных родов (рис. 1, 2), а также истории болезней, хранящиеся в медицинских учреждениях. Проводятся и целенаправленные обследования населения (скрининг) для выявления семей, в которых отмечается наследование интересующих исследователей признаков.
Рис. 1. Наследование выпяченной нижней губы и носа с горбинкой у мужчин в династии Габсбургов Рис. 2. Наследование гемофилии в потомстве королевы Виктории Ценными источниками сведений о наследовании признаков в ряду поколений являются родословные знатных родов (рис. 1, 2), а также истории болезней, хранящиеся в медицинских учреждениях. Проводятся и целенаправленные обследования населения (скрининг) для выявления семей, в которых отмечается наследование интересующих исследователей признаков.
 2. Генеалогический метод n Клинико генеалогический метод включает следующие этапы: n 1. Сбор наиболее полных сведений о семьях, в которых отмечено проявление изучаемого признака; n 2. Построение родословных по каждой отдельной семье; n З. Анализ каждой семейной родословной и выдвижение первоначальных гипотез о характере наследования признака; n 4. Объединение данных по всем родословным и вычисление сегрегационных соотношений (см. ниже); n 5. Анализ сегрегационных соотношений, подтверждение (или отрицание) и корректировка первоначальных гипотез.
2. Генеалогический метод n Клинико генеалогический метод включает следующие этапы: n 1. Сбор наиболее полных сведений о семьях, в которых отмечено проявление изучаемого признака; n 2. Построение родословных по каждой отдельной семье; n З. Анализ каждой семейной родословной и выдвижение первоначальных гипотез о характере наследования признака; n 4. Объединение данных по всем родословным и вычисление сегрегационных соотношений (см. ниже); n 5. Анализ сегрегационных соотношений, подтверждение (или отрицание) и корректировка первоначальных гипотез.
 Правила составления родословных n Обычно родословная составляется по одному двум признакам. Одновременный анализ большего числа признаков резко усложняет работу. Начинается составление родословной с пробанда первого, попавшего в поле зрения исследователя лица. Обычно это носитель изучаемого признака. n Дети одной родительской пары называются сибсами. Ядерной семьёй называют родительскую пару и их детей. Болeе широкий круг кровных родственников называет родом. n Cоставление родословных сопровождается кратким описанием сведений о каждом члене родословной. Для наглядности строится графическое изображение родословной с использованием стандартных символов. Поколения на схеме нумеруется римскими цифрами (ставятся слева). Арабскими цифрами нумеруется члены одного поколения по порядку рождения. Т. образом, каждый член родословной получает свой шифр. Например» шифр III 5 обозначает пятого ребенка а III м поколении. Всех членов родословной одного поколения (и их супругов) располагают строго в один ряд. Символы, обозначавшие обладателей изучаемого признака, выделяет штриховкoй.
Правила составления родословных n Обычно родословная составляется по одному двум признакам. Одновременный анализ большего числа признаков резко усложняет работу. Начинается составление родословной с пробанда первого, попавшего в поле зрения исследователя лица. Обычно это носитель изучаемого признака. n Дети одной родительской пары называются сибсами. Ядерной семьёй называют родительскую пару и их детей. Болeе широкий круг кровных родственников называет родом. n Cоставление родословных сопровождается кратким описанием сведений о каждом члене родословной. Для наглядности строится графическое изображение родословной с использованием стандартных символов. Поколения на схеме нумеруется римскими цифрами (ставятся слева). Арабскими цифрами нумеруется члены одного поколения по порядку рождения. Т. образом, каждый член родословной получает свой шифр. Например» шифр III 5 обозначает пятого ребенка а III м поколении. Всех членов родословной одного поколения (и их супругов) располагают строго в один ряд. Символы, обозначавшие обладателей изучаемого признака, выделяет штриховкoй.
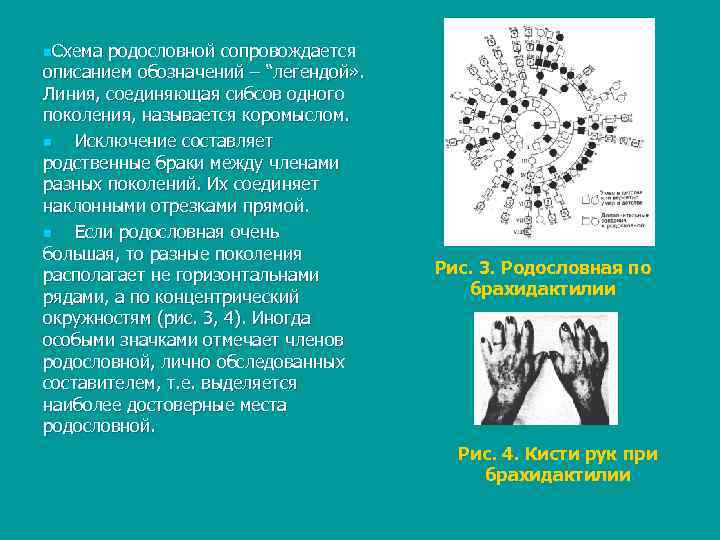
 n. Схема родословной сопровождаетcя описанием обозначений – “легендой» . Линия, соединяющая сибсов одного поколения, называется коромыслом. n Исключение составляет родственные браки между членами разных поколений. Их соединяет наклонными отрезками прямой. n Еcли родословная очень большая, то разные поколения располагает не горизонтальнами Рис. 3. Родословная по рядами, а по концентрический брахидактилии окружностям (рис. 3, 4). Иногда особыми значками отмечает членов родословной, лично обследованныx составителем, т. е. выделяется наиболее достоверные места родословной. Рис. 4. Кисти рук при брахидактилии
n. Схема родословной сопровождаетcя описанием обозначений – “легендой» . Линия, соединяющая сибсов одного поколения, называется коромыслом. n Исключение составляет родственные браки между членами разных поколений. Их соединяет наклонными отрезками прямой. n Еcли родословная очень большая, то разные поколения располагает не горизонтальнами Рис. 3. Родословная по рядами, а по концентрический брахидактилии окружностям (рис. 3, 4). Иногда особыми значками отмечает членов родословной, лично обследованныx составителем, т. е. выделяется наиболее достоверные места родословной. Рис. 4. Кисти рук при брахидактилии
 Анализ родословных n Первая задача при анализе родословных установление наследственной обусловленности признака. Если в ряду поколений изучаемый признак встречается несколько раз, то можно думать о его наследственной природе. Но необходимо исключить возможность влияния внешних факторов. Если один и тот же фактор действовал на женщину во время всех беременностей, то у неё может родиться несколько детей с одинаковыми аномалиями, хотя сами аномалии и не зависят от генотипа. Например, в некоторых странах Европы в 60 х годах был распространён снотворный препарат талидомид. У многих женщин, принимавших его в период беременности, рождались дети с уродливыми короткими конечностями (и даже совсем без конечностей). Генетически такие уроды вполне нормальны (у некоторых из них родились дети, которые все были нормальными). Уродство вызвано тем, что талидомид нарушает ход эмбрионального развития. n После установления наследственного характера признака (болезни) определяют тип наследования. Для этого используют логические приёмы генетического анализа и статистические методы (вычисление сегрегационных соотношений - отношение числа обладателей признака к общему числу сибсов). Полученные эмпирические значения сегрегационных соотношений сравнивают с теоретическими соотношениями, характерными для моногибридного скрещивания (1: 1 при браке Аа : аа, 3: 1 при браке Аа х Аа и полном доминировании и 1: 2 : 1 при неполном доминировании). На основании этого сравнения делают вывод о характере наследования признака.
Анализ родословных n Первая задача при анализе родословных установление наследственной обусловленности признака. Если в ряду поколений изучаемый признак встречается несколько раз, то можно думать о его наследственной природе. Но необходимо исключить возможность влияния внешних факторов. Если один и тот же фактор действовал на женщину во время всех беременностей, то у неё может родиться несколько детей с одинаковыми аномалиями, хотя сами аномалии и не зависят от генотипа. Например, в некоторых странах Европы в 60 х годах был распространён снотворный препарат талидомид. У многих женщин, принимавших его в период беременности, рождались дети с уродливыми короткими конечностями (и даже совсем без конечностей). Генетически такие уроды вполне нормальны (у некоторых из них родились дети, которые все были нормальными). Уродство вызвано тем, что талидомид нарушает ход эмбрионального развития. n После установления наследственного характера признака (болезни) определяют тип наследования. Для этого используют логические приёмы генетического анализа и статистические методы (вычисление сегрегационных соотношений - отношение числа обладателей признака к общему числу сибсов). Полученные эмпирические значения сегрегационных соотношений сравнивают с теоретическими соотношениями, характерными для моногибридного скрещивания (1: 1 при браке Аа : аа, 3: 1 при браке Аа х Аа и полном доминировании и 1: 2 : 1 при неполном доминировании). На основании этого сравнения делают вывод о характере наследования признака.
 n Прямое вычисление сегрегационных соотношений даёт правильные результаты при анализе лишь обширных родословных, содержащей много пар родителей и большое число потомков (например, для родословной, изображённой на рис. 4). В этой родословной брахидактилия встречается в каждом поколении, что характерно для наследования доминантных признаков. n Все обладатели признака имели нормальных супругов (не отмече ны), т. е. браки между больными и здоровыми имеют вид Аа х аа. В этом случае сегрегационное соотношение должно быть 1: 1. n. Всего в данной родословной можно выделить таких 25 браков, в которых родились 43 ребёнка с брахидактилией и 46 нормальных, что очень близко к ожидаемому соотношению 1: 1. n В браках нормальных членов родословной с нормальными супругами (таких браков 35) детей с брахидактилией нет, что соответствует схеме браков аа х аа. n. Можно отметить также, что брахидактилия распределена как среди сыновей, так и среди дочерей больных родителей. Т. е. признак не проявляет сцепленного с полом наследования.
n Прямое вычисление сегрегационных соотношений даёт правильные результаты при анализе лишь обширных родословных, содержащей много пар родителей и большое число потомков (например, для родословной, изображённой на рис. 4). В этой родословной брахидактилия встречается в каждом поколении, что характерно для наследования доминантных признаков. n Все обладатели признака имели нормальных супругов (не отмече ны), т. е. браки между больными и здоровыми имеют вид Аа х аа. В этом случае сегрегационное соотношение должно быть 1: 1. n. Всего в данной родословной можно выделить таких 25 браков, в которых родились 43 ребёнка с брахидактилией и 46 нормальных, что очень близко к ожидаемому соотношению 1: 1. n В браках нормальных членов родословной с нормальными супругами (таких браков 35) детей с брахидактилией нет, что соответствует схеме браков аа х аа. n. Можно отметить также, что брахидактилия распределена как среди сыновей, так и среди дочерей больных родителей. Т. е. признак не проявляет сцепленного с полом наследования.
 n Обширных родословных, подобных изображённой на рис. 4, известно немного. Большинство современных семей малодетны. Кроме того, многие люди знают мало сведений о своих предках. Часто исследователям доступны лишь ядерные семьи. Поэтому приходится выбирать по историям болезней большое число ядерных семей, в которых наблюдается изучаемая наследственная болезнь и по объединениям данным вычислять сегрегационное соотношение. При этом в вычисления вносятся ошибки, связанные с неполной регистрацией данных. Дело в том, что в истории болезни имеются сведения лишь об одном больном (пробанде) и, как правило, нет данных о сибсах и родителях пробанда. А для вычисления сегрегационного соотношения необходимы сведения о всех членах ядерной семьи. n Чтобы избежать грубых oшибок регистрации данных разработаны специальные эмпирические таблицы для определения сегрегационного соотношения по неполным данным, а также разработаны специальные формулы вычисления. Одна из них, часто используемая при неполной регистрации данных, имеет вид: P = (R –N)/ (T – N), где Р доля больных, R - общее число больных во всех родословных, N - число обследованных ядерных семей, Т общее число сибсов больных и здоровых. Например, по зарегистрированным пробандам выявлено 50 семей с алкаптонурией. Общее число детей в семьях равно 148. Из них больных (включая пробандов индикаторов) 77. Сегрегационное соотношение: Р = (77 – 50) / (148 – 50) = 0, 27 n. Соотношение здоровые : больные близко к отношению 3 : I, что характерно для рецессивного типа наследовании болезни, если родители гетерозиготы.
n Обширных родословных, подобных изображённой на рис. 4, известно немного. Большинство современных семей малодетны. Кроме того, многие люди знают мало сведений о своих предках. Часто исследователям доступны лишь ядерные семьи. Поэтому приходится выбирать по историям болезней большое число ядерных семей, в которых наблюдается изучаемая наследственная болезнь и по объединениям данным вычислять сегрегационное соотношение. При этом в вычисления вносятся ошибки, связанные с неполной регистрацией данных. Дело в том, что в истории болезни имеются сведения лишь об одном больном (пробанде) и, как правило, нет данных о сибсах и родителях пробанда. А для вычисления сегрегационного соотношения необходимы сведения о всех членах ядерной семьи. n Чтобы избежать грубых oшибок регистрации данных разработаны специальные эмпирические таблицы для определения сегрегационного соотношения по неполным данным, а также разработаны специальные формулы вычисления. Одна из них, часто используемая при неполной регистрации данных, имеет вид: P = (R –N)/ (T – N), где Р доля больных, R - общее число больных во всех родословных, N - число обследованных ядерных семей, Т общее число сибсов больных и здоровых. Например, по зарегистрированным пробандам выявлено 50 семей с алкаптонурией. Общее число детей в семьях равно 148. Из них больных (включая пробандов индикаторов) 77. Сегрегационное соотношение: Р = (77 – 50) / (148 – 50) = 0, 27 n. Соотношение здоровые : больные близко к отношению 3 : I, что характерно для рецессивного типа наследовании болезни, если родители гетерозиготы.
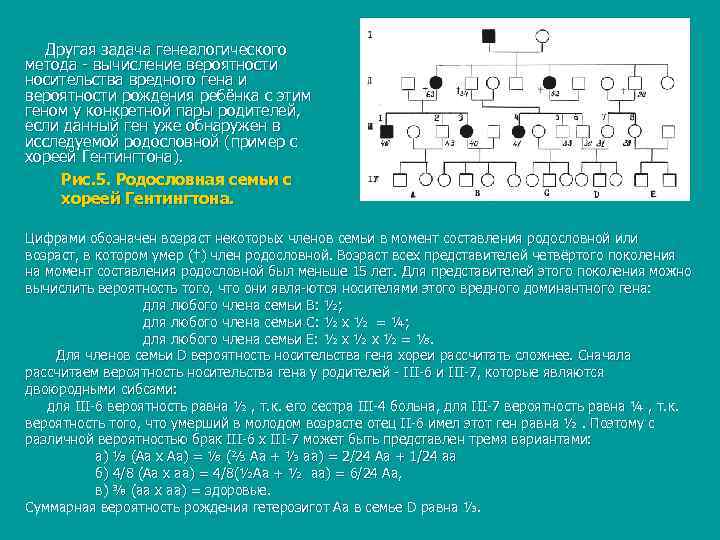
 Другая задача генеалогического метода вычисление вероятности носительства вредного гена и вероятности рождения ребёнка с этим геном у конкретной пары родителей, если данный ген уже обнаружен в исследуемой родословной (пример с хореей Гентингтона). Рис. 5. Родословная семьи с хореей Гентингтона. Цифрами обозначен возраст некоторых членов семьи в момент составления родословной или возраст, в котором умер (†) член родословной. Возраст всех представителей четвёртого поколения на момент составления родословной был меньше 15 лет. Для представителей этого поколения можно вычислить вероятность того, что они явля ются носителями этого вредного доминантного гена: для любого члена семьи В: ½; для любого члена семьи С: ½ х ½ = ¼; для любого члена семьи Е: ½ х ½ = ⅛. Для членов семьи D вероятность носительства гена хореи рассчитать сложнее. Сначала рассчитаем вероятность носительства гена у родителей III 6 и III 7, которые являются двоюродными сибсами: для III 6 вероятность равна ½ , т. к. его сестра III 4 больна, для III 7 вероятность равна ¼ , т. к. вероятность того, что умерший в молодом возрасте отец II 6 имел этот ген равна ½. Поэтому с различной вероятностью брак III 6 х III 7 может быть представлен тремя вариантами: а) ⅛ (Аа х Аа) = ⅛ (⅔ Аа + ⅓ аа) = 2/24 Аа + 1/24 аа б) 4/8 (Аа х аа) = 4/8(½Аа + ½ аа) = 6/24 Аа, в) ⅜ (аа х аа) = здоровые. Суммарная вероятность рождения гетерозигот Аа в семье D равна ⅓.
Другая задача генеалогического метода вычисление вероятности носительства вредного гена и вероятности рождения ребёнка с этим геном у конкретной пары родителей, если данный ген уже обнаружен в исследуемой родословной (пример с хореей Гентингтона). Рис. 5. Родословная семьи с хореей Гентингтона. Цифрами обозначен возраст некоторых членов семьи в момент составления родословной или возраст, в котором умер (†) член родословной. Возраст всех представителей четвёртого поколения на момент составления родословной был меньше 15 лет. Для представителей этого поколения можно вычислить вероятность того, что они явля ются носителями этого вредного доминантного гена: для любого члена семьи В: ½; для любого члена семьи С: ½ х ½ = ¼; для любого члена семьи Е: ½ х ½ = ⅛. Для членов семьи D вероятность носительства гена хореи рассчитать сложнее. Сначала рассчитаем вероятность носительства гена у родителей III 6 и III 7, которые являются двоюродными сибсами: для III 6 вероятность равна ½ , т. к. его сестра III 4 больна, для III 7 вероятность равна ¼ , т. к. вероятность того, что умерший в молодом возрасте отец II 6 имел этот ген равна ½. Поэтому с различной вероятностью брак III 6 х III 7 может быть представлен тремя вариантами: а) ⅛ (Аа х Аа) = ⅛ (⅔ Аа + ⅓ аа) = 2/24 Аа + 1/24 аа б) 4/8 (Аа х аа) = 4/8(½Аа + ½ аа) = 6/24 Аа, в) ⅜ (аа х аа) = здоровые. Суммарная вероятность рождения гетерозигот Аа в семье D равна ⅓.
 3. Близнецовый метод n Этот метод изучения генетических закономерностей на близнецах предложен Ф. Галь тоном в 1875 г. Близнецовый метод дает возможность определить вклад генетических (наследственных) и средовых факторов (климат, питание, обучение, воспитание и др. ) в развитии конкретных признаков или заболеваний у человека. n При использовании близнецового метода проводится сравнение: n 1) монозиготных (однояйцевых) близнецов — МБ с дизиготными (разнояйцевыми) — ДБ; n 2) партнеров в монозиготных парах между собой; n 3) данных анализа близнецовой выборки с общей популяцией. Монозиготные близнецы образуются из одной зиготы, разделившейся на стадии дробления на две (или более) части. С генетической точки зрения они идентичны. Особую группу среди МБ составляют необычные типы близнецов: двухголовые (как правило нежизнеспособные), каспофаги ("сиамские близнецы"). Наиболее известный случай — родившиеся в 1811 г. в Сиаме (ныне Таиланд) сиамские близнецы — Чанг и Энг. Они прожили 63 года, были женаты на сестрах близнецах; Чанг произвёл на свет 10, а Энг — 12 детей. Когда от бронхита умер Чанг, спустя 2 часа умер и Энг. Их связывала тканевая перемычка шириной около 10 см от грудины до пупка. Перемычка содержала печеночную ткань, связывающую две печени. Хирургическая попытка разделить братьев вряд ли в то время была бы успешной. В настоящее время разъединяют и более сложные связи между близнецами.
3. Близнецовый метод n Этот метод изучения генетических закономерностей на близнецах предложен Ф. Галь тоном в 1875 г. Близнецовый метод дает возможность определить вклад генетических (наследственных) и средовых факторов (климат, питание, обучение, воспитание и др. ) в развитии конкретных признаков или заболеваний у человека. n При использовании близнецового метода проводится сравнение: n 1) монозиготных (однояйцевых) близнецов — МБ с дизиготными (разнояйцевыми) — ДБ; n 2) партнеров в монозиготных парах между собой; n 3) данных анализа близнецовой выборки с общей популяцией. Монозиготные близнецы образуются из одной зиготы, разделившейся на стадии дробления на две (или более) части. С генетической точки зрения они идентичны. Особую группу среди МБ составляют необычные типы близнецов: двухголовые (как правило нежизнеспособные), каспофаги ("сиамские близнецы"). Наиболее известный случай — родившиеся в 1811 г. в Сиаме (ныне Таиланд) сиамские близнецы — Чанг и Энг. Они прожили 63 года, были женаты на сестрах близнецах; Чанг произвёл на свет 10, а Энг — 12 детей. Когда от бронхита умер Чанг, спустя 2 часа умер и Энг. Их связывала тканевая перемычка шириной около 10 см от грудины до пупка. Перемычка содержала печеночную ткань, связывающую две печени. Хирургическая попытка разделить братьев вряд ли в то время была бы успешной. В настоящее время разъединяют и более сложные связи между близнецами.
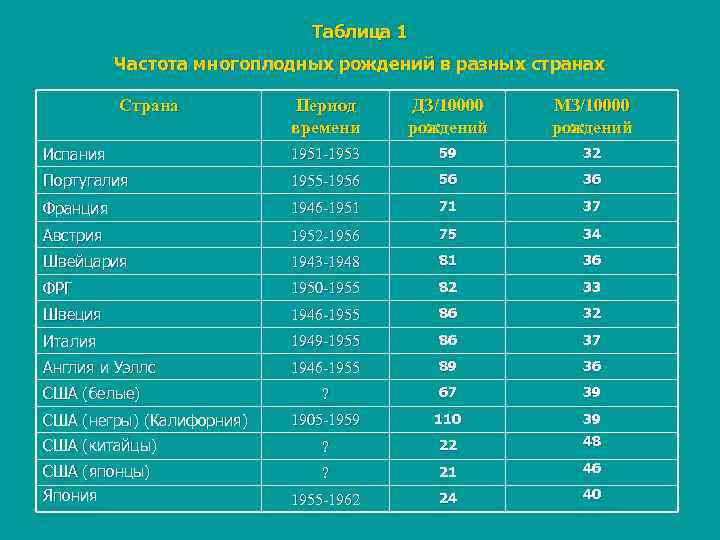
 Дизиготные близнецы развиваются в том случае, если одновременно две яйцеклетки оплодотворены двумя сперматозоидами. Дизиготные близнецы имеют различные генотипы. Они сходны между собой не более, чем братья и сестры, т. к. имеют около 50 % идентичных генов. Общая частота рождения близнецов составляет примерно 1 %, из них около 1/3 приходится на монозиготных близнецов. Известно, что число рождений монозиготных близнецов сходно в разных популяциях, в то время как для дизиготных эта цифра существенно различается. Например, в США дизиготные близнецы рождаются чаще среди негров, чем белых. В Европе частота появления дизиготных близнецов составляет 8 на 1000 рождений. Однако в отдельных популяциях их бывает больше. Самая низкая частота рождения близнецов присуща монголоидным популяциям, особенно в Японии (Табл. 1). Отмечается, что частота врожденных уродств у близнецов, как правило, выше, чем у одиночно рожденных.
Дизиготные близнецы развиваются в том случае, если одновременно две яйцеклетки оплодотворены двумя сперматозоидами. Дизиготные близнецы имеют различные генотипы. Они сходны между собой не более, чем братья и сестры, т. к. имеют около 50 % идентичных генов. Общая частота рождения близнецов составляет примерно 1 %, из них около 1/3 приходится на монозиготных близнецов. Известно, что число рождений монозиготных близнецов сходно в разных популяциях, в то время как для дизиготных эта цифра существенно различается. Например, в США дизиготные близнецы рождаются чаще среди негров, чем белых. В Европе частота появления дизиготных близнецов составляет 8 на 1000 рождений. Однако в отдельных популяциях их бывает больше. Самая низкая частота рождения близнецов присуща монголоидным популяциям, особенно в Японии (Табл. 1). Отмечается, что частота врожденных уродств у близнецов, как правило, выше, чем у одиночно рожденных.
 Таблица 1 Частота многоплодных рождений в разных странах Страна Период ДЗ/10000 МЗ/10000 времени рождений Испания 1951 -1953 59 32 Португалия 1955 -1956 56 36 Франция 1946 -1951 71 37 Австрия 1952 -1956 75 34 Швейцария 1943 -1948 81 36 ФРГ 1950 -1955 82 33 Швеция 1946 -1955 86 32 Италия 1949 -1955 86 37 Англия и Уэллс 1946 -1955 89 36 США (белые) ? 67 39 США (негры) (Калифорния) 1905 -1959 110 39 США (китайцы) ? 22 48 США (японцы) ? 21 46 Япония 1955 -1962 24 40
Таблица 1 Частота многоплодных рождений в разных странах Страна Период ДЗ/10000 МЗ/10000 времени рождений Испания 1951 -1953 59 32 Португалия 1955 -1956 56 36 Франция 1946 -1951 71 37 Австрия 1952 -1956 75 34 Швейцария 1943 -1948 81 36 ФРГ 1950 -1955 82 33 Швеция 1946 -1955 86 32 Италия 1949 -1955 86 37 Англия и Уэллс 1946 -1955 89 36 США (белые) ? 67 39 США (негры) (Калифорния) 1905 -1959 110 39 США (китайцы) ? 22 48 США (японцы) ? 21 46 Япония 1955 -1962 24 40
 n Полагают, что многоплодие генетически обусловлено. Однако это справедливо лишь для дизиготных близнецов. Факторы, влияющие на частоту рождения близнецов, в настоящее время мало изучены. Есть данные, показывающие, что вероятность рождения дизиготных близнецов повышается с увеличением возраста матери, а так же порядкового номера рождения. Влияние возраста матери объясняется, вероятно, повышением уровня гонадотропина, что приводит к учащению полиовуляции. Имеются также данные о снижении частоты рождения близнецов почти во всех индустриальных странах. n. Близнецовый метод включает в себя диагностику зиготности близнецов. В настоящее время используются следующие методы для ее установления.
n Полагают, что многоплодие генетически обусловлено. Однако это справедливо лишь для дизиготных близнецов. Факторы, влияющие на частоту рождения близнецов, в настоящее время мало изучены. Есть данные, показывающие, что вероятность рождения дизиготных близнецов повышается с увеличением возраста матери, а так же порядкового номера рождения. Влияние возраста матери объясняется, вероятно, повышением уровня гонадотропина, что приводит к учащению полиовуляции. Имеются также данные о снижении частоты рождения близнецов почти во всех индустриальных странах. n. Близнецовый метод включает в себя диагностику зиготности близнецов. В настоящее время используются следующие методы для ее установления.
 n 1. Полисимптомный метод. Он заключается в сравнении пары близнецов по внешним признакам (форма бровей, носа, губ, ушных раковин, цвет волос, глаз и. т. п. ). Несмотря на очевидное удобство, это метод до известной степени субъективный и может давать ошибки. n 2. Иммуногенетический метод. Более сложный, он основывается на анализе групп крови, белков сыворотки крови, лейкоцитарных антигенов, чувствительности к фенилтиокарбамиду и др. Если у обоих близнецов по этим признакам различий нет, их считают монозиготными. n 3. Достоверным критерием зиготности близнецов является приживляемость кусочков кожи. Установлено, что у дизиготных близнецов такая пересадка всегда заканчивается отторжением, в то время как у монозиготных пар отмечается высокая приживляемость трансплантантов. n 4. Метод дерматоглифики заключается в изучении папиллярных узоров пальцев, ладоней и стоп. Эти признаки строго индивидуальны и не изменяются в течение всей жизни человека. Не случайно, что эти показатели используются в криминалистике и в судебной медицине для опознания личности и установления отцовства. Сходство дерматоглифических показателей у монозиготных близнецов значительно выше, чем у дизиготных.
n 1. Полисимптомный метод. Он заключается в сравнении пары близнецов по внешним признакам (форма бровей, носа, губ, ушных раковин, цвет волос, глаз и. т. п. ). Несмотря на очевидное удобство, это метод до известной степени субъективный и может давать ошибки. n 2. Иммуногенетический метод. Более сложный, он основывается на анализе групп крови, белков сыворотки крови, лейкоцитарных антигенов, чувствительности к фенилтиокарбамиду и др. Если у обоих близнецов по этим признакам различий нет, их считают монозиготными. n 3. Достоверным критерием зиготности близнецов является приживляемость кусочков кожи. Установлено, что у дизиготных близнецов такая пересадка всегда заканчивается отторжением, в то время как у монозиготных пар отмечается высокая приживляемость трансплантантов. n 4. Метод дерматоглифики заключается в изучении папиллярных узоров пальцев, ладоней и стоп. Эти признаки строго индивидуальны и не изменяются в течение всей жизни человека. Не случайно, что эти показатели используются в криминалистике и в судебной медицине для опознания личности и установления отцовства. Сходство дерматоглифических показателей у монозиготных близнецов значительно выше, чем у дизиготных.
 Близнецовый метод включает сопоставление групп моно и дизиготных близнецов по изучаемому признаку. Если какой либо признак встречается у обоих близнецов одной пары, то она называется конкордантной, если же у одного из них, то пара близнецов называется дискордантной. (конкордантность — степень сходства, дискордантность — степень различия). При сопоставлении моно и дизиготных близнецов определяют коэффициент парной конкордантности, указывающий на долю близнецовых пар, в которых изучаемый признак проявился у обоих партнеров. Коэффициент конкордантности (Кд) выражается в долях единицы или в процентах и определяется по формуле: Кд = С / (С+Д) , где С — число конкордантных пар, Д — число дискордантных пар. Сравнение парной конкордантности у моно и дизиготных близнецов дает ответ о соотносительной роли наследственности и среды в развитии того или иного признака или болезни. При этом исходят из предположения о том, что степень конкордантности достоверно выше у монозиготных, чем у дизиготных близнецов, если наследственные факторы имеют доминирующую роль в развитии признака (табл. 2).
Близнецовый метод включает сопоставление групп моно и дизиготных близнецов по изучаемому признаку. Если какой либо признак встречается у обоих близнецов одной пары, то она называется конкордантной, если же у одного из них, то пара близнецов называется дискордантной. (конкордантность — степень сходства, дискордантность — степень различия). При сопоставлении моно и дизиготных близнецов определяют коэффициент парной конкордантности, указывающий на долю близнецовых пар, в которых изучаемый признак проявился у обоих партнеров. Коэффициент конкордантности (Кд) выражается в долях единицы или в процентах и определяется по формуле: Кд = С / (С+Д) , где С — число конкордантных пар, Д — число дискордантных пар. Сравнение парной конкордантности у моно и дизиготных близнецов дает ответ о соотносительной роли наследственности и среды в развитии того или иного признака или болезни. При этом исходят из предположения о том, что степень конкордантности достоверно выше у монозиготных, чем у дизиготных близнецов, если наследственные факторы имеют доминирующую роль в развитии признака (табл. 2).
 Таблица 2 Примеры конкордантности по некоторым признакам и заболеваниям у МБ и ДБ, % Признаки МБ ДБ Цвет глаз, волос 99, 5; 97, 0 28, 0; 23, 0 Форма губ, ушей 100, 0; 98, 0 65, 0; 20, 0 Папиллярные линии 92, 0 40, 0 Маниакально-депрессивный психоз 73, 1 15, 2 Шизофрения 67, 0 12, 1 Эпилепсия 60, 8; (37, 2) 12, 3; (1, 8) Сахарный диабет 84, 0; (58, 0) 37, 0; (20, 0) Туберкулез 66, 7 23, 0 Ревматизм 47, 3 17, 3 Воспаление среднего уха 30, 1 9, 8 Косолапость 45, 5 18, 2 Врожденный вывих бедра 41, 4 2, 8 Корь 97, 4 95, 7 Коклюш 97, 4 95, 7 Ветряная оспа 92, 8 92, 0 Скарлатина 56, 4 41, 2
Таблица 2 Примеры конкордантности по некоторым признакам и заболеваниям у МБ и ДБ, % Признаки МБ ДБ Цвет глаз, волос 99, 5; 97, 0 28, 0; 23, 0 Форма губ, ушей 100, 0; 98, 0 65, 0; 20, 0 Папиллярные линии 92, 0 40, 0 Маниакально-депрессивный психоз 73, 1 15, 2 Шизофрения 67, 0 12, 1 Эпилепсия 60, 8; (37, 2) 12, 3; (1, 8) Сахарный диабет 84, 0; (58, 0) 37, 0; (20, 0) Туберкулез 66, 7 23, 0 Ревматизм 47, 3 17, 3 Воспаление среднего уха 30, 1 9, 8 Косолапость 45, 5 18, 2 Врожденный вывих бедра 41, 4 2, 8 Корь 97, 4 95, 7 Коклюш 97, 4 95, 7 Ветряная оспа 92, 8 92, 0 Скарлатина 56, 4 41, 2
 n Для количественной оценки роли наследственности и среды в развитии того или иного признака используют различные формулы. Чаще всего пользуются коэффициентом наследуемости, который вычисляется по формуле: n. Н = (КМБ - КДБ) / (100 - КДБ) (в процентах) nили: n. Н = (КМБ – КДБ) / (1 -КДБ) (в долях единицы), где Н — коэффициент наследуемости. К — коэффициент парной конкордантности в группе монозиготных (МБ) или дизиготных (ДБ) близнецов. n В зависимости от значения Н судят о влиянии генетических и средовых факторов на развитие признака. Например, если значение Н близко к 0, считают, что развитие признака обусловлено только факторами внешней среды. При значении Н от 1 до 0, 7 — наследст венные факторы имеют доминирующее значение в развитии признака или болезни; nсреднее значение Н от 0, 4 до 0, 7 свидетельствует о том, что признак развивается под действием факторов внешней среды при наличии генетической предрасположенности (табл. 3).
n Для количественной оценки роли наследственности и среды в развитии того или иного признака используют различные формулы. Чаще всего пользуются коэффициентом наследуемости, который вычисляется по формуле: n. Н = (КМБ - КДБ) / (100 - КДБ) (в процентах) nили: n. Н = (КМБ – КДБ) / (1 -КДБ) (в долях единицы), где Н — коэффициент наследуемости. К — коэффициент парной конкордантности в группе монозиготных (МБ) или дизиготных (ДБ) близнецов. n В зависимости от значения Н судят о влиянии генетических и средовых факторов на развитие признака. Например, если значение Н близко к 0, считают, что развитие признака обусловлено только факторами внешней среды. При значении Н от 1 до 0, 7 — наследст венные факторы имеют доминирующее значение в развитии признака или болезни; nсреднее значение Н от 0, 4 до 0, 7 свидетельствует о том, что признак развивается под действием факторов внешней среды при наличии генетической предрасположенности (табл. 3).
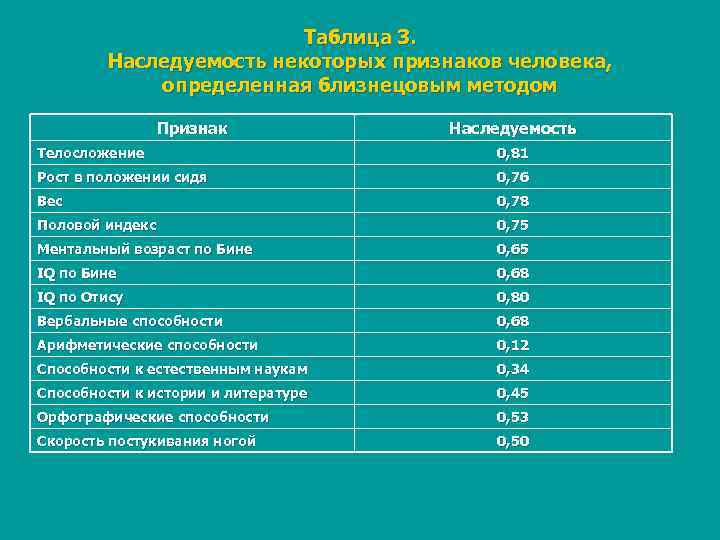
 Таблица 3. Наследуемость некоторых признаков человека, определенная близнецовым методом Признак Наследуемость Телосложение 0, 81 Рост в положении сидя 0, 76 Вес 0, 78 Половой индекс 0, 75 Ментальный возраст по Бине 0, 65 IQ по Бине 0, 68 IQ по Отису 0, 80 Вербальные способности 0, 68 Арифметические способности 0, 12 Способности к естественным наукам 0, 34 Способности к истории и литературе 0, 45 Орфографические способности 0, 53 Скорость постукивания ногой 0, 50
Таблица 3. Наследуемость некоторых признаков человека, определенная близнецовым методом Признак Наследуемость Телосложение 0, 81 Рост в положении сидя 0, 76 Вес 0, 78 Половой индекс 0, 75 Ментальный возраст по Бине 0, 65 IQ по Бине 0, 68 IQ по Отису 0, 80 Вербальные способности 0, 68 Арифметические способности 0, 12 Способности к естественным наукам 0, 34 Способности к истории и литературе 0, 45 Орфографические способности 0, 53 Скорость постукивания ногой 0, 50
 n. Рассмотрим несколько примеров: 1. Группы крови у человека полностью обусловлены генотипом и не изменяются под влиянием среды. Коэффициент наследуемости равен 100 %. 2. По некоторым морфологическим признакам (форме носа, бровей, губ и ушей, цвету глаз, волос и кожи) монозиготные близнецы конкордантны в 97 100 %, а дизиготные в зависимости от признака — в 70 20 % случаев. 3. Конкордантность МБ по заболеваемости шизофренией равна 70 %, а у ДБ 13%. Тогда: Н = (70 13) / (100 13) = 0, 65, или 65 %. В данном случае преобладают генетические факторы, но существенную роль играют и условия среды.
n. Рассмотрим несколько примеров: 1. Группы крови у человека полностью обусловлены генотипом и не изменяются под влиянием среды. Коэффициент наследуемости равен 100 %. 2. По некоторым морфологическим признакам (форме носа, бровей, губ и ушей, цвету глаз, волос и кожи) монозиготные близнецы конкордантны в 97 100 %, а дизиготные в зависимости от признака — в 70 20 % случаев. 3. Конкордантность МБ по заболеваемости шизофренией равна 70 %, а у ДБ 13%. Тогда: Н = (70 13) / (100 13) = 0, 65, или 65 %. В данном случае преобладают генетические факторы, но существенную роль играют и условия среды.
 ГЕНЕТИКА АЛКОГОЛИЗМА n. Алкоголизм определяемся как зависимость от алкоголя, которая приводит к потере трудоспособности. Превратится или нет пьющий человек в алкоголика во многом зависит от окружающей среды. Специальные исследования показывают, что в склонности к алкоголизму имеются индивидуальные различия, которые могут быть обусловлены генотипом. В экспериментах с мышами (см. ниже) было показано, что между генетически разными линиями существуют различия в предпочтении алкоголя. Для выяснения вопроса о существовании наследственной составляющей склонности к алкоголю у человека использовались близнецовый метод изучения приёмных детей. Эти исследования показали, что риск стать алкоголика ми у детей отца алкоголика равен 26% (при средней распространённости в популяции 2 4%), у детей матери алкоголика всего 2%. Частота алкоголизма среди братьев алкоголика 21%, среди братьев женщины алкоголика всего 1%. Т. е. , в семьях алкоголиков мужчин вероятность того, что другие родственники мужчины тоже станут алкоголиками очень велика. n Метод изучения усыновлённых детей использовался в следующих вариантах: n 1) сравнение генетически неродственных детей, живущих вместе (для тестирования средовых влияний); n 2) сравнение сибсов, выросших в разных условиях (для выяснения роли генотипа). n В одном исследовании, проведённом в 1973 году, изучалась судьба 55 усынов лённых мальчиков, у которых биологический родитель (отец) был алкоголиком. В возрасте 6 недель эти дети были усыновлены неродственными им людьми и больше не имели контакта с родителями. В момент обследования их возраст был равен 30 годам. Восемнадцать процентов из них уже стали алкоголиками. В контрольной группе усыновлённых детей того же возраста, воспитывавшихся в таких же по социальному статусу семьях, но не имевших отцов алкоголи ков, алкоголиками стали лишь 5% мужчин.
ГЕНЕТИКА АЛКОГОЛИЗМА n. Алкоголизм определяемся как зависимость от алкоголя, которая приводит к потере трудоспособности. Превратится или нет пьющий человек в алкоголика во многом зависит от окружающей среды. Специальные исследования показывают, что в склонности к алкоголизму имеются индивидуальные различия, которые могут быть обусловлены генотипом. В экспериментах с мышами (см. ниже) было показано, что между генетически разными линиями существуют различия в предпочтении алкоголя. Для выяснения вопроса о существовании наследственной составляющей склонности к алкоголю у человека использовались близнецовый метод изучения приёмных детей. Эти исследования показали, что риск стать алкоголика ми у детей отца алкоголика равен 26% (при средней распространённости в популяции 2 4%), у детей матери алкоголика всего 2%. Частота алкоголизма среди братьев алкоголика 21%, среди братьев женщины алкоголика всего 1%. Т. е. , в семьях алкоголиков мужчин вероятность того, что другие родственники мужчины тоже станут алкоголиками очень велика. n Метод изучения усыновлённых детей использовался в следующих вариантах: n 1) сравнение генетически неродственных детей, живущих вместе (для тестирования средовых влияний); n 2) сравнение сибсов, выросших в разных условиях (для выяснения роли генотипа). n В одном исследовании, проведённом в 1973 году, изучалась судьба 55 усынов лённых мальчиков, у которых биологический родитель (отец) был алкоголиком. В возрасте 6 недель эти дети были усыновлены неродственными им людьми и больше не имели контакта с родителями. В момент обследования их возраст был равен 30 годам. Восемнадцать процентов из них уже стали алкоголиками. В контрольной группе усыновлённых детей того же возраста, воспитывавшихся в таких же по социальному статусу семьях, но не имевших отцов алкоголи ков, алкоголиками стали лишь 5% мужчин.
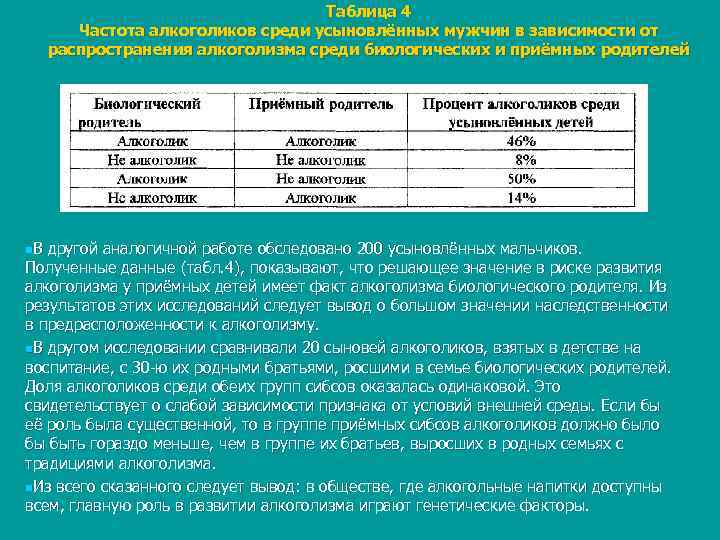
 Таблица 4 Частота алкоголиков среди усыновлённых мужчин в зависимости от распространения алкоголизма среди биологических и приёмных родителей n. В другой аналогичной работе обследовано 200 усыновлённых мальчиков. Полученные данные (табл. 4), показывают, что решающее значение в риске развития алкоголизма у приёмных детей имеет факт алкоголизма биологического родителя. Из результатов этих исследований следует вывод о большом значении наследственности в предрасположенности к алкоголизму. n. В другом исследовании сравнивали 20 сыновей алкоголиков, взятых в детстве на воспитание, с 30 ю их родными братьями, росшими в семье биологических родителей. Доля алкоголиков среди обеих групп сибсов оказалась одинаковой. Это свидетельствует о слабой зависимости признака от условий внешней среды. Если бы её роль была существенной, то в группе приёмных сибсов алкоголиков должно было бы быть гораздо меньше, чем в группе их братьев, выросших в родных семьях с традициями алкоголизма. n. Из всего сказанного следует вывод: в обществе, где алкогольные напитки доступны всем, главную роль в развитии алкоголизма играют генетические факторы.
Таблица 4 Частота алкоголиков среди усыновлённых мужчин в зависимости от распространения алкоголизма среди биологических и приёмных родителей n. В другой аналогичной работе обследовано 200 усыновлённых мальчиков. Полученные данные (табл. 4), показывают, что решающее значение в риске развития алкоголизма у приёмных детей имеет факт алкоголизма биологического родителя. Из результатов этих исследований следует вывод о большом значении наследственности в предрасположенности к алкоголизму. n. В другом исследовании сравнивали 20 сыновей алкоголиков, взятых в детстве на воспитание, с 30 ю их родными братьями, росшими в семье биологических родителей. Доля алкоголиков среди обеих групп сибсов оказалась одинаковой. Это свидетельствует о слабой зависимости признака от условий внешней среды. Если бы её роль была существенной, то в группе приёмных сибсов алкоголиков должно было бы быть гораздо меньше, чем в группе их братьев, выросших в родных семьях с традициями алкоголизма. n. Из всего сказанного следует вывод: в обществе, где алкогольные напитки доступны всем, главную роль в развитии алкоголизма играют генетические факторы.
 n. Если существует генетическая обусловленность алкоголизма, то каков механизм её реализации? Ответ нужно искать на двух уровнях биохимическом (изучая метаболизм алкоголя в организме) и физиологическом (на уровне работы мозга). Биохимические механизмы предрасположенности к алкоголю n. В организме человека алкоголь расщепляется с участием нескольких ферментов, активность которых зависит от строения их молекул, которое, в свою очередь, определяется соответствующими генами. Наиболее важные этапы окисления этанола изображены на следующей схеме:
n. Если существует генетическая обусловленность алкоголизма, то каков механизм её реализации? Ответ нужно искать на двух уровнях биохимическом (изучая метаболизм алкоголя в организме) и физиологическом (на уровне работы мозга). Биохимические механизмы предрасположенности к алкоголю n. В организме человека алкоголь расщепляется с участием нескольких ферментов, активность которых зависит от строения их молекул, которое, в свою очередь, определяется соответствующими генами. Наиболее важные этапы окисления этанола изображены на следующей схеме:
 n Ключевые ферменты, катализирующие эти этапы – алкогольдегидрогеназа (АДГ) и альдегидрогеназа (Ал. ДГ). n С помощью метода электрофореза установлено, что у человека имеется три разных аутосомных гена АДГ: АДГ 1 , АДГ 2 и АДГ 3. Гены АДГ 1 и АДГ 3 активны, преимущественно, во внутриутробном периоде, АДГ 2 у взрослых. Фермент АДГ 2 работает в тканях печени и почек. У 5 20 % европейцев и у 90 °/о японцев вырабатывается сверхактивный вариант этого фермента (изофермент). У обладателей этого варианта фермента (а, следовательно, аллеля гена АДГ 2) превращение этанола в ацетальдегид происходит очень быстро. Резкое увеличение концентрации ацетальдегида в крови оказывает на употребившего алкоголь человека дискомфортное воздействие: резко расширяются периферические кровеносные сосуды (лицо «вспыхивает» ), возрастает частота пульса, подскакивает давление. Замечено, что многие жители Восточной Азии именно так реагируют на алкоголь.
n Ключевые ферменты, катализирующие эти этапы – алкогольдегидрогеназа (АДГ) и альдегидрогеназа (Ал. ДГ). n С помощью метода электрофореза установлено, что у человека имеется три разных аутосомных гена АДГ: АДГ 1 , АДГ 2 и АДГ 3. Гены АДГ 1 и АДГ 3 активны, преимущественно, во внутриутробном периоде, АДГ 2 у взрослых. Фермент АДГ 2 работает в тканях печени и почек. У 5 20 % европейцев и у 90 °/о японцев вырабатывается сверхактивный вариант этого фермента (изофермент). У обладателей этого варианта фермента (а, следовательно, аллеля гена АДГ 2) превращение этанола в ацетальдегид происходит очень быстро. Резкое увеличение концентрации ацетальдегида в крови оказывает на употребившего алкоголь человека дискомфортное воздействие: резко расширяются периферические кровеносные сосуды (лицо «вспыхивает» ), возрастает частота пульса, подскакивает давление. Замечено, что многие жители Восточной Азии именно так реагируют на алкоголь.
 n Аналогичный физиологический эффект можно вызвать у носителей обычного среди европейцев аллеля АДГ 2 , если вместе с алкоголем дать им препарат дисульфирам. Но биохимическая причина этого эффекта иная. Дисульфирам тормозит работу другого фермента Ал. ДГ, что также ведёт к накоплению в организме ацетальдегида. Ген этого фермента также имеет, по крайней мере, два аллеля, которые определяют синтез разных по активности вариантов фермента. В европейской популяции преобладает аллель более активного варианта фермента Ал. ДГ. В восточно азиатской популяции частота этого аллеля составляет 50 %, а другая доля приходится на аллель менее активного варианта фермента. Понятно, что у гомозигот по такому аллелю принятие алкоголя приводит к накоплению ацетальдегида с большей скоростью, чем у носителей «европейского» аллеля. Очевидно, что сочетание в генотипе обоих «азиатских» аллелей приводит к образованию высокоэффективного фермента АДГ 2 и низкоэффективного Ал. ДГ. Люди с таким генотипом не в состоянии употреблять алкоголь и не могут стать алкоголиками.
n Аналогичный физиологический эффект можно вызвать у носителей обычного среди европейцев аллеля АДГ 2 , если вместе с алкоголем дать им препарат дисульфирам. Но биохимическая причина этого эффекта иная. Дисульфирам тормозит работу другого фермента Ал. ДГ, что также ведёт к накоплению в организме ацетальдегида. Ген этого фермента также имеет, по крайней мере, два аллеля, которые определяют синтез разных по активности вариантов фермента. В европейской популяции преобладает аллель более активного варианта фермента Ал. ДГ. В восточно азиатской популяции частота этого аллеля составляет 50 %, а другая доля приходится на аллель менее активного варианта фермента. Понятно, что у гомозигот по такому аллелю принятие алкоголя приводит к накоплению ацетальдегида с большей скоростью, чем у носителей «европейского» аллеля. Очевидно, что сочетание в генотипе обоих «азиатских» аллелей приводит к образованию высокоэффективного фермента АДГ 2 и низкоэффективного Ал. ДГ. Люди с таким генотипом не в состоянии употреблять алкоголь и не могут стать алкоголиками.
 4. Цитогенетический метод n. Основа метода микроскопическое изучение хромосом человека. n. Цитогенетические исследования стали широко использоваться с начала 20 х гг. XX в. для изучения морфологии хромосом человека, подсчета хромосом, культивирования лейкоцитов для получения метафазных пластинок. n. Развитие современной цитогенетики человека связано с именами цитологов Д. Тио и А. Левана. В 1956 г. они установили, что у человека 46 (а не 48, как думали раньше) хромосом (рис. 6), что положило начало широкому изучению митотических и мейотических хромосом человека. n. В 1959 г. французские ученые Д. Лежен, Р. Тюрпен и М. Готье установили хромосомную природу болезни Дауна. В последующие годы были описаны многие другие хромосомные синдромы, часто встречающиеся у человека. Цитогенетика стала важнейшим разделом практической медицины. В настоящее время цитогенетический метод применяется для диагностики хромосомных болезней, составления генетических карт хромосом, изучения мутационного процесса и других проблем генетики человека.
4. Цитогенетический метод n. Основа метода микроскопическое изучение хромосом человека. n. Цитогенетические исследования стали широко использоваться с начала 20 х гг. XX в. для изучения морфологии хромосом человека, подсчета хромосом, культивирования лейкоцитов для получения метафазных пластинок. n. Развитие современной цитогенетики человека связано с именами цитологов Д. Тио и А. Левана. В 1956 г. они установили, что у человека 46 (а не 48, как думали раньше) хромосом (рис. 6), что положило начало широкому изучению митотических и мейотических хромосом человека. n. В 1959 г. французские ученые Д. Лежен, Р. Тюрпен и М. Готье установили хромосомную природу болезни Дауна. В последующие годы были описаны многие другие хромосомные синдромы, часто встречающиеся у человека. Цитогенетика стала важнейшим разделом практической медицины. В настоящее время цитогенетический метод применяется для диагностики хромосомных болезней, составления генетических карт хромосом, изучения мутационного процесса и других проблем генетики человека.
 Рис. 6. Метафазная пластинка культивируемых in vitro фибробластов лёгкого эмбриона человека. Фото из первого сообщения, в котором констатировалось наличие в клетках человека 46 хромосом.
Рис. 6. Метафазная пластинка культивируемых in vitro фибробластов лёгкого эмбриона человека. Фото из первого сообщения, в котором констатировалось наличие в клетках человека 46 хромосом.
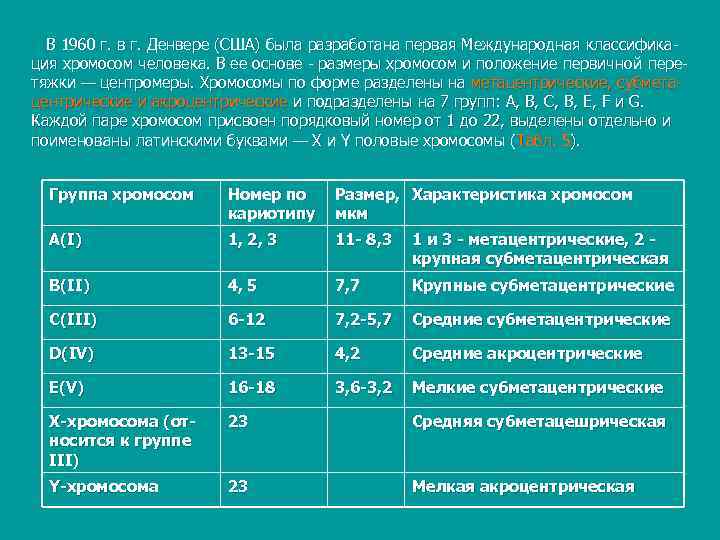
 В 1960 г. в г. Денвере (США) была разработана первая Международная классифика ция хромосом человека. В ее основе размеры хромосом и положение первичной пере тяжки — центромеры. Хромосомы по форме разделены на метацентрические, субмета центрические и акроцентрические и подразделены на 7 групп: А, В, С, В, Е, F и G. Каждой паре хромосом присвоен порядковый номер от 1 до 22, выделены отдельно и поименованы латинскими буквами — X и Y половые хромосомы ( Табл. 5). Группа хромосом Номер по Размер, Характеристика хромосом кариотипу мкм А(I) 1, 2, 3 11 - 8, 3 1 и 3 - метацентрические, 2 - крупная субметацентрическая В(II) 4, 5 7, 7 Крупные субметацентрические С(III) 6 -12 7, 2 -5, 7 Средние субметацентрические D(IV) 13 -15 4, 2 Средние акроцентрические E(V) 16 -18 3, 6 -3, 2 Мелкие субметацентрические Х-хромосома (от- 23 Средняя субметацешрическая носится к группе III) Y-хромосома 23 Мелкая акроцентрическая
В 1960 г. в г. Денвере (США) была разработана первая Международная классифика ция хромосом человека. В ее основе размеры хромосом и положение первичной пере тяжки — центромеры. Хромосомы по форме разделены на метацентрические, субмета центрические и акроцентрические и подразделены на 7 групп: А, В, С, В, Е, F и G. Каждой паре хромосом присвоен порядковый номер от 1 до 22, выделены отдельно и поименованы латинскими буквами — X и Y половые хромосомы ( Табл. 5). Группа хромосом Номер по Размер, Характеристика хромосом кариотипу мкм А(I) 1, 2, 3 11 - 8, 3 1 и 3 - метацентрические, 2 - крупная субметацентрическая В(II) 4, 5 7, 7 Крупные субметацентрические С(III) 6 -12 7, 2 -5, 7 Средние субметацентрические D(IV) 13 -15 4, 2 Средние акроцентрические E(V) 16 -18 3, 6 -3, 2 Мелкие субметацентрические Х-хромосома (от- 23 Средняя субметацешрическая носится к группе III) Y-хромосома 23 Мелкая акроцентрическая
 n 1971 г. на IV Парижской конференции генетиков в были представлены методы дифференциальной окраски хромосом, благодаря которым каждая хромосома приобретает свой неповторимый Рис. 7. Сравнение реальной сегментации со рисунок, что помогает точной схематическим изображением сегментов первой хромосомы. идентификации (рис. 7 и 8). Основные сведения о морфологии хромосом человека получены при изучении их в метафазах митоза и профазе-метафазе мейоза. При этом важно, чтобы количество делящихся клеток, было достаточно высоко. Важнейшие цитогенетические работы выполнены на лимфоцитах периферической крови, поскольку культивирование лимфоцитов в течение 2 -3 суток в присутствии фитогемагглютинина позволяет получить множество метафазных пластинок для хромосомного анализа. Рис. 8. Схема хромосом.
n 1971 г. на IV Парижской конференции генетиков в были представлены методы дифференциальной окраски хромосом, благодаря которым каждая хромосома приобретает свой неповторимый Рис. 7. Сравнение реальной сегментации со рисунок, что помогает точной схематическим изображением сегментов первой хромосомы. идентификации (рис. 7 и 8). Основные сведения о морфологии хромосом человека получены при изучении их в метафазах митоза и профазе-метафазе мейоза. При этом важно, чтобы количество делящихся клеток, было достаточно высоко. Важнейшие цитогенетические работы выполнены на лимфоцитах периферической крови, поскольку культивирование лимфоцитов в течение 2 -3 суток в присутствии фитогемагглютинина позволяет получить множество метафазных пластинок для хромосомного анализа. Рис. 8. Схема хромосом.
 n Цитогенетическому анализу подвергают однослойные метафазные пластинки с раздельно лежащими хромосомами (рис. 6). Для этого делящиеся клетки обрабатывают колхицином и некоторыми другими химическими веществами (гипотоническим раствором солей, метанол уксусным фиксатором и др. ). n. Важным этапом цитогенетического анализа является окраска полученных препаратов. Ее проводят простыми, дифференциальными и флюоресцентными методами. n. Простая (или сплошная)окраска обеспечивает групповую идентификацию хромосом. Используется она для количественного учета хромосомных аномалий при определении мутагенности среды (действия радиации, химических мутагенов и др. ). С помощью этого типа окраски были открыты многие хромосомные болезни, а также хромосомные аберрации), вызывающие самопроизвольные аборты, врожденные пороки развития, канцерогенез и т. п.
n Цитогенетическому анализу подвергают однослойные метафазные пластинки с раздельно лежащими хромосомами (рис. 6). Для этого делящиеся клетки обрабатывают колхицином и некоторыми другими химическими веществами (гипотоническим раствором солей, метанол уксусным фиксатором и др. ). n. Важным этапом цитогенетического анализа является окраска полученных препаратов. Ее проводят простыми, дифференциальными и флюоресцентными методами. n. Простая (или сплошная)окраска обеспечивает групповую идентификацию хромосом. Используется она для количественного учета хромосомных аномалий при определении мутагенности среды (действия радиации, химических мутагенов и др. ). С помощью этого типа окраски были открыты многие хромосомные болезни, а также хромосомные аберрации), вызывающие самопроизвольные аборты, врожденные пороки развития, канцерогенез и т. п.
 n В 70 е гг. XX в. были разработаны методы дифференциального окрашивания, выявляющие структурную разнородность хромосом по длине (рис. 7 и 8), что выражается в виде чередования светлых и темных полос. Рисунок полос специфичен для каждой хромосомы. n Первоначально использовали акрихин иприт — флюоресцентное алкилирующее вещество (Q метод). Действие его основано на способности метафазных хромосом дифференциально связывать флюорохромы. После окрашивания акрихин ипритом сегменты приобретают яркое флюоресцирующее свечение. Для просмотра таких препаратов используют люминесцентный микроскоп. n В дальнейшем был разработан способ окраски хромосом без флюоресцентных красителей. Это — G окраска (краситель Гимза). После инкубации в солевом растворе хромосомы обрабатываются протеазой. В результате они приобретают сегментированный вид благодаря чередованию темно и светлоокрашенных участков. n Механизм образования сегментов пока недостаточно ясен. Предполагается, что окрашенные сегменты — это гетерохроматиновые участки с повторяющимися последовательностями ДНК, а неокрашенные — эухроматиновые районы с кодирующими последовательностями ДНК.
n В 70 е гг. XX в. были разработаны методы дифференциального окрашивания, выявляющие структурную разнородность хромосом по длине (рис. 7 и 8), что выражается в виде чередования светлых и темных полос. Рисунок полос специфичен для каждой хромосомы. n Первоначально использовали акрихин иприт — флюоресцентное алкилирующее вещество (Q метод). Действие его основано на способности метафазных хромосом дифференциально связывать флюорохромы. После окрашивания акрихин ипритом сегменты приобретают яркое флюоресцирующее свечение. Для просмотра таких препаратов используют люминесцентный микроскоп. n В дальнейшем был разработан способ окраски хромосом без флюоресцентных красителей. Это — G окраска (краситель Гимза). После инкубации в солевом растворе хромосомы обрабатываются протеазой. В результате они приобретают сегментированный вид благодаря чередованию темно и светлоокрашенных участков. n Механизм образования сегментов пока недостаточно ясен. Предполагается, что окрашенные сегменты — это гетерохроматиновые участки с повторяющимися последовательностями ДНК, а неокрашенные — эухроматиновые районы с кодирующими последовательностями ДНК.
 Метод FISH Из новых методов цитогенетики следует отметить метод флюоресцентной гибридизации in situ (FISH), который позволяет исследовать широкий круг вопросов: от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Метод FISH может применяться и для диагностики анеуплоидий в интерфазных ядрах. В основе метода лежит флуоресцентная гибридизация нуклеиновых кислот in situ (fluorescent in silu hybridisation — FISH) с новыми более эффективными флуорохромами. Для анализа микроскопических изображений используются цифровые фотоаппараты, соединенные с микроскопом и компьютером (CCD камеры) вместо фотокамер. Одним из наиболее разрешающих методов является многоцветная гибридизация in situ.
Метод FISH Из новых методов цитогенетики следует отметить метод флюоресцентной гибридизации in situ (FISH), который позволяет исследовать широкий круг вопросов: от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Метод FISH может применяться и для диагностики анеуплоидий в интерфазных ядрах. В основе метода лежит флуоресцентная гибридизация нуклеиновых кислот in situ (fluorescent in silu hybridisation — FISH) с новыми более эффективными флуорохромами. Для анализа микроскопических изображений используются цифровые фотоаппараты, соединенные с микроскопом и компьютером (CCD камеры) вместо фотокамер. Одним из наиболее разрешающих методов является многоцветная гибридизация in situ.
 Для получения многоцветных изображений используют разные флуорохромы, которыми метят разные зонды ДНК. Информация об интенсивности свечения каждого из флуорохромов записывается в компьютере отдельно, и каждому из таких изображений присваивается свой собственный псевдоцвет. Одновременное использование нескольких флуорохромов позволяет получить значительно большее число псевдоцветов. Например, если фрагмент хромосомы, окрашенный флуорохромом а, будет давать один псевдоцвет, Рис. 9. 24 -цветная FISH-окраска фрагмент, окрашенный хромосом человека: флуорохромом b, — другой, то фрагмент, окрашенный a и b а — метафазная пластинка, на которой каждая одновременно, будет давать хромосома окрашена в свой псевдоцвет; третий псевдоцвет (рис. 9 и 10). 6 - наличие зелёного и красного псевдоцветов в 8 -й и 11 -й хромосомах свидетельствует о транслокации между ними
Для получения многоцветных изображений используют разные флуорохромы, которыми метят разные зонды ДНК. Информация об интенсивности свечения каждого из флуорохромов записывается в компьютере отдельно, и каждому из таких изображений присваивается свой собственный псевдоцвет. Одновременное использование нескольких флуорохромов позволяет получить значительно большее число псевдоцветов. Например, если фрагмент хромосомы, окрашенный флуорохромом а, будет давать один псевдоцвет, Рис. 9. 24 -цветная FISH-окраска фрагмент, окрашенный хромосом человека: флуорохромом b, — другой, то фрагмент, окрашенный a и b а — метафазная пластинка, на которой каждая одновременно, будет давать хромосома окрашена в свой псевдоцвет; третий псевдоцвет (рис. 9 и 10). 6 - наличие зелёного и красного псевдоцветов в 8 -й и 11 -й хромосомах свидетельствует о транслокации между ними
 n. В дополнение к этим двум флуо рохромам обычно используют третий — для общей окраски хромосом. Использование n флуорохромов позволяет одновременно определять локализацию 2 n 1 фрагментов ДНК. Применение пяти флуорохромов дает возможность анализировать результаты одновременной гибри дизации in situ 31 фрагмента ДНК. n. Дли мечения каждой хромосомы своим цветом ДНК этой хромосомы собирают микроманипулятором с препарата, амплифицируют с помощью полимеразной цепной реакции и метят комбинацией из Рис. 10. Многоцветная исчер- трех флуорохромом. Аналогичную ченность пятой хромосомы операцию проводят с другими человека. хромосомами, в результате чего каждая хромосома кариотипа Слева «раскрашенная» 22 полосами приобретает свой собственный методом FISH, рядом хромосома, псевдоцвет (рис. 9). Окраска окрашенная G окраской. хромосомы более чем одним цветом свидетельствует о наличии транслокации (рис. 9, б).
n. В дополнение к этим двум флуо рохромам обычно используют третий — для общей окраски хромосом. Использование n флуорохромов позволяет одновременно определять локализацию 2 n 1 фрагментов ДНК. Применение пяти флуорохромов дает возможность анализировать результаты одновременной гибри дизации in situ 31 фрагмента ДНК. n. Дли мечения каждой хромосомы своим цветом ДНК этой хромосомы собирают микроманипулятором с препарата, амплифицируют с помощью полимеразной цепной реакции и метят комбинацией из Рис. 10. Многоцветная исчер- трех флуорохромом. Аналогичную ченность пятой хромосомы операцию проводят с другими человека. хромосомами, в результате чего каждая хромосома кариотипа Слева «раскрашенная» 22 полосами приобретает свой собственный методом FISH, рядом хромосома, псевдоцвет (рис. 9). Окраска окрашенная G окраской. хромосомы более чем одним цветом свидетельствует о наличии транслокации (рис. 9, б).
 Таким образом, соединение цитогене тических и молекулярно генетических методов в генетике человека делает почти неограниченными возможности диагностики хромосомных аномалий.
Таким образом, соединение цитогене тических и молекулярно генетических методов в генетике человека делает почти неограниченными возможности диагностики хромосомных аномалий.
 5. Биохимические методы n. Причиной многих нарушений метабо лизма являются дефекты ферментов, возникающие вследствие мутаций генов (рис. 11). Биохимические показатели (первичные продукты гена, накопление патологиче ских метаболитов внутри клетки и в кле точных жидкостях) более точно отража ют сущность болезни по сравнению с показателями клиническими, поэтому их значение в диагностике наследственных болезней постоянно возрастает. n. Предмет биохимической диагнос- Рис. 11. Наследственные нарушения тики - специфические для данной метаболических путей некоторых болезни метаболиты, энзимопатии, ароматических аминокислот. различные белки. Указаны генетические дефекты, n. Объекты биохимического анализа вызывающие фенилкетонурию, - моча, пот, плазма и сыворотка альбинизм, алкаптонурию, тирози- крови, форменные элементы кро- ноз и три типа наследственного ви, культуры клеток (фибробласты, кретинизма. лимфоциты).
5. Биохимические методы n. Причиной многих нарушений метабо лизма являются дефекты ферментов, возникающие вследствие мутаций генов (рис. 11). Биохимические показатели (первичные продукты гена, накопление патологиче ских метаболитов внутри клетки и в кле точных жидкостях) более точно отража ют сущность болезни по сравнению с показателями клиническими, поэтому их значение в диагностике наследственных болезней постоянно возрастает. n. Предмет биохимической диагнос- Рис. 11. Наследственные нарушения тики - специфические для данной метаболических путей некоторых болезни метаболиты, энзимопатии, ароматических аминокислот. различные белки. Указаны генетические дефекты, n. Объекты биохимического анализа вызывающие фенилкетонурию, - моча, пот, плазма и сыворотка альбинизм, алкаптонурию, тирози- крови, форменные элементы кро- ноз и три типа наследственного ви, культуры клеток (фибробласты, кретинизма. лимфоциты).
 Современные биохимические методы (электрофорез, хроматография, спектроскопия) позволяют определять любые метаболиты, специфические для конкретной наследственной болезни. Установлено, что частота фенилкетонурии в разных странах варьирует от 1: 6000 до 1: 20000. Возможность успешного лечения фенилкетонурии в раннем детстве, до появления клинических симптомов, привела к мысли о необходимости обследования новорожденных. В большинстве высокоразвитых стран такое обследование уже проводится. Как правило, для этого используется тест Гатри, основанный использовании штамма бактерий Bacillus suhlilis нуждающихся в фенилаланине. Бактерии растут на капле крови только в том случае, если она содержит фенилаланин в достаточно высокой концентрации. Только кровь младенцев с высоким уровнем фенилаланина сможет обеспечить рост этих бактерий (рис. 12). Для биохимической диагностики используются как простые качественные реакции (например, хлорид железа для выявления фенилкетонурии или динитрофенилгидразин для выявления кетокислот), так и более точные методы.
Современные биохимические методы (электрофорез, хроматография, спектроскопия) позволяют определять любые метаболиты, специфические для конкретной наследственной болезни. Установлено, что частота фенилкетонурии в разных странах варьирует от 1: 6000 до 1: 20000. Возможность успешного лечения фенилкетонурии в раннем детстве, до появления клинических симптомов, привела к мысли о необходимости обследования новорожденных. В большинстве высокоразвитых стран такое обследование уже проводится. Как правило, для этого используется тест Гатри, основанный использовании штамма бактерий Bacillus suhlilis нуждающихся в фенилаланине. Бактерии растут на капле крови только в том случае, если она содержит фенилаланин в достаточно высокой концентрации. Только кровь младенцев с высоким уровнем фенилаланина сможет обеспечить рост этих бактерий (рис. 12). Для биохимической диагностики используются как простые качественные реакции (например, хлорид железа для выявления фенилкетонурии или динитрофенилгидразин для выявления кетокислот), так и более точные методы.
 Например, с помощью тонкослойной хроматографии мочи и крови можно диагностировать нарушение обмена аминокислот, олигосахаридов, мукополисахаридов. Газовая хроматография применяется для выявления нарушений обмена органических кислот. Рис. 12. Клетки штамма Bacillus subtilis, Показаниями для использования нуждающиеся в фенилаланине, инкубиру- биохимических методов являются ют на поверхности агара. Рост происходит такие симптомы, как судороги, кома, только тогда, когда в тестируемой пробе крови повышен уровень фенилаланина. В рвота, желтуха, специфический этом случае вокруг капли крови заметен запах мочи и пота, остановка роста, бактериальный рост. Диаметр зоны роста нарушение физического развития, прямо пропорционален концентрации фенилаланина в крови. непереносимость некоторых А. Точки со стандартными концентрациями продуктов и лекарств. фенилаланина, которые возрастают слева направо. Б. Пробы крови здоровых людей. В. Образцы крови с повышенным содержа- нием фенилаланина (от 6 до 12 мг%).
Например, с помощью тонкослойной хроматографии мочи и крови можно диагностировать нарушение обмена аминокислот, олигосахаридов, мукополисахаридов. Газовая хроматография применяется для выявления нарушений обмена органических кислот. Рис. 12. Клетки штамма Bacillus subtilis, Показаниями для использования нуждающиеся в фенилаланине, инкубиру- биохимических методов являются ют на поверхности агара. Рост происходит такие симптомы, как судороги, кома, только тогда, когда в тестируемой пробе крови повышен уровень фенилаланина. В рвота, желтуха, специфический этом случае вокруг капли крови заметен запах мочи и пота, остановка роста, бактериальный рост. Диаметр зоны роста нарушение физического развития, прямо пропорционален концентрации фенилаланина в крови. непереносимость некоторых А. Точки со стандартными концентрациями продуктов и лекарств. фенилаланина, которые возрастают слева направо. Б. Пробы крови здоровых людей. В. Образцы крови с повышенным содержа- нием фенилаланина (от 6 до 12 мг%).
 Биохимические методы применяются и для выявления гетерозиготных состояний у взрослых. Внешне здоровые люди являются носителями патологических генов (гетерозиготы). Например, что около 8% негритянскою населения США гетерозиготны по гену серповидноклеточной анемии и около 3 4% евреев ашкенази являются гетерозиготами по гену болезни Тея Сакса. Наиболее распространенным (1: 2000) рецессивным заболеванием в Северной и Центральной Европе следует считать муковисцидоз. Гетерозиготы по нему составтяют 4 5% всей популяции. Их выявление очень желательно, поскольку велика вероятность браков, в которых оба партнера несут ген муковисцидоза в гетерозиготном состоянии (не зная об этом). Потомство таких пар необходимо подвергать внутриутробному обследова нию. К сожалению, основной биохимический дефект при этом заболевании неизвестен. Поиск гетеро зигот и пренатальная диагностика значительно упростились после того, как ген, ответственный за это заболевание, с помощью тесно сцепленного маркерного фрагмента ДНК был лока лизован в 7 й хромосоме. Шансы рождения больных детей резко возрастают, если в брак вступают родственники, т. к. они могут унаследовать один и тот же рецессивный ген от своего общего предка. Если в брак вступают гетерозиготные носители какого либо заболевания, то риск рождения больного ребенка в такой семье составит 25%.
Биохимические методы применяются и для выявления гетерозиготных состояний у взрослых. Внешне здоровые люди являются носителями патологических генов (гетерозиготы). Например, что около 8% негритянскою населения США гетерозиготны по гену серповидноклеточной анемии и около 3 4% евреев ашкенази являются гетерозиготами по гену болезни Тея Сакса. Наиболее распространенным (1: 2000) рецессивным заболеванием в Северной и Центральной Европе следует считать муковисцидоз. Гетерозиготы по нему составтяют 4 5% всей популяции. Их выявление очень желательно, поскольку велика вероятность браков, в которых оба партнера несут ген муковисцидоза в гетерозиготном состоянии (не зная об этом). Потомство таких пар необходимо подвергать внутриутробному обследова нию. К сожалению, основной биохимический дефект при этом заболевании неизвестен. Поиск гетеро зигот и пренатальная диагностика значительно упростились после того, как ген, ответственный за это заболевание, с помощью тесно сцепленного маркерного фрагмента ДНК был лока лизован в 7 й хромосоме. Шансы рождения больных детей резко возрастают, если в брак вступают родственники, т. к. они могут унаследовать один и тот же рецессивный ген от своего общего предка. Если в брак вступают гетерозиготные носители какого либо заболевания, то риск рождения больного ребенка в такой семье составит 25%.
 n. Выявление гетерозиготного носительства — важная задача медицинской генетики. Предположить гетерозиготное носительство можно, если: nодин из родителей пациента поражен наследственной болезнью; nуже рождался больной ребёнок; nженщина имеет больного брата или сестру; nу двух дочерей женщины родились больные сыновья (или сын); Выявление гетерозиготных носителей того или иного заболевания возможно путем использования биохимических тестов (прием фенилаланина для выяв ления фенилкетонурии, сахара — для сахарного диабета и. т. д. ), микроскопи ческого исследования клеток крови и тканей, определения активности фермента, измененного в результате мутации. Так, гетерозиготные носители фенилкетонурии реагируют на введение фенилаланина более сильным повышением содержания аминокислоты в плазме, чем нормальные гомозиготы (болезнь обусловлена рецессивным аллелем). Биохимический метод широко применяется в медико генетическом консультировании для определения риска рождения больного ребенка. Успехи в области биохимической генетики способствуют более широкому внедрению диагностики гетерозиготного носительства в практику. Еще недавно можно было диагностировать не более 10 15 гетерозиготных состояний, в настоящее время — более 200. Однако следует отметить, что до сих пор имеется немало наследственных заболеваний, для которых методы гетерозиготной диагностики еще не разработаны.
n. Выявление гетерозиготного носительства — важная задача медицинской генетики. Предположить гетерозиготное носительство можно, если: nодин из родителей пациента поражен наследственной болезнью; nуже рождался больной ребёнок; nженщина имеет больного брата или сестру; nу двух дочерей женщины родились больные сыновья (или сын); Выявление гетерозиготных носителей того или иного заболевания возможно путем использования биохимических тестов (прием фенилаланина для выяв ления фенилкетонурии, сахара — для сахарного диабета и. т. д. ), микроскопи ческого исследования клеток крови и тканей, определения активности фермента, измененного в результате мутации. Так, гетерозиготные носители фенилкетонурии реагируют на введение фенилаланина более сильным повышением содержания аминокислоты в плазме, чем нормальные гомозиготы (болезнь обусловлена рецессивным аллелем). Биохимический метод широко применяется в медико генетическом консультировании для определения риска рождения больного ребенка. Успехи в области биохимической генетики способствуют более широкому внедрению диагностики гетерозиготного носительства в практику. Еще недавно можно было диагностировать не более 10 15 гетерозиготных состояний, в настоящее время — более 200. Однако следует отметить, что до сих пор имеется немало наследственных заболеваний, для которых методы гетерозиготной диагностики еще не разработаны.
 6. Методы локализации генов в хромосомах Современная генетика человека вступила в тот период развития, когда всё чаще проявляется необходимость в знании локализации гена в геноме в конкретной хромосоме или её участке локусе. Эти знания необходимы для: 1. Ранней диагностики вредных мутаций у развивающегося эмбриона, если его родители входят в группу риска; 2. Выделения «нормальных» генов с целью использования в проектах по созданию генетически модифицированных микроорганизмов для производства лекарственных белковых препаратов; 3. Сравнительного анализа последовательности нуклеотидов в генах некоторых белков человека для точной идентификации личности (в криминалистике, судебных делах по установлению отцовства, некоторых исторических и эволюционных исследованиях).
6. Методы локализации генов в хромосомах Современная генетика человека вступила в тот период развития, когда всё чаще проявляется необходимость в знании локализации гена в геноме в конкретной хромосоме или её участке локусе. Эти знания необходимы для: 1. Ранней диагностики вредных мутаций у развивающегося эмбриона, если его родители входят в группу риска; 2. Выделения «нормальных» генов с целью использования в проектах по созданию генетически модифицированных микроорганизмов для производства лекарственных белковых препаратов; 3. Сравнительного анализа последовательности нуклеотидов в генах некоторых белков человека для точной идентификации личности (в криминалистике, судебных делах по установлению отцовства, некоторых исторических и эволюционных исследованиях).
 1. Гибридизация соматических клеток Один из первых методов определения принадлежности того или иного гена к конкретной хромосоме метод гибридизации соматических клеток человека с соматическими клетками других млекопитающих. Этот метод впервые применили Харрис и Воткинс в 1965 году. Для гибридизации клеток разных видов организмов клетки обрабатывались вирусом Сендай, инактивированным ультрафиолетом. В 1967 г. Вейс и Грин таким способом получили гибридные клетки мыши и человека. Клетки мыши содержали мутацию гена фермента тимидинкиназы и поэтому не могли расти на селективной питательной среде, но росли на стандартной. Клетки же человека, имевшие нормальный ген тимидинкиназы, на селективной среде размножались нормально. Через 14 21 день культивирования на стандартной среде среди челове ческих клеток были обнаружены гибридные колонии, в ядрах которых были все мышиные хромосомы и несколько хромосом человека. Эти колонии были пересажены на селективную питательную среду. Некоторые из них стали расти и на этой среде (следовательно они содержали нормальный ген тимидинкиназы). В разных колониях присутствовали разные человеческие хромосомы, но одна из хромосом (17 я) присутствовала во всех выживших гибоидных клетках. Следовательно, ген фермента находится в 17 й хромосоме.
1. Гибридизация соматических клеток Один из первых методов определения принадлежности того или иного гена к конкретной хромосоме метод гибридизации соматических клеток человека с соматическими клетками других млекопитающих. Этот метод впервые применили Харрис и Воткинс в 1965 году. Для гибридизации клеток разных видов организмов клетки обрабатывались вирусом Сендай, инактивированным ультрафиолетом. В 1967 г. Вейс и Грин таким способом получили гибридные клетки мыши и человека. Клетки мыши содержали мутацию гена фермента тимидинкиназы и поэтому не могли расти на селективной питательной среде, но росли на стандартной. Клетки же человека, имевшие нормальный ген тимидинкиназы, на селективной среде размножались нормально. Через 14 21 день культивирования на стандартной среде среди челове ческих клеток были обнаружены гибридные колонии, в ядрах которых были все мышиные хромосомы и несколько хромосом человека. Эти колонии были пересажены на селективную питательную среду. Некоторые из них стали расти и на этой среде (следовательно они содержали нормальный ген тимидинкиназы). В разных колониях присутствовали разные человеческие хромосомы, но одна из хромосом (17 я) присутствовала во всех выживших гибоидных клетках. Следовательно, ген фермента находится в 17 й хромосоме.
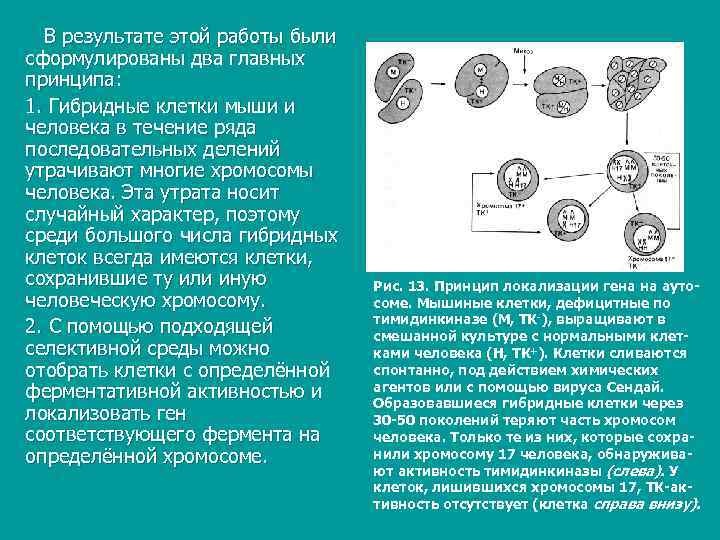
 В результате этой работы были сформулированы два главных принципа: 1. Гибридные клетки мыши и человека в течение ряда последовательных делений утрачивают многие хромосомы человека. Эта утрата носит случайный характер, поэтому среди большого числа гибридных клеток всегда имеются клетки, сохранившие ту или иную Рис. 13. Принцип локализации гена на ауто- человеческую хромосому. соме. Мышиные клетки, дефицитные по тимидинкиназе (М, ТК-), выращивают в 2. С помощью подходящей смешанной культуре с нормальными клет- селективной среды можно ками человека (Н, ТК+). Клетки сливаются отобрать клетки с определённой спонтанно, под действием химических ферментативной активностью и агентов или с помощью вируса Сендай. Образовавшиеся гибридные клетки через локализовать ген 30 -50 поколений теряют часть хромосом соответствующего фермента на человека. Только те из них, которые сохра- определённой хромосоме. нили хромосому 17 человека, обнаружива- ют активность тимидинкиназы (слева). У клеток, лишившихся хромосомы 17, ТК-ак- тивность отсутствует (клетка справа внизу).
В результате этой работы были сформулированы два главных принципа: 1. Гибридные клетки мыши и человека в течение ряда последовательных делений утрачивают многие хромосомы человека. Эта утрата носит случайный характер, поэтому среди большого числа гибридных клеток всегда имеются клетки, сохранившие ту или иную Рис. 13. Принцип локализации гена на ауто- человеческую хромосому. соме. Мышиные клетки, дефицитные по тимидинкиназе (М, ТК-), выращивают в 2. С помощью подходящей смешанной культуре с нормальными клет- селективной среды можно ками человека (Н, ТК+). Клетки сливаются отобрать клетки с определённой спонтанно, под действием химических ферментативной активностью и агентов или с помощью вируса Сендай. Образовавшиеся гибридные клетки через локализовать ген 30 -50 поколений теряют часть хромосом соответствующего фермента на человека. Только те из них, которые сохра- определённой хромосоме. нили хромосому 17 человека, обнаружива- ют активность тимидинкиназы (слева). У клеток, лишившихся хромосомы 17, ТК-ак- тивность отсутствует (клетка справа внизу).
 2. Метод гибридизации нуклеиновых кислот Другой эффективный метод определения местонахождения гена в хромосоме метод гибридизации нуклеиновых кислот. В этом методе используется способность комплементарных цепей нуклеиновых кислот гибридизоваться одна с другой и образовывать двойную спираль. Большинство природных ДНК встречается в виде двухцепочечных молекул. Их устойчивость поддерживается благодаря тому, что пиримидиновое основание цитозин (С) спаривается с пуриновым основанием гуанином (G), в то время как пиримидиновое основание тимин (Т) спаривается с пуриновым основанием аденином (А). Эти комплементарные пары оснований удерживаются водородными связями (тремя в паре G C и двумя в паре А Т), которые относительно легко разрываются, но и быстро восстанавливаются, при этом одноцепочечные фрагменты ДНК, присутствующие в растворе, снова формируют двойную спираль. Для реассоциации не имеет значения происхождение одноцепочечной ДНК, не требуется даже полной комплементарности отдельных цепей. Реассоциация происходит даже тогда, когда какая то часть оснований в каждой цепи не комплементарна (рис. 16).
2. Метод гибридизации нуклеиновых кислот Другой эффективный метод определения местонахождения гена в хромосоме метод гибридизации нуклеиновых кислот. В этом методе используется способность комплементарных цепей нуклеиновых кислот гибридизоваться одна с другой и образовывать двойную спираль. Большинство природных ДНК встречается в виде двухцепочечных молекул. Их устойчивость поддерживается благодаря тому, что пиримидиновое основание цитозин (С) спаривается с пуриновым основанием гуанином (G), в то время как пиримидиновое основание тимин (Т) спаривается с пуриновым основанием аденином (А). Эти комплементарные пары оснований удерживаются водородными связями (тремя в паре G C и двумя в паре А Т), которые относительно легко разрываются, но и быстро восстанавливаются, при этом одноцепочечные фрагменты ДНК, присутствующие в растворе, снова формируют двойную спираль. Для реассоциации не имеет значения происхождение одноцепочечной ДНК, не требуется даже полной комплементарности отдельных цепей. Реассоциация происходит даже тогда, когда какая то часть оснований в каждой цепи не комплементарна (рис. 16).
 Метод гибридизации используют, на пример, для анализа очень протяженного гена. С помощью подходящего зонда из геномной библиотеки ДНК извлекаются все фрагменты гена. Нуклеотидные последовательности этих фрагментов, как правило, длиннее зонда, и их концы перекрываются с другими фрагментами данного гена в этой библиотеке, т. е. по крайней мере частично гибридизуются с ними. Свободные концы этих фрагментов будут гибридизоваться со следующими и т. д. , пока весь структурный ген не будет полностью идентифицирован серией перекрывающихся фрагментов. Именно таким образом был реконструи рован структурный ген фактора сверты вания крови VIII человека, необычно Рис. 16. Принцип гибридизации длинный, состоящий из 180000 пар нуклеотидов. Реконструкцию начинали с нуклеиновых кислот. олигонуклеотидного зонда длиной всего в 36 нуклеотидов, который был синтезирован А - нуклеотидные цепи в на основе аминокислотной растворе; последовательности фрагмента белка фактора VIII, и его комплементарность Б - гибридизация оказалась достаточной для эффективной гибридизации. комплементарных цепей; В - гибридизация при неполной гомологии.
Метод гибридизации используют, на пример, для анализа очень протяженного гена. С помощью подходящего зонда из геномной библиотеки ДНК извлекаются все фрагменты гена. Нуклеотидные последовательности этих фрагментов, как правило, длиннее зонда, и их концы перекрываются с другими фрагментами данного гена в этой библиотеке, т. е. по крайней мере частично гибридизуются с ними. Свободные концы этих фрагментов будут гибридизоваться со следующими и т. д. , пока весь структурный ген не будет полностью идентифицирован серией перекрывающихся фрагментов. Именно таким образом был реконструи рован структурный ген фактора сверты вания крови VIII человека, необычно Рис. 16. Принцип гибридизации длинный, состоящий из 180000 пар нуклеотидов. Реконструкцию начинали с нуклеиновых кислот. олигонуклеотидного зонда длиной всего в 36 нуклеотидов, который был синтезирован А - нуклеотидные цепи в на основе аминокислотной растворе; последовательности фрагмента белка фактора VIII, и его комплементарность Б - гибридизация оказалась достаточной для эффективной гибридизации. комплементарных цепей; В - гибридизация при неполной гомологии.
 Гибридизация in situ Особенно удобен для определения локализации генов метод гибридизации in situ. Препарат метафазных хромосом обрабатыва ют радиоактивным ДНК зондом в условиях, позволяющих зонду гибридизоваться с хромосомной ДНК. Молекулы зонда концентри руются, преимущественно, в тех локусах хромосом, где имеются комплементрные последовательности ДНК. Таким образом исследуемый ген можно локализовать в специфическом хромосом ном сегменте. На первых этапах применение этого метода ограни чивалось идентификацией в хромосомах только высокоповторя ющихся нуклеотидных последовательностей. Позже метод гибри дизации in situ был усовершенствован настолько, что теперь с его помощью можно локализовать в хромосомах даже уникальные гены, такие, например, как ген инсулина. Для этого используют статистический анализ распределения радиоактивной метки по длине отдельных хромосом во многих метафазных препаратах. n. В качестве примера рассмотрим основные этапы анализа гена тяжелой цепи миозина.
Гибридизация in situ Особенно удобен для определения локализации генов метод гибридизации in situ. Препарат метафазных хромосом обрабатыва ют радиоактивным ДНК зондом в условиях, позволяющих зонду гибридизоваться с хромосомной ДНК. Молекулы зонда концентри руются, преимущественно, в тех локусах хромосом, где имеются комплементрные последовательности ДНК. Таким образом исследуемый ген можно локализовать в специфическом хромосом ном сегменте. На первых этапах применение этого метода ограни чивалось идентификацией в хромосомах только высокоповторя ющихся нуклеотидных последовательностей. Позже метод гибри дизации in situ был усовершенствован настолько, что теперь с его помощью можно локализовать в хромосомах даже уникальные гены, такие, например, как ген инсулина. Для этого используют статистический анализ распределения радиоактивной метки по длине отдельных хромосом во многих метафазных препаратах. n. В качестве примера рассмотрим основные этапы анализа гена тяжелой цепи миозина.
 n Вначале был синтезирован к. ДНК зонд для гена тяжелой цепи миозина кролика. Поскольку гомологичные гены различных млекопитающих в общем сходны, их гибриди зация проходит без затруднений. Зонд клонировали в плазмиде и выделенную затем ДНК метили тритием (3 Н) с помощью ник трансляции (nick translation). Для этого ДНК инкубировали с небольшим количеством ДНКазы 1, которая вносит несколько одноцепочечных разрывов в двухцепочечную ДНК. Затем добавляли радиоактивно меченные нуклеотиды и ДНК полимеразу, при этом меченые нуклеотиды встраивались в ДНК зонд. n Препараты митотических хромосом человека получали из культуры лимфоцитов, подвергали специальной обработке с целью денатурации хромосомной ДНК и затем проводили гибридизацию с меченным тритием ДНК зондом в течение 16 18 ч при 40°С. n. После отмывания препаратов с целью удаления несвязавшейся или неспецифически адсорбированной ДНК их экспонировали в течение 3 недель для получения радиоавтографов. После окрашивания акрихин ипритом (Q метод) препараты сфотографировали. На рис. 17 показана типичная метафазная пластинка, а на рис. 18 распределение метки по отдельным сегментам всех хромосом человека.
n Вначале был синтезирован к. ДНК зонд для гена тяжелой цепи миозина кролика. Поскольку гомологичные гены различных млекопитающих в общем сходны, их гибриди зация проходит без затруднений. Зонд клонировали в плазмиде и выделенную затем ДНК метили тритием (3 Н) с помощью ник трансляции (nick translation). Для этого ДНК инкубировали с небольшим количеством ДНКазы 1, которая вносит несколько одноцепочечных разрывов в двухцепочечную ДНК. Затем добавляли радиоактивно меченные нуклеотиды и ДНК полимеразу, при этом меченые нуклеотиды встраивались в ДНК зонд. n Препараты митотических хромосом человека получали из культуры лимфоцитов, подвергали специальной обработке с целью денатурации хромосомной ДНК и затем проводили гибридизацию с меченным тритием ДНК зондом в течение 16 18 ч при 40°С. n. После отмывания препаратов с целью удаления несвязавшейся или неспецифически адсорбированной ДНК их экспонировали в течение 3 недель для получения радиоавтографов. После окрашивания акрихин ипритом (Q метод) препараты сфотографировали. На рис. 17 показана типичная метафазная пластинка, а на рис. 18 распределение метки по отдельным сегментам всех хромосом человека.
 n. Основная масса метки обнаруживается на коротком плече хромосомы 17 в сегменте. На основании этого был сделан вывод, что ген тяжелой цепи миозина расположен в хромосоме 17. Рис. 17. На фотоэмульсии стрелка Поскольку данный эксперимент был указывает на зерно серебра в хромосоме. проведен с зондом к. ДНК, мы не вправе утверждать, что идентифицированный миозиновый ген является действительно активным. Он может быть и «псевдогеном» , т. е. такой последовательностью ДНК, которая структурно гомологична активному гену миозина, но сама не транскрибируется, т. е. не детерминирует синтез миозина, поскольку лишена каких то важных фланкирующих последовательностей вне транскрибируемой части. Такие псевдогены были обнаружены, например, в пределах кластеров а и р Рис. 18. Распределение зёрен серебра глобиновых генов. по длине хромосом человека после гибридизации с меченым ДНК-зондом. Больше всего зёрен сосредоточено в коротком плече 17 -й хромосомы.
n. Основная масса метки обнаруживается на коротком плече хромосомы 17 в сегменте. На основании этого был сделан вывод, что ген тяжелой цепи миозина расположен в хромосоме 17. Рис. 17. На фотоэмульсии стрелка Поскольку данный эксперимент был указывает на зерно серебра в хромосоме. проведен с зондом к. ДНК, мы не вправе утверждать, что идентифицированный миозиновый ген является действительно активным. Он может быть и «псевдогеном» , т. е. такой последовательностью ДНК, которая структурно гомологична активному гену миозина, но сама не транскрибируется, т. е. не детерминирует синтез миозина, поскольку лишена каких то важных фланкирующих последовательностей вне транскрибируемой части. Такие псевдогены были обнаружены, например, в пределах кластеров а и р Рис. 18. Распределение зёрен серебра глобиновых генов. по длине хромосом человека после гибридизации с меченым ДНК-зондом. Больше всего зёрен сосредоточено в коротком плече 17 -й хромосомы.
 Табл. 6 Некоторые гены человека, локализован- ные с помощью метода гибридизации n Все большее число генов человека успешно локализуется в хромосомах с помощью этого метода (табл. 6).
Табл. 6 Некоторые гены человека, локализован- ные с помощью метода гибридизации n Все большее число генов человека успешно локализуется в хромосомах с помощью этого метода (табл. 6).
 Метод обнаружения фрагментов гена в тотальной ДНК Метод Саузерна
Метод обнаружения фрагментов гена в тотальной ДНК Метод Саузерна

