Презен.эмисс.].ppt
- Количество слайдов: 25
 Методы электронной спектроскопии Эмиссионный спектральный анализ
Методы электронной спектроскопии Эмиссионный спектральный анализ
 • Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др. ) с веществом. В физике спектроскопические методы используются для изучения всевозможных свойств этих взаимодействий. В аналитической химии — для обнаружения и определения веществ при помощи измерения их характеристических спектров, то есть методами спектрометрии. К существенным преимуществам спектроскопии можно отнести возможность диагностики in situ, то есть непосредственно в «среде обитания» объекта, бесконтактно, дистанционно, без какой-либо специальной подготовки объекта. Поэтому она получила широкое развитие, например, в астрономии. • По объектам исследования можно выделить следующие виды спектроскопии: атомная спектроскопия, молекулярная спектроскопия, масс-спектроскопия, ядерная спектроскопия (ЯМР. ЭПР, ОЭС) и другие. • По типу излучения, которое используется в спектроскопии, её можно разделить на оптическую спектроскопию, рентгеновскую спектроскопию, фотоэлектронную спектроскопию, Мёссбауэровскую спектроскопию, масс-спектроскопию, спектроскопию с использованием радиоизлучения (γ-спектроскопия)и т. д.
• Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др. ) с веществом. В физике спектроскопические методы используются для изучения всевозможных свойств этих взаимодействий. В аналитической химии — для обнаружения и определения веществ при помощи измерения их характеристических спектров, то есть методами спектрометрии. К существенным преимуществам спектроскопии можно отнести возможность диагностики in situ, то есть непосредственно в «среде обитания» объекта, бесконтактно, дистанционно, без какой-либо специальной подготовки объекта. Поэтому она получила широкое развитие, например, в астрономии. • По объектам исследования можно выделить следующие виды спектроскопии: атомная спектроскопия, молекулярная спектроскопия, масс-спектроскопия, ядерная спектроскопия (ЯМР. ЭПР, ОЭС) и другие. • По типу излучения, которое используется в спектроскопии, её можно разделить на оптическую спектроскопию, рентгеновскую спектроскопию, фотоэлектронную спектроскопию, Мёссбауэровскую спектроскопию, масс-спектроскопию, спектроскопию с использованием радиоизлучения (γ-спектроскопия)и т. д.
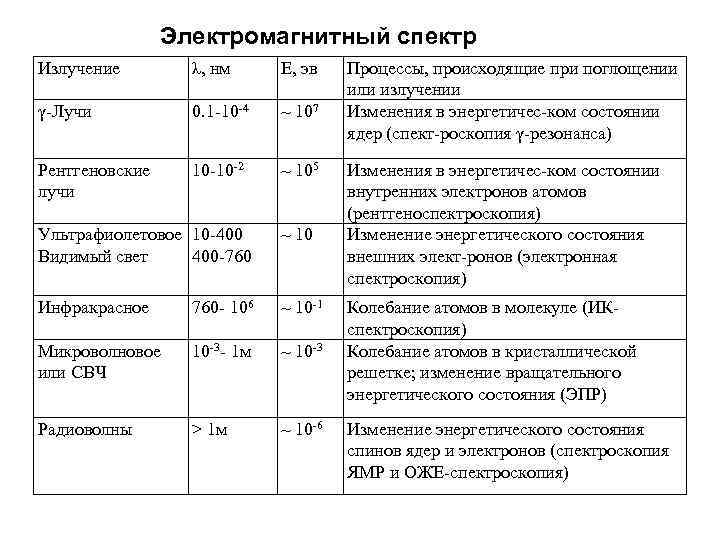 Электромагнитный спектр Излучение λ, нм Е, эв γ-Лучи 0. 1 -10 -4 ~ 107 Рентгеновские лучи 10 -10 -2 ~ 105 Ультрафиолетовое 10 -400 Видимый свет 400 -760 ~ 10 Инфракрасное 760 - 106 ~ 10 -1 Микроволновое или СВЧ 10 -3 - 1 м ~ 10 -3 Радиоволны > 1 м ~ 10 -6 Процессы, происходящие при поглощении или излучении Изменения в энергетичес-ком состоянии ядер (спект-роскопия γ-резонанса) Изменения в энергетичес-ком состоянии внутренних электронов атомов (рентгеноспектроскопия) Изменение энергетического состояния внешних элект-ронов (электронная спектроскопия) Колебание атомов в молекуле (ИКспектроскопия) Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния (ЭПР) Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ОЖЕ-спектроскопия)
Электромагнитный спектр Излучение λ, нм Е, эв γ-Лучи 0. 1 -10 -4 ~ 107 Рентгеновские лучи 10 -10 -2 ~ 105 Ультрафиолетовое 10 -400 Видимый свет 400 -760 ~ 10 Инфракрасное 760 - 106 ~ 10 -1 Микроволновое или СВЧ 10 -3 - 1 м ~ 10 -3 Радиоволны > 1 м ~ 10 -6 Процессы, происходящие при поглощении или излучении Изменения в энергетичес-ком состоянии ядер (спект-роскопия γ-резонанса) Изменения в энергетичес-ком состоянии внутренних электронов атомов (рентгеноспектроскопия) Изменение энергетического состояния внешних элект-ронов (электронная спектроскопия) Колебание атомов в молекуле (ИКспектроскопия) Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния (ЭПР) Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ОЖЕ-спектроскопия)
 • Прямая задача спектроскопии — предсказание вида спектра вещества исходя из знаний о его строении, составе и прочем. • Обратная задача спектроскопии — определение характеристик вещества (не являющихся непосредственно наблюдаемыми величинами) по свойствам его спектров (которые наблюдаются непосредственно и напрямую зависят как от определяемых характеристик, так и от внешних факторов).
• Прямая задача спектроскопии — предсказание вида спектра вещества исходя из знаний о его строении, составе и прочем. • Обратная задача спектроскопии — определение характеристик вещества (не являющихся непосредственно наблюдаемыми величинами) по свойствам его спектров (которые наблюдаются непосредственно и напрямую зависят как от определяемых характеристик, так и от внешних факторов).
 • Атомный и молекулярный спектральные анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения. • Эмиссионно-спектральный анализ (ЭСА) является методом определения содержания элементов по характеристическому линейчатому спектру испускания (эмиссии) свободных, нейтральных или ионизованных атомов химического элемента в оптическом диапазоне электромагнитных волн С его помощью можно анализировать твердые, жидкие и газообразные вещества более 70 элементов(и радиоактивных).
• Атомный и молекулярный спектральные анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения. • Эмиссионно-спектральный анализ (ЭСА) является методом определения содержания элементов по характеристическому линейчатому спектру испускания (эмиссии) свободных, нейтральных или ионизованных атомов химического элемента в оптическом диапазоне электромагнитных волн С его помощью можно анализировать твердые, жидкие и газообразные вещества более 70 элементов(и радиоактивных).
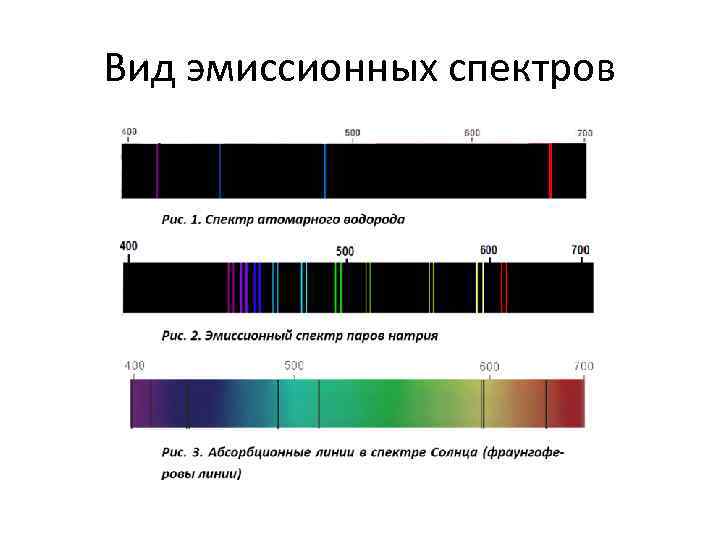 Вид эмиссионных спектров
Вид эмиссионных спектров
 • • • Е 0 , Е 1 , Е 2 , Еn Еi - Еn = hν (10 -7 -10 -8 с. ) ΔЕ=hν(э. В). ν= Еi – Еn / h (с-1), ν/= Еi – Еn / ch ν/= = ν/c (см-1), λ = c/ν (нм, мкм , Å), 1. Главное квантовое число п (п = 1 -7 для атомов в основном состоянии) соответствует уровням, обозначаемым К, L, M, . . . Q, и характеризует удаленность электрона от ядра. 2. Квантовое число орбитального углового момента l (l<п, l = 0, 1, 2, . . . ) L –для атома соответствует подуровням s, p, d, f и связано с пространственным распределением электронной плотности. (S, P, D, F –для атома) 3. Орбитальное магнитное квантовое число ml (любое целое, удовлетворяющее условию - l < ml < +l). • 4. Спиновое квантовое число ms (ms = ± 1/2).
• • • Е 0 , Е 1 , Е 2 , Еn Еi - Еn = hν (10 -7 -10 -8 с. ) ΔЕ=hν(э. В). ν= Еi – Еn / h (с-1), ν/= Еi – Еn / ch ν/= = ν/c (см-1), λ = c/ν (нм, мкм , Å), 1. Главное квантовое число п (п = 1 -7 для атомов в основном состоянии) соответствует уровням, обозначаемым К, L, M, . . . Q, и характеризует удаленность электрона от ядра. 2. Квантовое число орбитального углового момента l (l<п, l = 0, 1, 2, . . . ) L –для атома соответствует подуровням s, p, d, f и связано с пространственным распределением электронной плотности. (S, P, D, F –для атома) 3. Орбитальное магнитное квантовое число ml (любое целое, удовлетворяющее условию - l < ml < +l). • 4. Спиновое квантовое число ms (ms = ± 1/2).
 Спектральный терм-это группа энергетических состояний, характеризуемая одними и теми же величинами L и S и имеющих близкую энергию L - суммарный орбитальный момент атома S- суммарный спин атома М=2 S+1 -мультиплетность терма. - Полное обозначение терма L = 0, 1, 2, 3, 4, - обозначаются S, P, D, F, G ; - означают терм дублетного расщепления с L= 1, S= 1/2, J= 1/2 и 3/2. перед символом терма указывается главное квантовое число n, например, для. Na.
Спектральный терм-это группа энергетических состояний, характеризуемая одними и теми же величинами L и S и имеющих близкую энергию L - суммарный орбитальный момент атома S- суммарный спин атома М=2 S+1 -мультиплетность терма. - Полное обозначение терма L = 0, 1, 2, 3, 4, - обозначаются S, P, D, F, G ; - означают терм дублетного расщепления с L= 1, S= 1/2, J= 1/2 и 3/2. перед символом терма указывается главное квантовое число n, например, для. Na.
 Взаимное расположение термов одной электронной конфигурации определяется правилами Хунда: • 1. Основное, т. е. низшее, энергетическое состояние имеет наибольшее значение суммарного спина М (мультиплетности). • 2. Среди термов с максимальной мультиплетностью низшим является тот, у которого наибольшее значение L. • 3. Низшим компонентом мультиплета будет J = L – S, если уровень заполнен меньше чем наполовину, и J = L + S, если он заполнен больше чем наполовину.
Взаимное расположение термов одной электронной конфигурации определяется правилами Хунда: • 1. Основное, т. е. низшее, энергетическое состояние имеет наибольшее значение суммарного спина М (мультиплетности). • 2. Среди термов с максимальной мультиплетностью низшим является тот, у которого наибольшее значение L. • 3. Низшим компонентом мультиплета будет J = L – S, если уровень заполнен меньше чем наполовину, и J = L + S, если он заполнен больше чем наполовину.
 Вероятность перехода атома из одного энергетического состояния в другое и возникновение соответствующей линии в атомном спектре определяется правилами отбора. • Разрешены переходы при которых терм меняется на единицу, т. е P-S, D-P. Но не P-P, D-D или S-D L= 1 правило изменения четности • Внутреннее квантовое число J может меняться только на 1 или совсем не менятся. Запрещены переходы, при которых J= 2 • Разрешены переходы без изменения мультиплетности M=2 S+1
Вероятность перехода атома из одного энергетического состояния в другое и возникновение соответствующей линии в атомном спектре определяется правилами отбора. • Разрешены переходы при которых терм меняется на единицу, т. е P-S, D-P. Но не P-P, D-D или S-D L= 1 правило изменения четности • Внутреннее квантовое число J может меняться только на 1 или совсем не менятся. Запрещены переходы, при которых J= 2 • Разрешены переходы без изменения мультиплетности M=2 S+1
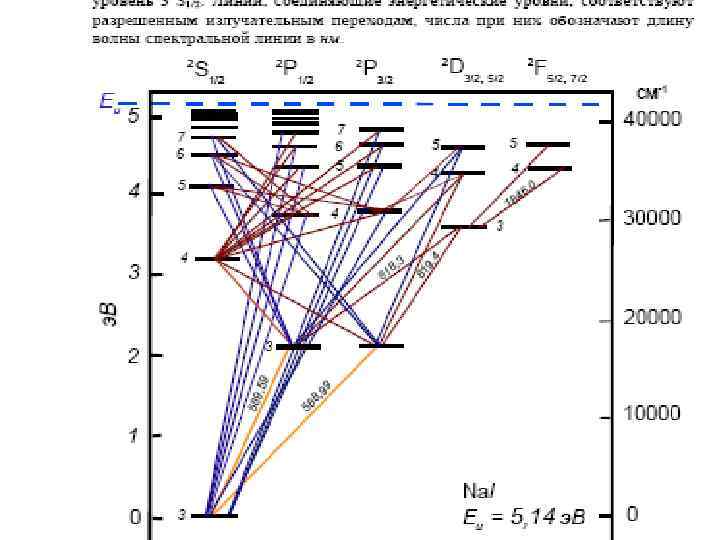
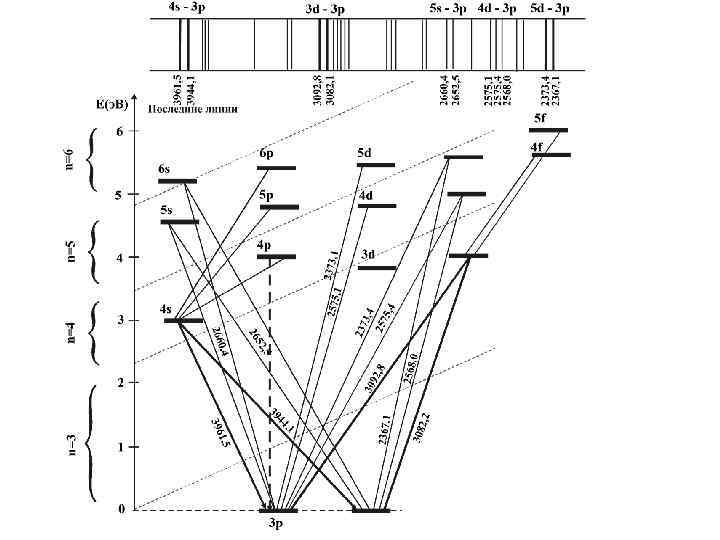
 • Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными. Особое аналитическое значение имеют все резонансные линии, соответствующие переходам с первого возбужденного уровня на основной • Наибольшую интенсивность имеют линии, имеющие низкий потенциал возбуждения и соответствующие разрешенным переходам. При уменьшении концентрации вещества в анализируемой пробе они исчезают из спектра после всех других линий данного элемента. Поэтому их называют последними. Для Na (дублет 3 s 3 р), Al- последними будут четыре линии: 3961, 5 , 3944, 1 (переход 4 s 3 р), 3092, 7 и 3082, 2 (переход 3 d 3 р). Большинство последних линий являются резонансными.
• Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными. Особое аналитическое значение имеют все резонансные линии, соответствующие переходам с первого возбужденного уровня на основной • Наибольшую интенсивность имеют линии, имеющие низкий потенциал возбуждения и соответствующие разрешенным переходам. При уменьшении концентрации вещества в анализируемой пробе они исчезают из спектра после всех других линий данного элемента. Поэтому их называют последними. Для Na (дублет 3 s 3 р), Al- последними будут четыре линии: 3961, 5 , 3944, 1 (переход 4 s 3 р), 3092, 7 и 3082, 2 (переход 3 d 3 р). Большинство последних линий являются резонансными.
 • Спектроскопический символ - величина Z, характеризующая зарядовое состояние атома или иона: Z = Zn - N + 1, где Zn - заряд атомного ядра, N - число электронов в атомной системе. • Обозначение Cu. I, Cu. III, Cu. IV в спектрах меди соответствуют спектрам Cu 0, Cu+, Cu 2+, Cu 3+ , Cu 4+. • Для дублета Na 589, 0– 589, 6 нм следует записать: Na. I 589, 0 нм 32 S 1/2 – 32 Р 3/2 Na. I 589, 6 нм 32 S 1/2 – 32 P 1/2 , где терм 32 S 1/2 соответствует низшему (основному) энергетическому уровню атома натрия.
• Спектроскопический символ - величина Z, характеризующая зарядовое состояние атома или иона: Z = Zn - N + 1, где Zn - заряд атомного ядра, N - число электронов в атомной системе. • Обозначение Cu. I, Cu. III, Cu. IV в спектрах меди соответствуют спектрам Cu 0, Cu+, Cu 2+, Cu 3+ , Cu 4+. • Для дублета Na 589, 0– 589, 6 нм следует записать: Na. I 589, 0 нм 32 S 1/2 – 32 Р 3/2 Na. I 589, 6 нм 32 S 1/2 – 32 P 1/2 , где терм 32 S 1/2 соответствует низшему (основному) энергетическому уровню атома натрия.
 Основные узлы приборов в АЭС • Источник возбуждения спектров -служит для получения атомного пара и термического возбуждения атомов определяемого элемента. Испарение, диссоциация молекул и возбуждение образовавшихся атомов (ионов). • Оптический блок-диспергирует по длинам волн важный с аналитической точки зрения участок спектра или выделяет отдельную спектральную линию. • Приемник излучения- преобразует энергию световой волны в электрический сигнал • Электронный блок-усиливает аналитический сигнал • Компьютер (система управления и обработки информации) • Измерительное устройство -стрелочный миллиамперметр или цифровой вольтметр.
Основные узлы приборов в АЭС • Источник возбуждения спектров -служит для получения атомного пара и термического возбуждения атомов определяемого элемента. Испарение, диссоциация молекул и возбуждение образовавшихся атомов (ионов). • Оптический блок-диспергирует по длинам волн важный с аналитической точки зрения участок спектра или выделяет отдельную спектральную линию. • Приемник излучения- преобразует энергию световой волны в электрический сигнал • Электронный блок-усиливает аналитический сигнал • Компьютер (система управления и обработки информации) • Измерительное устройство -стрелочный миллиамперметр или цифровой вольтметр.
 Источники возбуждения спектров • Пламя-Температура пламени-2000 -3000 °К • Определяют 25 -30 элементов (щелочные, щелочноземельные, Mg, Cu, Mn, Tl, и т. д) • Дуга-переменного и постоянного тока(I=5 -7 А) (U=50 -80 B). Т=50007000 °К. В дуге получают спектр почти всех элементов. Большая яркость , но малая воспроизводимость, абсолютные пределы обнаружения = 10 -7– 10 -9 г. , погрешность= 20 – 30%. (sr = 0, 2 – 0, 05. ) • Используют при качественных и полуколичественных определения. Работа дуги вызывает разрушение образца • Искра-получают в искровом генераторе. Т=7000 -12000 °К. Плотность тока - 10000– 50000 А/см 2. Получают спектры всех элементов. Яркость недостаточна, но характерна высокая стабильность разряда, работа с искрой не вызывает разрушения образца, используется при количественных определениях. воспроизводимость результатов анализа около 1 % (sr = 0, 01). В искре определяются такие трудно возбудимые элементы, как P, С, S, галогены.
Источники возбуждения спектров • Пламя-Температура пламени-2000 -3000 °К • Определяют 25 -30 элементов (щелочные, щелочноземельные, Mg, Cu, Mn, Tl, и т. д) • Дуга-переменного и постоянного тока(I=5 -7 А) (U=50 -80 B). Т=50007000 °К. В дуге получают спектр почти всех элементов. Большая яркость , но малая воспроизводимость, абсолютные пределы обнаружения = 10 -7– 10 -9 г. , погрешность= 20 – 30%. (sr = 0, 2 – 0, 05. ) • Используют при качественных и полуколичественных определения. Работа дуги вызывает разрушение образца • Искра-получают в искровом генераторе. Т=7000 -12000 °К. Плотность тока - 10000– 50000 А/см 2. Получают спектры всех элементов. Яркость недостаточна, но характерна высокая стабильность разряда, работа с искрой не вызывает разрушения образца, используется при количественных определениях. воспроизводимость результатов анализа около 1 % (sr = 0, 01). В искре определяются такие трудно возбудимые элементы, как P, С, S, галогены.
 Диспергирующий элемент • • Светофильтры (оптические фильтры) –устройства для выделения некоторого заданного участка спектра широкополосного оптического излучения. Абсорбционные фильтры (окрашенные стѐкла, плѐнки) характеризует небольшая ширины полос пропускания в пределах от 30 до 50 нм Интерференционные светофильтры- действие основано на явлении интерференции. Недостаток это отсутствие возможности перестройки по длинам волн. Монохроматоры- это спектральный прибор для выделения узких участков спектра оптического излучения. Диспергирующими элементами монохроматора служат дисперсионные призмы и дифракционные решетки. Дисперсия света в диф. решетке не зависит от длины волны, разрешающая способность выше, чем призм. Спектральный интервал 200 -1000 нм • Полихроматор- позволяет проводить одновременное наблюдение многих или даже всех участков спектра. Полихроматор, называемый спектрометром, это монохроматором с несколькими выходными щелями. Другой тип полихроматоров это спектрограф. В спектрографе отсутствует выходная щель, а вместо этого используется детектор сплошного излучения, такой, как фотографическая пластинка.
Диспергирующий элемент • • Светофильтры (оптические фильтры) –устройства для выделения некоторого заданного участка спектра широкополосного оптического излучения. Абсорбционные фильтры (окрашенные стѐкла, плѐнки) характеризует небольшая ширины полос пропускания в пределах от 30 до 50 нм Интерференционные светофильтры- действие основано на явлении интерференции. Недостаток это отсутствие возможности перестройки по длинам волн. Монохроматоры- это спектральный прибор для выделения узких участков спектра оптического излучения. Диспергирующими элементами монохроматора служат дисперсионные призмы и дифракционные решетки. Дисперсия света в диф. решетке не зависит от длины волны, разрешающая способность выше, чем призм. Спектральный интервал 200 -1000 нм • Полихроматор- позволяет проводить одновременное наблюдение многих или даже всех участков спектра. Полихроматор, называемый спектрометром, это монохроматором с несколькими выходными щелями. Другой тип полихроматоров это спектрограф. В спектрографе отсутствует выходная щель, а вместо этого используется детектор сплошного излучения, такой, как фотографическая пластинка.
 Приемники излучения Детектор Обл. спектр. , нм Человеческий глаз 400 – 700 0. 1(сек) (У) Вакуумный фотоэлемент 190 – 1100 10 -9 (В) Фот. элек. умнож (ФЭУ) 105 – 1100 10 -8 (ОВ) Лавинный фотодиод 450 – 1200 10 -10 (У) Фоторезистор (Cd. S) 400 – 800 0. 1 (Н) Кремниевый фотодиод 350 – 1200 10 -8 (В) Приборы с зар. св. (ПСЗ) <180 – 1000 10 -8 (ОВ)
Приемники излучения Детектор Обл. спектр. , нм Человеческий глаз 400 – 700 0. 1(сек) (У) Вакуумный фотоэлемент 190 – 1100 10 -9 (В) Фот. элек. умнож (ФЭУ) 105 – 1100 10 -8 (ОВ) Лавинный фотодиод 450 – 1200 10 -10 (У) Фоторезистор (Cd. S) 400 – 800 0. 1 (Н) Кремниевый фотодиод 350 – 1200 10 -8 (В) Приборы с зар. св. (ПСЗ) <180 – 1000 10 -8 (ОВ)
 • Качественный спектральный анализ основан на индивидуальности эмиссионных спектров каждого элемента и сводится, как правило, к определению длин волн и интенсивности линий в спектре и установлению принадлежности этих линий тому или иному элементу. Анализ ведется по «последним линиям» . Расшифровка спектров осуществляется либо на стилоскопе и (визуально), либо, на спектропроекторе или микроскопе после фотографирования спектров на фотопластинку. • • • λх = λ 1 + (а 1 / (а 1 + а 2))(λ 2 - λ 1). λ, А Оценка I Cr, % 1 Cr 5204. 5 I 1 = I 3 0. 05 2 Fe 5202. 3 I 1≤ I 2 0. 1 3 Fe 5198. 7 I 1> I 2 0. 2
• Качественный спектральный анализ основан на индивидуальности эмиссионных спектров каждого элемента и сводится, как правило, к определению длин волн и интенсивности линий в спектре и установлению принадлежности этих линий тому или иному элементу. Анализ ведется по «последним линиям» . Расшифровка спектров осуществляется либо на стилоскопе и (визуально), либо, на спектропроекторе или микроскопе после фотографирования спектров на фотопластинку. • • • λх = λ 1 + (а 1 / (а 1 + а 2))(λ 2 - λ 1). λ, А Оценка I Cr, % 1 Cr 5204. 5 I 1 = I 3 0. 05 2 Fe 5202. 3 I 1≤ I 2 0. 1 3 Fe 5198. 7 I 1> I 2 0. 2
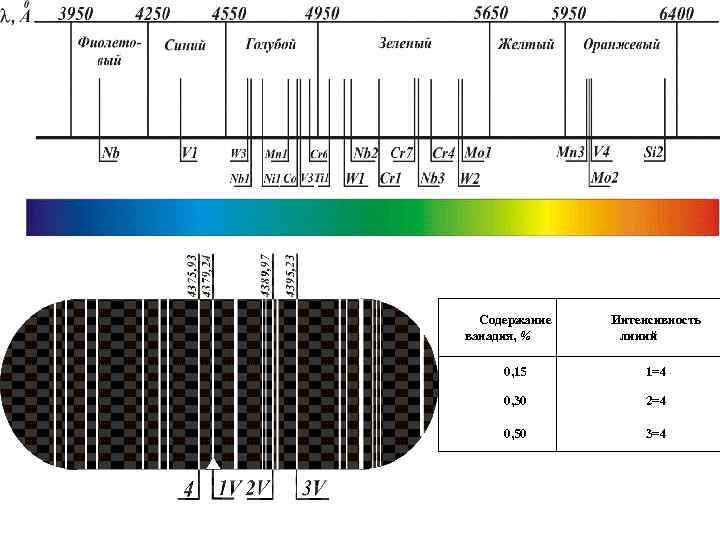 ржор Детекторы (приемники)оптического излучения Содержание ванадия, % Интенсивность линий 0, 15 1=4 0, 30 2=4 0, 50 3=4
ржор Детекторы (приемники)оптического излучения Содержание ванадия, % Интенсивность линий 0, 15 1=4 0, 30 2=4 0, 50 3=4
 Самообращение спектральной линии
Самообращение спектральной линии
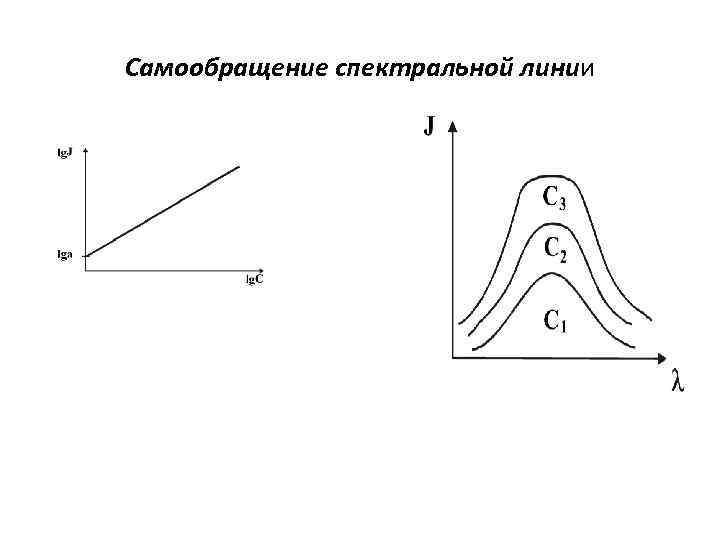
 • Количественный спектральный анализ основан на том, что интенсивность спектральных линий элемента зависит от концентрации этого элемента в пробе. Ik =Nk Ak-r hνk ; Ik =k. N ; N=a. C ; I=ka. C ; Ia/Iосн = Аexp( - ΔE/k. T ) ; • В некотором интервале концентраций при постоянстве условий возбуждения эта зависимость выражается эмпирическим уравнением Ломакина-Шайбе: I = a cb, • где I - интенсивность спектральной линии; • а - постоянная, объединяющая свойства линии (искровая, дуговая линия, узкая, широкая), условия возбуждения (скорость испарения, скорость диффузии) и другие факторы; с - концентрация элемента в пробе; • • • b - коэффициент самопоглощения. lg. I=lga + blgc ; Ia/Iосн = a cb, Признаки гомологичности : 0, 1≤Ia/Iосн≤ 10 ; λa –λосн≤ 100 А; ΔE≤ 1 е. В
• Количественный спектральный анализ основан на том, что интенсивность спектральных линий элемента зависит от концентрации этого элемента в пробе. Ik =Nk Ak-r hνk ; Ik =k. N ; N=a. C ; I=ka. C ; Ia/Iосн = Аexp( - ΔE/k. T ) ; • В некотором интервале концентраций при постоянстве условий возбуждения эта зависимость выражается эмпирическим уравнением Ломакина-Шайбе: I = a cb, • где I - интенсивность спектральной линии; • а - постоянная, объединяющая свойства линии (искровая, дуговая линия, узкая, широкая), условия возбуждения (скорость испарения, скорость диффузии) и другие факторы; с - концентрация элемента в пробе; • • • b - коэффициент самопоглощения. lg. I=lga + blgc ; Ia/Iосн = a cb, Признаки гомологичности : 0, 1≤Ia/Iосн≤ 10 ; λa –λосн≤ 100 А; ΔE≤ 1 е. В
 • • Sa = γ lg. Ia +const ; Sосн = γ lg. I осн +const; Sa - Sосн = ΔS = γ lg. Ia/ I осн = lga + blg. C ΔS = γ lga + γ blg. C • В методе трех эталонов на одной фотопластинке фотографируют спектры трех эталонов с известным содержанием элементов и спектр анализируемого образца. Измеряют почернение выбранных линий. Строят градуировочный график, по которому находят содержание изучаемых элементов. • В случае анализа однотипных объектов применяют метод постоянного графика, который строят по большому числу эталонов. Затем в строго одинаковых условиях снимают спектр образца и одного из эталонов. • В методе добавок пробу переводят в раствор и порции раствора добавляют известное количество определяемого элемента • Рассчитывают: сх = сдоб Ix / ( Iх+доб – Iх),
• • Sa = γ lg. Ia +const ; Sосн = γ lg. I осн +const; Sa - Sосн = ΔS = γ lg. Ia/ I осн = lga + blg. C ΔS = γ lga + γ blg. C • В методе трех эталонов на одной фотопластинке фотографируют спектры трех эталонов с известным содержанием элементов и спектр анализируемого образца. Измеряют почернение выбранных линий. Строят градуировочный график, по которому находят содержание изучаемых элементов. • В случае анализа однотипных объектов применяют метод постоянного графика, который строят по большому числу эталонов. Затем в строго одинаковых условиях снимают спектр образца и одного из эталонов. • В методе добавок пробу переводят в раствор и порции раствора добавляют известное количество определяемого элемента • Рассчитывают: сх = сдоб Ix / ( Iх+доб – Iх),
 • Ширина спектральной линии(δλ или δν) - это мера не монохроматичности, оптическое изображение щели прибора. • δλ (δν)- определяется как естественная ширина и уширения, обусловленные эффектами Лоренца(ударное) , Доплера • Уширение- за счет эффекта Штарка и Зеемана(расщепление в электрическом и магнитном поле) • Величина δλ (δν)- 0. 01 -0. 02 Å
• Ширина спектральной линии(δλ или δν) - это мера не монохроматичности, оптическое изображение щели прибора. • δλ (δν)- определяется как естественная ширина и уширения, обусловленные эффектами Лоренца(ударное) , Доплера • Уширение- за счет эффекта Штарка и Зеемана(расщепление в электрическом и магнитном поле) • Величина δλ (δν)- 0. 01 -0. 02 Å
 • Методами эмиссионного спектрального анализа выполняется значительная часть анализов в металлургической промышленности. Анализируется исходное сырье и готовая продукция. Существенную роль этот метод играет для анализа природных и сточных вод, почвы, атмосферы и других объектов окружающей среды, а также в медицине, биологии и т. д. Метод характеризуется высокой чувствительностью • Средний предел обнаружения методами эмиссионной спектроскопии составляет 10 -3 -10 -4% до 10 -5%. Погрешность определения характеризуется в среднем величиной 1 -2%.
• Методами эмиссионного спектрального анализа выполняется значительная часть анализов в металлургической промышленности. Анализируется исходное сырье и готовая продукция. Существенную роль этот метод играет для анализа природных и сточных вод, почвы, атмосферы и других объектов окружающей среды, а также в медицине, биологии и т. д. Метод характеризуется высокой чувствительностью • Средний предел обнаружения методами эмиссионной спектроскопии составляет 10 -3 -10 -4% до 10 -5%. Погрешность определения характеризуется в среднем величиной 1 -2%.


