methodmyc1-2015-intro.ppt
- Количество слайдов: 58

Методология и методика полевых исследований грибов 1

Методология – теоретическая база эксперимента. Методология определяет цели и задачи исследователя, выбор метода, условий эксперимента и анализа полученных данных. Методика (=метод)– конкретный способ решения задачи.

Схема проведения исследования 1. Подготовительный этап: знакомство с литературой по исследуемому вопросу; 2. формулирование цели и задач исследования; 3. подбор адекватных и корректных методов их решения; 4. разработка схемы сбора материала и проведение сбора; 5. лабораторная (камеральная) обработка материала; 6. математическая (в т. ч. , статистическая) обработка полученных результатов; 7. обсуждение результатов исследования с использованием литературных данных; 8. получение выводов и обнародование (публикация) данных.

Рекомендуемая литература Великанов Л. Л. , Сидорова И. И. , Успенская Г. Д. Полевая практика по экологии грибов и лишайников. М. МГУ. 1980. 112 с. Миркин Б. М. , Розенберг Г. С. , Наумова Л. Г. Словарь понятий и терминов современной фитоценологии. М. Наука. 1989. 223 с. Мегарран Э. Экологическое разнообразие и его измерение. М. Мир. 1992. 181 с. Foster M. , Mueller G. , Bills G. Biodiversity of fungi. Inventory and monitoring methods. Boston. Elsevier Academic Press. 2004. 777 p. Hawksworth D. L. Mycologist's handbook. An introduction to the principles of taxonomy and nomenclature in the fungi and lichens. Kew Commonwealth Mycological Institute. 1974. 231 p. Winterhoff W. (ed. ) Fungi in vegetation science. Dordrecht. Kluwer Academic Publishers. 1992. 256 p.

Полезные интернет-ресурсы Сайт кафедры: http: //mycol-algol. ru Ссылки на полезные интернет-источники, в т. ч. , библиотеки и базы данных: http: //mycolalgol. ru/materials. html

Полезные интернет-ресурсы American Bryological and Lichenological Society http: //www. unomaha. edu/~abls/ American Phytopathological Society (APS) http: //www. apsnet. org/visitors/top. asp Ascomycete Species from Freshwater Habitats http: //fm 5 web. life. uiuc. edu: 23523/ascomycete/ The Bank of European Glomales (BEG) http: //www. ukc. ac. uk/bio/beg/ The British Lichen Society http: //www. argonet. co. uk/users/jmgray The British Mycological Society http: //www. ulst. ac. uk/faculty/science/bms/

Полезные интернет-ресурсы Centre for Agriculture and Biosciences International (CABI), International Mycological Institute (IMI) http: //www. cabi. org/ CABI Bioscience and CBS Database of Fungal Names http: //indexfungorum. org/Names. asp Common Data Structure for European Floristic Databases, Biodiversity and Biological Collections Web Server http: //www. keil. ukans. edu/ Fungal Genetics Stock Center http: //www. fgsc. net/ Gen. Bank: NCBI = National Center for Biotechnology Information http: //www. ncbi. nlm. nih. gov

Полезные интернет-ресурсы Genebank for European Molecular Biology Laboratory (EMBL)—EMBL Nucleotide Sequence Database http: //www. ebi. ac. uk/embl/ The German Mycological Society (Die Deutsche Gesellschaft für Mykologie) http: //www. dgfm-ev. de/ Index Herbariorum online (Holmgren et al. 1990) http: //www. nybg. org/bsci/ih/ih. html Integrated Taxonomic Information System (ITIS) http: //www. itis. usda. gov/ International Code of Botanical Nomenclature http: //www. bgbm. org/iapt/nomenclature/code/default/html

Полезные интернет-ресурсы International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi (INVAM) http: //invam. caf. wvu. edu/ International Plant Names Index (IPNI) http: //www. ipni. org/index. html The Internet Directory for Botany: Botanical Museums, Herbaria, Natural History Museums http: //www. botany. net/IDB/subject/botmus. html Internet Directory for Botany: Lower Plants, Algae— Bryophytes—Fungi http: //www. botany. net/IDB/subject/botcryp. html#fungi The Internet Guide to Myxomycetes http: //www. wvonline. com/myxo

Полезные интернет-ресурсы LIAS—A Global Information System for Lichenized and Non-Lichenized Ascomycetes http: //www. lias. net Lichen Determination Keys Available on INTERNET (H. J. M. Sipman) http: //www. bgbm. org/sipman/keys/ MYCOBANK Database Fungal Databases, Nomenclature & Species Banks http: //www. mycobank. org/ Mycology Resources 2 (список микологических сайтов, директорий, онлайн-публикаций) http: //www. edae. gr/myco 2. html

Полезные интернет-ресурсы The Mycological Society of America http: //msafungi. org Myconet http: //www. umu. se/myconet/Myconet. html Plant Pathology Internet Guide Book http: //www. bspp. org. uk/ppigb/ Society for the Preservation of Natural History Collections http: //www. spnhc. org United States Department of Agriculture (USDA) Forest Service, Forestry Sciences Laboratory, Mycological Herbarium Database http: //mgd. nacse. org/cgi-bin/qml 2. 0/fslmyco/fslherb. qml

Полезные интернет-ресурсы United States National Science Foundation (NSF) http: //www. nsf. gov/ The World Data Centre for Microorganisms (WDCM) (Коллекции микроорганизмов и клеточных линий. Ссылки на малоизвестные, небольшие и широко известные коллекции) http: //wdcm. nig. ac. jp/ World Federation for Culture Collections (WFCC), Committee on Postal, Quarantine, and Safety Regulations http: //wdcm. nig. ac. jp/wfcc/postal_committee. html

База данных «Index Fungorum» http: //www. indexfungorum. org/Names. asp
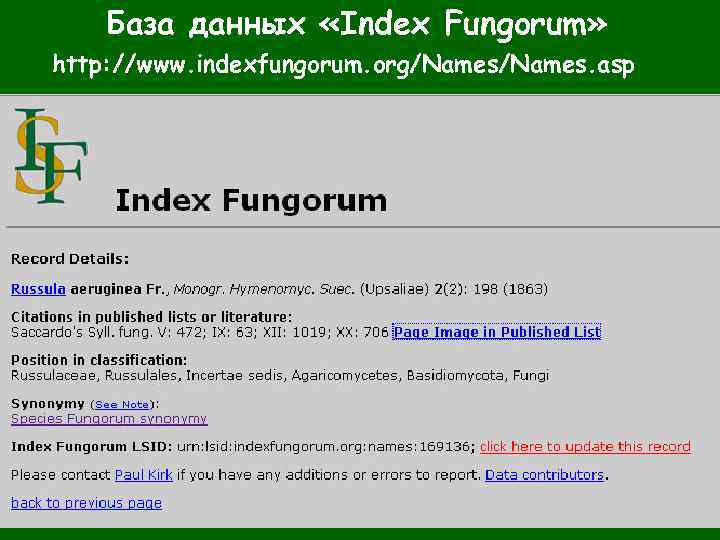
База данных «Index Fungorum» http: //www. indexfungorum. org/Names. asp

База данных «Myco. Bank» http: //www. mycobank. org/Names. asp

База данных «Myco. Bank» http: //www. mycobank. org/Names. asp

База данных «Myco. Bank» http: //www. mycobank. org/Names. asp Для многих видов существует возможность просмотра описаний и иллюстраций. По вопросам систематического положения объекта и трактовки объема таксона встречаются значительные расхождения с Index Fungorum, поэтому при составлении списков необходимо пользоваться одной базой для всех таксонов.
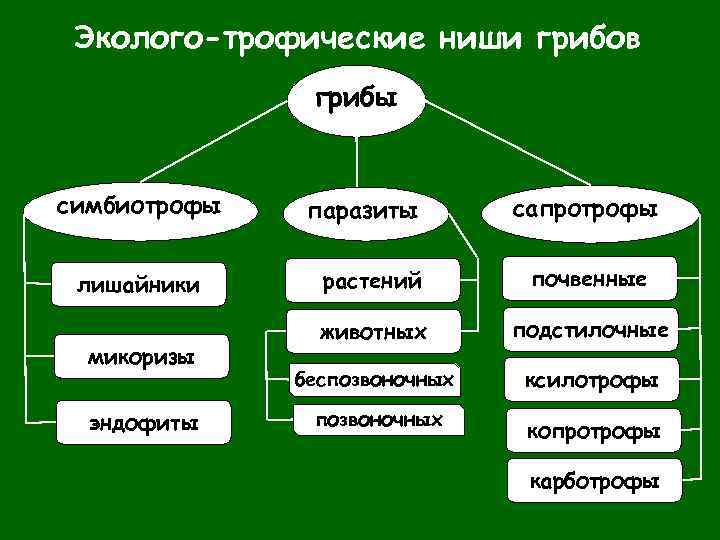
Эколого-трофические ниши грибов грибы симбиотрофы лишайники микоризы эндофиты паразиты сапротрофы растений почвенные животных подстилочные беспозвоночных ксилотрофы позвоночных копротрофы карботрофы

Роль грибов в природе

Роль грибов в деятельности человека: + • продуценты химических соединений промышленного назначения и медицинского сырья (ферменты, пигменты, органические кислоты, липиды, биологически активные вещества); • пищевой ресурс (как дикорастущие, так и культивируемые виды); • косвенное участие в пищевых производствах (хлебопечение, сыроварение, производство алкогольных и безалкогольных напитков брожения); • участие в биологической утилизации отходов (биоремедиации); • участие в биоконтроле вредителей; • роль в традиционных обществах.

Роль грибов в деятельности человека: • продуценты токсинов – источников отравления человека и животных; • источник аллергенов; • возбудители болезней растений; • возбудители микозов человека и животных; • порча продуктов и непищевых материалов (включая разрушение построек, предметов искусства и памятников культуры).

Методы исследования грибов: • полевые/ экспериментальные; • геоботанические (=фитоценологические)/ микробиологические; • прямые/ косвенные; • качественные /количественные.
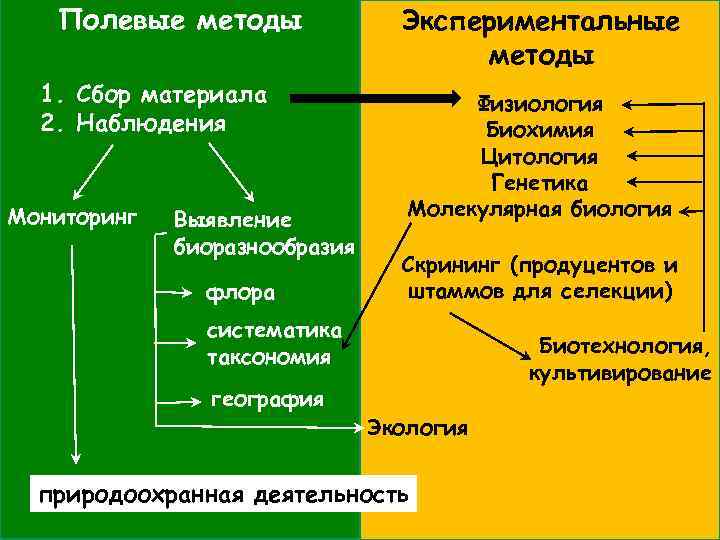
Полевые методы 1. Сбор материала 2. Наблюдения Мониторинг Выявление биоразнообразия флора Экспериментальные методы Физиология Биохимия Цитология Генетика Молекулярная биология Скрининг (продуцентов и штаммов для селекции) систематика таксономия география Биотехнология, культивирование Экология природоохранная деятельность

Методы исследования грибов: ПОЛЕВЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ выявление видов в природе изучение скорости роста картирование колоний изучение утилизации различных субстратов количественный учет в природе выявление ферментативной активности наблюдение сукцессии изучение взаимодействия между видами наблюдение процессов разложения субстрата изучение процессов образования и развития плодовых тел

Методы исследования грибов: ГЕОБОТАНИЧЕСКИЕ картирование МИКРОБИОЛОГИЧЕСКИЕ выделение чистых культур, в т. ч. , из природных субстратов выявление сообществ грибов и изучение физиологии в чистой их связи с факторами среды культуре выявление сопряженности между видами в природе изучение биохимии в чистой культуре

Методы исследования грибов: ПРЯМЫЕ КОСВЕННЫЕ наблюдение роста мицелия на стеклах и фильтрах выделение чистых культур из природных субстратов количественный учет численности спор или биомассы мицелия учет численности по колониеобразующим единицам (КОЕ)

Методы исследования грибов: КАЧЕСТВЕННЫЕ КОЛИЧЕСТВЕННЫЕ выявление видового состава и составление аннотированного списка определение обилия и частоты встречаемости вида изучение фенологии оценка запасов мицелия и биомассы плодовых тел изучение приуроченности видов к типу местообитания выявление видов-доминантов сообщества и построение экологических моделей

Особенности/сложности исследования грибов I. Сложность выявления 1. специфичность местообитаний, в т. ч. , из-за наличия связей с другими организмами у патогенов и симбионтов, и субстратов, как у копротрофов и симбиотрофов; 2. микроскопические размеры, требующие применения лабораторных методов для выявления; 3. «временная недоступность» (сложность циклов и временные флуктуации). Onygena Penicillium Verpa

Особенности/сложности исследования грибов II. Сложность видовой идентификации 1. скудная морфология; 2. высокая внутривидовая изменчивость; 3. различия в концепции понимания видов и, следовательно, трудности в сопоставлении данных. Saprolegnia

Особенности/сложности исследования грибов III. Сложность определения границ особи и, следовательно, получения количественных характеристик и подбора математического аппарата

Макромицеты и микромицеты Макромицеты – грибы, образующие макроскопические плодовые тела (размером более 1 мм). К макромицетам относят менее 1% известных видов грибов. Все прочие – микромицеты. Termitomyces titanicus Calvatia gigantea Dacrymyces stillatus

Макромицеты и микромицеты строма Cordyceps militaris Некоторые представители Ascomycota формируют макроскопические спороношения – стромы, но размеры индивидуальных плодовых тел внутри них микроскопические

Положение макромицетов в системе: отд. Ascomycota Типы плодовых тел: жёлтый – клейстотеций красный – апотеций зелёный - перитеций (Hibbett et al. , 2007)

Положение макромицетов в системе: отд. Basidiomycota, п/отд Agaricomycotina Типы плодовых тел: жёлтый – дрожалковое красный – агарикоидное зелёный – афиллофороидное фиолетовый гастероидное (Hibbett et al. , 2007)

Макромицеты и микромицеты • границы макро- и микромицетов различны у разных авторов; • существуют традиционно недоучитываемые группы макромицетов (с подземными или малозаметными плодовыми телами); • для изучения макромицетов применяются в основном фитоценологические методы, микромицетов – микробиологические методы. Rhizopogon

Полевые методы: • происходят из геоботаники, т. к. , большинство грибов связано в своей жизнедеятельности с растениями, но имеются отличия в связи с мицелиальным образом жизни большинства грибов и специфичностью местообитаний многих из них, хотя в большинстве случаев применяется аналогичный математический аппарат; • могут быть применены как таковые или только на этапе сбора материала.

Сбор материала: • цель сбора; • типы образцов; • необходимость подробного описания (местообитания и образца); • инвентарь; • техника безопасности; • минимальное нарушение природного сообщества возможность дальнейшего сравнения и математической обработки; • необходимость наличия контроля, если планируется постановка эксперимента; • подбор схемы отбора; • маршрутные и стационарные методы.

Сбор материала: • целью сбора определяется место отбора (работа на одном участке или широкий географический охват), количество материала и число повторностей сбора (35 и более). • Материал может быть собран для: 1. Использования в экспериментальной работе (большие количества). 2. Идентификации видов грибов с целью инвентаризации (изучения биоразнообразия) или мониторинга (малые количества) и/или последующих исследований в области экологии.

Сбор материала: Инвентаризация – выявление видового состава для расширения знаний в области биоразнообразия и выяснения предпочтений в отношении местоообитаний и географического распространения. Практический выход: скрининг и охрана редких видов. Мониторинг –система долгосрочных наблюдений и экспериментов, направленных на оценку состояния сообществ и изучение динамики. Практический выход: первичный материал для экологического прогнозирования, поиск видовиндикаторов, учет урожайности съедобных грибов, тенденции развития редких видов, оценка влияния антропогенного воздействия. В идеале инвентаризация должна предварять мониторинг.

Сбор материала: типы образцов • субстрат (почва, опад, древесина ит. п. ) для выделения культур или анализа процессов разложения: собирают в конверты из плотной бумаги ( «крафт» ); • растения или животные, пораженные грибами: конверты или небольшие контейнеры; • плодовые тела грибов: ящики с отделениями для мелких форм, корзина, мелкие коробки, фольга или конверты для прочных плодовых тел; • мицелий: конверты из плотной бумаги ( «крафт» ) • пробы воды для изучения водных грибов. В любом случае необходима скорейшая транспортировка в лабораторию и дальнейшая обработка.

Сбор материала: Документация: • Этикетки на стандартных бланках и полевой журнал. 1. Субстрат/хозяин (тип почвы, вид растения и т. п. ). 2. Местоположение (координаты). 3. Описание биоценоза. 4. Описание местообитания (в т. ч. , аномалии). 5. Дополнительные сведения (глубина взятия образца, высота роста плодовых тел, географические особенности и т. д. ). 6. Дата сбора. 7. Фамилия, инициалы сборщика. 8. Исчезающие признаки, химические реакции и измерения в свежем состоянии (для сильно изменяющихся при хранении образцов – напр. , плодовых тел макромицетов). • Фото образца и места отбора.

Сбор материала:

Сбор материала: инвентарь • • • • корзина (коробка для сбора и т. п. ) этикетки (на заранее заготовленных бланках) топорик карандаш с ластиком нож с кисточкой бумажные конверты ( «крафт» ) ручная лупа пинцет вощеная бумага или фольга лопата или копалка фотоаппарат полевой набор реактивов емкости для водных проб

Сбор материала: инвентарь

Сбор материала: техника безопасности • избегать одиночных выходов на маршрут • ориентирование в лесу • наличие минимальной аптечки • инструмент при неправильном хранении может представлять опасность (ножи, топоры, пинцеты, стеклянные емкости и пр. ) • режущий инструмент должен находиться в чехлах • надежная упаковка реактивов • кровососущие насекомые могут сильно мешать работе, в лесу необходим репеллент • при работе с почвой возможна встреча с земляными осами • при работе с валежом возможна встреча с осами и змеями: проверять полые бревна и дупла голыми руками не рекомендуется

Сбор материала: сохранность местообитания «Сборы должны отражать не то, что находилось на данной территории до прихода исследователя, а то, что там имеется в данный момент» Д. Хоксворт Необходимо: • при отборе почвы закапывать сделанные прикопки • возвращать на место перевернутые валежины • выбирать плодовые тела из почвы, осторожно выкручивая их, а не срезая • собирать за одно посещение только то количество материала, которое реально обработать в лаборатории (1 день поля = 3 -4 дня в лаборатории)

Сбор материала: возможность дальнейшего сравнения и математической обработки • наличие повторностей • сбор одинакового количества образцов во всех местообитаниях (на всех территориях, которые предполагается сравнивать и во все сезоны работы) • при необходимости получения количественных данных в поле проводить учеты при каждом посещении • сбор максимально полной информации при каждом сборе • равноценно полное описание всех образцов и местообитаний

Сбор материала: возможность дальнейшего сравнения и математической обработки ОПЫТ КОНТРОЛЬ влияние нарушения местообитания ненарушенное местообитание изучение микобиоты ризосферы микобиота прилегающей почвы, свободной от корней влияние различных концентраций удобрений почва без удобрений конкурентное подавление одного вида другим при совместном культивировании каждый из исследуемых видов в чистой культуре

Сбор материала: схема отбора • определяется задачами исследователя и особенностями группы, которую он изучает • временной фактор: сборы почти никогда нельзя качественно провести за одно посещение • пространственный фактор: каков должен быть охват территории сборов? Исследования почти всегда ограничены временем, а также силами исследователя, если он работает в одиночку, принцип «наименьшего зла» реализуется разными способами в зависимости от исследуемого объекта.

Хранение материала • Сохранение гербарных образцов чрезвычайно важно • За последние 200 лет объемы фондов грибных гербариев значительно возросли и изменились методики подготовки и хранения • Крупнейший отечественный гербарий находится в СПб – БИН РАН (LE). • Грибные образцы: плодовые тела, талломы лишайников, псевдогрибы, спороношения миксомицетов • После сборов необходима немедленная сушка (на воздухе, обезвоживание силикагелем или сушка замораживанием) • Все три метода позволяют сохранить ДНК

Хранение материала • Сушка на воздухе – для ПТ (40 -50 С) • Сушка силикагелем - образцы и полевые этикетки помещают в запечатанные стеклянные трубки или пластиковые пакеты с кристаллами. Метод применим только для мелких, легко высыхающих образцов • Высушивание замораживанием – техника обезвоживания, при которой образец вначале замораживают, а затем выпаривают воду в вакууме. Необходимо дорогостоящее оборудование, но образец при этом сохраняет форму и годится для демонстрационных целей. Недостаток: образцы становятся ломкими и через некоторое время снова насыщаются влагой (5 -6 лет).

Хранение материала Плодовые тела - сушить в постоянном токе теплого воздуха (40– 50°C, предпочтительно, 42°C) на несплошной поверхности. Мелкие образцы на высохшем субстрате - на солнце или под мощной лампой накаливания (свыше 75 Вт). Фитопатогены - сушить в сетках как гербарий растений на солнце или при температуре 35– 45°C. Полностью высушенные образцы можно поместить в бумажные конверты.

Хранение материала Лишайники - сушить на солнце или при температуре 42°C. Если образцы собраны в сухую погоду, можно не сушить. Некоторые листоватые или кустистые - как растительный гербарий. Хрупкие напочвенные лишайники сушат вместе с субстратом, смонтировав на лист картона Миксомицеты - воздушная сушка вместе с субстратом. Высушенные образцы можно хранить в маленьких коробочках, например, спичечных коробках.

Культуры мицелиальных грибов - в открытой чашке Петри высушивается путем замораживания в ненамораживающем холодильнике (4 -6 недель). Затем колонию переносят в бумажный конверт или в низкую (8 мм) чашку Петри и помещают в бумажный конверт. Влажные препараты -для гастеромицетов с влажной глебой -для анализа ДНК непригодно -свежий материал в фиксатор на 2 -7 дней, затем переносят в раствор для хранения. смесь Кью (фиксатор): Этанол (95%) 50. 0 мл Формалин (37%) 5. 0 мл Глицерин 5. 0 мл Вода 40. 0 мл Копенгагенский раствор (для хранения): Этанол 52. 6 мл Глицерин 5. 3 мл Вода 42. 1 мл

Хранение материала • гербарные образцы повреждаются насекомыми и микромицетами • микромицеты - контаминирующая ДНК • от насекомых: промораживание при температуре 18°C или ниже в течение 7 дней в пластиковых пакетах, чтобы предотвратить конденсат • от насекомых: бытовые репелленты, нафталин, махорка • профилактика: качественная сушка и тщательный осмотр образцов

Гербарный образец: гербарий, гербарная этикетка, дополнительные материалы (полевые записи, рисунки, фото, споровые отпечатки, постоянные препараты) Гербарная этикетка: 1. название сборов и происхождение образца (напр. , Грибы московской области) 2. научное название 3. авторы таксона и библиографические ссылки, особенно для типовых образцов 4. информация о месте сбора 5. субстрат/хозяин, информация о растительности и местообитании 6. имя собравшего, коллекционный номер 7. дата сбора 8. название гербария и номер образца.

Гербарный конверт и этикетка

Микологический гербарий БИН РАН (LE)
methodmyc1-2015-intro.ppt