4. Лекция-семинар_ПЦР_Частн бот_2 курс_2013.ppt
- Количество слайдов: 39

Метод ПЦР в современных исследованиях грибов Шнырева Алла Викторовна Кафедра микологии и альгологии МГУ

Полимеразная цепная реакция (ПЦР) Polymerase chain reaction (PCR) Метод, который сделал революционный прорыв в современной молекулярной биологии

Что такое ПЦР? Полмеразная цепная реакция – это синтез определенной последовательности ДНК in vitro в экспоненциальной прогрессии. Метод был предложен Кэри Мюллисом в 1983 г. , за что ему присудили в 1993 г. Нобелевскую премию в области химии. Science. 1985, 20; 230(4732): 1350 В реакции «работает» фермент ДНК-полимераза.

Этапы (шаги) ПЦР ДНК-матрица 1. Денатурация ДНК (нагревание реакционной смеси до 95 -98 o. C) 2. Отжиг праймеров на денатурированной 1 -цеп. ДНК-матрице (понижение температуры до 56 o. C (или др. T) 3. Синтез новой комплементарной цепи ДНК по матрице (повышение температуры до 72 o. C, ДНК полимераза + d. NTPs)
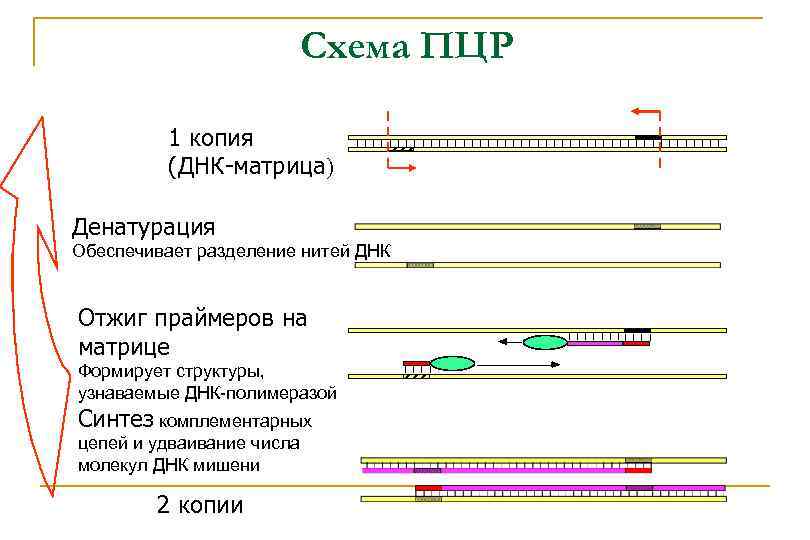
Схема ПЦР 1 копия (ДНК-матрица) Денатурация Обеспечивает разделение нитей ДНК Отжиг праймеров на матрице Формирует структуры, узнаваемые ДНК-полимеразой Синтез комплементарных цепей и удваивание числа молекул ДНК мишени 2 копии
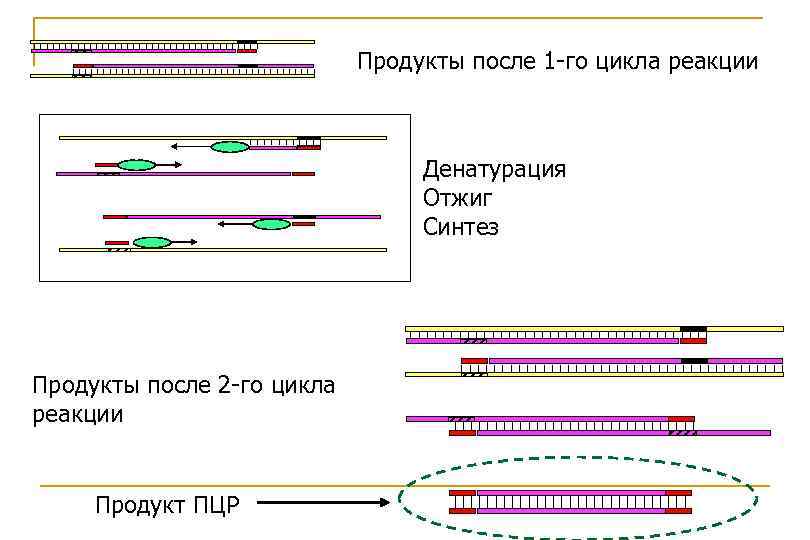
Продукты после 1 -го цикла реакции Денатурация Отжиг Синтез Продукты после 2 -го цикла реакции Продукт ПЦР
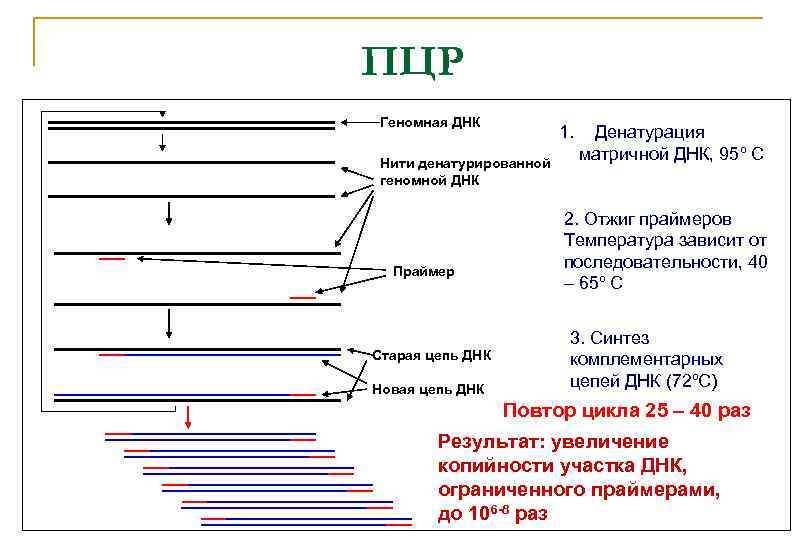
ПЦР Геномная ДНК 1. Нити денатурированной геномной ДНК Праймер Старая цепь ДНК Новая цепь ДНК Денатурация матричной ДНК, 95º С 2. Отжиг праймеров Температура зависит от последовательности, 40 – 65º С 3. Синтез комплементарных цепей ДНК (72ºС) Повтор цикла 25 – 40 раз Результат: увеличение копийности участка ДНК, ограниченного праймерами, до 106 -8 раз

Основные принципы ПЦР n ПЦР основана на процессе денатурации-реассоциации ДНК и синтезе комплементарных участков ДНК при помощи “затравок” (праймеров) и соответствующих ферментов – термостабильных полимераз. n Амплификация фрагмента происходит между двумя праймерами n Амплификацию проводят в течение 25 -40 циклов n Каждый цикл состоит из смены температурных режимов n В реакции используют термостабильные ДНК-полимеразы n За 30 циклов происходит умножение амплифицируемого фрагмента ДНК в 1 000 000 раз Критическую роль играет подбор специфических праймеров, которые должны взаимодействовать со строго определенными участками ДНК.
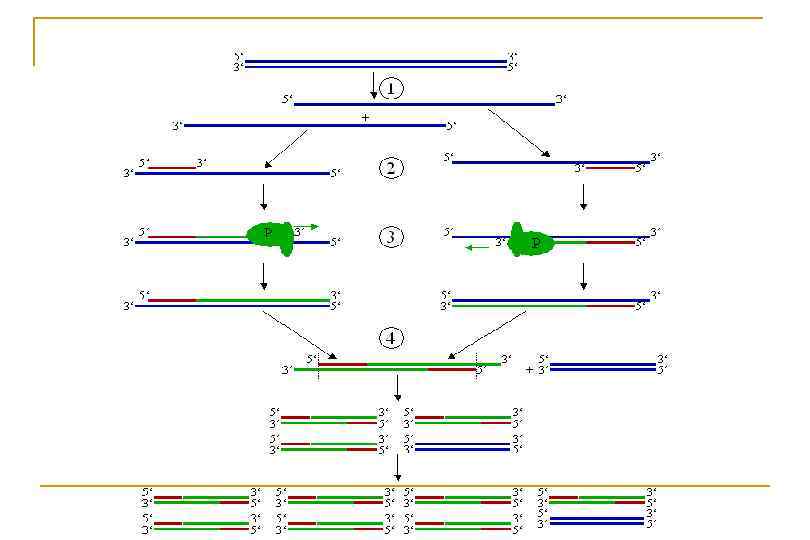

В реакционной смеси должны присутствовать следующие компоненты: 1) ДНК-матрица с заданной последовательностью; 2) Пара праймеров - олигонуклеотиды, которые определяют границы амплифицированной последовательности; 3) d. NTPs - дезоксинуклеозидтрифосфаты: материал для смнтеза комплементарной цепи ДНК; 4) Термостабильная ДНК полимераза – фермент, катализирующий реакцию; 5) Ионы Mg++ - кофактор фермента полимеразы; 6) Рабочий буфер – с определенным p. H и ионной силой, что необходимо для эффективной работы фермента.

Компоненты реакции: n n n Буфер (Tris-HCl, p. H = 8, 0 -8, 8; KCl) Mg. Cl 2 (1 -3 m. M) Праймеры (0. 4 мк. М каждого) d. NTP (40 -200 мк. М каждого) ДНК-полимераза (1 ед) ДНК-матрица (1 до 1000 нг)

Компоненты реакции: ПЦР пробирка Буфер (Tris-HCl, p. H = 8, 0 -8, 8; KCl) Mg. Cl 2 (1 -3 m. M) Праймеры (0. 4 мк. М каждого) d. NTP (40 -200 мк. М каждого) ДНК-полимераза (1 ед) ДНК- -матрица (1 до 1000 нг) Амплификатор, или Термоциклер

Подбор праймеров и расчет температуры отжига – один из важнейших моментов постановки ПЦР ДНК Праймер – это короткая олигонуклеотидная последовательность (обычно в 15 -24 нп), которая служит «затравкой» для начала репликации второй комплементарной цепи ДНК после ее денатурации.

Дизайн праймеров. Расчет температуры отжига. F Температура, при которой 50% двуспиральной нити ДНК будет диссоциировано на одноцепочечные молекулы, называют температурой плавления Tm. Температура плавления праймера зависит от нуклеотидного состава праймера. F При дизайне праймеров нужно учитывать: § содержание ГЦ-пар должно быть в пределах 40 -60%; § относительно высокая температура плавления (Tm~ 55 -65°C) § разница Tm между парой праймеров должна быть не более 5°C Tm = 4(G+C) + 2(A+T)°C. Температура отжига рассчитывается как Tan = Tm - 5°C, т. е. на 5°C ниже Т плавления.

Calculating Tm of primer - пример n n n Primer: TGACCTGAAAAGAC Count nucleic acids: Guanine = 3 Cytosine = 3 Adenine = 6 Thymine = 2 n n Calculation: Tm = 2(6 + 2) + 4 (3 + 3) Tm = 24 + 36 Tm = 60°C

Оценка результатов реакции n Электрофорез в агарозном геле ¯ +

Основные достоинства метода ПЦР: FВысокая чувствительность FВысокая специфичность FПроста в исполнении FНет необходимости в выделении или сложной очистке матричной ДНК FВозможность практически с любым биологическим материалом и малыми количествами ДНК

ПЦР – универсальный метод, который применяется для решения многих задач: Фундаментальные исследования: Прикладные исследования: Ø Геносистематика Ø Генотипирование Ø Секвенирование Ø Мутагенез (site-directed) Ø Идентификация мутаций Ø Клонирование генов Ø Изучение экспрессии генов Ø Генная инженерия Ø Диагностика и детекция патогенов Ø ДНК фингепринтинг Ø Установление родства между организмами Ø Молекулярная археология Ø Молекулярная эпидемиология Ø Судебно-медицинская экспертиза
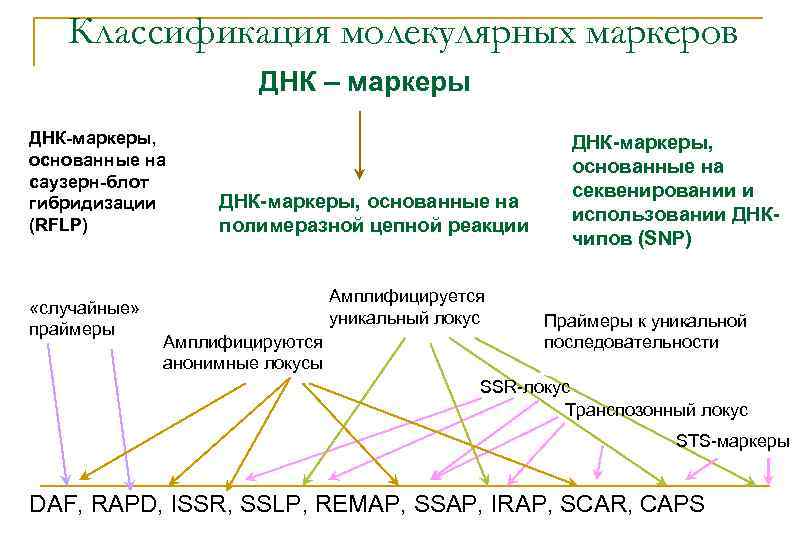
Классификация молекулярных маркеров ДНК – маркеры ДНК-маркеры, основанные на саузерн-блот гибридизации (RFLP) «случайные» праймеры ДНК-маркеры, основанные на полимеразной цепной реакции Амплифицируется уникальный локус Амплифицируются анонимные локусы ДНК-маркеры, основанные на секвенировании и использовании ДНКчипов (SNP) Праймеры к уникальной последовательности SSR-локус Транспозонный локус STS-маркеры DAF, RAPD, ISSR, SSLP, REMAP, SSAP, IRAP, SCAR, CAPS
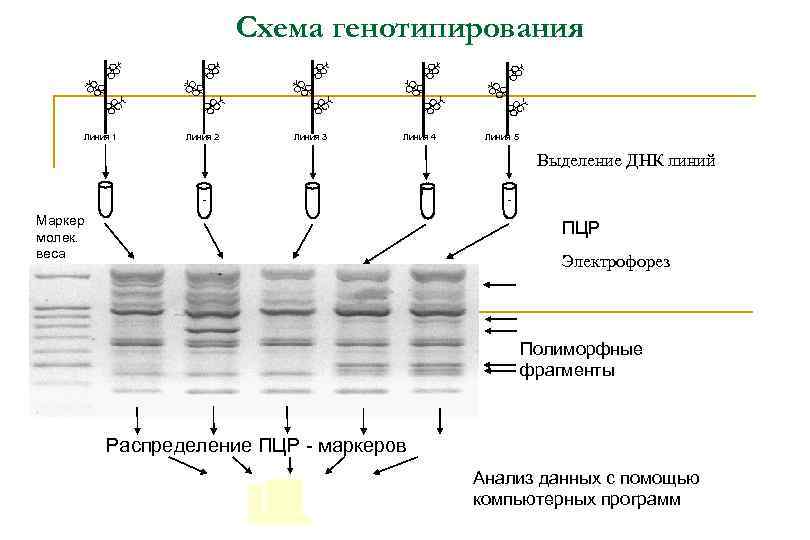
Схема генотипирования Линия 1 Линия 2 Линия 3 Линия 4 Линия 5 Выделение ДНК линий Маркер молек. веса ПЦР Электрофорез Полиморфные фрагменты Распределение ПЦР - маркеров Анализ данных с помощью компьютерных программ
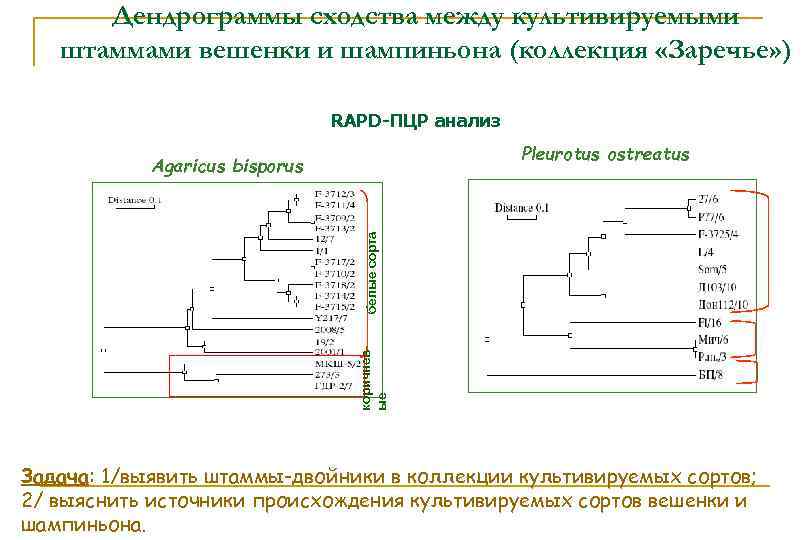
Дендрограммы сходства между культивируемыми штаммами вешенки и шампиньона (коллекция «Заречье» ) RAPD-ПЦР анализ Pleurotus ostreatus коричнев ые белые сорта Agaricus bisporus Задача: 1/выявить штаммы-двойники в коллекции культивируемых сортов; 2/ выяснить источники происхождения культивируемых сортов вешенки и шампиньона.

Задача: Молекулярная идентификация видов грибов Подготовка образца (мицелий, плодовое тело, ткань растения-хозяина) Выделение тотальной ДНК ПЦР с геноспецифическими праймерами (участки кластера генов р. РНК) Элетрофоретическое разделение ПЦР-продуктов (в агарозных гелях) Очистка ПЦР-продуктов (с магнитными частицами или другими сорбентами Количественное определение ДНК (спектрофотометр или агарозный гель) Подготовка образцов для секвенирования: ДНК-матрица + праймер Секвенирование ПЦР-продуктов Поиск гомологий в Генбанке (BLAST) Установление видовой принадлежности
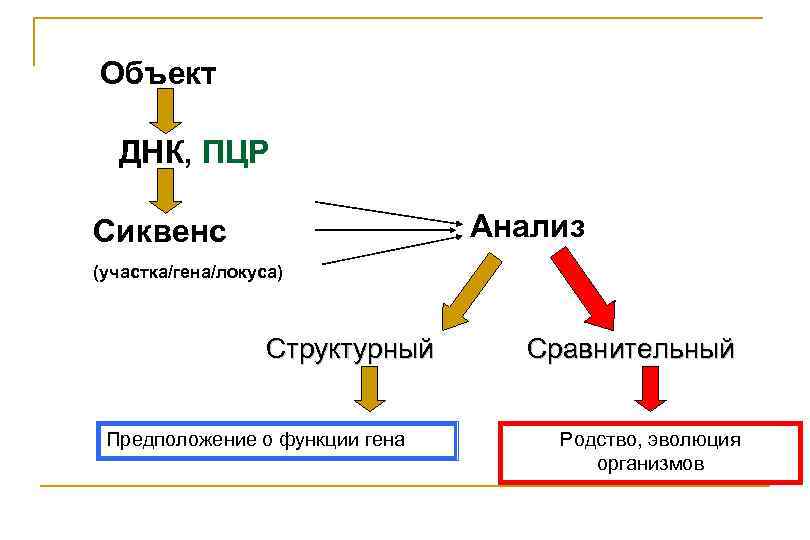
Объект ДНК, ПЦР Анализ Сиквенс (участка/гена/локуса) Структурный Предположение о функции гена Сравнительный Родство, эволюция организмов

Прикладные аспекты. ПЦР-методы для диагностики грибов, продуцирующих микотоксины. Подбор target-ДНКпоследовательностей (мишеней) должен удовлетворять двум условиям: q способность дифференцировать близкородственные виды; q различать токсин-продуцирующие и непродуцирующие штаммы в пределах видов. q Хорошо изучены кластеры генов, участвующих в цепи биосинтеза афлатоксина, трихотецина, патулина, PR-токсина, стеригматоцистина (предшественника афлатоксина): q проведена идентификация афлатоксин-продуцирующих грибов A. flavus в мультиплексных ПЦР-реакциях (multiplex PCR) по ключевым генам ver-1, nor 1, omt. A и других потенциальных продуцентов афлатоксинов - Chaetomium, Monocillium, Bipolaris, Fusarium; q отобраны для производства сыра рокфора штаммы-продуценты Penicillium roqueforti с делецией в гене ari 1, кодирующем ключевой фермент пути биосинтеза PR-токсина;

Методы ПЦР в клинической диагностике возбудителей микозов из родов Candida, Aspergillus, Cryptococcus, Fusarium, Trichosporon, Histoplasma, Cocсidioides Использование D 1|D 2 доменов 28 S р. ДНК и ITS: - для разделения гетерогенных видов Candida albicans и C. dubliniensis; виды рода Trichosporon; - для получения зондов, позволяющих дифференцировать патогенные виды и сапрофиты в пределах родов, а также в диагностике возбудителей инфекции (PCR-immunoassay). Использование последовательностей функциональных генов: q актиновые, хитинсинтаза (CHS 1), белок теплового шока HSP 90 (heat shock) - для диагностики грибов Candida в тканях пациентов; - ген хитинсинтазы позволил разделить виды по длине ампликона – Candida albicans (122 нп), C. parapsilosis (311 нп), C. tropicalis (519 нп), C. glabrata (535 нп); - последовательность гена алкалинпротеазы (Alp) для дифференциации видов Aspergillus fumigatus и A. flavus у больных с легочным аспергиллезом; - последовательности URA 5 гена и 5. 8 S р. ДНК в диагностике криптококковых менингитов (Cryptococcus spp. ).

Значение метода ПЦР для современной науки и медицины: n n n n Решение самых различных научных задач Генотипирование организмов Диагностика инфекционных заболеваний Диагностика генетических заболеваний и генетической предрасположенности Установление родства, идентификация личности Анализ древних останков, криминалистика Детекция ГМО

ОТ-ПЦР (RT-PCR, Real-time PCR) В реакции используется РНК-матрица; Перед ПЦР амплификацией необходимо провести синтез к. ДНК копии на РНК-матрице с помощью фермента обратной транскриптазы (RT, reverse-transcriptase) Все м. РНК имеют поли. ААААхвост RNA c. DNA AAAAAA TTTTTT oligo d. T primer http: //www. invitrogen. com/site/us/en/home/Products-and-Services/Applications/Nucleic-Acid. Amplification-and-Expression-Profiling/Reverse-Transcription-and-c. DNA-Synthesis/RNA-Priming-
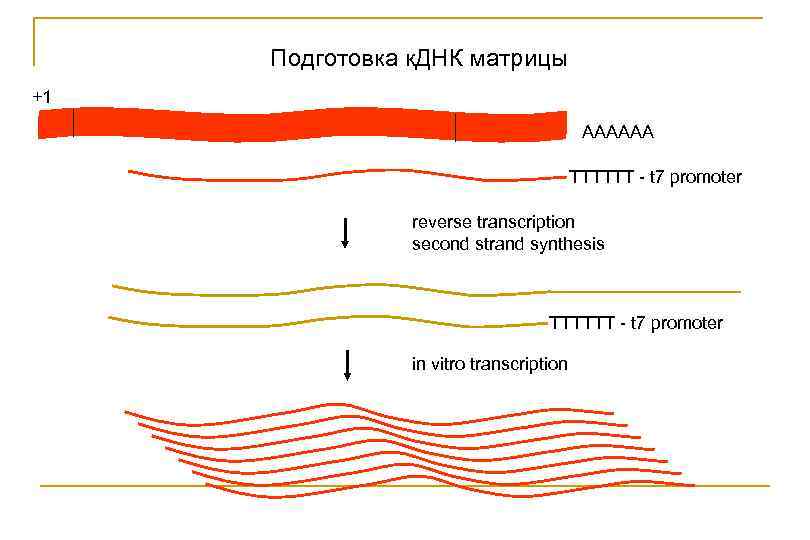
Подготовка к. ДНК матрицы +1 AAAAAA TTTTTT - t 7 promoter reverse transcription second strand synthesis TTTTTT - t 7 promoter in vitro transcription

Real time PCR - точный метод, который позволяет определить: üЧисло генных копий üУровень экспрессии генов üНаличие вирусной инфекции üНаличие различных патогенов в тканях üРазличные типы мутаций (в том числе точковые) üУчастки метилирования ДНК

Real-time PCR – разновидность метода ПЦР Интеркалирующие красители n SYBR green Гибридизационные зонды n Taqman n Molecular beacons n FRET probes
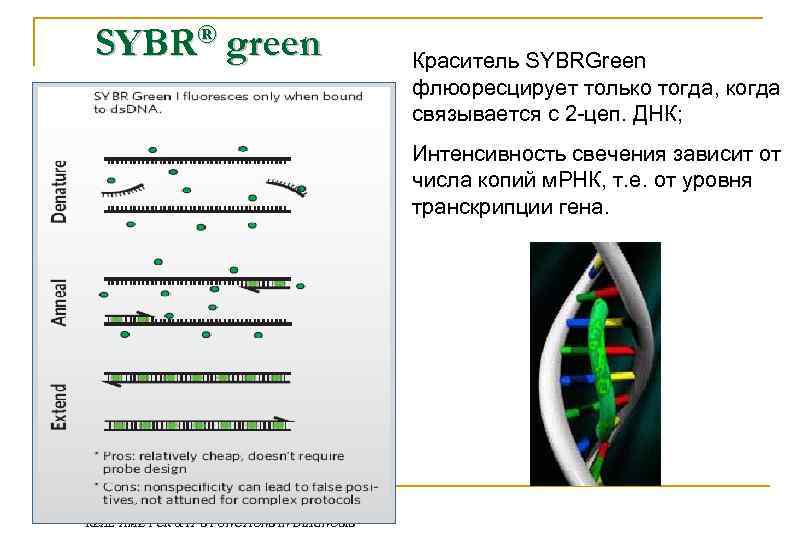
SYBR® green Краситель SYBRGreen флюоресцирует только тогда, когда связывается с 2 -цеп. ДНК; Интенсивность свечения зависит от числа копий м. РНК, т. е. от уровня транскрипции гена. REAL TIME PCR & IT’S FUNCTIONS IN DIAGNOSIS
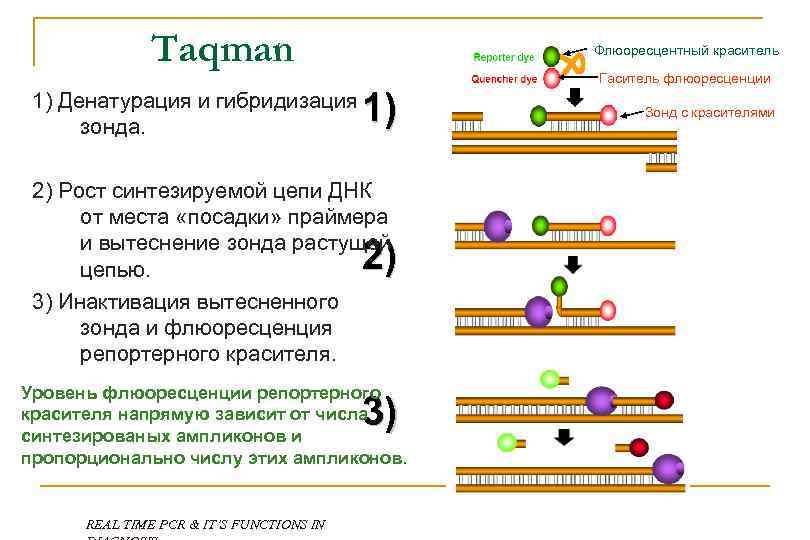
Taqman 1) Денатурация и гибридизация зонда. Флюоресцентный краситель 1) 2) Рост синтезируемой цепи ДНК от места «посадки» праймера и вытеснение зонда растущей цепью. 3) Инактивация вытесненного зонда и флюоресценция репортерного красителя. 2) Уровень флюоресценции репортерного красителя напрямую зависит от числа синтезированых ампликонов и пропорционально числу этих ампликонов. 3) REAL TIME PCR & IT’S FUNCTIONS IN Гаситель флюоресценции Зонд с красителями
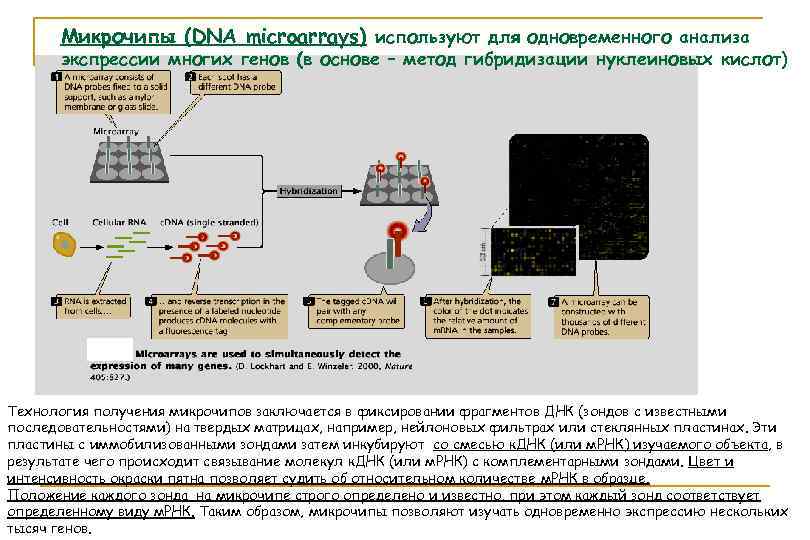
Микрочипы (DNA microarrays) используют для одновременного анализа экспрессии многих генов (в основе – метод гибридизации нуклеиновых кислот) Технология получения микрочипов заключается в фиксировании фрагментов ДНК (зондов с известными последовательностями) на твердых матрицах, например, нейлоновых фильтрах или стеклянных пластинах. Эти пластины с иммобилизованными зондами затем инкубируют со смесью к. ДНК (или м. РНК) изучаемого объекта, в результате чего происходит связывание молекул к. ДНК (или м. РНК) с комплементарными зондами. Цвет и интенсивность окраски пятна позволяет судить об относительном количестве м. РНК в образце. Положение каждого зонда на микрочипе строго определено и известно, при этом каждый зонд соответствует определенному виду м. РНК. Таким образом, микрочипы позволяют изучать одновременно экспрессию нескольких тысяч генов.
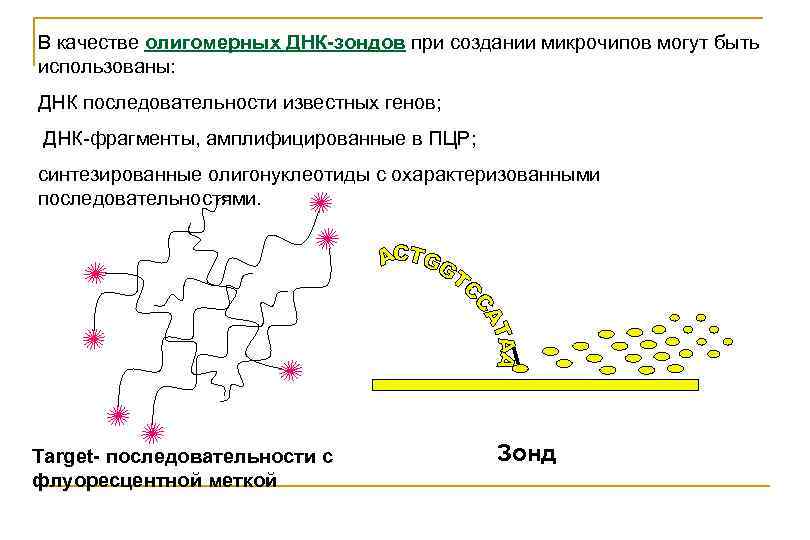
В качестве олигомерных ДНК-зондов при создании микрочипов могут быть использованы: ДНК последовательности известных генов; ДНК-фрагменты, амплифицированные в ПЦР; синтезированные олигонуклеотиды с охарактеризованными последовательностями. Target- последовательности с флуоресцентной меткой Зонд
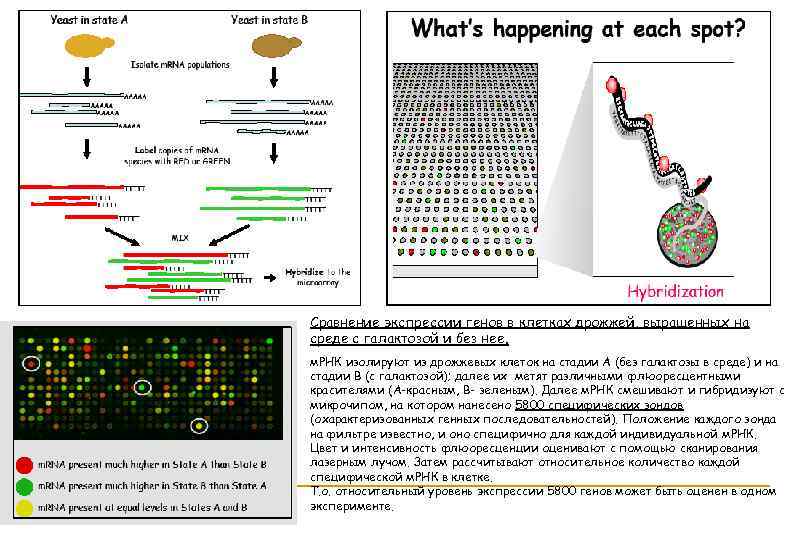
Сравнение экспрессии генов в клетках дрожжей, выращенных на среде с галактозой и без нее. м. РНК изолируют из дрожжевых клеток на стадии А (без галактозы в среде) и на стадии В (с галактозой); далее их метят различными флюоресцентными красителями (А-красным, В- зеленым). Далее м. РНК смешивают и гибридизуют с микрочипом, на котором нанесено 5800 специфических зондов (охарактеризованных генных последовательностей). Положение каждого зонда на фильтре известно, и оно специфично для каждой индивидуальной м. РНК. Цвет и интенсивность флюоресценции оценивают с помощью сканирования лазерным лучом. Затем рассчитывают относительное количество каждой специфической м. РНК в клетке. Т. о. относительный уровень экспрессии 5800 генов может быть оценен в одном эксперименте.

Микрочипы (DNA microarrays ) могут быть использованы: Fдля оценки уровня генной экспрессии; Fдля выявления мутаций и полиморфизма по нуклеотидным заменам (1 и более нуклеотидов) – молекулярное генотипирование полиморфизмов среди родственных организмов (например, кластер генов р. РНК); Fдля идентификации видов в окружающей среде по специфическим последовательностям ДНК; Fдля диагностики патогенов в тканях хозяина по экспрессии генов; F для анализа сцепления генов в клинической медицине и выявления наследственных заболеваний.

Успехов в учебе!!!
4. Лекция-семинар_ПЦР_Частн бот_2 курс_2013.ppt