Лекция 7-Метод нейтр 2012.ppt
- Количество слайдов: 18
 Метод нейтрализации 1. 2. 3. 4. 5. Принцип метода Кривые титрования Кислотно-основные индикаторы Неводное титрование Метод нейтрализации в анализе нефтепродуктов
Метод нейтрализации 1. 2. 3. 4. 5. Принцип метода Кривые титрования Кислотно-основные индикаторы Неводное титрование Метод нейтрализации в анализе нефтепродуктов
 Метод нейтрализации Принцип метода : Н+ + ОН- = Н 2 О Реакция нейтрализации характеризуется высокой скоростью, протекает строго стехиометрически, имеются индикаторы, позволяющие фиксировать т. э. Объекты определения – сильные и слабые кислоты, основания, вещества, взаимодействующие с кислотами и основаниями. Примеры практического применения кислотноосновного титрования: • определение кислотности пищевых продуктов, почв и природных вод • определение кислотности нефтепродуктов; • определение карбонатов и гидрокарбонатов в минералах и строительных материалах; • определение азота в солях аммония и в органических веществах (в т. ч. лекарствах, наркотических ср-вах)
Метод нейтрализации Принцип метода : Н+ + ОН- = Н 2 О Реакция нейтрализации характеризуется высокой скоростью, протекает строго стехиометрически, имеются индикаторы, позволяющие фиксировать т. э. Объекты определения – сильные и слабые кислоты, основания, вещества, взаимодействующие с кислотами и основаниями. Примеры практического применения кислотноосновного титрования: • определение кислотности пищевых продуктов, почв и природных вод • определение кислотности нефтепродуктов; • определение карбонатов и гидрокарбонатов в минералах и строительных материалах; • определение азота в солях аммония и в органических веществах (в т. ч. лекарствах, наркотических ср-вах)
 Приготовление растворов титрантов • В качестве титрантов выступают растворы кислот или оснований. Растворы кислот более устойчивы, могут храниться без изменений длительное время. • Растворы оснований при хранении могут поглощать СО 2 , поэтому перед началом работы надо проверять их концентрацию. • Готовят растворы: -из фиксаналов - из концентрированных растворов кислот - основания – по навеске.
Приготовление растворов титрантов • В качестве титрантов выступают растворы кислот или оснований. Растворы кислот более устойчивы, могут храниться без изменений длительное время. • Растворы оснований при хранении могут поглощать СО 2 , поэтому перед началом работы надо проверять их концентрацию. • Готовят растворы: -из фиксаналов - из концентрированных растворов кислот - основания – по навеске.
 Стандартизация растворов титрантов • Стандартизацию растворов кислот проводят по тетраборату натрия: Na 2 B 4 O 7 + 2 HCl + 5 H 2 O = 2 Na. Cl + 4 H 3 BO 3 • карбонату натрия: Na 2 CO 3 + 2 HCl = H 2 O + CO 2 + 2 Na. Cl • Стандартизацию оснований проводят по щавелевой кислоте, бифталату калия • Н 2 С 2 О 4 + 2 Na. OH = Na 2 C 2 O 4 + 2 H 2 O • C 6 H 4 COOH(COOK) + Na. OH = C 6 H 4 COONa(COOK) + H 2 O
Стандартизация растворов титрантов • Стандартизацию растворов кислот проводят по тетраборату натрия: Na 2 B 4 O 7 + 2 HCl + 5 H 2 O = 2 Na. Cl + 4 H 3 BO 3 • карбонату натрия: Na 2 CO 3 + 2 HCl = H 2 O + CO 2 + 2 Na. Cl • Стандартизацию оснований проводят по щавелевой кислоте, бифталату калия • Н 2 С 2 О 4 + 2 Na. OH = Na 2 C 2 O 4 + 2 H 2 O • C 6 H 4 COOH(COOK) + Na. OH = C 6 H 4 COONa(COOK) + H 2 O
 Кривые титрования В методе нейтрализации - это зависимость р. Н титруемого раствора от объема добавленного титранта, v, или от степени оттитрованности ( f, в %). Кривые титрования строят для того, чтобы выбрать подходящий индикатор; оценить минимально определяемую к-цию компонента; возможность раздельного определения компонентов. При построении кривых допускают: - постоянство ионной силы, температуры р-ра; - изменением концентрации титруемого раствора за счет разбавления пренебрегают; считают, что к-ция меняется только в результате протекания р-ции между определяемым веществом и титрантом.
Кривые титрования В методе нейтрализации - это зависимость р. Н титруемого раствора от объема добавленного титранта, v, или от степени оттитрованности ( f, в %). Кривые титрования строят для того, чтобы выбрать подходящий индикатор; оценить минимально определяемую к-цию компонента; возможность раздельного определения компонентов. При построении кривых допускают: - постоянство ионной силы, температуры р-ра; - изменением концентрации титруемого раствора за счет разбавления пренебрегают; считают, что к-ция меняется только в результате протекания р-ции между определяемым веществом и титрантом.
 Формулы для расчета кривых титрования сильных и слабых кислот (р. Н как функция от f) Титрант – сильное основание Стадия титрования исходный р-р до т. экв. Степень оттитр-сти, f f=0 0
Формулы для расчета кривых титрования сильных и слабых кислот (р. Н как функция от f) Титрант – сильное основание Стадия титрования исходный р-р до т. экв. Степень оттитр-сти, f f=0 0
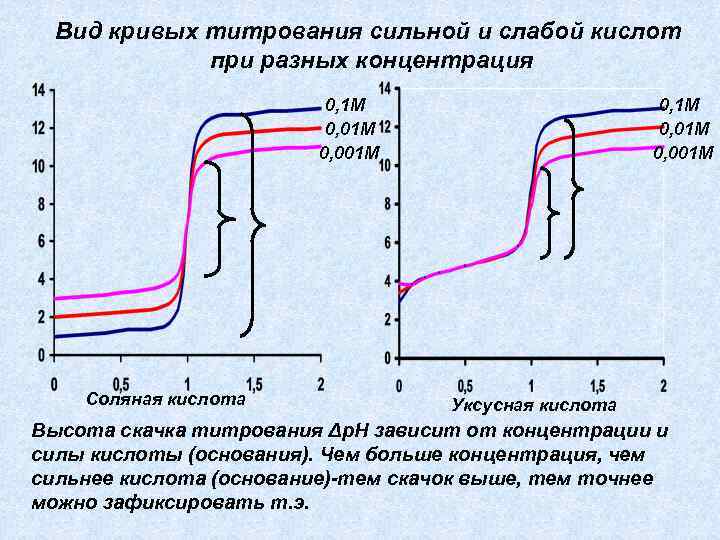 Вид кривых титрования сильной и слабой кислот при разных концентрация 0, 1 М 0, 001 М Соляная кислота 0, 1 М 0, 001 М Уксусная кислота Высота скачка титрования Δр. Н зависит от концентрации и силы кислоты (основания). Чем больше концентрация, чем сильнее кислота (основание)-тем скачок выше, тем точнее можно зафиксировать т. э.
Вид кривых титрования сильной и слабой кислот при разных концентрация 0, 1 М 0, 001 М Соляная кислота 0, 1 М 0, 001 М Уксусная кислота Высота скачка титрования Δр. Н зависит от концентрации и силы кислоты (основания). Чем больше концентрация, чем сильнее кислота (основание)-тем скачок выше, тем точнее можно зафиксировать т. э.
 Скачок титрования: ∆p. Н ± 1% = p. Н 1, 01 - p. Н 0, 99 Сильные протолиты: Слабые протолиты: ∆p. Н ± 1%= (14 – р. С – 2) – (р. С + 2) = 14 – 2 p. С – 4 ∆p. Н ± 1% = 10 - 2 p. C ∆p. Н ± 1% = (14 – р. С – 2) – (р. Кa + 2) = 14 – р. Кa – p. С – 4 ∆p. Н ± 1% =10 - р. Кa – p. С Δр. Нmin = 2 Условия возможности титрования слабого протолита с индикатором: р. Кa + р. С ≤ 8 (1) р. Кb + р. С ≤ 8 Титрование смесей протолитов (или многопротонных протолитов) При титровании смеси протолитов (кислот или оснований) каждый компонент даст хорошо выраженный скачок при выполнении условия (1) и условия (2): (2)
Скачок титрования: ∆p. Н ± 1% = p. Н 1, 01 - p. Н 0, 99 Сильные протолиты: Слабые протолиты: ∆p. Н ± 1%= (14 – р. С – 2) – (р. С + 2) = 14 – 2 p. С – 4 ∆p. Н ± 1% = 10 - 2 p. C ∆p. Н ± 1% = (14 – р. С – 2) – (р. Кa + 2) = 14 – р. Кa – p. С – 4 ∆p. Н ± 1% =10 - р. Кa – p. С Δр. Нmin = 2 Условия возможности титрования слабого протолита с индикатором: р. Кa + р. С ≤ 8 (1) р. Кb + р. С ≤ 8 Титрование смесей протолитов (или многопротонных протолитов) При титровании смеси протолитов (кислот или оснований) каждый компонент даст хорошо выраженный скачок при выполнении условия (1) и условия (2): (2)
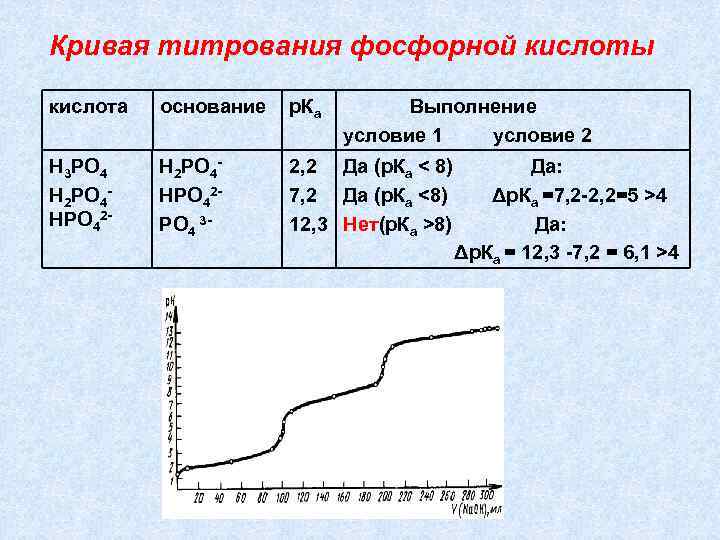 Кривая титрования фосфорной кислоты кислота основание р. Ка Выполнение условие 1 условие 2 Н 3 РО 4 Н 2 РО 4 НРО 42 - Н 2 РО 4 НРО 42 РО 4 3 - 2, 2 Да (р. Ка < 8) 7, 2 Да (р. Ка <8) 12, 3 Нет(р. Ка >8) Да: Δр. Ка =7, 2 -2, 2=5 >4 Да: Δр. Ка = 12, 3 -7, 2 = 6, 1 >4
Кривая титрования фосфорной кислоты кислота основание р. Ка Выполнение условие 1 условие 2 Н 3 РО 4 Н 2 РО 4 НРО 42 - Н 2 РО 4 НРО 42 РО 4 3 - 2, 2 Да (р. Ка < 8) 7, 2 Да (р. Ка <8) 12, 3 Нет(р. Ка >8) Да: Δр. Ка =7, 2 -2, 2=5 >4 Да: Δр. Ка = 12, 3 -7, 2 = 6, 1 >4
 Индикаторы Кислотно-основные индикаторы – органические соединения, которые меняют окраску в зависимости от р. Н раствора HInd H+ + Ind- Зона перехода окраски индикатора р. Т – показатель титрования – это р. Н, при котором индикатор резко меняет свою окраску Индикатор выбирают так, чтобы зона перехода окраски индикатора попадала в скачок к титрования, а р. Т был как можно ближе к р. Н в т. э.
Индикаторы Кислотно-основные индикаторы – органические соединения, которые меняют окраску в зависимости от р. Н раствора HInd H+ + Ind- Зона перехода окраски индикатора р. Т – показатель титрования – это р. Н, при котором индикатор резко меняет свою окраску Индикатор выбирают так, чтобы зона перехода окраски индикатора попадала в скачок к титрования, а р. Т был как можно ближе к р. Н в т. э.
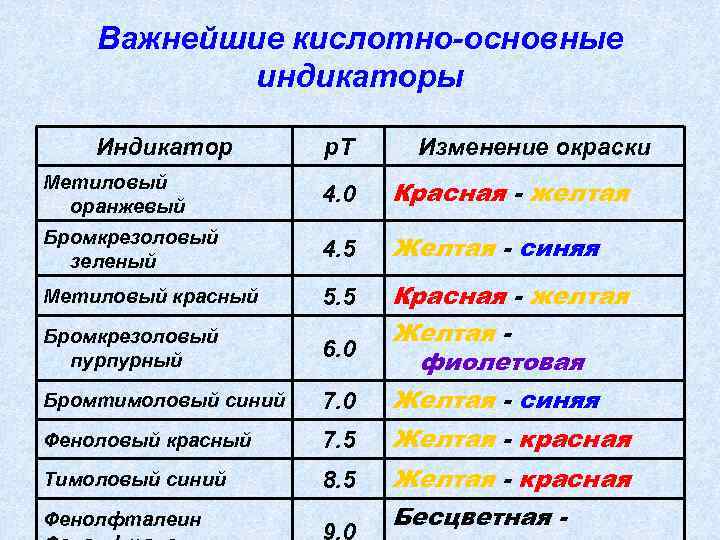 Важнейшие кислотно-основные индикаторы Индикатор р. Т Изменение окраски Метиловый оранжевый 4. 0 Красная - желтая Бромкрезоловый зеленый 4. 5 Желтая - синяя Метиловый красный 5. 5 Бромкрезоловый пурпурный 6. 0 Бромтимоловый синий 7. 0 Красная - желтая Желтая фиолетовая Желтая - синяя Феноловый красный 7. 5 Желтая - красная Тимоловый синий 8. 5 Фенолфталеин 9. 0 Желтая - красная Бесцветная -
Важнейшие кислотно-основные индикаторы Индикатор р. Т Изменение окраски Метиловый оранжевый 4. 0 Красная - желтая Бромкрезоловый зеленый 4. 5 Желтая - синяя Метиловый красный 5. 5 Бромкрезоловый пурпурный 6. 0 Бромтимоловый синий 7. 0 Красная - желтая Желтая фиолетовая Желтая - синяя Феноловый красный 7. 5 Желтая - красная Тимоловый синий 8. 5 Фенолфталеин 9. 0 Желтая - красная Бесцветная -
 Титрование в неводных средах Его проводят, когда: - вещество не растворяется в воде - разлагается водой - очень слабый электролит ( р. Ка(в) > 8) - надо раститровать смесь близких по силе электролитов (кислот или оснований) В качестве растворителя можно взять любую жидкость или смесь жидкостей, в которой компоненты пробы хорошо растворяются. Растворитель не должен мешать взаимодействию Х и R. Учитывают: доступность растворителя, стоимость, токсичность, взрыво- или пожаропасность, летучесть при комнатной температуре, запах.
Титрование в неводных средах Его проводят, когда: - вещество не растворяется в воде - разлагается водой - очень слабый электролит ( р. Ка(в) > 8) - надо раститровать смесь близких по силе электролитов (кислот или оснований) В качестве растворителя можно взять любую жидкость или смесь жидкостей, в которой компоненты пробы хорошо растворяются. Растворитель не должен мешать взаимодействию Х и R. Учитывают: доступность растворителя, стоимость, токсичность, взрыво- или пожаропасность, летучесть при комнатной температуре, запах.
 При выборе подходящего растворителя руководствуются следующими соображениями. • Если титруют одно вещество • для усиления его кислотно-основных свойств выбирают растворитель с противоположной функцией • для улучшения условий титрования (чтобы был выше скачок) следует учитывать соотношение Кs/Ка: чем оно меньше ( чем больше разность р. Кs-р. Ка), тем лучше • желательно выбирать растворитель с большим значением р. Кs, тогда шкала кислотности (р. Н) будет больше.
При выборе подходящего растворителя руководствуются следующими соображениями. • Если титруют одно вещество • для усиления его кислотно-основных свойств выбирают растворитель с противоположной функцией • для улучшения условий титрования (чтобы был выше скачок) следует учитывать соотношение Кs/Ка: чем оно меньше ( чем больше разность р. Кs-р. Ка), тем лучше • желательно выбирать растворитель с большим значением р. Кs, тогда шкала кислотности (р. Н) будет больше.
 Если титруют смесь веществ • можно выбрать нивелирующий растворитель (с противоположной функцией), тогда оттитровывают смесь разом, т. е. находят суммарную концентрацию. • если требуется раститровать смесь, т. е. определить все компоненты порознь, надо выбрать дифференцирующий растворитель(с той же функцией)
Если титруют смесь веществ • можно выбрать нивелирующий растворитель (с противоположной функцией), тогда оттитровывают смесь разом, т. е. находят суммарную концентрацию. • если требуется раститровать смесь, т. е. определить все компоненты порознь, надо выбрать дифференцирующий растворитель(с той же функцией)
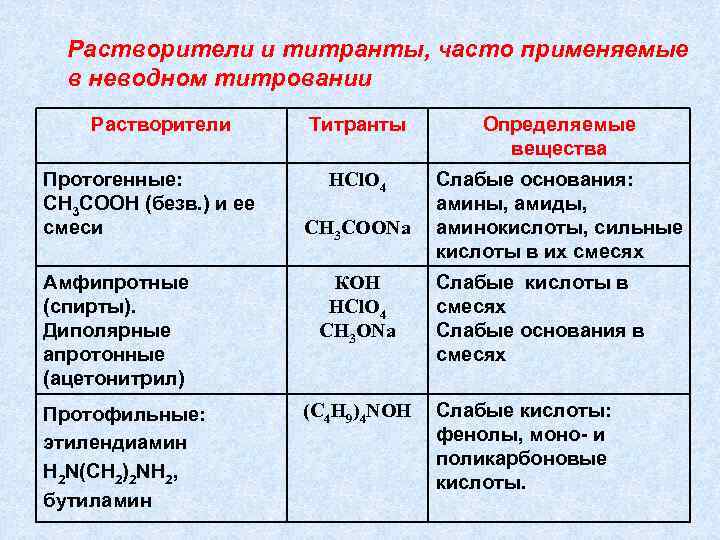 Растворители и титранты, часто применяемые в неводном титровании Растворители Протогенные: СН 3 СООН (безв. ) и ее смеси Амфипротные (спирты). Диполярные апротонные (ацетонитрил) Протофильные: этилендиамин H 2 N(СН 2)2 NH 2, бутиламин Титранты Определяемые вещества HCl. O 4 Слабые основания: амины, амиды, аминокислоты, сильные кислоты в их смесях СН 3 СООNa КОН HCl. O 4 СН 3 ОNa (С 4 Н 9)4 NOH Слабые кислоты в смесях Слабые основания в смесях Слабые кислоты: фенолы, моно- и поликарбоновые кислоты.
Растворители и титранты, часто применяемые в неводном титровании Растворители Протогенные: СН 3 СООН (безв. ) и ее смеси Амфипротные (спирты). Диполярные апротонные (ацетонитрил) Протофильные: этилендиамин H 2 N(СН 2)2 NH 2, бутиламин Титранты Определяемые вещества HCl. O 4 Слабые основания: амины, амиды, аминокислоты, сильные кислоты в их смесях СН 3 СООNa КОН HCl. O 4 СН 3 ОNa (С 4 Н 9)4 NOH Слабые кислоты в смесях Слабые основания в смесях Слабые кислоты: фенолы, моно- и поликарбоновые кислоты.
 Техника кислотно-основного титрования в неводных средах • Растворители должны иметь достаточную степень чистоты. • Для уменьшения расхода неводных растворителей пользуются малыми объемами титруемого раствора и титранта – 1 -2 мл. • Титрант добавляют из микробюретки с точностью 0, 01 мл. • Титрование проводят обязательно под тягой. • Отработанные растворы собирают, а затем неводные растворители регенерируют для повторного использования.
Техника кислотно-основного титрования в неводных средах • Растворители должны иметь достаточную степень чистоты. • Для уменьшения расхода неводных растворителей пользуются малыми объемами титруемого раствора и титранта – 1 -2 мл. • Титрант добавляют из микробюретки с точностью 0, 01 мл. • Титрование проводят обязательно под тягой. • Отработанные растворы собирают, а затем неводные растворители регенерируют для повторного использования.
 Метод нейтрализации в анализе нефтепродуктов • В нефти и нефтепродуктах содержатся нафтеновые, карбоновые и оксикарбоновые кислоты, фенолы и другие кислые вещества, присутствие которых крайне нежелательно. • Особенно это относится к низкомолекулярным жирным кислотам, обладающим большой коррозионной активностью. Поэтому содержание кислых органических соединений строго нормируется. • Для оценки их содержания используют следующие характеристики: • Кислотность н/п – мг КОН/100 см 3 - для светлых (жидких) нефтепродуктов • Кислотное число – мг КОН/ г – для масел и мазутов • Нормативным документом, по которому определяют кислотность или кислотное число нефтепродуктов, является ГОСТ 5985 -79.
Метод нейтрализации в анализе нефтепродуктов • В нефти и нефтепродуктах содержатся нафтеновые, карбоновые и оксикарбоновые кислоты, фенолы и другие кислые вещества, присутствие которых крайне нежелательно. • Особенно это относится к низкомолекулярным жирным кислотам, обладающим большой коррозионной активностью. Поэтому содержание кислых органических соединений строго нормируется. • Для оценки их содержания используют следующие характеристики: • Кислотность н/п – мг КОН/100 см 3 - для светлых (жидких) нефтепродуктов • Кислотное число – мг КОН/ г – для масел и мазутов • Нормативным документом, по которому определяют кислотность или кислотное число нефтепродуктов, является ГОСТ 5985 -79.
 • Растворитель – этиловый спирт • Титрант – спиртовый раствор КОН • Для стандартизации раствора КОН используют янтарную кислоту, или бифталат калия. • Индикатор – фенолфталеин. • Титрование ведут методом отдельных навесок.
• Растворитель – этиловый спирт • Титрант – спиртовый раствор КОН • Для стандартизации раствора КОН используют янтарную кислоту, или бифталат калия. • Индикатор – фенолфталеин. • Титрование ведут методом отдельных навесок.


