MMO for students.ppt
- Количество слайдов: 16

Метод молекулярных орбиталей (Линейная комбинация атомных орбиталей) ММО (ЛКАО) Электроны принадлежат молекуле в целом. Вместо атомных орбиталей рассматриваются молекулярные орбитали.

В образовании химической связи могут участвовать как пара, так и один электрон. Состояние электронов в молекулах соответствует принципам минимальной энергии, Паули и Гунда.

Молекулярные орбитали строятся из атомных орбиталей путем линейных комбинаций, т. е. путем сложения и вычитания волновых функций. Из N атомных получают N молекулярных орбиталей.

При ЛКАО форму молекулярных орбиталей можно предвидеть, зная форму атомных орбиталей. Во втором периоде валентными электронами являются только s-, px, py , pz.
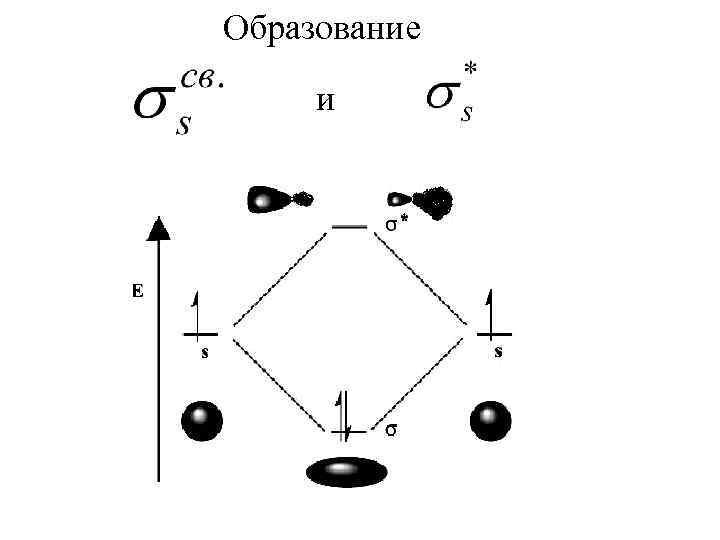
Образование и
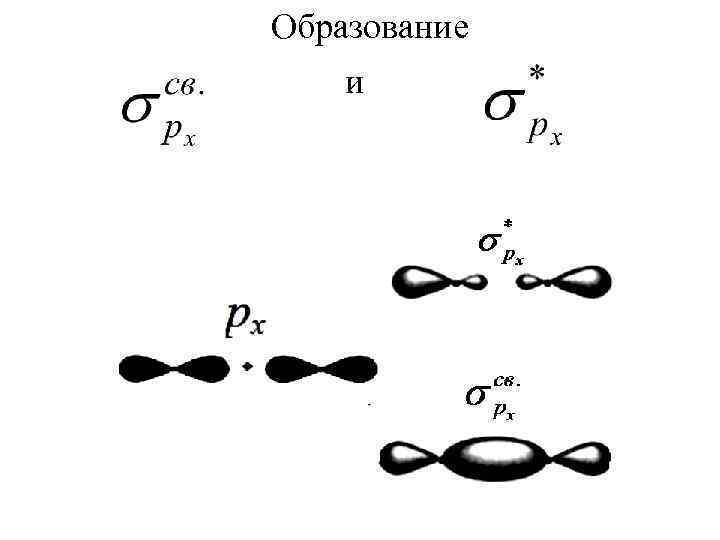
Образование и
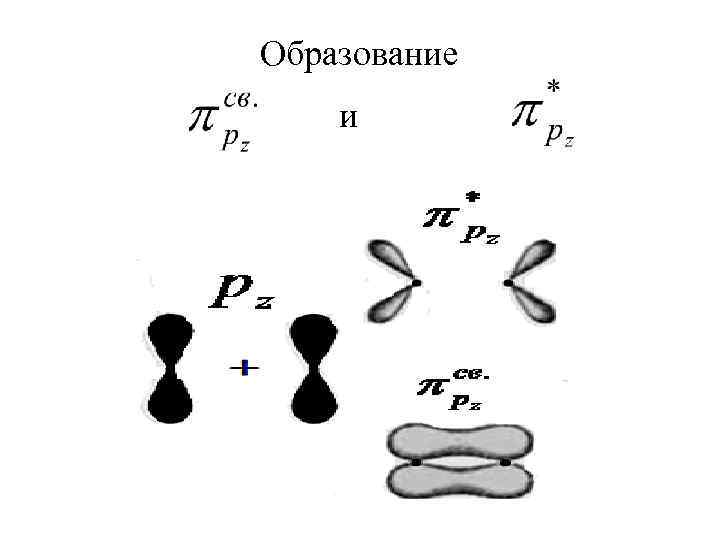
Образование и
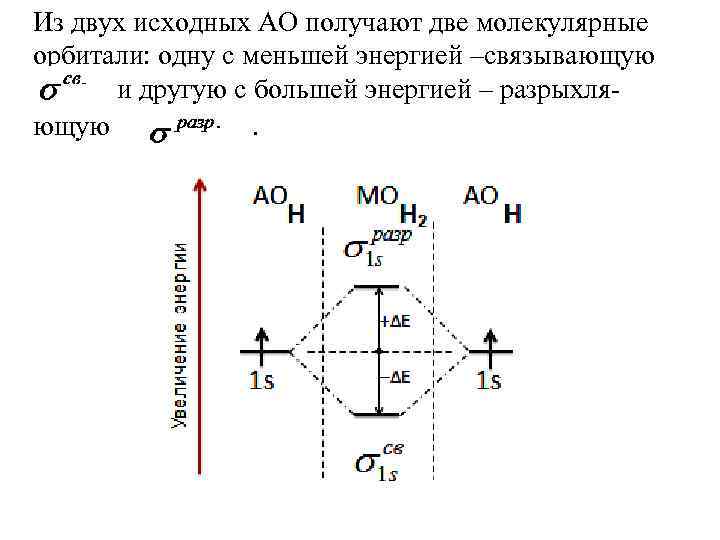
Из двух исходных АО получают две молекулярные орбитали: одну с меньшей энергией –связывающую и другую с большей энергией – разрыхляющую. .
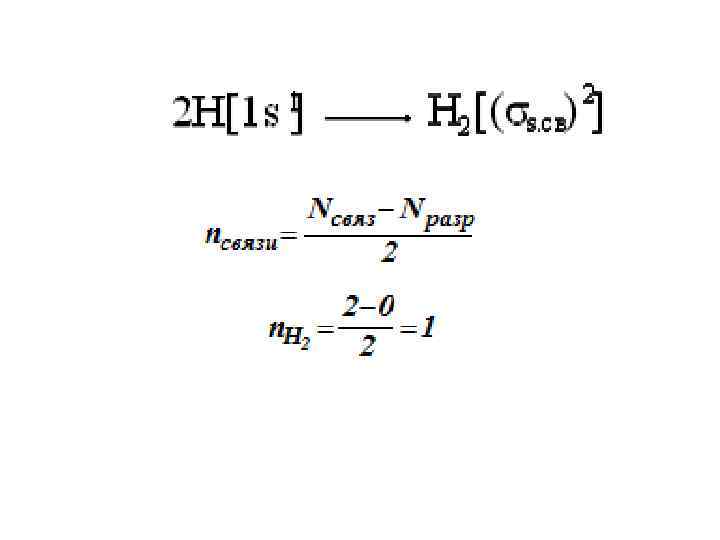
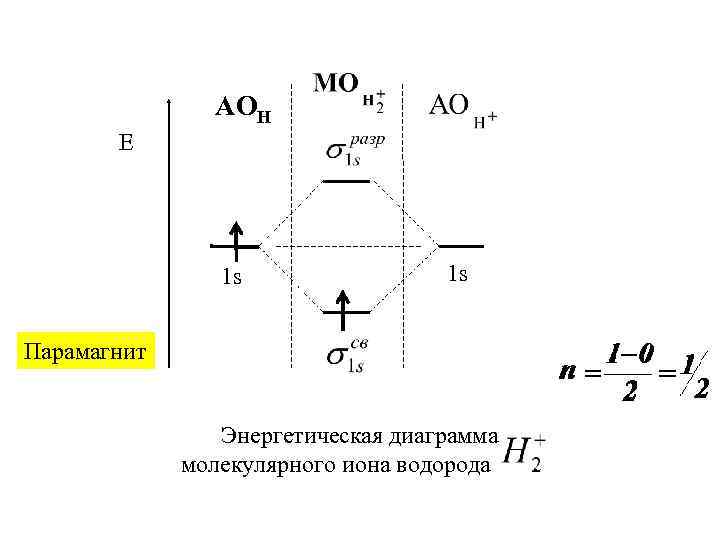
АОН Е 1 s 1 s Парамагнит Энергетическая диаграмма молекулярного иона водорода .

Последовательность расположения молекулярных орбиталей в зависимости от возрастания их энергии: *<σ <σ *< σ1 s 2 s 2 s < πy* = πz* < σx*
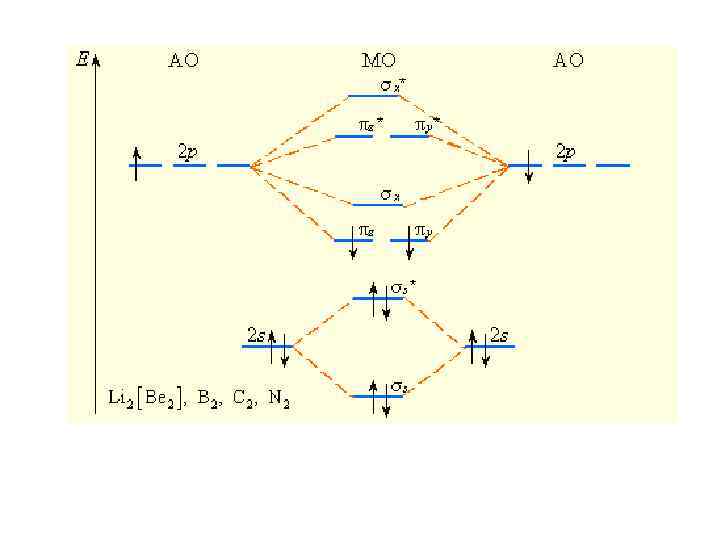
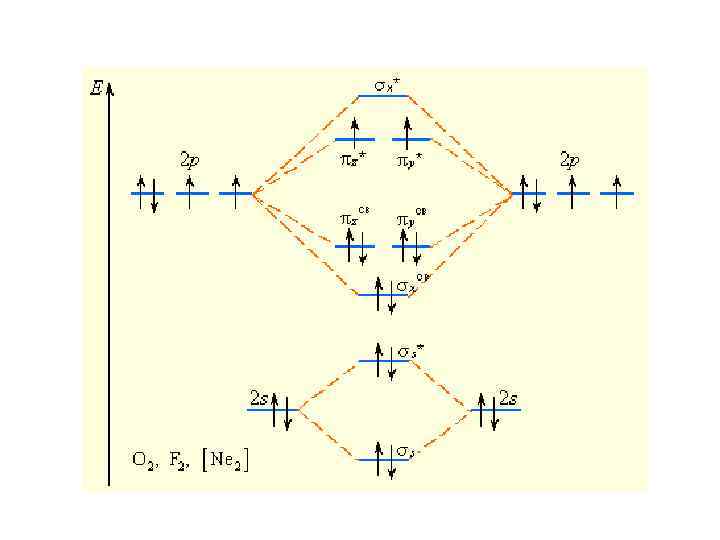

Изоэлектронные частицы + NO N 2, CO, имеют одинаковый набор МО, одинаковую энергетическую последовательность, заселенность электронами и одинаковый порядок связи
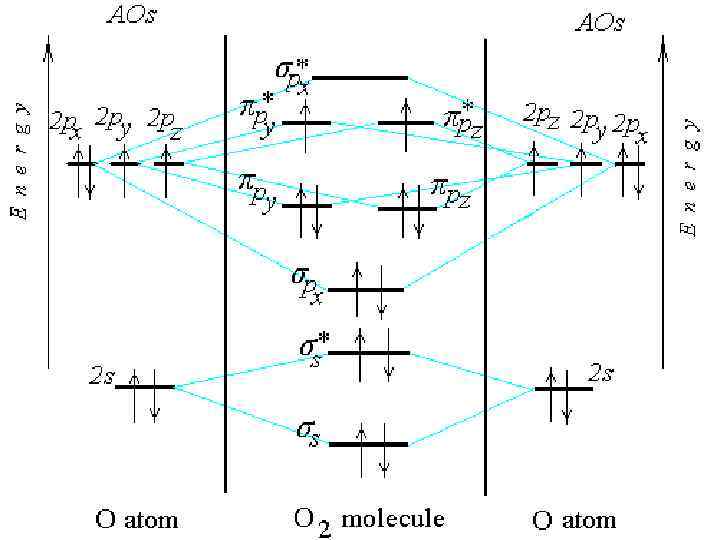
O 2

O 2 (KK) s 2 2 p 2 s* x 2 2 *1 *1 y z Обозначение (KK) относится к внутренним электронам в O 2 N 2 2 s*2 p 2 2 2 (KK) s x y z
MMO for students.ppt