13_metod_MO_Hukkela.ppt
- Количество слайдов: 42
 Метод МО Хюккеля Семинар 13
Метод МО Хюккеля Семинар 13
 Метод молекулярных орбиталей Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО ЛКАО. Несколько приближений: Каждая МО в методе Хюккеля строится в виде линейной комбинации атомных орбиталей (ЛКАО): i = С 1 1 + С 2 2 +. . . + С n n Полный набор МО: n — число атомов
Метод молекулярных орбиталей Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО ЛКАО. Несколько приближений: Каждая МО в методе Хюккеля строится в виде линейной комбинации атомных орбиталей (ЛКАО): i = С 1 1 + С 2 2 +. . . + С n n Полный набор МО: n — число атомов
 Система уравнений Рутана для нахождения коэффициентов Сi имеет вид: матричные элементы оператора Фока интегралы перекрывания для данной пары атомов орбитальная энергия В методе МОХ F и S находятся экспериментально! МОХ относится к большой группе т. н. полуэмпирических вариантов общего метода МО.
Система уравнений Рутана для нахождения коэффициентов Сi имеет вид: матричные элементы оператора Фока интегралы перекрывания для данной пары атомов орбитальная энергия В методе МОХ F и S находятся экспериментально! МОХ относится к большой группе т. н. полуэмпирических вариантов общего метода МО.
 Еще одно приближение Fii = Fjj = (т. н. остовный интеграл) (что все атомы, входящие в состав молекулы, одинаковы по своей химической природе) Третье приближение недиагональные интегралы Fij Пары атомов с хим. связями Пары атомов без хим. связей Fij = (т. н. резонансный интеграл) Fij = 0 Структура матрицы уравнений Рутана в методе Хюккеля определенным образом "приспосабливается" к топологии молекулы. Поэтому метод МОХ относится к классу т. н. топологических вариантов МО.
Еще одно приближение Fii = Fjj = (т. н. остовный интеграл) (что все атомы, входящие в состав молекулы, одинаковы по своей химической природе) Третье приближение недиагональные интегралы Fij Пары атомов с хим. связями Пары атомов без хим. связей Fij = (т. н. резонансный интеграл) Fij = 0 Структура матрицы уравнений Рутана в методе Хюккеля определенным образом "приспосабливается" к топологии молекулы. Поэтому метод МОХ относится к классу т. н. топологических вариантов МО.
 Четвертое приближение Такой подход называется приближением нулевого дифференциального перекрывания (НДП) После сделанных приближений разделим все элементы матрицы на число Система уравнений Рутана
Четвертое приближение Такой подход называется приближением нулевого дифференциального перекрывания (НДП) После сделанных приближений разделим все элементы матрицы на число Система уравнений Рутана
 Система является однородной (все правые части равны 0). Такие системы имеют решения только тогда, когда определитель системы равен нулю. Раскрыв этот определитель, получим характеристическое уравнение, имеющее n корней {x 1, x 2, . . . , xn} При подстановке их в систему, получим n экземпляров системы, причем все они будут заведомо совместны (разрешимы). Энергии соответствующих орбиталей легко рассчитать через значения корней: i = – • хi.
Система является однородной (все правые части равны 0). Такие системы имеют решения только тогда, когда определитель системы равен нулю. Раскрыв этот определитель, получим характеристическое уравнение, имеющее n корней {x 1, x 2, . . . , xn} При подстановке их в систему, получим n экземпляров системы, причем все они будут заведомо совместны (разрешимы). Энергии соответствующих орбиталей легко рассчитать через значения корней: i = – • хi.
 ЭТИЛЕН Электроны -типа описываются двухцентровыми МО 1 = С 1 а pa + C 1 b pb 2 = С 2 а pa + C 2 b pb Уравнения Рутана имеют простой вид: характеристическое уравнение: х2 – 1 = 0 х1 = +1 и х2 = – 1 С 1 a = (0, 5)1/2 и C 1 b = – (0, 5)1/2 С 2 a = (0, 5)1/2 и C 2 b = (0, 5)1/2
ЭТИЛЕН Электроны -типа описываются двухцентровыми МО 1 = С 1 а pa + C 1 b pb 2 = С 2 а pa + C 2 b pb Уравнения Рутана имеют простой вид: характеристическое уравнение: х2 – 1 = 0 х1 = +1 и х2 = – 1 С 1 a = (0, 5)1/2 и C 1 b = – (0, 5)1/2 С 2 a = (0, 5)1/2 и C 2 b = (0, 5)1/2
 Таким образом, МО молекулы этилена имеют вид: а соответствующие им энергии равны: 1 = – • х1 = – 2 = – • х2 = + Корреляционная энергетическая диаграмма Разрыхляющая МО Е = 2 Связывающая МО ~ 65 к. Дж/моль (по частоте перехода молекулы в возбуждённое состояние)
Таким образом, МО молекулы этилена имеют вид: а соответствующие им энергии равны: 1 = – • х1 = – 2 = – • х2 = + Корреляционная энергетическая диаграмма Разрыхляющая МО Е = 2 Связывающая МО ~ 65 к. Дж/моль (по частоте перехода молекулы в возбуждённое состояние)
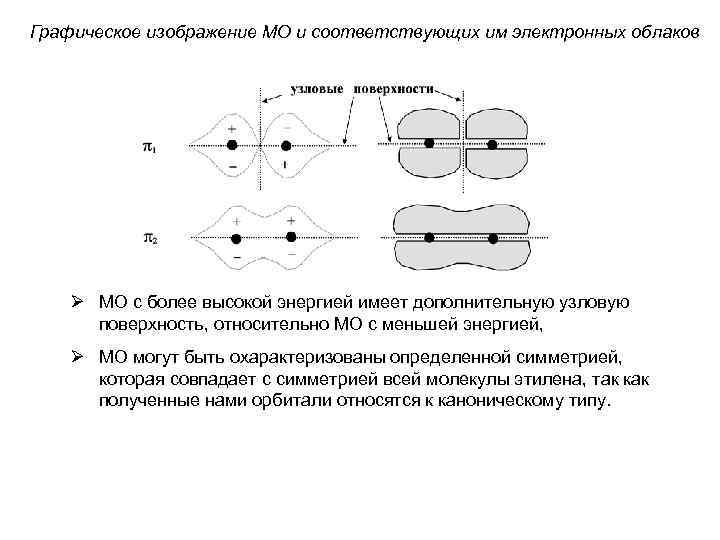 Графическое изображение МО и соответствующих им электронных облаков Ø МО с более высокой энергией имеет дополнительную узловую поверхность, относительно МО с меньшей энергией, Ø МО могут быть охарактеризованы определенной симметрией, которая совпадает с симметрией всей молекулы этилена, так как полученные нами орбитали относятся к каноническому типу.
Графическое изображение МО и соответствующих им электронных облаков Ø МО с более высокой энергией имеет дополнительную узловую поверхность, относительно МО с меньшей энергией, Ø МО могут быть охарактеризованы определенной симметрией, которая совпадает с симметрией всей молекулы этилена, так как полученные нами орбитали относятся к каноническому типу.
 ЦИКЛОБУТАДИЕН Уравнения Рутана вырождение При подстановке вырожденного корня Ca = – Cc и Сb = – Cd Поскольку поднаборы никак не связаны между собой, любая их линейная комбинация является решением системы:
ЦИКЛОБУТАДИЕН Уравнения Рутана вырождение При подстановке вырожденного корня Ca = – Cc и Сb = – Cd Поскольку поднаборы никак не связаны между собой, любая их линейная комбинация является решением системы:
 Чтобы не перечислять все эти орбитали, мы можем выбрать из них две линейно независимые и взаимно ортогональные МО, которые будут играть роль базиса в этом двумерном пространстве. Например, такой базис можно получить, если положить: Возможны и другие варианты выбора базиса. Например, образуем еще один базис из предыдущего путем построения суммы и разности орбиталей ' и '' + = (0, 5)1/2 [ ' + '' ] – = (0, 5)1/2 [ ' – '' ] + = 0, 5 ( pa + pb – pс – pd ) + = – = 0, 5 ( pa – pb – pс + pd ) – = Ситуация аналогична модели плоского ротатора!
Чтобы не перечислять все эти орбитали, мы можем выбрать из них две линейно независимые и взаимно ортогональные МО, которые будут играть роль базиса в этом двумерном пространстве. Например, такой базис можно получить, если положить: Возможны и другие варианты выбора базиса. Например, образуем еще один базис из предыдущего путем построения суммы и разности орбиталей ' и '' + = (0, 5)1/2 [ ' + '' ] – = (0, 5)1/2 [ ' – '' ] + = 0, 5 ( pa + pb – pс – pd ) + = – = 0, 5 ( pa – pb – pс + pd ) – = Ситуация аналогична модели плоского ротатора!
 Общие решения ЛИНЕЙНЫЕ ПОЛИЕНЫ Определитель Хюккеля для таких молекул
Общие решения ЛИНЕЙНЫЕ ПОЛИЕНЫ Определитель Хюккеля для таких молекул
 Все энергетические уровни линейных молекул лежат в узком интервале от + 2 до – 2 , располагаясь, по мере увеличения числа атомов, все более и более тесно: энергетические зоны полупроводниковые свойства связывающие и разрыхляющие энергетические уровни располагаются симметрично, относительно атомного уровня ( ). Для нечетных полиенов (нечетное число атомов) наблюдается, кроме того, один несвязывающий уровень.
Все энергетические уровни линейных молекул лежат в узком интервале от + 2 до – 2 , располагаясь, по мере увеличения числа атомов, все более и более тесно: энергетические зоны полупроводниковые свойства связывающие и разрыхляющие энергетические уровни располагаются симметрично, относительно атомного уровня ( ). Для нечетных полиенов (нечетное число атомов) наблюдается, кроме того, один несвязывающий уровень.
 Общее решение существует и для коэффициентов МО: Для каждой МО рассчитаем набор углов: k = ( • k • ) / (n + 1) Построим для каждого такого угла (угол нужно отсчитывать от горизонтальной оси) радиус-вектор в круге радиусом R = [2 / (n + 1)]1/2. Проекции этих векторов на вертикальную ось и дадут величины коэффициентов Сk
Общее решение существует и для коэффициентов МО: Для каждой МО рассчитаем набор углов: k = ( • k • ) / (n + 1) Построим для каждого такого угла (угол нужно отсчитывать от горизонтальной оси) радиус-вектор в круге радиусом R = [2 / (n + 1)]1/2. Проекции этих векторов на вертикальную ось и дадут величины коэффициентов Сk
 Рассмотрим для примера молекулу бутадиена 4 атома k=1 4 МО Углы: 1 = /5; 2 /5; 3 /5; 4 /5 Коэффициенты: {0, 372 0, 602 0, 372}. Молекулярная орбиталь: k=2 Углы: : 2 = 2 /5; 4 /5; 6 /5; 8 /5. Коэффициенты : {0, 602 0, 372 Молекулярная орбиталь: – 0, 372 – 0, 602}
Рассмотрим для примера молекулу бутадиена 4 атома k=1 4 МО Углы: 1 = /5; 2 /5; 3 /5; 4 /5 Коэффициенты: {0, 372 0, 602 0, 372}. Молекулярная орбиталь: k=2 Углы: : 2 = 2 /5; 4 /5; 6 /5; 8 /5. Коэффициенты : {0, 602 0, 372 Молекулярная орбиталь: – 0, 372 – 0, 602}
 1 4 k=3 Углы: 3 = 3 /5; 6 /5; 9 /5; 12 /5 Коэффициенты: {0, 602 – 0, 372 0, 602}. 3 2 Молекулярная орбиталь: 3 1 k=4 Углы: 4 = 4 /5; 8 /5; 12 /5; 16 /5 Коэффициенты: {0, 372 – 0, 602 – 0, 372} Молекулярная орбиталь: 4 2
1 4 k=3 Углы: 3 = 3 /5; 6 /5; 9 /5; 12 /5 Коэффициенты: {0, 602 – 0, 372 0, 602}. 3 2 Молекулярная орбиталь: 3 1 k=4 Углы: 4 = 4 /5; 8 /5; 12 /5; 16 /5 Коэффициенты: {0, 372 – 0, 602 – 0, 372} Молекулярная орбиталь: 4 2
 Циклические полиены (аннулены) +2 +1 +1 -1 -2 +1 +1 N=3 -1 -2 N=6 (циклопропенил) Первый радиус-вектор (бензол)
Циклические полиены (аннулены) +2 +1 +1 -1 -2 +1 +1 N=3 -1 -2 N=6 (циклопропенил) Первый радиус-вектор (бензол)
 Основное отличие циклических систем: энергетические уровни являются дважды вырожденными (за исключением самого нижнего у всех циклов и самого верхнего у четных циклов) число связывающих МО нечетное (2 n + 1) полная электронная емкость равна 2(2 n + 1) = 4 n + 2 Правило Хюккеля Ароматической является плоская моноциклическая сопряженная система, содержащая (4 n + 2) -электронов (где n = 0, 1, 2…). Если число электронов в аннулене можно выразить как 4 n, то два из этих электронов будут располагаться на паре вырожденных МО, то молекула приобретет электронную конфигурацию бирадикала и будет отличаться повышенной химической активностью. Такие структуры называются антиароматическими.
Основное отличие циклических систем: энергетические уровни являются дважды вырожденными (за исключением самого нижнего у всех циклов и самого верхнего у четных циклов) число связывающих МО нечетное (2 n + 1) полная электронная емкость равна 2(2 n + 1) = 4 n + 2 Правило Хюккеля Ароматической является плоская моноциклическая сопряженная система, содержащая (4 n + 2) -электронов (где n = 0, 1, 2…). Если число электронов в аннулене можно выразить как 4 n, то два из этих электронов будут располагаться на паре вырожденных МО, то молекула приобретет электронную конфигурацию бирадикала и будет отличаться повышенной химической активностью. Такие структуры называются антиароматическими.
 Ароматические молекулы и ионы. N= 3 4 5 6 7 n = 2 2 6 6 6 +2 + – +
Ароматические молекулы и ионы. N= 3 4 5 6 7 n = 2 2 6 6 6 +2 + – +
 Коэффициенты МО в аннуленах могут быть единообразно выражены через комплексные числа типа: Рассмотрим пример трехчленного цикла. Матрица коэффициентов МО будет выглядеть так:
Коэффициенты МО в аннуленах могут быть единообразно выражены через комплексные числа типа: Рассмотрим пример трехчленного цикла. Матрица коэффициентов МО будет выглядеть так:
 Построим из комплексных МО действительные линейные комбинации: + = (1/2)0, 5 ( 1 + 2) = = (1/6)0, 5 { e i(2 /3) + e i(-2 /3) ; e i(-2 /3) + e i(2 /3) ; 1 + 1 } = = (1/6)0, 5 {2 cos(2 /3); 2} = (1/6)0, 5 {-1; 2}. – = (1/2)0, 5 ( 1 – 2) = (1/6)0, 5 {2 sin(2 /3); – 2 sin(2 /3); 0} = = (1/6)0, 5 { 3 ; – 3 ; 0 }. Таким образом, набор коэффициентов действительных МО можно записать в виде матрицы:
Построим из комплексных МО действительные линейные комбинации: + = (1/2)0, 5 ( 1 + 2) = = (1/6)0, 5 { e i(2 /3) + e i(-2 /3) ; e i(-2 /3) + e i(2 /3) ; 1 + 1 } = = (1/6)0, 5 {2 cos(2 /3); 2} = (1/6)0, 5 {-1; 2}. – = (1/2)0, 5 ( 1 – 2) = (1/6)0, 5 {2 sin(2 /3); – 2 sin(2 /3); 0} = = (1/6)0, 5 { 3 ; – 3 ; 0 }. Таким образом, набор коэффициентов действительных МО можно записать в виде матрицы:
 Графические изображения самих МО и соответствующих им электронных облаков о – Формулы для расчета коэффициентов действительных МО в общем виде + узловые плоскости
Графические изображения самих МО и соответствующих им электронных облаков о – Формулы для расчета коэффициентов действительных МО в общем виде + узловые плоскости
![Расчет молекулярных характеристик Электронная плотность атомов n = [ ni (Ci )2] i заселенность Расчет молекулярных характеристик Электронная плотность атомов n = [ ni (Ci )2] i заселенность](https://present5.com/presentation/-30315190_87164931/image-23.jpg) Расчет молекулярных характеристик Электронная плотность атомов n = [ ni (Ci )2] i заселенность данной МО (число электронов) no коэффициент МО с номером i при атоме с номером n число электронов, поставляемых данным атомом в общую электронную оболочку молекулы. избыточный электрический заряд, локализованный в области пространства молекулы, занимаемой данным атомом
Расчет молекулярных характеристик Электронная плотность атомов n = [ ni (Ci )2] i заселенность данной МО (число электронов) no коэффициент МО с номером i при атоме с номером n число электронов, поставляемых данным атомом в общую электронную оболочку молекулы. избыточный электрический заряд, локализованный в области пространства молекулы, занимаемой данным атомом
 Порядок химической связи Для заданной пары атомов с номерами и Рассчитанные порядки относятся только к p-связям. Полные порядки связи между атомами можно получить, добавив соответствующие величины для порядков -связей. Индекс свободной валентности In = Nmax - Pn Nmax - некоторая калибровочная константа (для атомов углерода она, обычно принимается равной 1, 732 Pn- сумма порядков всех связей π-типа, которые атом с номером n образует со своими соседями
Порядок химической связи Для заданной пары атомов с номерами и Рассчитанные порядки относятся только к p-связям. Полные порядки связи между атомами можно получить, добавив соответствующие величины для порядков -связей. Индекс свободной валентности In = Nmax - Pn Nmax - некоторая калибровочная константа (для атомов углерода она, обычно принимается равной 1, 732 Pn- сумма порядков всех связей π-типа, которые атом с номером n образует со своими соседями
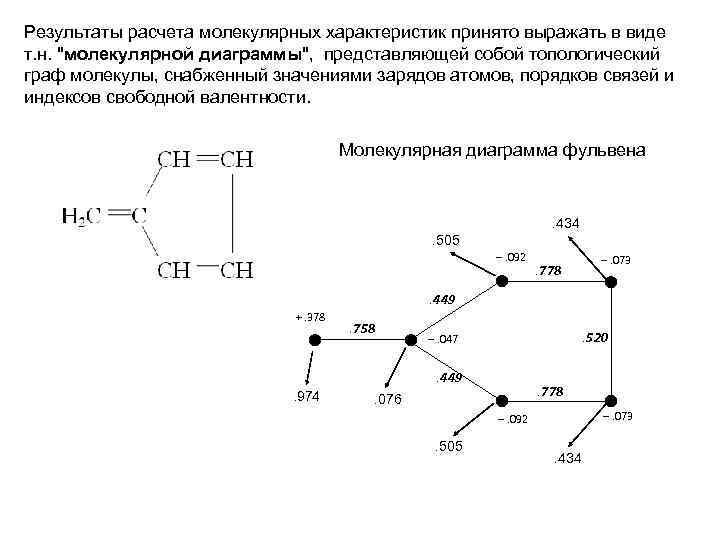 Результаты расчета молекулярных характеристик принято выражать в виде т. н. "молекулярной диаграммы", представляющей собой топологический граф молекулы, снабженный значениями зарядов атомов, порядков связей и индексов свободной валентности. Молекулярная диаграмма фульвена . 434. 505 –. 092 . 778 –. 073 . 449 +. 378 . 758 . 520 –. 047. 449 . 974 . 778 . 076 –. 073 –. 092 . 505 . 434
Результаты расчета молекулярных характеристик принято выражать в виде т. н. "молекулярной диаграммы", представляющей собой топологический граф молекулы, снабженный значениями зарядов атомов, порядков связей и индексов свободной валентности. Молекулярная диаграмма фульвена . 434. 505 –. 092 . 778 –. 073 . 449 +. 378 . 758 . 520 –. 047. 449 . 974 . 778 . 076 –. 073 –. 092 . 505 . 434
 Кроме того, можно встретить и другой способ описания молекулярных характеристик – в виде т. н. "матрицы порядков" квадратная матрица, размером (n n) по диагонали ее располагаются электронные плотности атомов недиагональным элементам соответствуют порядки -связей для данной пары атомов Эти формулы были предложены Коулсоном, и матрица поэтому часто называется "матрицей Коулсона"
Кроме того, можно встретить и другой способ описания молекулярных характеристик – в виде т. н. "матрицы порядков" квадратная матрица, размером (n n) по диагонали ее располагаются электронные плотности атомов недиагональным элементам соответствуют порядки -связей для данной пары атомов Эти формулы были предложены Коулсоном, и матрица поэтому часто называется "матрицей Коулсона"
 Молекулярные характеристики подчиняются некоторым общим закономерностям, связанным с типом строения молекулы. углеводородные молекулы альтернантные (АУ) топологический граф может быть раскрашен в два цвета, причем так, что никакие одинаково окрашенные вершины не связаны между собой неальтернантные (НАУ) такую раску найти нельзя
Молекулярные характеристики подчиняются некоторым общим закономерностям, связанным с типом строения молекулы. углеводородные молекулы альтернантные (АУ) топологический граф может быть раскрашен в два цвета, причем так, что никакие одинаково окрашенные вершины не связаны между собой неальтернантные (НАУ) такую раску найти нельзя
 Перечислим некоторые правила: в четных АУ величины х имеют вид хk энергетические уровни расположены всегда симметрично, относительно нулевого уровня ( ) среди них могут быть и нулевые (циклические структуры), тогда в молекуле имеется две вырожденные несвязывающие МО в нечетных АУ величины х имеют вид 0, хk среди энергетических уровней обязательно имеется и нулевой ( ), соответствующий несвязывающей МО для нециклических НАУ все величины х различны между собой (за исключением случайных совпадений), и все энергетические уровни невырождены; для циклических НАУ дважды вырожденные уровни располагаются несимметрично, относительно нулевого уровня и среди них нет уровня с (несвязывающей МО) для АУ (как четных, так и нечетных) все атомные электронные плотности равны 1, а электрические заряды атомов равны нулю (за исключением молекулярных ионов)
Перечислим некоторые правила: в четных АУ величины х имеют вид хk энергетические уровни расположены всегда симметрично, относительно нулевого уровня ( ) среди них могут быть и нулевые (циклические структуры), тогда в молекуле имеется две вырожденные несвязывающие МО в нечетных АУ величины х имеют вид 0, хk среди энергетических уровней обязательно имеется и нулевой ( ), соответствующий несвязывающей МО для нециклических НАУ все величины х различны между собой (за исключением случайных совпадений), и все энергетические уровни невырождены; для циклических НАУ дважды вырожденные уровни располагаются несимметрично, относительно нулевого уровня и среди них нет уровня с (несвязывающей МО) для АУ (как четных, так и нечетных) все атомные электронные плотности равны 1, а электрические заряды атомов равны нулю (за исключением молекулярных ионов)
 Молекулы с гетероатомами в методе МОХ —С—С—С— q r —С—Х—С— s q r s (Сr ) (Xr ) (Cq — Cr) (Cq — Xr) и (Cr — Cs) (Xr — Cs) новые интегралы (X) и (CХ) могут быть выражены через известные стандартные величины (С) и (CС) (X) = (С) + h • (CС) поправки (CХ) = K • (CС)
Молекулы с гетероатомами в методе МОХ —С—С—С— q r —С—Х—С— s q r s (Сr ) (Xr ) (Cq — Cr) (Cq — Xr) и (Cr — Cs) (Xr — Cs) новые интегралы (X) и (CХ) могут быть выражены через известные стандартные величины (С) и (CС) (X) = (С) + h • (CС) поправки (CХ) = K • (CС)
 матрица и определитель Хюккеля 0 K 0 x K 0 K +h K K x+h K K 0 K x 0 Система параметров Стрейтвизера K ~ разница в размерах гетероатома и атома углерода Тип связи любой >C=O h 0 1. 0 K 1 1. 0 >C=C—O: 2. 0 0. 8 >C=N– 0. 5 1. 0 >C=C—N: 1. 5 0. 8 >C=S 0. 4 1. 0 >C=C—S: h ~ электроотрицательность Атом C O 1. 3 0. 6 F >C=C—F: 3. 0 0. 7 Cl >C=C—Cl: 2. 0 0. 4 Br >C=C—Br: 1. 5 0. 3 I >C=C—I: 1. 3 0. 25 N гетероатомы S >С=Х >C=C—X:
матрица и определитель Хюккеля 0 K 0 x K 0 K +h K K x+h K K 0 K x 0 Система параметров Стрейтвизера K ~ разница в размерах гетероатома и атома углерода Тип связи любой >C=O h 0 1. 0 K 1 1. 0 >C=C—O: 2. 0 0. 8 >C=N– 0. 5 1. 0 >C=C—N: 1. 5 0. 8 >C=S 0. 4 1. 0 >C=C—S: h ~ электроотрицательность Атом C O 1. 3 0. 6 F >C=C—F: 3. 0 0. 7 Cl >C=C—Cl: 2. 0 0. 4 Br >C=C—Br: 1. 5 0. 3 I >C=C—I: 1. 3 0. 25 N гетероатомы S >С=Х >C=C—X:
 Винилхлорид >C= C — Cl: h = 2. 0 х 1 0 1 х 0. 4 0 K = 0. 4 1. 027 0. 4 х+2 = х3 + 2 х2 – 1. 16 х – 2 = 0 х = – 0. 928 – 2. 099 Решив уравнения Рутана, найдем и коэффициенты МО: C 1 C 2 0. 695 – 0. 733 Cl ni 0. 012 РС 1 0 0. 710 0. 659 – 0. 246 * РС 2 2 0. 114 0. 239 РCl 2 0. 964 Располагая коэффициентами МО и заселенностями, рассчитаем молекулярные параметры: n. C 1 = 1. 034 no = 1 Q = – 0. 034 n. C 2 = 0. 983 no = 1 Q = + 0. 017 PC-C = 0. 990 n. Cl = 1. 980 no = 2 Q = + 0. 020 PC-Cl = 0. 137
Винилхлорид >C= C — Cl: h = 2. 0 х 1 0 1 х 0. 4 0 K = 0. 4 1. 027 0. 4 х+2 = х3 + 2 х2 – 1. 16 х – 2 = 0 х = – 0. 928 – 2. 099 Решив уравнения Рутана, найдем и коэффициенты МО: C 1 C 2 0. 695 – 0. 733 Cl ni 0. 012 РС 1 0 0. 710 0. 659 – 0. 246 * РС 2 2 0. 114 0. 239 РCl 2 0. 964 Располагая коэффициентами МО и заселенностями, рассчитаем молекулярные параметры: n. C 1 = 1. 034 no = 1 Q = – 0. 034 n. C 2 = 0. 983 no = 1 Q = + 0. 017 PC-C = 0. 990 n. Cl = 1. 980 no = 2 Q = + 0. 020 PC-Cl = 0. 137
 Молекулярная диаграмма (порядки связей указаны с учетом и -связей) имеет вид: классическая структурная формула винилхлорида неклассическая структурная формула мезомерный эффект Указанные на диаграмме заряды атомов обусловлены только -электронами, а индуктивные эффекты смещения -электронов не учтены (поскольку это выходит за рамки простого метода Хюккеля)
Молекулярная диаграмма (порядки связей указаны с учетом и -связей) имеет вид: классическая структурная формула винилхлорида неклассическая структурная формула мезомерный эффект Указанные на диаграмме заряды атомов обусловлены только -электронами, а индуктивные эффекты смещения -электронов не учтены (поскольку это выходит за рамки простого метода Хюккеля)
 Корреляционная диаграмма МО суммарная энергия без сопряжения 6 суммарная энергия с учётом сопряжения 2 0. 928 + 2 2. 099 = 6. 053 0. 053 энергия сопряжения
Корреляционная диаграмма МО суммарная энергия без сопряжения 6 суммарная энергия с учётом сопряжения 2 0. 928 + 2 2. 099 = 6. 053 0. 053 энергия сопряжения
 Амидная группа кислород h = 1. 0 азот h = 1. 5 K = 1. 0 K = 0. 8 Запишем матрицу Хюккеля и характеристическое уравнение: коэффициенты МО C O N ni 0. 840 – 0. 460 – 0. 289 0. 193 0. 749 – 0. 634 0. 508 0. 476 0. 717 РС * 0 РO 2 РN 2
Амидная группа кислород h = 1. 0 азот h = 1. 5 K = 1. 0 K = 0. 8 Запишем матрицу Хюккеля и характеристическое уравнение: коэффициенты МО C O N ni 0. 840 – 0. 460 – 0. 289 0. 193 0. 749 – 0. 634 0. 508 0. 476 0. 717 РС * 0 РO 2 РN 2
 Молекулярные характеристики n. C = 0. 591 no = 1 Q = + 0. 409 n. O = 1. 575 no = 1 Q = – 0. 575 n. N = 1. 832 no = 2 Q = + 0. 168 PC-O = 0. 773 PC-N = 0. 484 Молекулярная диаграмма и ее классический аналог имеют вид: "Неклассическая" формула амидной группы:
Молекулярные характеристики n. C = 0. 591 no = 1 Q = + 0. 409 n. O = 1. 575 no = 1 Q = – 0. 575 n. N = 1. 832 no = 2 Q = + 0. 168 PC-O = 0. 773 PC-N = 0. 484 Молекулярная диаграмма и ее классический аналог имеют вид: "Неклассическая" формула амидной группы:
 Корреляционная диаграмма
Корреляционная диаграмма
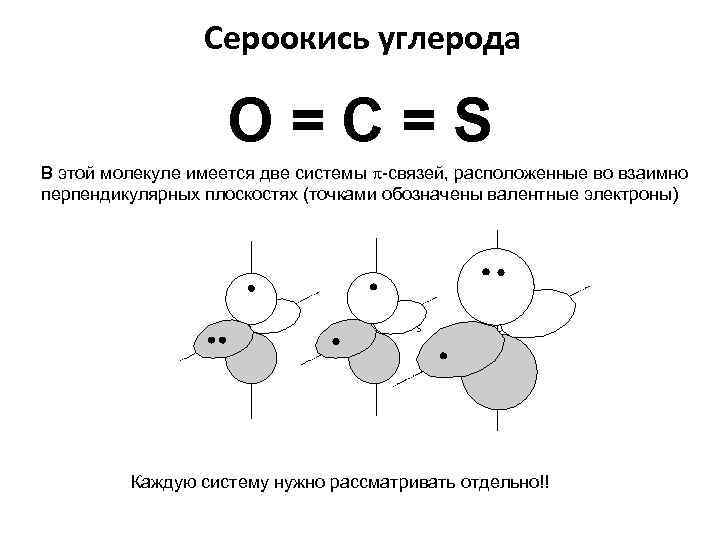 Сероокись углерода O=С=S В этой молекуле имеется две системы -связей, расположенные во взаимно перпендикулярных плоскостях (точками обозначены валентные электроны) O C S Каждую систему нужно рассматривать отдельно!!
Сероокись углерода O=С=S В этой молекуле имеется две системы -связей, расположенные во взаимно перпендикулярных плоскостях (точками обозначены валентные электроны) O C S Каждую систему нужно рассматривать отдельно!!
 Вертикальная плоскость Решение Хюккелевской матрицы выглядит так: Коэффициенты МО и молекулярные характеристики:
Вертикальная плоскость Решение Хюккелевской матрицы выглядит так: Коэффициенты МО и молекулярные характеристики:
 Горизонтальная плоскость Решение Хюккелевской матрицы выглядит так: Коэффициенты МО и молекулярные характеристики:
Горизонтальная плоскость Решение Хюккелевской матрицы выглядит так: Коэффициенты МО и молекулярные характеристики:
 Для того, чтобы найти суммарные параметры молекулы, необходимо сложить величины, соответствующие отдельным подсистемам: Можно построить суммарные диаграммы
Для того, чтобы найти суммарные параметры молекулы, необходимо сложить величины, соответствующие отдельным подсистемам: Можно построить суммарные диаграммы
 Недостатки метода Хюккеля Во-первых, это возможность расчета только -электронных свойств молекул. Во-вторых, полуэмпиричность метода приводит к необходимости экспериментального определения величины , являющейся наиболее важной величиной.
Недостатки метода Хюккеля Во-первых, это возможность расчета только -электронных свойств молекул. Во-вторых, полуэмпиричность метода приводит к необходимости экспериментального определения величины , являющейся наиболее важной величиной.
 КОНЕЦ
КОНЕЦ


