4.метилирование ДНК 2 декабря 2012.ppt
- Количество слайдов: 72
 Метилирование ДНК и его роль в регуляции экспрессии генов
Метилирование ДНК и его роль в регуляции экспрессии генов
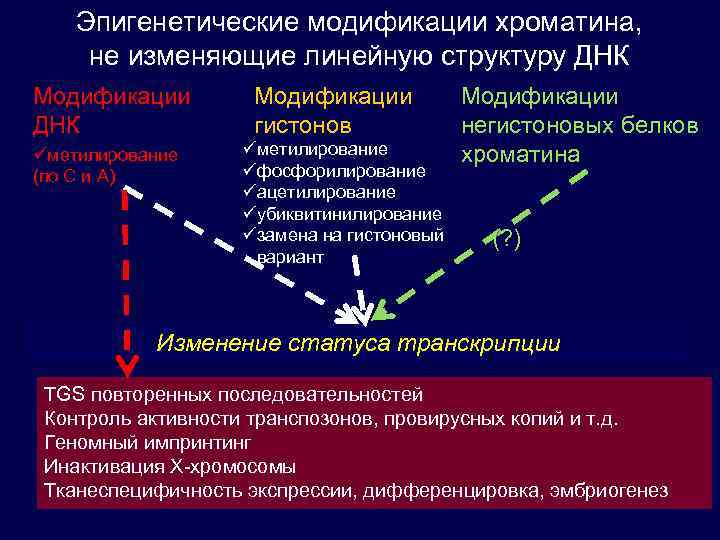 Эпигенетические модификации хроматина, не изменяющие линейную структуру ДНК Модификации ДНК üметилирование (по C и A) Модификации гистонов üметилирование üфосфорилирование üацетилирование üубиквитинилирование üзамена на гистоновый вариант Модификации негистоновых белков хроматина (? ) Изменение статуса транскрипции TGS повторенных последовательностей Контроль активности транспозонов, провирусных копий и т. д. Геномный импринтинг Инактивация Х-хромосомы Тканеспецифичность экспрессии, дифференцировка, эмбриогенез
Эпигенетические модификации хроматина, не изменяющие линейную структуру ДНК Модификации ДНК üметилирование (по C и A) Модификации гистонов üметилирование üфосфорилирование üацетилирование üубиквитинилирование üзамена на гистоновый вариант Модификации негистоновых белков хроматина (? ) Изменение статуса транскрипции TGS повторенных последовательностей Контроль активности транспозонов, провирусных копий и т. д. Геномный импринтинг Инактивация Х-хромосомы Тканеспецифичность экспрессии, дифференцировка, эмбриогенез
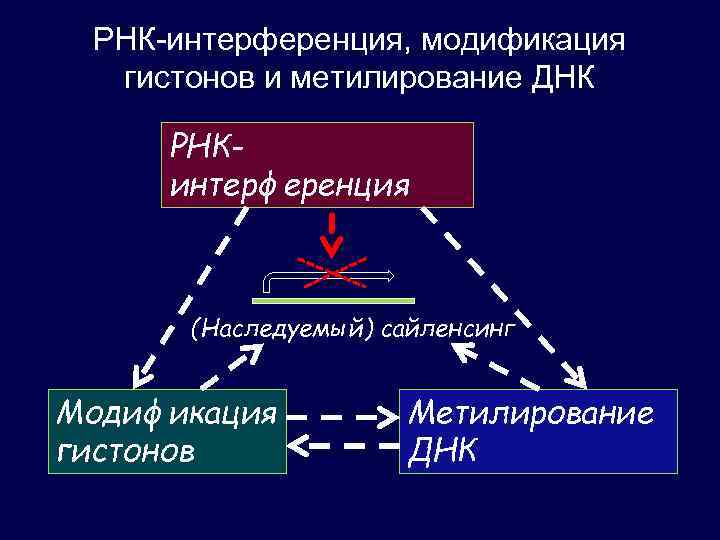 РНК-интерференция, модификация гистонов и метилирование ДНК РНКинтерференция (Наследуемый) сайленсинг Модификация гистонов Метилирование ДНК
РНК-интерференция, модификация гистонов и метилирование ДНК РНКинтерференция (Наследуемый) сайленсинг Модификация гистонов Метилирование ДНК
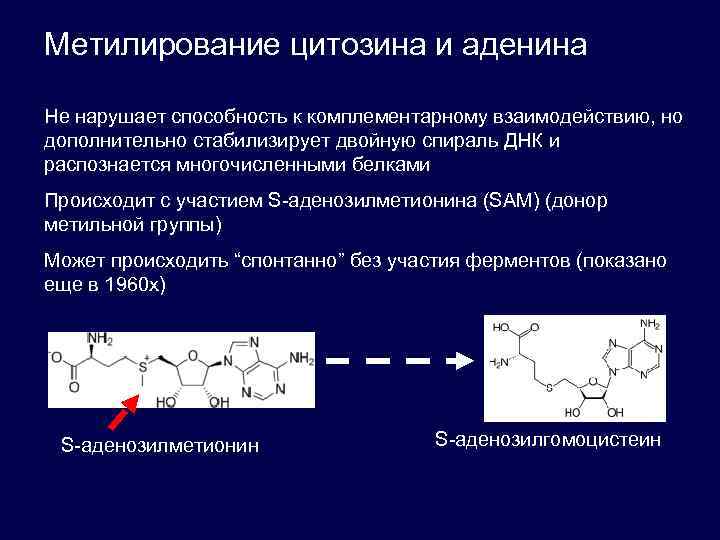 Метилирование цитозина и аденина Не нарушает способность к комплементарному взаимодействию, но дополнительно стабилизирует двойную спираль ДНК и распознается многочисленными белками Происходит с участием S-аденозилметионина (SAM) (донор метильной группы) Может происходить “спонтанно” без участия ферментов (показано еще в 1960 х) S-аденозилметионин S-аденозилгомоцистеин
Метилирование цитозина и аденина Не нарушает способность к комплементарному взаимодействию, но дополнительно стабилизирует двойную спираль ДНК и распознается многочисленными белками Происходит с участием S-аденозилметионина (SAM) (донор метильной группы) Может происходить “спонтанно” без участия ферментов (показано еще в 1960 х) S-аденозилметионин S-аденозилгомоцистеин
 Метилирование цитозина и аденина In vivo цитозин метилируется значительно чаще, чем аденин В результате “спонтанного” дезаминирования метилированного цитозина возникает тимин, что приводит к мутации, закрепляемой при репликации ДНК Наиболее эффективно “спонтанно” метилируется цитозин в мотиве Cp. G То же самое происходит в геномах in vivo, результат – элиминация мотивов Cp. G (у растений – Cp. Np. G) Большинство актов метилирования in vivo происходит не спонтанно, а с участием ферментов-метилаз me Cp. G Gp. C me 5
Метилирование цитозина и аденина In vivo цитозин метилируется значительно чаще, чем аденин В результате “спонтанного” дезаминирования метилированного цитозина возникает тимин, что приводит к мутации, закрепляемой при репликации ДНК Наиболее эффективно “спонтанно” метилируется цитозин в мотиве Cp. G То же самое происходит в геномах in vivo, результат – элиминация мотивов Cp. G (у растений – Cp. Np. G) Большинство актов метилирования in vivo происходит не спонтанно, а с участием ферментов-метилаз me Cp. G Gp. C me 5
 Относительная распространенность Cp. G у разных организмов За 400 млн лет позвоночными утрачено 75% Cp. G Содержание мотива Cp. G всегда ниже статистического (соответствует 1 в данной шкале, 1/16 при 50% GC-составе) Gentles AJ. , Karlin S. Genome-scale compositional comparisons in eukaryotes. Genome Res. 2001 S.
Относительная распространенность Cp. G у разных организмов За 400 млн лет позвоночными утрачено 75% Cp. G Содержание мотива Cp. G всегда ниже статистического (соответствует 1 в данной шкале, 1/16 при 50% GC-составе) Gentles AJ. , Karlin S. Genome-scale compositional comparisons in eukaryotes. Genome Res. 2001 S.
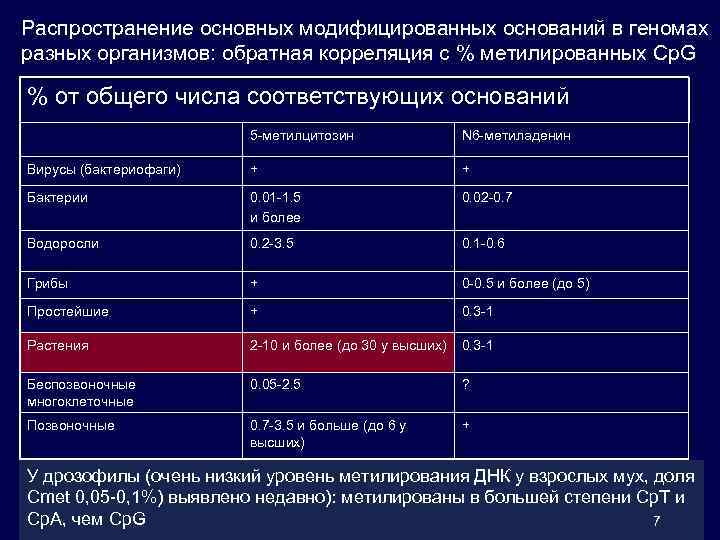 Распространение основных модифицированных оснований в геномах разных организмов: обратная корреляция с % метилированных Cp. G % от общего числа соответствующих оснований 5 -метилцитозин N 6 -метиладенин Вирусы (бактериофаги) + + Бактерии 0. 01 -1. 5 и более 0. 02 -0. 7 Водоросли 0. 2 -3. 5 0. 1 -0. 6 Грибы + 0 -0. 5 и более (до 5) Простейшие + 0. 3 -1 Растения 2 -10 и более (до 30 у высших) 0. 3 -1 Беспозвоночные многоклеточные 0. 05 -2. 5 ? Позвоночные 0. 7 -3. 5 и больше (до 6 у высших) + У дрозофилы (очень низкий уровень метилирования ДНК у взрослых мух, доля Сmet 0, 05 -0, 1%) выявлено недавно): метилированы в большей степени Cp. T и Ср. А, чем Cp. G 7
Распространение основных модифицированных оснований в геномах разных организмов: обратная корреляция с % метилированных Cp. G % от общего числа соответствующих оснований 5 -метилцитозин N 6 -метиладенин Вирусы (бактериофаги) + + Бактерии 0. 01 -1. 5 и более 0. 02 -0. 7 Водоросли 0. 2 -3. 5 0. 1 -0. 6 Грибы + 0 -0. 5 и более (до 5) Простейшие + 0. 3 -1 Растения 2 -10 и более (до 30 у высших) 0. 3 -1 Беспозвоночные многоклеточные 0. 05 -2. 5 ? Позвоночные 0. 7 -3. 5 и больше (до 6 у высших) + У дрозофилы (очень низкий уровень метилирования ДНК у взрослых мух, доля Сmet 0, 05 -0, 1%) выявлено недавно): метилированы в большей степени Cp. T и Ср. А, чем Cp. G 7
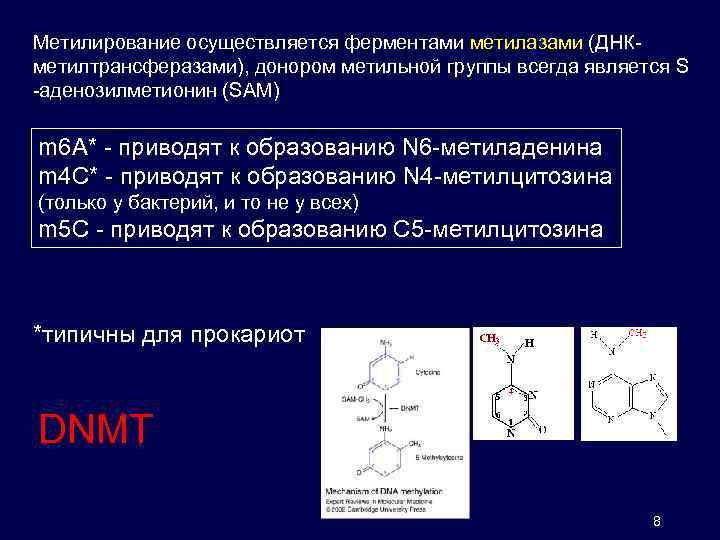 Метилирование осуществляется ферментами метилазами (ДНКметилтрансферазами), донором метильной группы всегда является S -аденозилметионин (SAM) m 6 A* - приводят к образованию N 6 -метиладенина m 4 C* - приводят к образованию N 4 -метилцитозина (только у бактерий, и то не у всех) m 5 C - приводят к образованию С 5 -метилцитозина *типичны для прокариот DNMT 8
Метилирование осуществляется ферментами метилазами (ДНКметилтрансферазами), донором метильной группы всегда является S -аденозилметионин (SAM) m 6 A* - приводят к образованию N 6 -метиладенина m 4 C* - приводят к образованию N 4 -метилцитозина (только у бактерий, и то не у всех) m 5 C - приводят к образованию С 5 -метилцитозина *типичны для прокариот DNMT 8
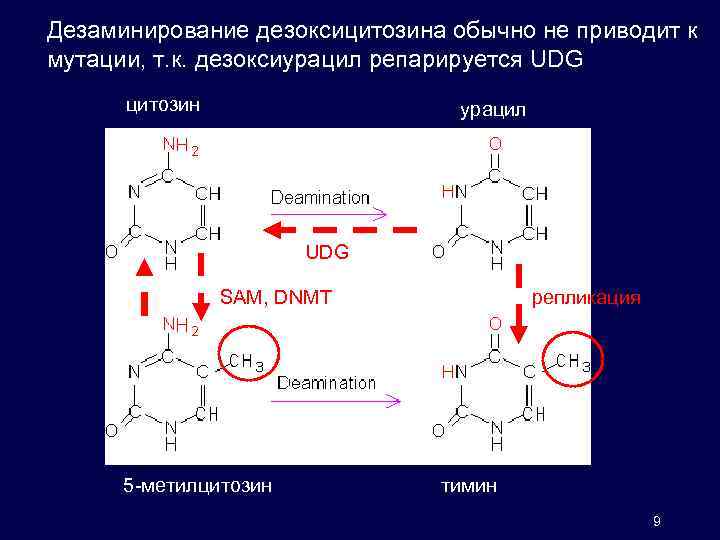 Дезаминирование дезоксицитозина обычно не приводит к мутации, т. к. дезоксиурацил репарируется UDG цитозин урацил UDG SAM, DNMT 5 -метилцитозин репликация тимин 9
Дезаминирование дезоксицитозина обычно не приводит к мутации, т. к. дезоксиурацил репарируется UDG цитозин урацил UDG SAM, DNMT 5 -метилцитозин репликация тимин 9
 6 -метиладенин Обнаружен у бактерий (системы рестрикции-модификации, регуляция репликации) Позже выявлен у растений (у них выделена первая метиладенинтрансфераза), затем у некоторых насекомых Имеется у архей и простейших (у последних выделены соответствующие метилазы и эндонуклеазы – защита от инфекции? ) У Ciliata – только в макронуклеусе TGATCA TGm 6 ATCA Растения обладают чувствительными к метилированию Ado. Metзависимыми эндонуклеазами Возможно, у них подобно микроорганизмам и некоторым низшим эукариотам, существует система рестрикции–модификации (R–М). ? Роль неясна
6 -метиладенин Обнаружен у бактерий (системы рестрикции-модификации, регуляция репликации) Позже выявлен у растений (у них выделена первая метиладенинтрансфераза), затем у некоторых насекомых Имеется у архей и простейших (у последних выделены соответствующие метилазы и эндонуклеазы – защита от инфекции? ) У Ciliata – только в макронуклеусе TGATCA TGm 6 ATCA Растения обладают чувствительными к метилированию Ado. Metзависимыми эндонуклеазами Возможно, у них подобно микроорганизмам и некоторым низшим эукариотам, существует система рестрикции–модификации (R–М). ? Роль неясна
 ДНК-метилтрансферазы прокариот Dam метилазы – метилируют аденин по положению N 6 в мотивах типа CC(A/T)GG компонент РМ-систем, участвуют в регуляторных процессах, в т. ч. регуляции репликации Формируют DMP (DNA methylation patterns) Dcm метилазы – метилируют цитозин по положению C 5 в мотивах GATC Ccr. M метилазы – метилируют цитозин по положению C 5 в мотивах типа GAn. TC все они сиквенс-специфичны компонент РМ-систем участвуют в регуляторных процессах, в т. ч. регуляции клеточного цикла и контроле вирулентности метилирование аденозина в GATCпоследовательностях в геноме прокариот может приводить к ошибкам копирования в ходе рекомбинации
ДНК-метилтрансферазы прокариот Dam метилазы – метилируют аденин по положению N 6 в мотивах типа CC(A/T)GG компонент РМ-систем, участвуют в регуляторных процессах, в т. ч. регуляции репликации Формируют DMP (DNA methylation patterns) Dcm метилазы – метилируют цитозин по положению C 5 в мотивах GATC Ccr. M метилазы – метилируют цитозин по положению C 5 в мотивах типа GAn. TC все они сиквенс-специфичны компонент РМ-систем участвуют в регуляторных процессах, в т. ч. регуляции клеточного цикла и контроле вирулентности метилирование аденозина в GATCпоследовательностях в геноме прокариот может приводить к ошибкам копирования в ходе рекомбинации
 ü У эукариот метилирование ДНК – один из ключевых механизмов регуляции развития и клеточной дифференцировки. Другая важная функция – подавление экспрессии чужеродных последовательностей и мобильных элементов ü Метилирование ДНК эукариот обратимо, паттерн метилирования ДНК создается равновесием между метилированием и деметилированием ü Метилирование в основном активно, а деметилирование может быть активным (катализируется ферментами) и пассивным (отсутствие метилирования в очередном цикле репликации) В клетках млекопитающих действуют по крайней мере две системы метилирования, за которые отвечают разные метилазы Метилирование de novo вносит элементы изменчивости в профиль метилирования Поддерживающее метилирование обеспечивает поддержание уже сформированного профиля
ü У эукариот метилирование ДНК – один из ключевых механизмов регуляции развития и клеточной дифференцировки. Другая важная функция – подавление экспрессии чужеродных последовательностей и мобильных элементов ü Метилирование ДНК эукариот обратимо, паттерн метилирования ДНК создается равновесием между метилированием и деметилированием ü Метилирование в основном активно, а деметилирование может быть активным (катализируется ферментами) и пассивным (отсутствие метилирования в очередном цикле репликации) В клетках млекопитающих действуют по крайней мере две системы метилирования, за которые отвечают разные метилазы Метилирование de novo вносит элементы изменчивости в профиль метилирования Поддерживающее метилирование обеспечивает поддержание уже сформированного профиля
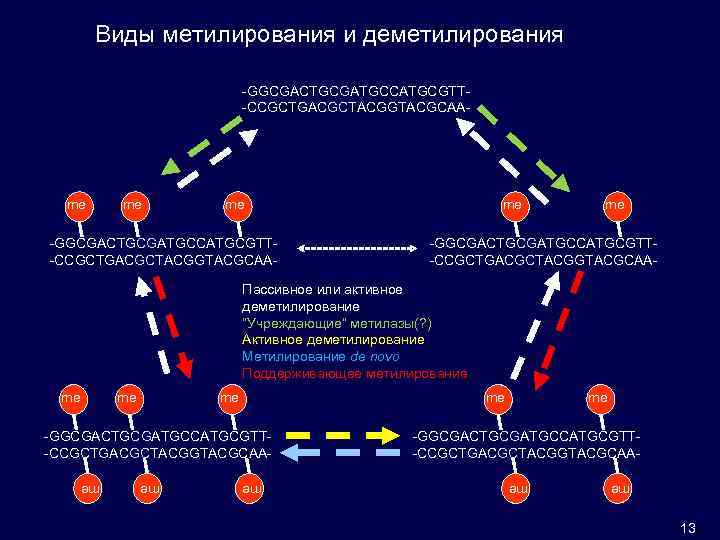 Виды метилирования и деметилирования -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- me me me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- Пассивное или активное деметилирование “Учреждающие” метилазы(? ) Активное деметилирование Метилирование de novo Поддерживающее метилирование me me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAAme me 13 me me me
Виды метилирования и деметилирования -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- me me me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- Пассивное или активное деметилирование “Учреждающие” метилазы(? ) Активное деметилирование Метилирование de novo Поддерживающее метилирование me me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAA- me -GGCGACTGCGATGCCATGCGTT-CCGCTGACGCTACGGTACGCAAme me 13 me me me
 гаметы, зигота Метилированная ДНК деметилирование раннее дробление Деметилированная ДНК (“clean state”? ) метилирование de novo (волнами при имплантации эмбриона) дифференцировка Метилированная зрелые ДНК ДНК соматические Метилированная клетки ДНК ДНК Поддерживающее метилирование активируется при каждом клеточном делении Фрагменты Оказаки : аденилируются у бактерий, у растений паттерны метилирования и его степень отличаются от лигированной ДНК! Метилазы чувствительны к другим ингибиторам 14
гаметы, зигота Метилированная ДНК деметилирование раннее дробление Деметилированная ДНК (“clean state”? ) метилирование de novo (волнами при имплантации эмбриона) дифференцировка Метилированная зрелые ДНК ДНК соматические Метилированная клетки ДНК ДНК Поддерживающее метилирование активируется при каждом клеточном делении Фрагменты Оказаки : аденилируются у бактерий, у растений паттерны метилирования и его степень отличаются от лигированной ДНК! Метилазы чувствительны к другим ингибиторам 14
 ДНК-метилтрансферазы эукариот Крупные (около 190 к. Да) однодоменные белки Zn-зависимы С-конец — каталитический, в пределах 500 ак гомологичен бактериальным метилазам N-конец – регуляторный домен, богат цистеином, связывает ионы Zn и ответственен за подавление неспецифического метилирования de novo Наименьшая суммарная активность в G 1 фазе клеточного цикла, увеличивается к S-фазе и опять падает в G 2/М «Проскакивание» : при метилировании полуметилированных CG-пар эукариотическими метилазами близкорасположенные неметилированные CG-пары также могут быть метилированы 15
ДНК-метилтрансферазы эукариот Крупные (около 190 к. Да) однодоменные белки Zn-зависимы С-конец — каталитический, в пределах 500 ак гомологичен бактериальным метилазам N-конец – регуляторный домен, богат цистеином, связывает ионы Zn и ответственен за подавление неспецифического метилирования de novo Наименьшая суммарная активность в G 1 фазе клеточного цикла, увеличивается к S-фазе и опять падает в G 2/М «Проскакивание» : при метилировании полуметилированных CG-пар эукариотическими метилазами близкорасположенные неметилированные CG-пары также могут быть метилированы 15
 ДНК-метилтрансферазы высших позвоночных Dnmt 1: поддерживающая метилаза локализуется в фокусах репликации спрединг в 3’направлении, способна проявлять активность метилазы de novo, но сродство к полуметилированной ДНК на 1 -2 порядка выше есть несколько изоформ, в т. ч. ооцитспецифичная ЭСК, дефицитные по DNMT 1, жизнеспособны мутанты: эмбриональная летальность, глобальное гипометилирование, потеря импринтинга Dnmt 3 a: de novo метилаза но: in vitro одинаковая активность на полуметилированной и неметилированной ДНК – возможна поддерживающая активность мутанты: постнатальная летальность Dnmt 3 b: de novo метилаза одинаковая активность на полуметилированной и неметилированной ДНК, предпочитает мини- и микросателлиты необходима для метилирования центромерных минисателлитных повторов нарушение синтеза Dnmt 3 b у человека – редкий ICF syndrome у человека – редкий (Immunodeficiency, Centromeric instability, Facial anomalies)
ДНК-метилтрансферазы высших позвоночных Dnmt 1: поддерживающая метилаза локализуется в фокусах репликации спрединг в 3’направлении, способна проявлять активность метилазы de novo, но сродство к полуметилированной ДНК на 1 -2 порядка выше есть несколько изоформ, в т. ч. ооцитспецифичная ЭСК, дефицитные по DNMT 1, жизнеспособны мутанты: эмбриональная летальность, глобальное гипометилирование, потеря импринтинга Dnmt 3 a: de novo метилаза но: in vitro одинаковая активность на полуметилированной и неметилированной ДНК – возможна поддерживающая активность мутанты: постнатальная летальность Dnmt 3 b: de novo метилаза одинаковая активность на полуметилированной и неметилированной ДНК, предпочитает мини- и микросателлиты необходима для метилирования центромерных минисателлитных повторов нарушение синтеза Dnmt 3 b у человека – редкий ICF syndrome у человека – редкий (Immunodeficiency, Centromeric instability, Facial anomalies)
 ДНК-метилтрансферазы высших позвоночных Dnmt 3 l Гомологичен другим DNMT-белкам, но не имеет собственной каталитической активности Поддерживает de novo метилазы Dnmt 3 a и Dnmt 3 b, способствуя Dnmt 3 b связыванию этих ферментов с ДНК и стимулируя их активность Ассоциирует с Dnmt 3 a и Dnmt 3 b, участвует в установлении импринтов во время гаметогенеза и репрессии транскрипции импринтированных генов У мутантов – мужская стерильность, экспрессия обоих аллелей импринтированных генов в гаметах 17
ДНК-метилтрансферазы высших позвоночных Dnmt 3 l Гомологичен другим DNMT-белкам, но не имеет собственной каталитической активности Поддерживает de novo метилазы Dnmt 3 a и Dnmt 3 b, способствуя Dnmt 3 b связыванию этих ферментов с ДНК и стимулируя их активность Ассоциирует с Dnmt 3 a и Dnmt 3 b, участвует в установлении импринтов во время гаметогенеза и репрессии транскрипции импринтированных генов У мутантов – мужская стерильность, экспрессия обоих аллелей импринтированных генов в гаметах 17
 ДНК-метилтрансферазы высших позвоночных Dnmt 2 сиквенсспецифичность? самая консервативная! метилирование некоторых t. РНК В 2006 г. переназвали этот фермент TRDMT 1 (t. RNA aspartic acid methyltransferase 1) Низкая метилазная активность, предполагается роль в метилировании “паразитных” последовательностей, предпочитает центромерные структуры Зачем это нужно? Известно немногое… У Drosophila – защита т. РНК от стресс-индуцируемого расщепления в стрессовых гранулах при тепловом шоке (Schaefer et al. , Genes Dev. 2010) 18
ДНК-метилтрансферазы высших позвоночных Dnmt 2 сиквенсспецифичность? самая консервативная! метилирование некоторых t. РНК В 2006 г. переназвали этот фермент TRDMT 1 (t. RNA aspartic acid methyltransferase 1) Низкая метилазная активность, предполагается роль в метилировании “паразитных” последовательностей, предпочитает центромерные структуры Зачем это нужно? Известно немногое… У Drosophila – защита т. РНК от стресс-индуцируемого расщепления в стрессовых гранулах при тепловом шоке (Schaefer et al. , Genes Dev. 2010) 18
 ДНК-метилтрансферазы высших позвоночных DNMT 1: регуляторный домен обеспечивает доставку к репликативным комплексам активно делящихся клеток Ассоциируют с разнообразными белками (и последовательностями РНК? ): ü гистондеацетилазами (HDAC) ü репрессорами транскрипции, опухолевыми супрессорами (напр. p. Rb, RP 58) ü продуктами генов некоторых онкобелков (напр. PML-RAR). ü белками, связывающими метилированный Cp. G (Me. CP 2/1, MBD 2, MBD 3) в комплексе с ферментами, модифицирующими хроматин 19
ДНК-метилтрансферазы высших позвоночных DNMT 1: регуляторный домен обеспечивает доставку к репликативным комплексам активно делящихся клеток Ассоциируют с разнообразными белками (и последовательностями РНК? ): ü гистондеацетилазами (HDAC) ü репрессорами транскрипции, опухолевыми супрессорами (напр. p. Rb, RP 58) ü продуктами генов некоторых онкобелков (напр. PML-RAR). ü белками, связывающими метилированный Cp. G (Me. CP 2/1, MBD 2, MBD 3) в комплексе с ферментами, модифицирующими хроматин 19
 Деметилирование ДНК Может носить глобальный (млекопитающие – ранние этапы развития зародыша, старение) или специфический характер (геномный импринтинг) Нерешенные вопросы: как регулируется пассивное деметилирование и насколько оно распространено? какие ферменты отвечают за активное деметилирование и каковы его механизмы? ДНК-деметилаза до сих пор не выявлена – уже 12 лет обсуждается кандидатура MBD 2! Необходима для формирования некоторых опухолей, необходимость для Н нормального роста клеток не доказана ü Активирует в модельных экспериментах лишь некоторые промоторы, среди них – промоторы генов опухолевой инвазии ü Ингибиторы – потенциальное средство противоопухолевой терапии (US Patent Ингибиторы – потенциальное средство противоопухолевой терапии 7465714, US Patent Application 20060009403). Ингибирование трансляции MBD 2 приводило к резкому снижению темпов роста клеток аденокарциномы А 549 и рака толстой кишки ACT 116 (Campbell et al. , Carcinogenesis 2004) ü Сейчас у млекопитающих предполагается механизм Base Excision Repair и активное участие ДНК-гликозилаз после ферментативных преобразований метилированного цитозина (см. напр. Nabel, Kohli, Science 2011) (у растений этот путь уже подтвержден), а также участие Dnmt 3 a и Dnmt 3 b (Ooi, Bestor, Cell 2008) и белка 20 Gadd 45 a (Barreto et al. , Nature 2007)
Деметилирование ДНК Может носить глобальный (млекопитающие – ранние этапы развития зародыша, старение) или специфический характер (геномный импринтинг) Нерешенные вопросы: как регулируется пассивное деметилирование и насколько оно распространено? какие ферменты отвечают за активное деметилирование и каковы его механизмы? ДНК-деметилаза до сих пор не выявлена – уже 12 лет обсуждается кандидатура MBD 2! Необходима для формирования некоторых опухолей, необходимость для Н нормального роста клеток не доказана ü Активирует в модельных экспериментах лишь некоторые промоторы, среди них – промоторы генов опухолевой инвазии ü Ингибиторы – потенциальное средство противоопухолевой терапии (US Patent Ингибиторы – потенциальное средство противоопухолевой терапии 7465714, US Patent Application 20060009403). Ингибирование трансляции MBD 2 приводило к резкому снижению темпов роста клеток аденокарциномы А 549 и рака толстой кишки ACT 116 (Campbell et al. , Carcinogenesis 2004) ü Сейчас у млекопитающих предполагается механизм Base Excision Repair и активное участие ДНК-гликозилаз после ферментативных преобразований метилированного цитозина (см. напр. Nabel, Kohli, Science 2011) (у растений этот путь уже подтвержден), а также участие Dnmt 3 a и Dnmt 3 b (Ooi, Bestor, Cell 2008) и белка 20 Gadd 45 a (Barreto et al. , Nature 2007)
 Метилирование ДНК: основные функции (1) Ø Поддержание структуры хроматина и стабильности хромосом Ø Сайленсинг повторенных и интегрированных чужеродных последовательностей Ø Механизм защиты против эффектов встраивания чужеродной ДНК (в т. ч. паразитической) В соответствии с этим, как правило, высоко метилированы: Сателлиты и другие повторяющиеся последовательности Транспозоны, провирусные копии Прочие последовательности, характерные для гетерохроматина 21
Метилирование ДНК: основные функции (1) Ø Поддержание структуры хроматина и стабильности хромосом Ø Сайленсинг повторенных и интегрированных чужеродных последовательностей Ø Механизм защиты против эффектов встраивания чужеродной ДНК (в т. ч. паразитической) В соответствии с этим, как правило, высоко метилированы: Сателлиты и другие повторяющиеся последовательности Транспозоны, провирусные копии Прочие последовательности, характерные для гетерохроматина 21
 Метилирование ДНК: основные функции (2) Ø Тканеспецифичное ненаследуемое долговременное подавление экспрессии генов на уровне транскрипции Ø Формирование профиля экспрессии, характерного для данного типа клеток В соответствии с этим, как правило, высоко метилированы: Транскрипционно неактивные гены (в гаметах – все, кроме экспрессируемых гаметоспецифично) Гены “опухолевой инвазии” и другие онкогены Импринтированные гены И, как правило, гипометилированы: Транскрипционно активные гены (!) непосредственное влияние метилирования на уровень экспрессии гена далеко не всегда понятно 22
Метилирование ДНК: основные функции (2) Ø Тканеспецифичное ненаследуемое долговременное подавление экспрессии генов на уровне транскрипции Ø Формирование профиля экспрессии, характерного для данного типа клеток В соответствии с этим, как правило, высоко метилированы: Транскрипционно неактивные гены (в гаметах – все, кроме экспрессируемых гаметоспецифично) Гены “опухолевой инвазии” и другие онкогены Импринтированные гены И, как правило, гипометилированы: Транскрипционно активные гены (!) непосредственное влияние метилирования на уровень экспрессии гена далеко не всегда понятно 22
 Нормальное метилирование ДНК: Потенциально метилируемые С в мотиве Cp. G в генах обычно метилированы (50 -90%, обычно 70 -80%) в клетках взрослых людей приблизительно 70% Cp. G метилированы Метилирование С вне мотива Cp. G (выявлено в эмбриональных стволовых клетках) составляет незначительную долю (может быть результатом “проскакивания” метилаз) Метилированные Cp. G либо являются одиночными (80% от общего состава, чаще всего в интронах или промоторах тканеспецифичных генов, уровень варьирует в широких пределах), либо сконцентрированы в т. н. Cp. G островках Статус метилирования определяется структурой хроматина и локализацией ряда ферментативных комплексов и активно поддерживается! Дефекты системы метилирования, в т. ч. активности белков, связывающихся с метилированной ДНК, приводят к тяжелым наследственным заболеваниям
Нормальное метилирование ДНК: Потенциально метилируемые С в мотиве Cp. G в генах обычно метилированы (50 -90%, обычно 70 -80%) в клетках взрослых людей приблизительно 70% Cp. G метилированы Метилирование С вне мотива Cp. G (выявлено в эмбриональных стволовых клетках) составляет незначительную долю (может быть результатом “проскакивания” метилаз) Метилированные Cp. G либо являются одиночными (80% от общего состава, чаще всего в интронах или промоторах тканеспецифичных генов, уровень варьирует в широких пределах), либо сконцентрированы в т. н. Cp. G островках Статус метилирования определяется структурой хроматина и локализацией ряда ферментативных комплексов и активно поддерживается! Дефекты системы метилирования, в т. ч. активности белков, связывающихся с метилированной ДНК, приводят к тяжелым наследственным заболеваниям
 У кого есть Cp. G островки, и у кого их нет 24
У кого есть Cp. G островки, и у кого их нет 24
 ДНК-метилтрансферазы эукариот 25
ДНК-метилтрансферазы эукариот 25
 Свойства Cp. G островков У человека - около 45000, имеются в 60% генов, в У человека - около 45000, имеются том числе всех генах “домашнего хозяйства” >200 пн, длина большинства - 0. 5 -3 тпн. Относительно высокий GC-состав (>50, обычно>60%), плотное расположение мотива Cp. G (один на 10 пн, в 10 -20 раз выше, чем в среднем по геному) и его статистическая встречаемость Понижено содержание гистона H 1 в нуклеосомах, остальные гистоны высоко ацетилированы Как правило, содержат мотивы CCGCCC (сайты связывания транскрипционного фактора SP 1) Два определения Cp. G островка: Frommer (1987) Any stretch of DNA greater than 200 bp with a GC content of greater than 50% and an observed to expected Cp. G ratio of greater than 0. 5 Takai (2002) Any stretch of DNA greater than 500 bp with a GC content of greater than 55% and an observed to expected Cp. G ratio of greater than 0. 6
Свойства Cp. G островков У человека - около 45000, имеются в 60% генов, в У человека - около 45000, имеются том числе всех генах “домашнего хозяйства” >200 пн, длина большинства - 0. 5 -3 тпн. Относительно высокий GC-состав (>50, обычно>60%), плотное расположение мотива Cp. G (один на 10 пн, в 10 -20 раз выше, чем в среднем по геному) и его статистическая встречаемость Понижено содержание гистона H 1 в нуклеосомах, остальные гистоны высоко ацетилированы Как правило, содержат мотивы CCGCCC (сайты связывания транскрипционного фактора SP 1) Два определения Cp. G островка: Frommer (1987) Any stretch of DNA greater than 200 bp with a GC content of greater than 50% and an observed to expected Cp. G ratio of greater than 0. 5 Takai (2002) Any stretch of DNA greater than 500 bp with a GC content of greater than 55% and an observed to expected Cp. G ratio of greater than 0. 6
 У позвоночных метилирование островков используется для закрепления статуса экспрессии, который может быть “выбран” иными способами. Установленный статус метилирования, как правило, стабилен и в дальнейшем поддерживается Культура мышечных Культура клеток (в норме ген актина фибробластов (в экспрессируется) норме ген актина не экспрессируется) Трансфекция Нормальная экспрессия неметилированной формой гена актина Трансфекция полностью Сайт-специфичное метилированной деметилирование, формой гена актина нормальная экспрессия Пониженная экспрессия Экспрессия на фоновом уровне (как и эндогенный аналог) При введении неметилированной ДНК в оплодотворенную яйцеклетку мыши метилируются почти все CG-пары Некоторые островки не метилируются in vivo, но метилируются в клеточных культурах 27
У позвоночных метилирование островков используется для закрепления статуса экспрессии, который может быть “выбран” иными способами. Установленный статус метилирования, как правило, стабилен и в дальнейшем поддерживается Культура мышечных Культура клеток (в норме ген актина фибробластов (в экспрессируется) норме ген актина не экспрессируется) Трансфекция Нормальная экспрессия неметилированной формой гена актина Трансфекция полностью Сайт-специфичное метилированной деметилирование, формой гена актина нормальная экспрессия Пониженная экспрессия Экспрессия на фоновом уровне (как и эндогенный аналог) При введении неметилированной ДНК в оплодотворенную яйцеклетку мыши метилируются почти все CG-пары Некоторые островки не метилируются in vivo, но метилируются в клеточных культурах 27
 Cp. G-островки и гены: варианты взаимного расположения ü В основном в промоторах и 5’ районах генов ü Связанные с промотором и первым экзоном ü Внутригенные, не захватывающие старт транскрипции ü Захватывающие последний экзон и 3’UTR ü Межгенные ü Некоторые островки могут захватывать практически весь ген Внутренние экзоны генов млекопитающих обычно метилированы, в то время как внутренние экзоны генов высших растений – нет
Cp. G-островки и гены: варианты взаимного расположения ü В основном в промоторах и 5’ районах генов ü Связанные с промотором и первым экзоном ü Внутригенные, не захватывающие старт транскрипции ü Захватывающие последний экзон и 3’UTR ü Межгенные ü Некоторые островки могут захватывать практически весь ген Внутренние экзоны генов млекопитающих обычно метилированы, в то время как внутренние экзоны генов высших растений – нет
 Cp. G met Cp. G Типичный Cp. G островок в гене домашнего хозяйства Cp. G/Gp. C ~ 1 Cp. G/Gp. C ~ 0, 2 Cp. G островки и промоторы Cp. G в промоторах обычно неметилированы, что необходимо для транскрипции соответствующего гена (метилирование, как правило, приводит к блоку транскрипции) Метилированный фрагмент ДНК подавляет активность расположенного рядом промотора, даже если сам промотор не метилирован (по видимому, путем создания локального неактивного хроматинового домена) Механизмы инактивации: Вовлекают белки, связывающие метилированную ДНК (Me. CPs), играющие роль репрессоров транскрипции Сборка белковых комплексов на хроматине, включающих гистоны, HDAC и пр. , формирование “закрытой структуры” хроматина 29
Cp. G met Cp. G Типичный Cp. G островок в гене домашнего хозяйства Cp. G/Gp. C ~ 1 Cp. G/Gp. C ~ 0, 2 Cp. G островки и промоторы Cp. G в промоторах обычно неметилированы, что необходимо для транскрипции соответствующего гена (метилирование, как правило, приводит к блоку транскрипции) Метилированный фрагмент ДНК подавляет активность расположенного рядом промотора, даже если сам промотор не метилирован (по видимому, путем создания локального неактивного хроматинового домена) Механизмы инактивации: Вовлекают белки, связывающие метилированную ДНК (Me. CPs), играющие роль репрессоров транскрипции Сборка белковых комплексов на хроматине, включающих гистоны, HDAC и пр. , формирование “закрытой структуры” хроматина 29
 Cp. G островки и промоторы В Cp. G островках млекопитающих расположено около 60% всех промоторов РНК-полимеразы II, в т. ч. абсолютное большинство промоторов генов «домашнего хозяйства» . В целом промоторы либо богаты, либо бедны Cp. G мотивами В тех промоторах, которые перекрываются с Cp. G островками, все сайты связывания транскрипционных факторов расположены в пределах Cp. G островков В целом Cp. G-островки - маркеры потенциальной транскрибируемости последовательности (но не обязательной транскрипции) 30
Cp. G островки и промоторы В Cp. G островках млекопитающих расположено около 60% всех промоторов РНК-полимеразы II, в т. ч. абсолютное большинство промоторов генов «домашнего хозяйства» . В целом промоторы либо богаты, либо бедны Cp. G мотивами В тех промоторах, которые перекрываются с Cp. G островками, все сайты связывания транскрипционных факторов расположены в пределах Cp. G островков В целом Cp. G-островки - маркеры потенциальной транскрибируемости последовательности (но не обязательной транскрипции) 30
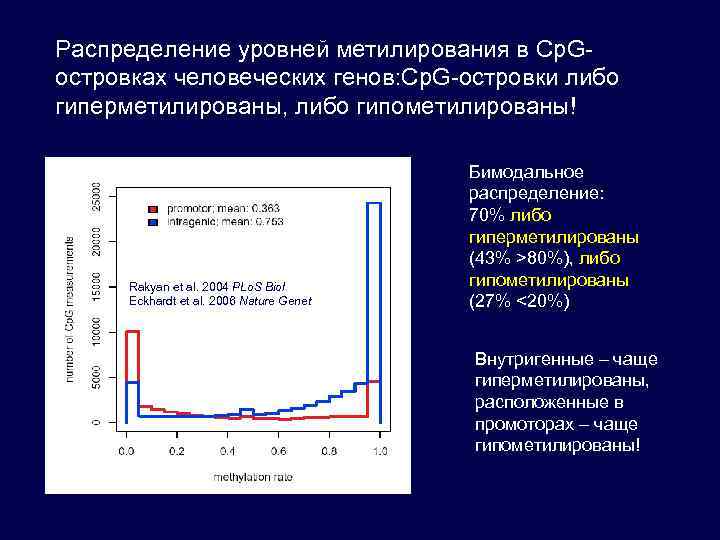 Распределение уровней метилирования в Cp. Gостровках человеческих генов: Cp. G-островки либо гиперметилированы, либо гипометилированы! Rakyan et al. 2004 PLo. S Biol Eckhardt et al. 2006 Nature Genet Бимодальное распределение: 70% либо гиперметилированы (43% >80%), либо гипометилированы (27% <20%) Внутригенные – чаще гиперметилированы, расположенные в промоторах – чаще гипометилированы!
Распределение уровней метилирования в Cp. Gостровках человеческих генов: Cp. G-островки либо гиперметилированы, либо гипометилированы! Rakyan et al. 2004 PLo. S Biol Eckhardt et al. 2006 Nature Genet Бимодальное распределение: 70% либо гиперметилированы (43% >80%), либо гипометилированы (27% <20%) Внутригенные – чаще гиперметилированы, расположенные в промоторах – чаще гипометилированы!
 Cp. G-богатые промоторы: Активность гена зависит от плотности метилирования Островки, как правило, неметилированы (исключения – импринтированные гены, неактивная Х-хромосома) Ø Инактивация, как правило, необратима Ø Ø Ø Cp. G- бедные промоторы: Ø Регулируются частично метилированием, частично другими механизмами регуляции экспрессии Ø Инактивация обратима! Мало Cp. G Много Cp. G Гиперметилирование характерно нехарактерно Гипометилирование нехарактерно Weber M. et al. Nature Genetics 2007
Cp. G-богатые промоторы: Активность гена зависит от плотности метилирования Островки, как правило, неметилированы (исключения – импринтированные гены, неактивная Х-хромосома) Ø Инактивация, как правило, необратима Ø Ø Ø Cp. G- бедные промоторы: Ø Регулируются частично метилированием, частично другими механизмами регуляции экспрессии Ø Инактивация обратима! Мало Cp. G Много Cp. G Гиперметилирование характерно нехарактерно Гипометилирование нехарактерно Weber M. et al. Nature Genetics 2007
 Зачем нужны внутригенные и межгенные Cp. G островки? Рабочие гипотезы (с использованием биоинформационных подходов): 1) внутригенные островки являются потенциальными маркерами сайтов альтернативного сплайсинга (Majewski, Ott, Genome Research 2002) Сp. G- энхансер сплайсинга? Непосредственно на границах экзон/интрон, кроме 3’конца последнего экзона (не сплайсируется) повышено содержание Сp. G мотивов 2) Cp. G островки, удаленные от сайтов инициации транскрипции, способны связывать промотор-специфические ТФ (в частности, Sp 1) и сами по себе служить сигналами инициации транскрипции (например, для регуляторных РНК) (Medvedeva et al. , BMC Genomics 2010) 3) Служат участками инициации ремоделлинга хроматина
Зачем нужны внутригенные и межгенные Cp. G островки? Рабочие гипотезы (с использованием биоинформационных подходов): 1) внутригенные островки являются потенциальными маркерами сайтов альтернативного сплайсинга (Majewski, Ott, Genome Research 2002) Сp. G- энхансер сплайсинга? Непосредственно на границах экзон/интрон, кроме 3’конца последнего экзона (не сплайсируется) повышено содержание Сp. G мотивов 2) Cp. G островки, удаленные от сайтов инициации транскрипции, способны связывать промотор-специфические ТФ (в частности, Sp 1) и сами по себе служить сигналами инициации транскрипции (например, для регуляторных РНК) (Medvedeva et al. , BMC Genomics 2010) 3) Служат участками инициации ремоделлинга хроматина
 Выше GC-состав –шире спектр экспрессии И у животных, и у растений %GC для гена в целом (в основном обеспечивается И у животных, и у растений внутригенными островками) связан с широтой спектра экспрессии этого гена в разных связан тканях (у растений – каллус) GC-богатые гены – более древние и универсальные функции Vinogradov A. E. , Genome Analysis, 2005, Ashikava I, DNA Research, 2002, Aerts S. et al. , BMC , Genomics 2004 и др.
Выше GC-состав –шире спектр экспрессии И у животных, и у растений %GC для гена в целом (в основном обеспечивается И у животных, и у растений внутригенными островками) связан с широтой спектра экспрессии этого гена в разных связан тканях (у растений – каллус) GC-богатые гены – более древние и универсальные функции Vinogradov A. E. , Genome Analysis, 2005, Ashikava I, DNA Research, 2002, Aerts S. et al. , BMC , Genomics 2004 и др.
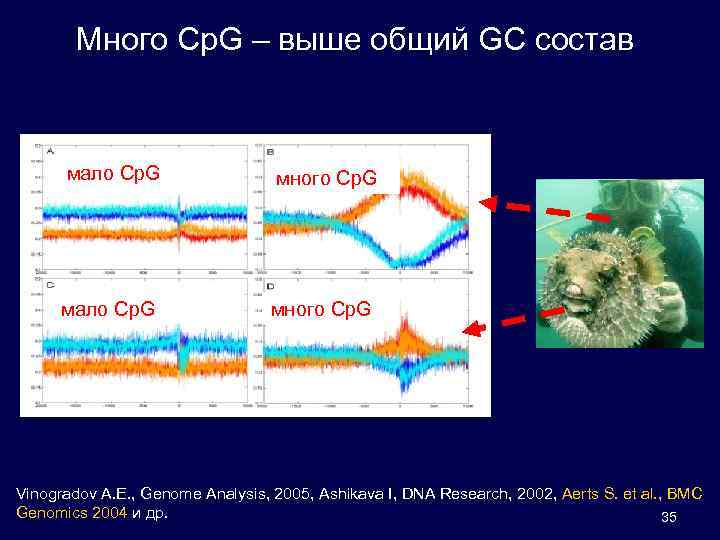 Много Cp. G – выше общий GC состав мало Cp. G много Cp. G Vinogradov A. E. , Genome Analysis, 2005, Ashikava I, DNA Research, 2002, Aerts S. et al. , BMC , Genomics 2004 и др. 35
Много Cp. G – выше общий GC состав мало Cp. G много Cp. G Vinogradov A. E. , Genome Analysis, 2005, Ashikava I, DNA Research, 2002, Aerts S. et al. , BMC , Genomics 2004 и др. 35
 Особенности метилирования ДНК у растений: Очень высокое содержание Сmet (до десятков %) , биологическая специфичность метилирования реализуется при помощи РНКинтерференции (Rd. DM) Есть ферменты, которые метилируют не только Cp. G, но также Ср. Hp. G и Ср. H (H=A, C, T), существуют не только Cp. G-, но и Ср. Np. Gостровки Метилазы: DRM 2 (аналог DNMT 3), CMT 3 – уникальная по структуре, поддерживающая, известны и другие Есть аналог геномного импринтинга у млекопитающих (связан в большей степени с разметилированием материнских аллелей) Внутренние экзоны генов обычно неметилированы (в отличие от млекопитающих) 36
Особенности метилирования ДНК у растений: Очень высокое содержание Сmet (до десятков %) , биологическая специфичность метилирования реализуется при помощи РНКинтерференции (Rd. DM) Есть ферменты, которые метилируют не только Cp. G, но также Ср. Hp. G и Ср. H (H=A, C, T), существуют не только Cp. G-, но и Ср. Np. Gостровки Метилазы: DRM 2 (аналог DNMT 3), CMT 3 – уникальная по структуре, поддерживающая, известны и другие Есть аналог геномного импринтинга у млекопитающих (связан в большей степени с разметилированием материнских аллелей) Внутренние экзоны генов обычно неметилированы (в отличие от млекопитающих) 36
 У многих ДНК-вирусов эукариот метилирование ДНК необходимо для обеспечения репликации ДНК Frog virus 3 (FV 3) наиболее метилирована из всех известных вирусных ДНК (метилировано около 20% всех цитозинов) 5 -азацитидин (ингибитор метилаз) не влияниет на экспрессию вирусных генов в инфицированных клетках, но наблюдается неполная упаковка ДНК в преформированные капсиды, или капсиды вообще остаются пустыми, в итоге снижение продукции инфекционного FV 3 в 100 раз и более Метилирование происходит de novo в ядрах инфицированных клеток в Cp. G мотивах вирусной ДНК с участием клеточных DNMT, затем метилированная ДНК экспортируется в цитоплазму (Willis D. B. , Granoff A. Virology 1980, Goorha R. et al. , Virology 1984, Schetter C. et al. J. Virol. 1993) Многие вирусы при инфицировании способны стимулировать повышение уровня экспрессии ДНК-метилтрансфераз клетки – хозяина (аденовирусы, герпесвирусы, папиломавирусы и пр. ) (Hoelzer et al. , NAR 2008) Статус метилирования может значительно отличаться между интегрированной и реплицирующейся формами (Hoelzer et al. , NAR 2008) 37
У многих ДНК-вирусов эукариот метилирование ДНК необходимо для обеспечения репликации ДНК Frog virus 3 (FV 3) наиболее метилирована из всех известных вирусных ДНК (метилировано около 20% всех цитозинов) 5 -азацитидин (ингибитор метилаз) не влияниет на экспрессию вирусных генов в инфицированных клетках, но наблюдается неполная упаковка ДНК в преформированные капсиды, или капсиды вообще остаются пустыми, в итоге снижение продукции инфекционного FV 3 в 100 раз и более Метилирование происходит de novo в ядрах инфицированных клеток в Cp. G мотивах вирусной ДНК с участием клеточных DNMT, затем метилированная ДНК экспортируется в цитоплазму (Willis D. B. , Granoff A. Virology 1980, Goorha R. et al. , Virology 1984, Schetter C. et al. J. Virol. 1993) Многие вирусы при инфицировании способны стимулировать повышение уровня экспрессии ДНК-метилтрансфераз клетки – хозяина (аденовирусы, герпесвирусы, папиломавирусы и пр. ) (Hoelzer et al. , NAR 2008) Статус метилирования может значительно отличаться между интегрированной и реплицирующейся формами (Hoelzer et al. , NAR 2008) 37
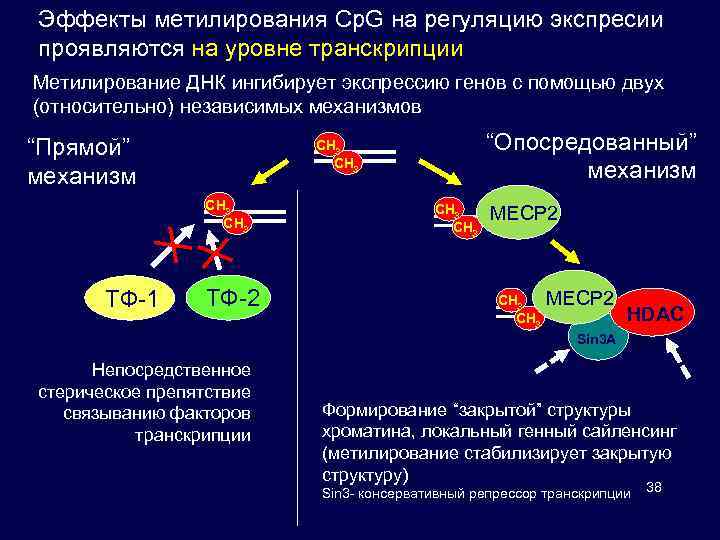 Эффекты метилирования Cp. G на регуляцию экспресии проявляются на уровне транскрипции Метилирование ДНК ингибирует экспрессию генов с помощью двух (относительно) независимых механизмов “Прямой” механизм CH 3 ТФ-1 “Опосредованный” механизм CH 3 ТФ-2 CH 3 MECP 2 HDAC Sin 3 A Непосредственное стерическое препятствие связыванию факторов транскрипции Формирование “закрытой” структуры хроматина, локальный генный сайленсинг (метилирование стабилизирует закрытую структуру) Sin 3 - консервативный репрессор транскрипции 38
Эффекты метилирования Cp. G на регуляцию экспресии проявляются на уровне транскрипции Метилирование ДНК ингибирует экспрессию генов с помощью двух (относительно) независимых механизмов “Прямой” механизм CH 3 ТФ-1 “Опосредованный” механизм CH 3 ТФ-2 CH 3 MECP 2 HDAC Sin 3 A Непосредственное стерическое препятствие связыванию факторов транскрипции Формирование “закрытой” структуры хроматина, локальный генный сайленсинг (метилирование стабилизирует закрытую структуру) Sin 3 - консервативный репрессор транскрипции 38
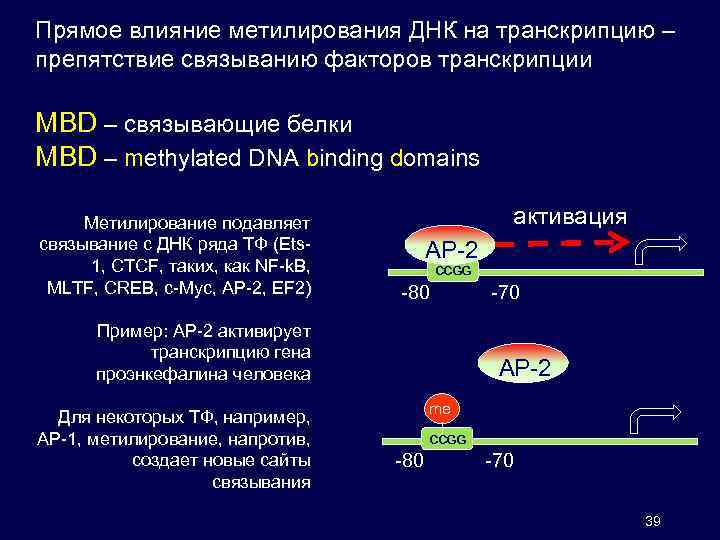 Прямое влияние метилирования ДНК на транскрипцию – препятствие связыванию факторов транскрипции MBD – связывающие белки MBD – methylated DNA binding domains Метилирование подавляет связывание с ДНК ряда ТФ (Ets 1, CTCF, таких, как NF-k. B, MLTF, СREB, с-Мус, АP-2, EF 2) активация AP-2 CCGG -80 -70 Пример: AP-2 активирует транскрипцию гена проэнкефалина человека Для некоторых ТФ, например, АР-1, метилирование, напротив, создает новые сайты связывания AP-2 me CCGG -80 -70 39
Прямое влияние метилирования ДНК на транскрипцию – препятствие связыванию факторов транскрипции MBD – связывающие белки MBD – methylated DNA binding domains Метилирование подавляет связывание с ДНК ряда ТФ (Ets 1, CTCF, таких, как NF-k. B, MLTF, СREB, с-Мус, АP-2, EF 2) активация AP-2 CCGG -80 -70 Пример: AP-2 активирует транскрипцию гена проэнкефалина человека Для некоторых ТФ, например, АР-1, метилирование, напротив, создает новые сайты связывания AP-2 me CCGG -80 -70 39
 MBD-белки Me. CP-1 Конкурирует за связывание метилированной ДНК с факторами транскрипции в зависимости от плотности метилирования, а также может замещать гистон Н 1 в нуклеосомах Связывается с последовательностью, содержащей несколько метильных групп Me. CP-2 В отличие от всех прочих MBD-белков, ген находится в Х-хромосоме, подвержен X-инактивации В высокой концентрации обнаруживается в нейронах, участвует в созревании ЦНС и формировании синаптических связей Может быть и репрессором, и активатором транскрипции, а также регулятором альтернативного сплайсинга (Young et al. , PNAS 2005). Может связываться с неметилированной ДНК Связывается с последовательностью, содержащей хотя бы одну метильную группу, рекрутирует Sin 3 A и HDAC, может и непосредственно блокировать транскрипцию 40
MBD-белки Me. CP-1 Конкурирует за связывание метилированной ДНК с факторами транскрипции в зависимости от плотности метилирования, а также может замещать гистон Н 1 в нуклеосомах Связывается с последовательностью, содержащей несколько метильных групп Me. CP-2 В отличие от всех прочих MBD-белков, ген находится в Х-хромосоме, подвержен X-инактивации В высокой концентрации обнаруживается в нейронах, участвует в созревании ЦНС и формировании синаптических связей Может быть и репрессором, и активатором транскрипции, а также регулятором альтернативного сплайсинга (Young et al. , PNAS 2005). Может связываться с неметилированной ДНК Связывается с последовательностью, содержащей хотя бы одну метильную группу, рекрутирует Sin 3 A и HDAC, может и непосредственно блокировать транскрипцию 40
 Влияние Me. CP-2 на экспрессию своих мишеней может быть довольно тонким Результат дефицита Me. CP-2 - синдром Ретта: X-сцепленное нейродегеративное заболевание, смерть в 15 -30 лет частота встречаемости 1: 10, 000 -15, 000 (только женщины) причина – мутация в гене, кодирующем Me. CP-2, результат - утрата генного сайленсинга многими локусами http: //science. compulenta. ru/306074/ 41
Влияние Me. CP-2 на экспрессию своих мишеней может быть довольно тонким Результат дефицита Me. CP-2 - синдром Ретта: X-сцепленное нейродегеративное заболевание, смерть в 15 -30 лет частота встречаемости 1: 10, 000 -15, 000 (только женщины) причина – мутация в гене, кодирующем Me. CP-2, результат - утрата генного сайленсинга многими локусами http: //science. compulenta. ru/306074/ 41
 MBD-белки MBD 1 -2, KAISO– репрессоры транскрипции, мыши-мутанты в целом жизнеспособны, незначительные дефекты MBD 2 b – укороченная форма, ассоциирует с HDAC и Me. CP 1 в клетках He. La, привлекает комплексы ремоделлинга к метилированной ДНК in vitro, мутанты не могут эффективно репрессировать метилированные репортерные конструкции MBD 3 - схож по строению с MBD 2 b, произошли от общего предка, компонент комплексов ремоделлинга (дефицит летален) MBD 4 – компонент системы репарации мисматчей, тимин. ДНКгликозилаза, предполагаемый компонент аппарата деметилирования. Относительно слабое сродство к met. Cp. G. При дефиците в разы возрастает частота мутаций в Cp. G сайтах MBD 1 -4 найдены в 1997 -1998 гг. по гомологии с met. Cp. G связывающим доменом Me. CP 1/2 Известно множество других MBD-белков. DBP-m не сиквенс-специфичен (растения), MDBP-1, MDBP-2, HMBP связываются с метилированной ДНК сиквенс-специфично 42 (высшие позвоночные, в т. ч. человек)
MBD-белки MBD 1 -2, KAISO– репрессоры транскрипции, мыши-мутанты в целом жизнеспособны, незначительные дефекты MBD 2 b – укороченная форма, ассоциирует с HDAC и Me. CP 1 в клетках He. La, привлекает комплексы ремоделлинга к метилированной ДНК in vitro, мутанты не могут эффективно репрессировать метилированные репортерные конструкции MBD 3 - схож по строению с MBD 2 b, произошли от общего предка, компонент комплексов ремоделлинга (дефицит летален) MBD 4 – компонент системы репарации мисматчей, тимин. ДНКгликозилаза, предполагаемый компонент аппарата деметилирования. Относительно слабое сродство к met. Cp. G. При дефиците в разы возрастает частота мутаций в Cp. G сайтах MBD 1 -4 найдены в 1997 -1998 гг. по гомологии с met. Cp. G связывающим доменом Me. CP 1/2 Известно множество других MBD-белков. DBP-m не сиквенс-специфичен (растения), MDBP-1, MDBP-2, HMBP связываются с метилированной ДНК сиквенс-специфично 42 (высшие позвоночные, в т. ч. человек)
 Метилирование ДНК: наследование и поддержание паттернов
Метилирование ДНК: наследование и поддержание паттернов
 Большая часть (почти все) метилирования “стирается” в раннем эмбриогенезе за счет деметилирования и/или гидроксилирования метильных групп (Iqbal et al. , PNAS 2011) Паттерн метилирования генома (распределение метилированных оснований) устанавливается заново в каждом поколении, в основном не наследуется, но есть и исключения – доказаны факты наследования статуса метилирования некоторых локусов После установления специфические паттерны метилирования поддерживаются в поколениях клеток, обеспечивая специфичность экспрессии генов за счет формирования репрессирующих структур хроматина Таким образом, при смене поколений происходит последовательное цикличное метилирование/деметилирование по множеству позиций в геноме 44
Большая часть (почти все) метилирования “стирается” в раннем эмбриогенезе за счет деметилирования и/или гидроксилирования метильных групп (Iqbal et al. , PNAS 2011) Паттерн метилирования генома (распределение метилированных оснований) устанавливается заново в каждом поколении, в основном не наследуется, но есть и исключения – доказаны факты наследования статуса метилирования некоторых локусов После установления специфические паттерны метилирования поддерживаются в поколениях клеток, обеспечивая специфичность экспрессии генов за счет формирования репрессирующих структур хроматина Таким образом, при смене поколений происходит последовательное цикличное метилирование/деметилирование по множеству позиций в геноме 44
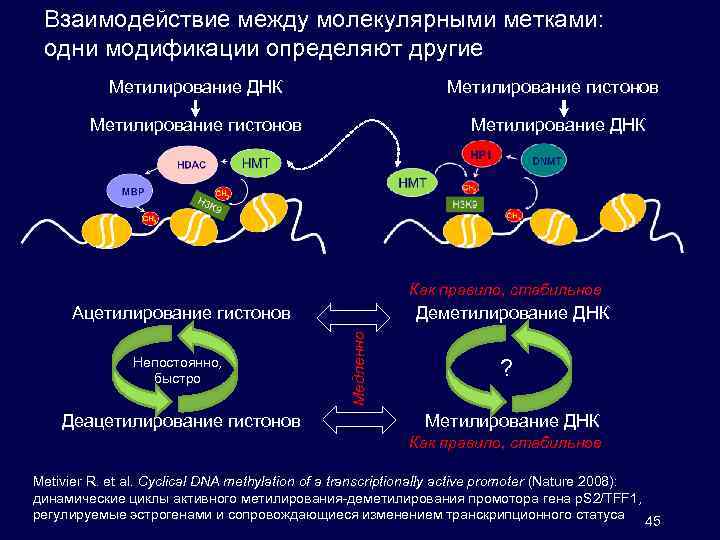 Взаимодействие между молекулярными метками: одни модификации определяют другие Метилирование ДНК Метилирование гистонов Метилирование ДНК Как правило, стабильное Непостоянно, быстро Деацетилирование гистонов Деметилирование ДНК Медленно Ацетилирование гистонов ? Метилирование ДНК Как правило, стабильное Metivier R. et al. Cyclical DNA methylation of a transcriptionally active promoter (Nature 2008): динамические циклы активного метилирования-деметилирования промотора гена p. S 2/TFF 1, регулируемые эстрогенами и сопровождающиеся изменением транскрипционного статуса 45
Взаимодействие между молекулярными метками: одни модификации определяют другие Метилирование ДНК Метилирование гистонов Метилирование ДНК Как правило, стабильное Непостоянно, быстро Деацетилирование гистонов Деметилирование ДНК Медленно Ацетилирование гистонов ? Метилирование ДНК Как правило, стабильное Metivier R. et al. Cyclical DNA methylation of a transcriptionally active promoter (Nature 2008): динамические циклы активного метилирования-деметилирования промотора гена p. S 2/TFF 1, регулируемые эстрогенами и сопровождающиеся изменением транскрипционного статуса 45
 Геномный импринтинг и метилирование Некоторые гены активны или неактивны в зависимости от того, от родителя какого пола поступил данный аллель Установление статуса активности копии гена в клетках полового пути в связи с ее происхождением от родителя того или иного пола называют геномным импринтингом Показан для млекопитающих, растений (импринтинг отдельных генов), насекомых и грибов (импринтинг целых хромосом) В геноме млекопитающих > 100 импринтируемых генов в кластерах (импринтируется менее 1% генов) оценка Luedi et al. (2001): у мыши – 600 потенциально импринтированных генов, у человека известно 78, из которых для 26 определена функция 2010: в мозгу грызунов с помощью высокопроизводительного анализа транскриптома выявлено более 1300 импринтированных локусов (Gregg et al. Science 2010) Метилирование происходит в контрольных участках импринтинга (ICR’s - imprinting control (choice) regions), частный случай DMR (differentially methylated regions)
Геномный импринтинг и метилирование Некоторые гены активны или неактивны в зависимости от того, от родителя какого пола поступил данный аллель Установление статуса активности копии гена в клетках полового пути в связи с ее происхождением от родителя того или иного пола называют геномным импринтингом Показан для млекопитающих, растений (импринтинг отдельных генов), насекомых и грибов (импринтинг целых хромосом) В геноме млекопитающих > 100 импринтируемых генов в кластерах (импринтируется менее 1% генов) оценка Luedi et al. (2001): у мыши – 600 потенциально импринтированных генов, у человека известно 78, из которых для 26 определена функция 2010: в мозгу грызунов с помощью высокопроизводительного анализа транскриптома выявлено более 1300 импринтированных локусов (Gregg et al. Science 2010) Метилирование происходит в контрольных участках импринтинга (ICR’s - imprinting control (choice) regions), частный случай DMR (differentially methylated regions)
 Свойства импринтированных генов (1): Экспрессия в диплоидных клетках по родительскому типу (импринтированный ген, активный на хромосоме, пришедшей от матери, будет активен на соответствующей хромосоме и неактивен на варианте хромосомы, пришедшем от отца, у всех мужских и женских особей в потомстве) Но: импринтированный ген не обязательно будет импринтирован на всех стадиях развития и/или во всех тканях! Механизмы импринтинга являются эпигенетическими, связаны с метилированием, модификацией гистонов и перестройкой хроматина. Не путать с другими генами с родительским типом наследования (Y -сцепленные, митохондриальные и т. п. ) Импринты модифицируют гены регуляторных элементов широкого спектра действия, участвующие в регуляции развития. Ортологичные гены у разных млекопитающих (человек и мышь) не обязательно, но как правило импринтируются по типу того же пола
Свойства импринтированных генов (1): Экспрессия в диплоидных клетках по родительскому типу (импринтированный ген, активный на хромосоме, пришедшей от матери, будет активен на соответствующей хромосоме и неактивен на варианте хромосомы, пришедшем от отца, у всех мужских и женских особей в потомстве) Но: импринтированный ген не обязательно будет импринтирован на всех стадиях развития и/или во всех тканях! Механизмы импринтинга являются эпигенетическими, связаны с метилированием, модификацией гистонов и перестройкой хроматина. Не путать с другими генами с родительским типом наследования (Y -сцепленные, митохондриальные и т. п. ) Импринты модифицируют гены регуляторных элементов широкого спектра действия, участвующие в регуляции развития. Ортологичные гены у разных млекопитающих (человек и мышь) не обязательно, но как правило импринтируются по типу того же пола
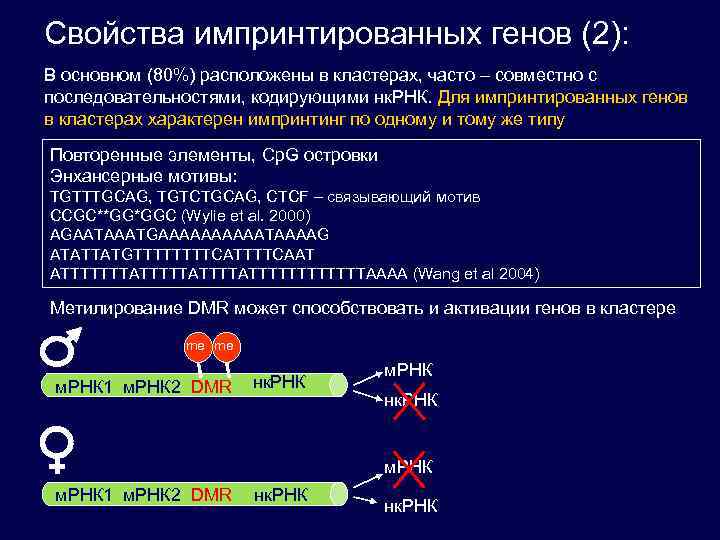 Свойства импринтированных генов (2): В основном (80%) расположены в кластерах, часто – совместно с последовательностями, кодирующими нк. РНК. Для импринтированных генов в кластерах характерен импринтинг по одному и тому же типу Повторенные элементы, Cp. G островки Энхансерные мотивы: TGTTTGCAG, TGTCTGCAG, CTCF – связывающий мотив CCGC**GG*GGC (Wylie et al. 2000) AGAATAAATGAAAAATAAAAG ATATTATGTTTTCATTTTCAAT ATTTTTTTATTTTATTTTTTAAAA (Wang et al 2004) Метилирование DMR может способствовать и активации генов в кластере me me м. РНК 1 м. РНК 2 DMR нк. РНК
Свойства импринтированных генов (2): В основном (80%) расположены в кластерах, часто – совместно с последовательностями, кодирующими нк. РНК. Для импринтированных генов в кластерах характерен импринтинг по одному и тому же типу Повторенные элементы, Cp. G островки Энхансерные мотивы: TGTTTGCAG, TGTCTGCAG, CTCF – связывающий мотив CCGC**GG*GGC (Wylie et al. 2000) AGAATAAATGAAAAATAAAAG ATATTATGTTTTCATTTTCAAT ATTTTTTTATTTTATTTTTTAAAA (Wang et al 2004) Метилирование DMR может способствовать и активации генов в кластере me me м. РНК 1 м. РНК 2 DMR нк. РНК
 Геномный импринтинг, метилирование и нк. РНК IGF 2=Insulin-like Growth Factor 2 90 тпн Материнский аллель CTCF ICE Ig. F 2 H 19 E Инсулятор препятствует активации Ig. F 2 downstream энхансером Отцовский аллель Ig. F 2 me me ICE me me H 19 Инсулятор не препятствует активации Ig. F 2 энхансером, но метилирование мешает транскрипции H 19 E
Геномный импринтинг, метилирование и нк. РНК IGF 2=Insulin-like Growth Factor 2 90 тпн Материнский аллель CTCF ICE Ig. F 2 H 19 E Инсулятор препятствует активации Ig. F 2 downstream энхансером Отцовский аллель Ig. F 2 me me ICE me me H 19 Инсулятор не препятствует активации Ig. F 2 энхансером, но метилирование мешает транскрипции H 19 E
 Peters, Genome Biology 2000 Biochemical Journal 2010 50
Peters, Genome Biology 2000 Biochemical Journal 2010 50
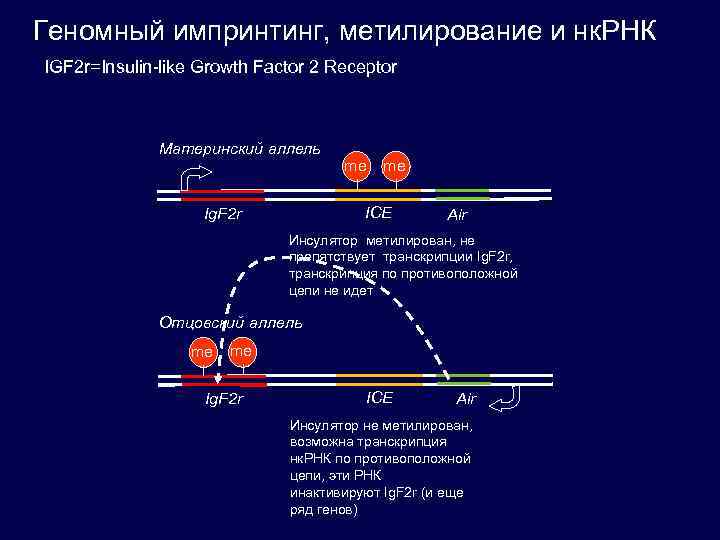 Геномный импринтинг, метилирование и нк. РНК IGF 2 r=Insulin-like Growth Factor 2 Receptor Материнский аллель me me ICE Ig. F 2 r Air Инсулятор метилирован, не препятствует транскрипции Ig. F 2 r, транскрипция по противоположной цепи не идет Отцовский аллель me me Ig. F 2 r ICE Air Инсулятор не метилирован, возможна транскрипция нк. РНК по противоположной цепи, эти РНК инактивируют Ig. F 2 r (и еще ряд генов)
Геномный импринтинг, метилирование и нк. РНК IGF 2 r=Insulin-like Growth Factor 2 Receptor Материнский аллель me me ICE Ig. F 2 r Air Инсулятор метилирован, не препятствует транскрипции Ig. F 2 r, транскрипция по противоположной цепи не идет Отцовский аллель me me Ig. F 2 r ICE Air Инсулятор не метилирован, возможна транскрипция нк. РНК по противоположной цепи, эти РНК инактивируют Ig. F 2 r (и еще ряд генов)
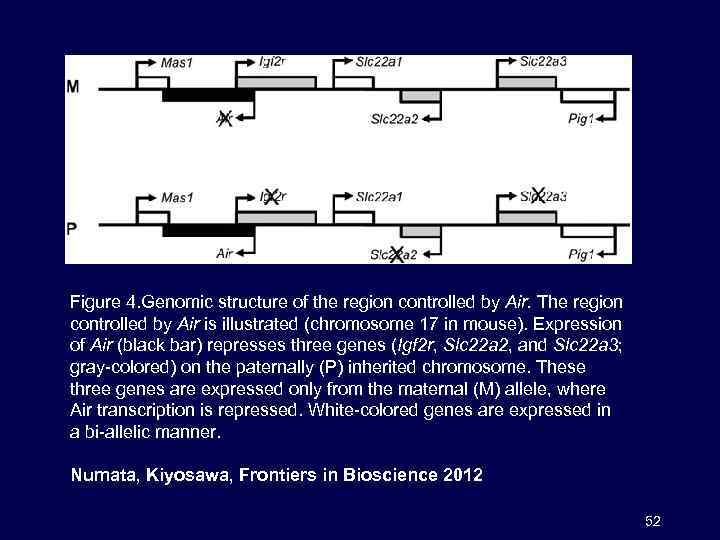 Figure 4. Genomic structure of the region controlled by Air. The region controlled by Air is illustrated (chromosome 17 in mouse). Expression of Air (black bar) represses three genes (Igf 2 r, Slc 22 a 2, and Slc 22 a 3; gray-colored) on the paternally (P) inherited chromosome. These three genes are expressed only from the maternal (M) allele, where Air transcription is repressed. White-colored genes are expressed in a bi-allelic manner. Numata, Kiyosawa, Frontiers in Bioscience 2012 52
Figure 4. Genomic structure of the region controlled by Air. The region controlled by Air is illustrated (chromosome 17 in mouse). Expression of Air (black bar) represses three genes (Igf 2 r, Slc 22 a 2, and Slc 22 a 3; gray-colored) on the paternally (P) inherited chromosome. These three genes are expressed only from the maternal (M) allele, where Air transcription is repressed. White-colored genes are expressed in a bi-allelic manner. Numata, Kiyosawa, Frontiers in Bioscience 2012 52
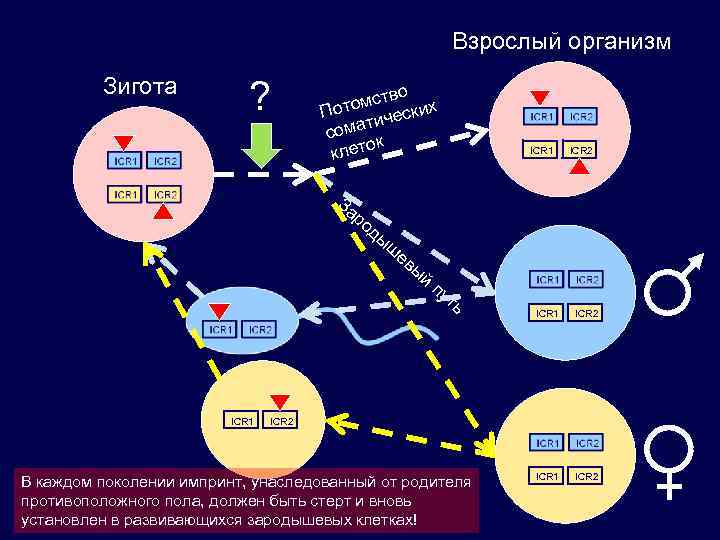 Взрослый организм Зигота ? о мств их Пото ическ т сома к клето ICR 1 ICR 2 За ро ды ш ICR 1 ев ы й пу ть ICR 1 ICR 2 В каждом поколении импринт, унаследованный от родителя противоположного пола, должен быть стерт и вновь установлен в развивающихся зародышевых клетках!
Взрослый организм Зигота ? о мств их Пото ическ т сома к клето ICR 1 ICR 2 За ро ды ш ICR 1 ев ы й пу ть ICR 1 ICR 2 В каждом поколении импринт, унаследованный от родителя противоположного пола, должен быть стерт и вновь установлен в развивающихся зародышевых клетках!
 В раннем эмбриогенезе волны деметилирования и последующего метилирования не затрагивают метилирование ICR сперматогонии Стирание всего метилирования, включая импринты Активное деметилирование после оплодотворения (отцовский геном) Пассивное деметилирование (с запаздыванием) после оплодотворения (материнский геном) Х-инактивация отцовской Х-хромосомы (стадия 4 клеток) Волна глобального деметилирования (ранняя бластоциста) ? Волна полу ре-метилирования (resetting) (перед имплантацией (? )) Быстрое установление гено- и ткане-специфичных паттернов метилирования (стадия имплантации)
В раннем эмбриогенезе волны деметилирования и последующего метилирования не затрагивают метилирование ICR сперматогонии Стирание всего метилирования, включая импринты Активное деметилирование после оплодотворения (отцовский геном) Пассивное деметилирование (с запаздыванием) после оплодотворения (материнский геном) Х-инактивация отцовской Х-хромосомы (стадия 4 клеток) Волна глобального деметилирования (ранняя бластоциста) ? Волна полу ре-метилирования (resetting) (перед имплантацией (? )) Быстрое установление гено- и ткане-специфичных паттернов метилирования (стадия имплантации)
 Геномный импринтинг: необходимы оба импринта! Дефект функционирующих аллелей, не инактивированных импринтингом, приводит к разным наследственным заболеваниям Синдромы Ангельмана и Прадер-Вилли (1: 10000 -15000) связаны с различными вариантами метилирования отцовских и материнских аллелей двух генов, расположенных близко на длинном плече 5 хромосомы, возникают в случае делеции участка одной из хромосом 15 -й пары Больные с синдромами: Angelman (слева ) - серьёзная умственная отсталость, припадки, нарушения речи, неуместный смех Prader-Willi (справа)- умственная отсталость, ожирение, неразвитые половые железы, низкий рост Существование импринтинга – основное препятствие для партеногенеза у млекопитающих
Геномный импринтинг: необходимы оба импринта! Дефект функционирующих аллелей, не инактивированных импринтингом, приводит к разным наследственным заболеваниям Синдромы Ангельмана и Прадер-Вилли (1: 10000 -15000) связаны с различными вариантами метилирования отцовских и материнских аллелей двух генов, расположенных близко на длинном плече 5 хромосомы, возникают в случае делеции участка одной из хромосом 15 -й пары Больные с синдромами: Angelman (слева ) - серьёзная умственная отсталость, припадки, нарушения речи, неуместный смех Prader-Willi (справа)- умственная отсталость, ожирение, неразвитые половые железы, низкий рост Существование импринтинга – основное препятствие для партеногенеза у млекопитающих
 Нарушения метилирования ДНК, старение и патологии Esteller M. Epigenetic differences arise during the lifetime of monozygotic twins. PNAS 2005 Исследование 80 пар однояйцевых близнецов в возрасте 3 -74 года выявило очевидную зависимость количества различий в профилях метилирования геномов и паттернов экспрессии генов от возраста пары…
Нарушения метилирования ДНК, старение и патологии Esteller M. Epigenetic differences arise during the lifetime of monozygotic twins. PNAS 2005 Исследование 80 пар однояйцевых близнецов в возрасте 3 -74 года выявило очевидную зависимость количества различий в профилях метилирования геномов и паттернов экспрессии генов от возраста пары…
 Некоторые патологии, связанные с нарушением метилирования ДНК Канцерогенез Комплексные нарушения - диабет 2 типа Болезни, связанные с нарушением импринтинга - - синдром Beckwith-Wiedemann синдром Silver Russel синдром Prader-Willi синдром Angelman Нейродегенеративные расстройства - - Fragile X (хрупкая Х-хромосома) ICF syndrome Rett syndrome
Некоторые патологии, связанные с нарушением метилирования ДНК Канцерогенез Комплексные нарушения - диабет 2 типа Болезни, связанные с нарушением импринтинга - - синдром Beckwith-Wiedemann синдром Silver Russel синдром Prader-Willi синдром Angelman Нейродегенеративные расстройства - - Fragile X (хрупкая Х-хромосома) ICF syndrome Rett syndrome
 Изменения метилирования ДНК при старении Чем длиннее характерная продолжительность жизни у вида животного, тем медленнее снижается у этого вида уровень метилирования с возрастом Метилирование, связанное со старением: воздействует только на небольшую часть генома человека тканеспецифично в ткани, на которую оно воздействует, затрагивает как экспрессируемые, так и неэкспрессируемые гены Формирование аберрантных паттернов метилирования: гипометилирование в стареющих клетках и тканях (в целом) но: гиперметилирование Cp. G-островков в стареющих клетках и тканях Такие же разнонаправленные изменения метилирования характерны для раковых клеток (Esteller 2007)
Изменения метилирования ДНК при старении Чем длиннее характерная продолжительность жизни у вида животного, тем медленнее снижается у этого вида уровень метилирования с возрастом Метилирование, связанное со старением: воздействует только на небольшую часть генома человека тканеспецифично в ткани, на которую оно воздействует, затрагивает как экспрессируемые, так и неэкспрессируемые гены Формирование аберрантных паттернов метилирования: гипометилирование в стареющих клетках и тканях (в целом) но: гиперметилирование Cp. G-островков в стареющих клетках и тканях Такие же разнонаправленные изменения метилирования характерны для раковых клеток (Esteller 2007)
 Отклонения в метилировании могут быть равноценны мутациям и в том числе приводить к канцерогенным эффектам Из: Herman J. and Baylin S. NEJM 2003 Из: Balmain et al. , Nature Genetics 2003 Канцерогенным эффектом может обладать не только гиперметилирование, но и гипометилирование – зависит от контекста 59
Отклонения в метилировании могут быть равноценны мутациям и в том числе приводить к канцерогенным эффектам Из: Herman J. and Baylin S. NEJM 2003 Из: Balmain et al. , Nature Genetics 2003 Канцерогенным эффектом может обладать не только гиперметилирование, но и гипометилирование – зависит от контекста 59
 Аберрантные паттерны метилирования могут не возникать “мгновенно”, а являться результатом кумулятивных и обратимых эффектов 60
Аберрантные паттерны метилирования могут не возникать “мгновенно”, а являться результатом кумулятивных и обратимых эффектов 60
 Метилирование и канцерогенез me Протоонкогены импринтированные гены me Cp. G-островки промоторов геновсупрессоров опухолей me Протоонкогены, импринтированные гены Активация me Cp. G-островки промоторов геновсупрессоров опухолей Репрессия Уход от апоптоза, вхождение в клеточный цикл, дефекты репарации, потеря адгезии, ангиогенез me me Повторенные последовательности me Геном Ретротранспозоны и т. п. Глобальное деметилирование, повышенное метилирование Cp. G островков геновсупрессоров опухолей Геном Повторенные последовательности Ретротранспозоны и т. п. Активация Высокая частота рекомбинации Нарушения сегрегации хромосом +”классические” точечные мутации 61
Метилирование и канцерогенез me Протоонкогены импринтированные гены me Cp. G-островки промоторов геновсупрессоров опухолей me Протоонкогены, импринтированные гены Активация me Cp. G-островки промоторов геновсупрессоров опухолей Репрессия Уход от апоптоза, вхождение в клеточный цикл, дефекты репарации, потеря адгезии, ангиогенез me me Повторенные последовательности me Геном Ретротранспозоны и т. п. Глобальное деметилирование, повышенное метилирование Cp. G островков геновсупрессоров опухолей Геном Повторенные последовательности Ретротранспозоны и т. п. Активация Высокая частота рекомбинации Нарушения сегрегации хромосом +”классические” точечные мутации 61
 Гиперметилирование локальных участков при раке Цепочка событий не вполне понятна Возрастающая ассоциация белков, модифицирующих хроматин (ингибиторов HAT), с промоторами генов опухолевой супрессии привлечение DNMTs, ингибирование деметилирования локальное гиперметилирование Выявлено множество генов, экспрессия которых подавлена за счет гиперметилирования промоторов при разных формах рака у человека. По профилю гиперметилирования можно промоторов при разных формах рака у человека классифицировать тип опухоли (Esteller, Nat Rev Genet 2007, Perspectives Can. Res 2001) Клеточный цикл Репарация ДНК Адгезия/метастазирование
Гиперметилирование локальных участков при раке Цепочка событий не вполне понятна Возрастающая ассоциация белков, модифицирующих хроматин (ингибиторов HAT), с промоторами генов опухолевой супрессии привлечение DNMTs, ингибирование деметилирования локальное гиперметилирование Выявлено множество генов, экспрессия которых подавлена за счет гиперметилирования промоторов при разных формах рака у человека. По профилю гиперметилирования можно промоторов при разных формах рака у человека классифицировать тип опухоли (Esteller, Nat Rev Genet 2007, Perspectives Can. Res 2001) Клеточный цикл Репарация ДНК Адгезия/метастазирование
 Опухолеспецифичное гипометилирование Впервые описано: Feinberg and Vogelstein, 1983 Опухоли кишечника, груди, почек, легких Индукция опухолеобразования возможна путем… …гипометилирования за счет подавления DNMT 1 (Gaudet, et al. Science 2003) DNMT 1, DNMT 3 b (Karpf and Matsui. Can Res. 2005) Анеуплоидия, дупликации, транслокации, активация мобильных элементов, потеря импринтинга в опухолях гипометилированы повторенные, сателлитные и прицентромерные последовательности ДНК ингибиторы DNMT (такие, как 5 -азацитидин) стимулируют опухолеобразование и метастазирование стимуляторы метилирования ДНК (например, SAM) препятствуют опухолевой трансформации
Опухолеспецифичное гипометилирование Впервые описано: Feinberg and Vogelstein, 1983 Опухоли кишечника, груди, почек, легких Индукция опухолеобразования возможна путем… …гипометилирования за счет подавления DNMT 1 (Gaudet, et al. Science 2003) DNMT 1, DNMT 3 b (Karpf and Matsui. Can Res. 2005) Анеуплоидия, дупликации, транслокации, активация мобильных элементов, потеря импринтинга в опухолях гипометилированы повторенные, сателлитные и прицентромерные последовательности ДНК ингибиторы DNMT (такие, как 5 -азацитидин) стимулируют опухолеобразование и метастазирование стимуляторы метилирования ДНК (например, SAM) препятствуют опухолевой трансформации
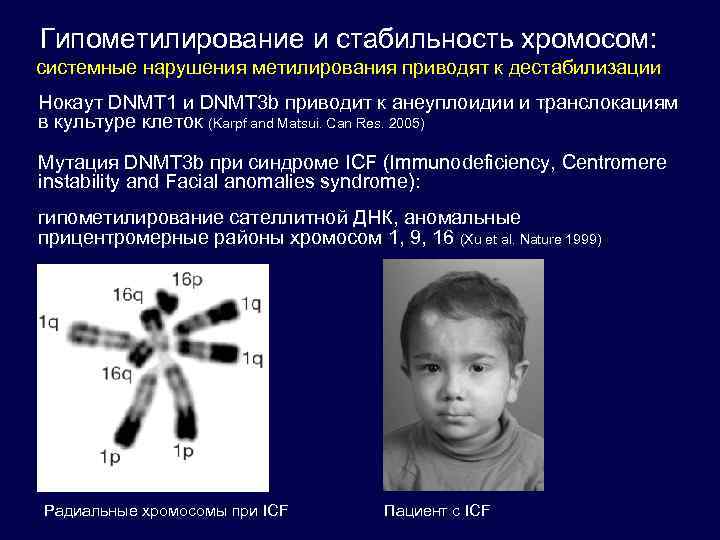 Гипометилирование и стабильность хромосом: системные нарушения метилирования приводят к дестабилизации Нокаут DNMT 1 и DNMT 3 b приводит к анеуплоидии и транслокациям в культуре клеток (Karpf and Matsui. Can Res. 2005) Мутация DNMT 3 b при синдроме ICF (Immunodeficiency, Centromere instability and Facial anomalies syndrome): гипометилирование сателлитной ДНК, аномальные прицентромерные районы хромосом 1, 9, 16 (Xu et al. Nature 1999) Радиальные хромосомы при ICF Пациент с ICF
Гипометилирование и стабильность хромосом: системные нарушения метилирования приводят к дестабилизации Нокаут DNMT 1 и DNMT 3 b приводит к анеуплоидии и транслокациям в культуре клеток (Karpf and Matsui. Can Res. 2005) Мутация DNMT 3 b при синдроме ICF (Immunodeficiency, Centromere instability and Facial anomalies syndrome): гипометилирование сателлитной ДНК, аномальные прицентромерные районы хромосом 1, 9, 16 (Xu et al. Nature 1999) Радиальные хромосомы при ICF Пациент с ICF
 Опухолеспецифичное гипометилирование Не обязательно подавляется метилаза – возможно облегчение деметилирования за счет (локального) изменения структуры хроматина! Метилирование – обратимый процесс, его паттерн может быть результатом динамического равновесия между активностями метилаз и “деметилаз” активация CH 3 инактивация CH 3 метилаза “деметилаза” CH 3 инактивация CH 3 Белки, ингибирующие HAT, приводят к гиперметилированной закрытой структуре, ингибируют деметилирование Для активного деметилирования необходима транскрипция РНКполимеразой II! Перед ним происходит ацетилирование гистонов Acetylation-Induced Transcription Is Required for Active DNA Demethylation in Methylation-Silenced Genes (D’Alessio et al. , Mol. and Cell. Biol. 2007) 65
Опухолеспецифичное гипометилирование Не обязательно подавляется метилаза – возможно облегчение деметилирования за счет (локального) изменения структуры хроматина! Метилирование – обратимый процесс, его паттерн может быть результатом динамического равновесия между активностями метилаз и “деметилаз” активация CH 3 инактивация CH 3 метилаза “деметилаза” CH 3 инактивация CH 3 Белки, ингибирующие HAT, приводят к гиперметилированной закрытой структуре, ингибируют деметилирование Для активного деметилирования необходима транскрипция РНКполимеразой II! Перед ним происходит ацетилирование гистонов Acetylation-Induced Transcription Is Required for Active DNA Demethylation in Methylation-Silenced Genes (D’Alessio et al. , Mol. and Cell. Biol. 2007) 65
 Почему статус метилирования промоторов некоторых “генов домашнего хозяйства” меняется при раке, а других - нет? Промоторы могут быть в большей или меньшей степени “защищены” Гипотеза: некоторые белки связываются со специфическими промоторами и ингибируют ацетилирование гистонов и деметилирование Факт: такие белки существуют (пример – INHATs), их экспрессия может специфично регулироваться Гипотеза: статус метилирования разных промоторов может поддерживаться с разной степенью “надежности” Факт: обработка TSA индуцирует деметилирование не всех метилированных генов– опухолевых супрессоров Гипотеза: уровень метилирования может быть подвержен “тонкой настройке”
Почему статус метилирования промоторов некоторых “генов домашнего хозяйства” меняется при раке, а других - нет? Промоторы могут быть в большей или меньшей степени “защищены” Гипотеза: некоторые белки связываются со специфическими промоторами и ингибируют ацетилирование гистонов и деметилирование Факт: такие белки существуют (пример – INHATs), их экспрессия может специфично регулироваться Гипотеза: статус метилирования разных промоторов может поддерживаться с разной степенью “надежности” Факт: обработка TSA индуцирует деметилирование не всех метилированных генов– опухолевых супрессоров Гипотеза: уровень метилирования может быть подвержен “тонкой настройке”
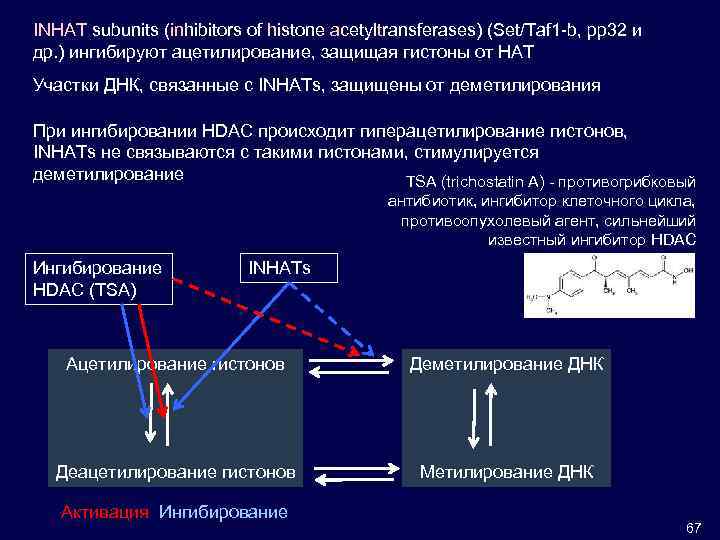 INHAT subunits (inhibitors of histone acetyltransferases) (Set/Taf 1 -b, pp 32 и др. ) ингибируют ацетилирование, защищая гистоны от HAT Участки ДНК, связанные с INHATs, защищены от деметилирования При ингибировании HDAC происходит гиперацетилирование гистонов, INHATs не связываются с такими гистонами, стимулируется деметилирование TSA (trichostatin A) - противогрибковый антибиотик, ингибитор клеточного цикла, противоопухолевый агент, сильнейший известный ингибитор HDAC Ингибирование HDAC (TSA) INHATs Ацетилирование гистонов Деметилирование ДНК Деацетилирование гистонов Метилирование ДНК Активация Ингибирование 67
INHAT subunits (inhibitors of histone acetyltransferases) (Set/Taf 1 -b, pp 32 и др. ) ингибируют ацетилирование, защищая гистоны от HAT Участки ДНК, связанные с INHATs, защищены от деметилирования При ингибировании HDAC происходит гиперацетилирование гистонов, INHATs не связываются с такими гистонами, стимулируется деметилирование TSA (trichostatin A) - противогрибковый антибиотик, ингибитор клеточного цикла, противоопухолевый агент, сильнейший известный ингибитор HDAC Ингибирование HDAC (TSA) INHATs Ацетилирование гистонов Деметилирование ДНК Деацетилирование гистонов Метилирование ДНК Активация Ингибирование 67
 Lsh – белок из семейства SNF 2/helicases (многие белки вовлечены в перестройку хроматина) Исключительно ядерный белок, концентрирован в прицентромерном ГХ Взаимодействует с модификациями гистонов Регулирует уровни метилирования, влияя на доступность хроматина для ряда ДНК-связывающих белков, в т. ч. DNMT Вовлечен в метилирование de novo и метилирование гистонов; ассоциирует с DNMT 3 a и 3 b (не DNMT 1) Делеционные мутанты (делеции геликазных доменов) – перинатальная смертность; почти нормальное развитие, но дефекты развития почки и наработки лимфоцитов При умеренных нарушениях экспрессии: Гипометилирование как ряда повторенных последовательностей, так и уников (например, ген β-глобина) при сохранении активности метилаз Задержка роста и раннее старение, повышенная экспрессия ряда маркеров старения (прежде всего, бета-галактозидазы) Изменение паттернов экспрессии ряда генов Yan Q. et al. Moll. Cell. Biol. 2003; Zhu et al. , EMBO J. 2006
Lsh – белок из семейства SNF 2/helicases (многие белки вовлечены в перестройку хроматина) Исключительно ядерный белок, концентрирован в прицентромерном ГХ Взаимодействует с модификациями гистонов Регулирует уровни метилирования, влияя на доступность хроматина для ряда ДНК-связывающих белков, в т. ч. DNMT Вовлечен в метилирование de novo и метилирование гистонов; ассоциирует с DNMT 3 a и 3 b (не DNMT 1) Делеционные мутанты (делеции геликазных доменов) – перинатальная смертность; почти нормальное развитие, но дефекты развития почки и наработки лимфоцитов При умеренных нарушениях экспрессии: Гипометилирование как ряда повторенных последовательностей, так и уников (например, ген β-глобина) при сохранении активности метилаз Задержка роста и раннее старение, повышенная экспрессия ряда маркеров старения (прежде всего, бета-галактозидазы) Изменение паттернов экспрессии ряда генов Yan Q. et al. Moll. Cell. Biol. 2003; Zhu et al. , EMBO J. 2006
 Эпигенетические аберрации, ассоциированные с опухолями, часто представляют собой комплекс разнообразных изменений Esteller M. NEJM 2008
Эпигенетические аберрации, ассоциированные с опухолями, часто представляют собой комплекс разнообразных изменений Esteller M. NEJM 2008
 Механизмы поддержания эпигенетических паттернов неметилированная ДНК За “Учреждающая” метилаза? метилированная ДНК ро ды Де ше де мет ил ко вы нд ир ен ов й п са ан ци ие ут я , ь TSA Ингибирование HDAC, ацетилирование, инактивация DNMT 1, доступ деметилазы MBD белки HDAC, репрессоры, INHAT Деацетилирование гистонов, транзиентная репрессия Репликация Метилтрансферазы Подд. метилирование Метилирование de novo, метилирование гистонов, конденсация хроматина, стабильная репрессия 70
Механизмы поддержания эпигенетических паттернов неметилированная ДНК За “Учреждающая” метилаза? метилированная ДНК ро ды Де ше де мет ил ко вы нд ир ен ов й п са ан ци ие ут я , ь TSA Ингибирование HDAC, ацетилирование, инактивация DNMT 1, доступ деметилазы MBD белки HDAC, репрессоры, INHAT Деацетилирование гистонов, транзиентная репрессия Репликация Метилтрансферазы Подд. метилирование Метилирование de novo, метилирование гистонов, конденсация хроматина, стабильная репрессия 70
 Метилирование ДНК - итоги: Ø Метилирование ДНК широко распространено у прокариот и эукариот, а также их вирусов Ø Функции метилирования – защита от экспрессии чужеродных последовательностей, регуляция репликации, специфичная регуляция транскрипции генов, поддержание стабильности генома Ø Метилирование является одним из механизмов долговременной эпигенетической регуляции экспрессии генов эукариот Ø Механизмы регуляции, вовлекающие метилирование, тесно связаны с другими механизмами эпигенетической регуляции Ø В ходе формирования клеток зародышевой линии и в раннем развитии происходят глобальные волнообразные изменения статуса метилирования в масштабе генома Ø Статус метилирования многих последовательностей изменяется с возрастом. Нарушения метилирования могут приводить к разнообразным патологиям
Метилирование ДНК - итоги: Ø Метилирование ДНК широко распространено у прокариот и эукариот, а также их вирусов Ø Функции метилирования – защита от экспрессии чужеродных последовательностей, регуляция репликации, специфичная регуляция транскрипции генов, поддержание стабильности генома Ø Метилирование является одним из механизмов долговременной эпигенетической регуляции экспрессии генов эукариот Ø Механизмы регуляции, вовлекающие метилирование, тесно связаны с другими механизмами эпигенетической регуляции Ø В ходе формирования клеток зародышевой линии и в раннем развитии происходят глобальные волнообразные изменения статуса метилирования в масштабе генома Ø Статус метилирования многих последовательностей изменяется с возрастом. Нарушения метилирования могут приводить к разнообразным патологиям
 Благодарю за внимание! 72
Благодарю за внимание! 72


