 Металокомплексний каталіз
Металокомплексний каталіз
 Промислове використання гомогенних каталізаторів Гідроформилювання алкенів (оксосинтез): Окиснення алкенів (процес Вакера): Карбонилювання метанолу до оцтової кислоти (процес Монсанто):
Промислове використання гомогенних каталізаторів Гідроформилювання алкенів (оксосинтез): Окиснення алкенів (процес Вакера): Карбонилювання метанолу до оцтової кислоти (процес Монсанто):
 Промислове використання гомогенних каталізаторів Гідроціанування бутадієну до адипонітрилу: Олігомеризація етилену: Дисмутація алкенів (метатезис):
Промислове використання гомогенних каталізаторів Гідроціанування бутадієну до адипонітрилу: Олігомеризація етилену: Дисмутація алкенів (метатезис):
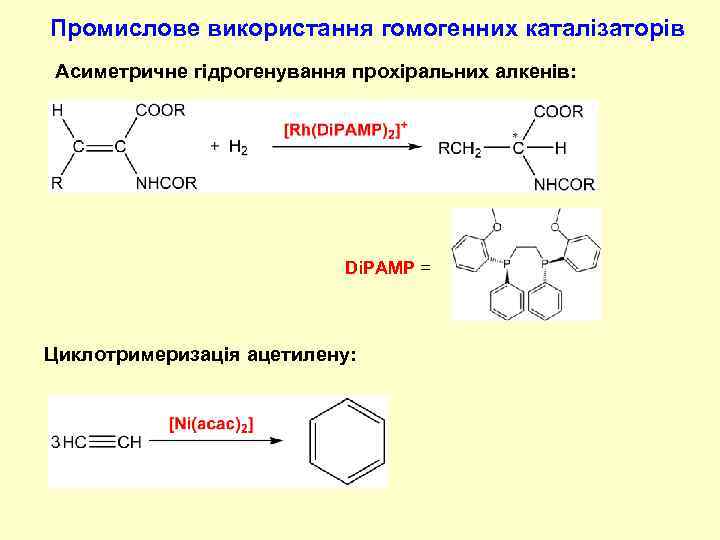 Промислове використання гомогенних каталізаторів Асиметричне гідрогенування прохіральних алкенів: Di. PAMP = Циклотримеризація ацетилену:
Промислове використання гомогенних каталізаторів Асиметричне гідрогенування прохіральних алкенів: Di. PAMP = Циклотримеризація ацетилену:
 Гідрування олефінів Каталізатори – комплекси родію Rh. Cl. L 3
Гідрування олефінів Каталізатори – комплекси родію Rh. Cl. L 3
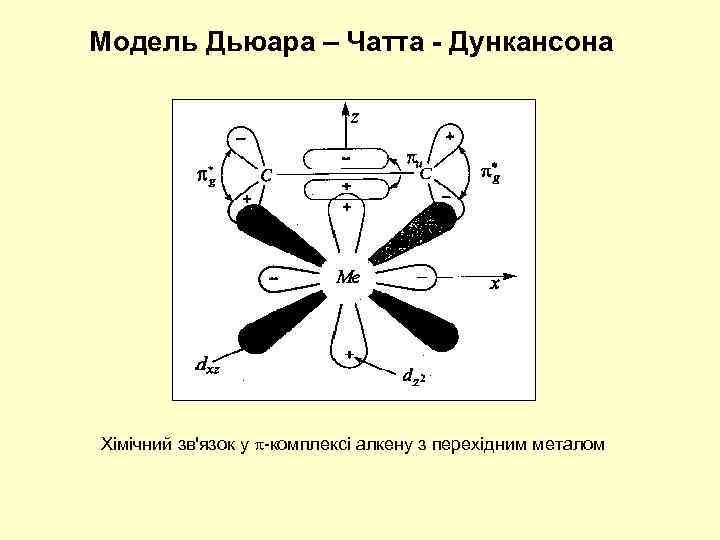 Модель Дьюара – Чатта - Дункансона Хімічний зв'язок у -комплексі алкену з перехідним металом
Модель Дьюара – Чатта - Дункансона Хімічний зв'язок у -комплексі алкену з перехідним металом
 Гідрування олефінів Каталітична полімеризація олефінів
Гідрування олефінів Каталітична полімеризація олефінів
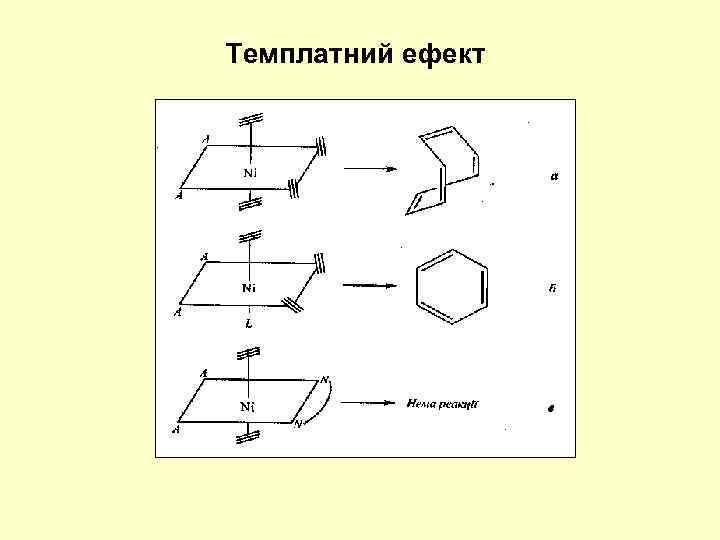 Темплатний ефект
Темплатний ефект
 Поліядерні та кластерні сполуки у каталізі Каталіз моноядерними комплексами 2 HO 2● H 2 O 2 + O 2 2 HO 2● + Mx+Ln H+ + O 2 + M(x-1)+Ln 2 HO 2● + M(x-1)+Ln HO 2 - + Mx+Ln Кластерна сполука кобальту Co 3(CR))(CO)9 Каталізатор реакції перетворення пероксид-радикалів HO 2 - + H+ H 2 O 2 2 HO 2● + [K] [K←: O–H] I O [K←: O–H] + HO 2● [K] + O 2 + H+ + HO 2 I O
Поліядерні та кластерні сполуки у каталізі Каталіз моноядерними комплексами 2 HO 2● H 2 O 2 + O 2 2 HO 2● + Mx+Ln H+ + O 2 + M(x-1)+Ln 2 HO 2● + M(x-1)+Ln HO 2 - + Mx+Ln Кластерна сполука кобальту Co 3(CR))(CO)9 Каталізатор реакції перетворення пероксид-радикалів HO 2 - + H+ H 2 O 2 2 HO 2● + [K] [K←: O–H] I O [K←: O–H] + HO 2● [K] + O 2 + H+ + HO 2 I O
 Ферментативний каталіз
Ферментативний каталіз
![Залежність швидкості ферментативної реакції від концентрації субстрату [Продукт] [S 4] [S 3] V V Залежність швидкості ферментативної реакції від концентрації субстрату [Продукт] [S 4] [S 3] V V](https://present5.com/presentation/15901622_151330688/image-11.jpg) Залежність швидкості ферментативної реакції від концентрації субстрату [Продукт] [S 4] [S 3] V V Час [S 2] [S 1]
Залежність швидкості ферментативної реакції від концентрації субстрату [Продукт] [S 4] [S 3] V V Час [S 2] [S 1]
![Початкова швидкість Залежність швидкості ферментативної реакції від концентрації субстрату [S] Концентрація субстрату [S], ммоль/л Початкова швидкість Залежність швидкості ферментативної реакції від концентрації субстрату [S] Концентрація субстрату [S], ммоль/л](https://present5.com/presentation/15901622_151330688/image-12.jpg) Початкова швидкість Залежність швидкості ферментативної реакції від концентрації субстрату [S] Концентрація субстрату [S], ммоль/л
Початкова швидкість Залежність швидкості ферментативної реакції від концентрації субстрату [S] Концентрація субстрату [S], ммоль/л
 Схема Міхаеліса – Ментен В стані динамічної рівноваги (steady state) швидкість утворення субстратензимного комплексу дорівнює швидкості його розпаду:
Схема Міхаеліса – Ментен В стані динамічної рівноваги (steady state) швидкість утворення субстратензимного комплексу дорівнює швидкості його розпаду:
![Схема Міхаеліса – Ментен Рівняння Міхаеліса - Ментен Vmax [S] V= KM + [S] Схема Міхаеліса – Ментен Рівняння Міхаеліса - Ментен Vmax [S] V= KM + [S]](https://present5.com/presentation/15901622_151330688/image-14.jpg) Схема Міхаеліса – Ментен Рівняння Міхаеліса - Ментен Vmax [S] V= KM + [S]
Схема Міхаеліса – Ментен Рівняння Міхаеліса - Ментен Vmax [S] V= KM + [S]
 Константа Міхаеліса - KM має розмірність концентрації (моль/літр) - типові величини KM: від 10 -1 до 10 -7 моль/літр) - KM чисельно дорівнює концентрації субстрату, при якій швидкість реакції досягає Vmax/2 - якщо k 2 << k-1, тоді KM фактично являється константою дисоціації KD ES-комплексу - при низьких концентраціях субстрату V прямо пропорційно [S] - при дуже високих концентраціях субстрату V не залежить від [S] (реакція „псевдо“- нульового порядку)
Константа Міхаеліса - KM має розмірність концентрації (моль/літр) - типові величини KM: від 10 -1 до 10 -7 моль/літр) - KM чисельно дорівнює концентрації субстрату, при якій швидкість реакції досягає Vmax/2 - якщо k 2 << k-1, тоді KM фактично являється константою дисоціації KD ES-комплексу - при низьких концентраціях субстрату V прямо пропорційно [S] - при дуже високих концентраціях субстрату V не залежить від [S] (реакція „псевдо“- нульового порядку)
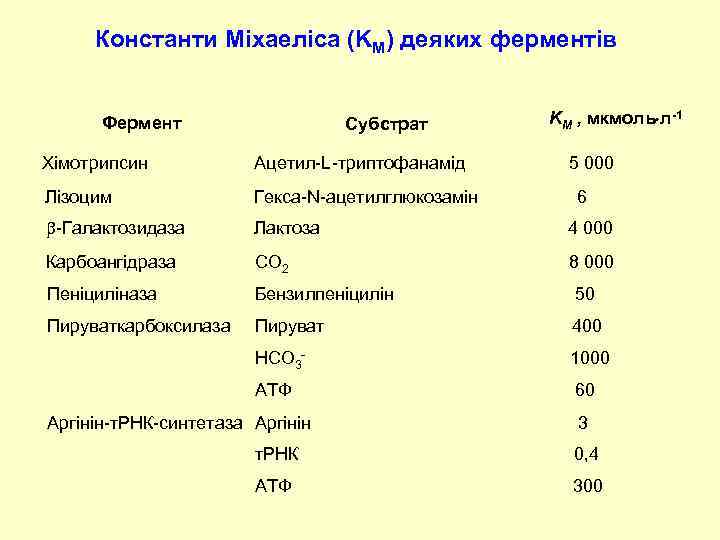 Константи Міхаеліса (KM) деяких ферментів Фермент Субстрат KM , мкмоль л-1 Хімотрипсин Ацетил-L-триптофанамід Лізоцим Гекса-N-ацетилглюкозамін -Галактозидаза Лактоза 4 000 Карбоангідраза CO 2 8 000 Пеніциліназа Бензилпеніцилін 50 Пируваткарбоксилаза Пируват 400 НСO 3 - 1000 АТФ 60 Аргінін-т. РНК-синтетаза Аргінін 5 000 6 3 т. РНК 0, 4 АТФ 300
Константи Міхаеліса (KM) деяких ферментів Фермент Субстрат KM , мкмоль л-1 Хімотрипсин Ацетил-L-триптофанамід Лізоцим Гекса-N-ацетилглюкозамін -Галактозидаза Лактоза 4 000 Карбоангідраза CO 2 8 000 Пеніциліназа Бензилпеніцилін 50 Пируваткарбоксилаза Пируват 400 НСO 3 - 1000 АТФ 60 Аргінін-т. РНК-синтетаза Аргінін 5 000 6 3 т. РНК 0, 4 АТФ 300
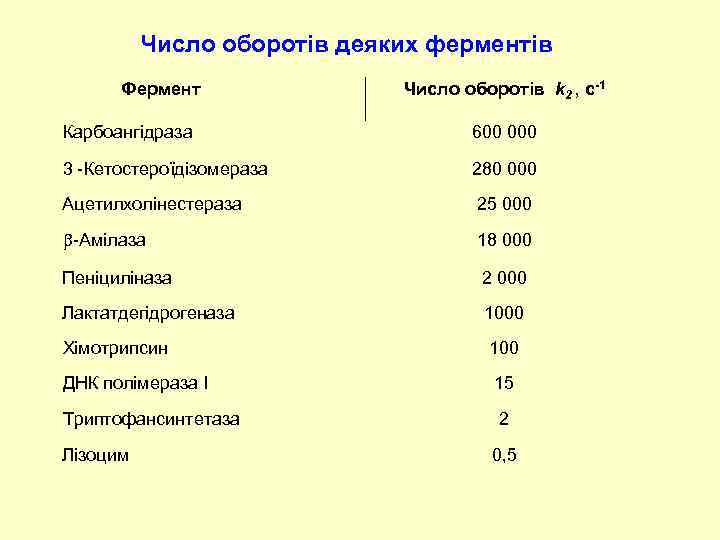 Число оборотів деяких ферментів Фермент Число оборотів k 2 , с-1 Карбоангідраза 600 000 3 -Кетостероїдізомераза 280 000 Ацетилхолінестераза 25 000 -Амілаза 18 000 Пеніциліназа 2 000 Лактатдегідрогеназа 1000 Хімотрипсин 100 ДНК полімераза I 15 Триптофансинтетаза 2 Лізоцим 0, 5
Число оборотів деяких ферментів Фермент Число оборотів k 2 , с-1 Карбоангідраза 600 000 3 -Кетостероїдізомераза 280 000 Ацетилхолінестераза 25 000 -Амілаза 18 000 Пеніциліназа 2 000 Лактатдегідрогеназа 1000 Хімотрипсин 100 ДНК полімераза I 15 Триптофансинтетаза 2 Лізоцим 0, 5
 Каталітична ефективність ензимів • Каталітична ефективність = kcat/Km • Міра оцінки “досконалості” ензиму • kcat/Km фактично є константою другого порядку (моль-1 • л • сек-1) • Верхня межа kcat/Km є дифузійною межею – швидкість, з якою ензим та субстрат дифундують разом (109 моль-1 • л • сек-1) • Багато ензимів наближається до цієї межі (напр. , каталаза, ацетилхолінестераза)
Каталітична ефективність ензимів • Каталітична ефективність = kcat/Km • Міра оцінки “досконалості” ензиму • kcat/Km фактично є константою другого порядку (моль-1 • л • сек-1) • Верхня межа kcat/Km є дифузійною межею – швидкість, з якою ензим та субстрат дифундують разом (109 моль-1 • л • сек-1) • Багато ензимів наближається до цієї межі (напр. , каталаза, ацетилхолінестераза)
![Графік Лайнуівера-Берка 1 V = KM x Vmax 1 [S] + Нахил 1 Vmax Графік Лайнуівера-Берка 1 V = KM x Vmax 1 [S] + Нахил 1 Vmax](https://present5.com/presentation/15901622_151330688/image-19.jpg) Графік Лайнуівера-Берка 1 V = KM x Vmax 1 [S] + Нахил 1 Vmax Y = a. X + b
Графік Лайнуівера-Берка 1 V = KM x Vmax 1 [S] + Нахил 1 Vmax Y = a. X + b
 Industrial use of homogeneous catalysis
Industrial use of homogeneous catalysis
 Доделать • Из Крылова стр. 315 – 336. • Перевести предідущий слайд
Доделать • Из Крылова стр. 315 – 336. • Перевести предідущий слайд