Металлы Выполнил: Жуковская Е.




























 Металлы Выполнил: Жуковская Е. 9 «б» класс Провела: Тужик Ольга Петровна
Металлы Выполнил: Жуковская Е. 9 «б» класс Провела: Тужик Ольга Петровна
 Понятие о металлах МЕТАЛЛЫ (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Понятие о металлах МЕТАЛЛЫ (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
 Химические элементы 118 -химические элементы; 6 элементов-щелочные МТ; 6 группа-щелочноземельных МТ; 38 группа-переходные МТ; 11 группа-лёгкие МТ; 7 группа-полуметаллы ; 14 группа-лантаноиды + лантан; 14 группа актиноиды + актиний; Вне определённых групп-бериллий и магний.
Химические элементы 118 -химические элементы; 6 элементов-щелочные МТ; 6 группа-щелочноземельных МТ; 38 группа-переходные МТ; 11 группа-лёгкие МТ; 7 группа-полуметаллы ; 14 группа-лантаноиды + лантан; 14 группа актиноиды + актиний; Вне определённых групп-бериллий и магний.
 =Ag= (серебро) Серебро — элемент побочной подгруппы первой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. Обозначается символом Ag (лат. Argentum). Простое вещество серебро (CAS-номер: 7440 -22 -4) — ковкий, пластичный благородный металл серебристо- белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 960 °C, плотность — 10, 5 г/см³.
=Ag= (серебро) Серебро — элемент побочной подгруппы первой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. Обозначается символом Ag (лат. Argentum). Простое вещество серебро (CAS-номер: 7440 -22 -4) — ковкий, пластичный благородный металл серебристо- белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 960 °C, плотность — 10, 5 г/см³.
 История Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки монет.
История Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки монет.
 Месторождения Значительные месторождения серебра расположены на территориях следующих стран: Германия, Испания, Перу, Чили, Мексика, Китай, Канада, США, Австралия, Польша, Россия, Казахстан, Румыния, Швеция, Чехия, Словакия, Австрия, Венгрия, Норвегия. Также, месторождения серебра есть в Армении, на Кипре и на Сардинии.
Месторождения Значительные месторождения серебра расположены на территориях следующих стран: Германия, Испания, Перу, Чили, Мексика, Китай, Канада, США, Австралия, Польша, Россия, Казахстан, Румыния, Швеция, Чехия, Словакия, Австрия, Венгрия, Норвегия. Также, месторождения серебра есть в Армении, на Кипре и на Сардинии.
 Химические свойства o Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется: Ag + 2 HNO 3(конц. ) = Ag. NO 3 + NO 2↑ + H 2 O NO 2↑ o Растворяется оно и в хлорном железе, что применяется для травления: Ag + Fe. Cl 3 = Ag. Cl + Fe. Cl 2 o Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра). o Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий: 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O o Свободные галогены легко окисляют серебро до галогенидов: 2 Ag + I 2 = 2 Ag. I o При нагревании с серой серебро даёт сульфид.
Химические свойства o Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется: Ag + 2 HNO 3(конц. ) = Ag. NO 3 + NO 2↑ + H 2 O NO 2↑ o Растворяется оно и в хлорном железе, что применяется для травления: Ag + Fe. Cl 3 = Ag. Cl + Fe. Cl 2 o Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра). o Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий: 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O o Свободные галогены легко окисляют серебро до галогенидов: 2 Ag + I 2 = 2 Ag. I o При нагревании с серой серебро даёт сульфид.
 =Au= (золото) Зо лото — элемент побочной лото подгруппы первой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79. Обозначается символом Au (лат. Aurum[2]). Простое вещество золото (CAS- номер: 7440 -57 -5) — благородный металл жёлтого цвета.
=Au= (золото) Зо лото — элемент побочной лото подгруппы первой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79. Обозначается символом Au (лат. Aurum[2]). Простое вещество золото (CAS- номер: 7440 -57 -5) — благородный металл жёлтого цвета.
 История Праславянское *zolto (русск. золото, ст. -слав. злато, польск. złoto) родственно лит. geltonas «жёлтый» , латыш. zelts «золото, золотой» ; с другим вокализмом: готск. gulþ, нем. gold, англ. gold; далее санскр. hiraṇyam, авест. zaranya, осет. zærījnæ «золото» , также санскр. hari «жёлтый, золотистый, зеленоватый» , от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий» . Отсюда же названия цветов: жёлтый, зелёный.
История Праславянское *zolto (русск. золото, ст. -слав. злато, польск. złoto) родственно лит. geltonas «жёлтый» , латыш. zelts «золото, золотой» ; с другим вокализмом: готск. gulþ, нем. gold, англ. gold; далее санскр. hiraṇyam, авест. zaranya, осет. zærījnæ «золото» , также санскр. hari «жёлтый, золотистый, зеленоватый» , от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий» . Отсюда же названия цветов: жёлтый, зелёный.
 Химические свойства o Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности. o Есть соединения золота со степенью окисления − 1. Например Cs. Au (Аурид цезия) Na 3 Au (Аурид натрия)[3]. Эти соединения называют Ауриды. o Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид Au. Br 3[4]. o Со фтором золото реагирует в интервале температур 300− 400 °C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются. o Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму). o Существуют золотоорганические соединения (например, бромид диэтилзолота).
Химические свойства o Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности. o Есть соединения золота со степенью окисления − 1. Например Cs. Au (Аурид цезия) Na 3 Au (Аурид натрия)[3]. Эти соединения называют Ауриды. o Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид Au. Br 3[4]. o Со фтором золото реагирует в интервале температур 300− 400 °C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются. o Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму). o Существуют золотоорганические соединения (например, бромид диэтилзолота).
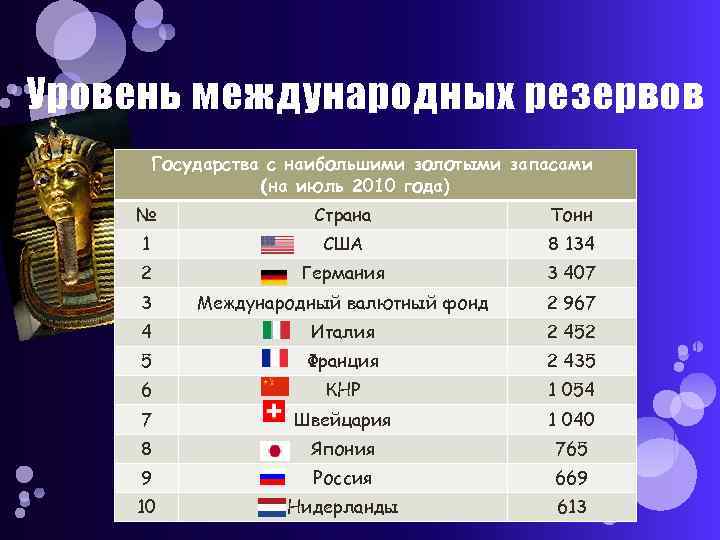
 Уровень международных резервов Государства с наибольшими золотыми запасами (на июль 2010 года) № Страна Тонн 1 США 8 134 2 Германия 3 407 3 Международный валютный фонд 2 967 4 Италия 2 452 5 Франция 2 435 6 КНР 1 054 7 Швейцария 1 040 8 Япония 765 9 Россия 669 10 Нидерланды 613
Уровень международных резервов Государства с наибольшими золотыми запасами (на июль 2010 года) № Страна Тонн 1 США 8 134 2 Германия 3 407 3 Международный валютный фонд 2 967 4 Италия 2 452 5 Франция 2 435 6 КНР 1 054 7 Швейцария 1 040 8 Япония 765 9 Россия 669 10 Нидерланды 613
 =Hg= (ртуть) Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть (CAS- номер: 7439 -97 -6) — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй элемент — бром). В природе находится как в самородном виде, так и образует ряд минералов. Чаще всего ртуть получают путём восстановления из её наиболее распространённого минерала — киновари. Применяется для изготовления измерительных приборов, вакуумных насосов, источников света и в других областях науки и техники. В старину применялась в изготовлении зеркал.
=Hg= (ртуть) Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть (CAS- номер: 7439 -97 -6) — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй элемент — бром). В природе находится как в самородном виде, так и образует ряд минералов. Чаще всего ртуть получают путём восстановления из её наиболее распространённого минерала — киновари. Применяется для изготовления измерительных приборов, вакуумных насосов, источников света и в других областях науки и техники. В старину применялась в изготовлении зеркал.
 Месторождения Ртуть считается редким металлом. Известны месторождения ртути в Закавказье (Дагестан, Армения), Таджикистане, Словении, Киргизии, Узбекистане[источник не указан 232 дня], Украине (Горловка, Никитовский ртутный комбинат).
Месторождения Ртуть считается редким металлом. Известны месторождения ртути в Закавказье (Дагестан, Армения), Таджикистане, Словении, Киргизии, Узбекистане[источник не указан 232 дня], Украине (Горловка, Никитовский ртутный комбинат).
 В окружающей среде До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограмма на литр льда. Природные источники, такие как вулканы, составляют примерно половину всех выбросов атмосферной ртути. За оставшуюся половину ответственна деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля главным образом в тепловых электростанциях — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6, 8 %, производство цемента — 6, 4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1, 4 %, ртути (в основном для батареек) — 1, 1 %, остальное — 2 %. Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
В окружающей среде До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограмма на литр льда. Природные источники, такие как вулканы, составляют примерно половину всех выбросов атмосферной ртути. За оставшуюся половину ответственна деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля главным образом в тепловых электростанциях — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6, 8 %, производство цемента — 6, 4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1, 4 %, ртути (в основном для батареек) — 1, 1 %, остальное — 2 %. Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
 Химические свойства Ртуть — малоактивный металл (см. ряд напряжений ). При нагревании до 300 °C ртуть вступает в реакцию с кислородом : ~mathrm{2 Hg+O_2 ~mathrm{2 Hg+O_2 xrightarrow{300^circ C} 2 Hg. O} xrightarrow{300^circ Образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. ~mathrm{Hg. O xrightarrow{>340^circ C} веществ. ~mathrm{ xrightarrow{>340^circ 2 Hg+O_2uparrow} Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II ): ~mathrm{Hg+S ~mathrm{ xrightarrow{t^circ C} Hg. S} xrightarrow{t^circ Hg. S} Ртуть не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте, образуя соли двухвалентной ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg 2(NO 3)2. Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6 d 10 — электронной оболочки, что приводит к возможности существования соединений ртути (+4). Так, кроме малорастворимого Hg 2 F 2 и разлагающегося водой Hg. F 2 существует и Hg. F 4, получаемый при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К.
Химические свойства Ртуть — малоактивный металл (см. ряд напряжений ). При нагревании до 300 °C ртуть вступает в реакцию с кислородом : ~mathrm{2 Hg+O_2 ~mathrm{2 Hg+O_2 xrightarrow{300^circ C} 2 Hg. O} xrightarrow{300^circ Образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. ~mathrm{Hg. O xrightarrow{>340^circ C} веществ. ~mathrm{ xrightarrow{>340^circ 2 Hg+O_2uparrow} Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II ): ~mathrm{Hg+S ~mathrm{ xrightarrow{t^circ C} Hg. S} xrightarrow{t^circ Hg. S} Ртуть не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте, образуя соли двухвалентной ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg 2(NO 3)2. Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6 d 10 — электронной оболочки, что приводит к возможности существования соединений ртути (+4). Так, кроме малорастворимого Hg 2 F 2 и разлагающегося водой Hg. F 2 существует и Hg. F 4, получаемый при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К.
 =W= (вольфрам ) Вольфра м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
=W= (вольфрам ) Вольфра м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
 История и происхождение названия Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков ( «пожирает олово как волк овцу» ). В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень» ).
История и происхождение названия Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков ( «пожирает олово как волк овцу» ). В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень» ).
 Месторождения Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 18 -20 тысяч тонн в год, в том числе в Китае 10, России 3, 5; Казахстане 0, 7, Австрии 0, 5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания. Также есть месторождения вольфрама в Армении и других странах.
Месторождения Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 18 -20 тысяч тонн в год, в том числе в Китае 10, России 3, 5; Казахстане 0, 7, Австрии 0, 5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания. Также есть месторождения вольфрама в Армении и других странах.
 Химические свойства Валентность от 2 до 6. Наиболее устойчив 6 -валентный вольфрам. 3 - и 2 -валентные соединения вольфрама неустойчивы и практического значения не имеют. Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Химические свойства Валентность от 2 до 6. Наиболее устойчив 6 -валентный вольфрам. 3 - и 2 -валентные соединения вольфрама неустойчивы и практического значения не имеют. Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
 =Rh= (родий) Ро дий (лат. Rhodium; обозначается дий символом Rh) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 45. Простое вещество родий (CAS- номер: 7440 -16 -6) — твёрдый переходный металл серебристо- белого цвета. Благородный металл платиновой группы.
=Rh= (родий) Ро дий (лат. Rhodium; обозначается дий символом Rh) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 45. Простое вещество родий (CAS- номер: 7440 -16 -6) — твёрдый переходный металл серебристо- белого цвета. Благородный металл платиновой группы.
 Содержание в природе Родий содержится в платиновых рудах, в некоторых золотых песках Южной Америки. До 43 % родия содержится в мексиканском золоте. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3, 3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал
Содержание в природе Родий содержится в платиновых рудах, в некоторых золотых песках Южной Америки. До 43 % родия содержится в мексиканском золоте. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3, 3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал
 Биологическая роль и физиологическое воздействие Родий не играет биологической роли. Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высоко токсичными и канцерогенными веществами. LD 50 хлорида родия для крыс — 12, 6 мг/кг. Соли родия способны сильно окрашивать человеческую кожу.
Биологическая роль и физиологическое воздействие Родий не играет биологической роли. Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высоко токсичными и канцерогенными веществами. LD 50 хлорида родия для крыс — 12, 6 мг/кг. Соли родия способны сильно окрашивать человеческую кожу.
 Химические свойства Родий — благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину. Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты. Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C. Высшую степень окисления +6 родий проявляет в гексафториде Rh. F 6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или оксид азота (II) NO. При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3. При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита натрия и бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO 4, пероксида натрия Na 2 O 2 и пероксида бария Ba. O 2.
Химические свойства Родий — благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину. Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты. Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C. Высшую степень окисления +6 родий проявляет в гексафториде Rh. F 6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или оксид азота (II) NO. При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3. При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита натрия и бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO 4, пероксида натрия Na 2 O 2 и пероксида бария Ba. O 2.
 =Sb= (сурьма) Сурьма (лат. Stibium; обозначается символом Sb) — элемент главной подгруппы пятой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 51. Простое вещество сурьма (CAS- номер: 7440 -36 -0) — металл (полуметалл) серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма).
=Sb= (сурьма) Сурьма (лат. Stibium; обозначается символом Sb) — элемент главной подгруппы пятой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 51. Простое вещество сурьма (CAS- номер: 7440 -36 -0) — металл (полуметалл) серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма).
 Нахождение в природе Кларк сурьмы 500 мг/т. Её содержание в изверженных породах в общем ниже, чем в осадочных. Из осадочных пород наиболее высокие концентрации сурьмы отмечаются в глинистых сланцах (1, 2 г/т), бокситах и фосфоритах (2 г/т) и самые низкие в известняках и песчаниках (0, 3 г/т). Повышенные количества сурьмы установлены в золе углей. Сурьма, с одной стороны, в природных соединениях имеет свойства металла и является типичным халькофильным элементом, образуя антимонит. С другой стороны она обладает свойствами металлоида, проявляющимися в образовании различных сульфосолей — бурнонита, буланжерита, тетраэдрита, джемсонита, пираргирита и др. С такими металлами как медь, мышьяк и палладий, сурьма может давать интерметаллические соединения.
Нахождение в природе Кларк сурьмы 500 мг/т. Её содержание в изверженных породах в общем ниже, чем в осадочных. Из осадочных пород наиболее высокие концентрации сурьмы отмечаются в глинистых сланцах (1, 2 г/т), бокситах и фосфоритах (2 г/т) и самые низкие в известняках и песчаниках (0, 3 г/т). Повышенные количества сурьмы установлены в золе углей. Сурьма, с одной стороны, в природных соединениях имеет свойства металла и является типичным халькофильным элементом, образуя антимонит. С другой стороны она обладает свойствами металлоида, проявляющимися в образовании различных сульфосолей — бурнонита, буланжерита, тетраэдрита, джемсонита, пираргирита и др. С такими металлами как медь, мышьяк и палладий, сурьма может давать интерметаллические соединения.
 Изотопы Природная сурьма является смесью двух изотопов: 121 Sb (изотопная распространённость 57, 36 %) и 123 Sb (42, 64 %). Единственный долгоживущий радионуклид — 125 Sb с периодом полураспада 2, 76 года, все остальные изотопы и изомеры сурьмы имеют период полураспада, не превышающий двух месяцев. Пороговая энергия для реакций с высвобождением нейтрона (первого): 121 Sb — 9, 248 Мэв, 123 Sb — 8, 977 Мэв, 125 Sb — 8, 730 Мэв.
Изотопы Природная сурьма является смесью двух изотопов: 121 Sb (изотопная распространённость 57, 36 %) и 123 Sb (42, 64 %). Единственный долгоживущий радионуклид — 125 Sb с периодом полураспада 2, 76 года, все остальные изотопы и изомеры сурьмы имеют период полураспада, не превышающий двух месяцев. Пороговая энергия для реакций с высвобождением нейтрона (первого): 121 Sb — 9, 248 Мэв, 123 Sb — 8, 977 Мэв, 125 Sb — 8, 730 Мэв.
 Биологическая роль и воздействие на организм Сурьма относится к микроэлементам. Её содержание в организме человека составляет 10− 6% по массе. Постоянно присутствует в живых организмах, физиологическая и биохимическая роль не выяснена. Сурьма проявляет раздражающее и кумулятивное действие. Накапливается в щитовидной железе, угнетает её функцию и вызывает эндемический зоб. Однако, попадая в пищеварительный тракт, соединения сурьмы не вызывают отравления, так как соли Sb(III) там гидролизуются с образованием малорастворимых продуктов. При этом соединения сурьмы (III) более токсичны, чем сурьмы (V). Пыль и пары Sb вызывают носовые кровотечения, сурьмяную «литейную лихорадку» , пневмосклероз, поражают кожу, нарушают половые функции. Порог восприятия привкуса в воде — 0, 5 мг/л. Смертельная доза для взрослого человека — 100 мг, для детей — 49 мг. Для аэрозолей сурьмы ПДК в воздухе рабочей зоны 0, 5 мг/м³, в атмосферном воздухе 0, 01 мг/м³. ПДК в почве 4, 5 мг/кг. В питьевой воде сурьма относится ко 2 классу опасности, имеет ПДК 0, 005 мг/л[8], установленное по санитарно-токсикологическому ЛПВ. В природных водах норматив содержания составляет 0, 05 мг/л. В сточных промышленных водах, сбрасываемых на очистные сооружения, имеющие биофильтры, содержание сурьмы не должно превышать 0, 2 мг/л.
Биологическая роль и воздействие на организм Сурьма относится к микроэлементам. Её содержание в организме человека составляет 10− 6% по массе. Постоянно присутствует в живых организмах, физиологическая и биохимическая роль не выяснена. Сурьма проявляет раздражающее и кумулятивное действие. Накапливается в щитовидной железе, угнетает её функцию и вызывает эндемический зоб. Однако, попадая в пищеварительный тракт, соединения сурьмы не вызывают отравления, так как соли Sb(III) там гидролизуются с образованием малорастворимых продуктов. При этом соединения сурьмы (III) более токсичны, чем сурьмы (V). Пыль и пары Sb вызывают носовые кровотечения, сурьмяную «литейную лихорадку» , пневмосклероз, поражают кожу, нарушают половые функции. Порог восприятия привкуса в воде — 0, 5 мг/л. Смертельная доза для взрослого человека — 100 мг, для детей — 49 мг. Для аэрозолей сурьмы ПДК в воздухе рабочей зоны 0, 5 мг/м³, в атмосферном воздухе 0, 01 мг/м³. ПДК в почве 4, 5 мг/кг. В питьевой воде сурьма относится ко 2 классу опасности, имеет ПДК 0, 005 мг/л[8], установленное по санитарно-токсикологическому ЛПВ. В природных водах норматив содержания составляет 0, 05 мг/л. В сточных промышленных водах, сбрасываемых на очистные сооружения, имеющие биофильтры, содержание сурьмы не должно превышать 0, 2 мг/л.
 Конец
Конец

