Metally_sredney_aktivnosti_Andrianov_Kuzmin.pptx
- Количество слайдов: 24
 Металлы средней активности (Fe, Al, Zn)
Металлы средней активности (Fe, Al, Zn)
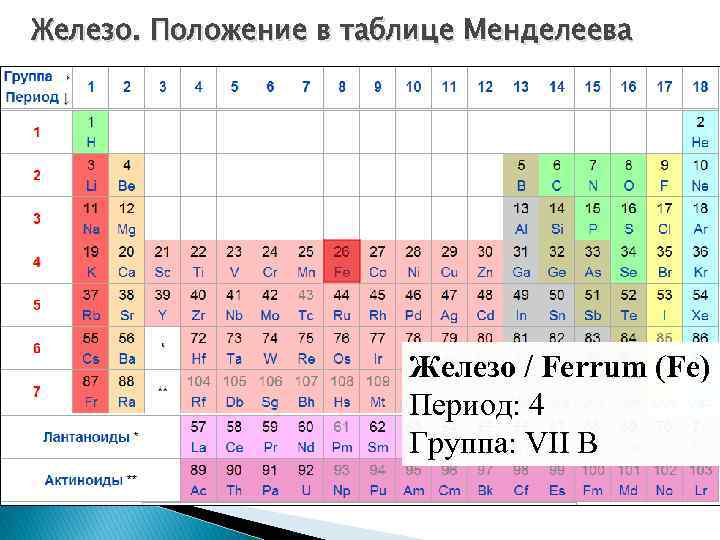 Железо. Положение в таблице Менделеева Железо / Ferrum (Fe) Период: 4 Группа: VII B
Железо. Положение в таблице Менделеева Железо / Ferrum (Fe) Период: 4 Группа: VII B
 Железо. Строение атома Молярная масса: 55, 847 г/моль Электронная конфигурация 1 s 2|2 s 22 p 6|3 s 23 p 63 d 6|4 s 2 Степени окисления: 0, +2, +3, +6 Валентности: I, II
Железо. Строение атома Молярная масса: 55, 847 г/моль Электронная конфигурация 1 s 2|2 s 22 p 6|3 s 23 p 63 d 6|4 s 2 Степени окисления: 0, +2, +3, +6 Валентности: I, II
 Нахождение в природе. Соединения • Распространённость в земной коре — 4, 65 % • Составляет бо льшую часть земного ядра • Соединения: • Fe 2 O 3 (гематит, или красный железняк) • Fe 3 O 4 (магнетит, или магнитный железняк) • Fe. S 2 (сульфид железа, или пирит) – см. рис.
Нахождение в природе. Соединения • Распространённость в земной коре — 4, 65 % • Составляет бо льшую часть земного ядра • Соединения: • Fe 2 O 3 (гематит, или красный железняк) • Fe 3 O 4 (магнетит, или магнитный железняк) • Fe. S 2 (сульфид железа, или пирит) – см. рис.
 Получение • В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) Доменный процесс: • Восстановление водородом из оксида • Алюминотермия: 8 Al + 3 Fe 3 O 4 = 9 Fe + 4 Al 2 O 3 • Лабораторный способ: электролиз расплава хлорида железа Fe. Cl 3 = Fe+ + 3 Cl-
Получение • В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) Доменный процесс: • Восстановление водородом из оксида • Алюминотермия: 8 Al + 3 Fe 3 O 4 = 9 Fe + 4 Al 2 O 3 • Лабораторный способ: электролиз расплава хлорида железа Fe. Cl 3 = Fe+ + 3 Cl-
 Физические свойства • • Серебристо-белый цвет с сероватым оттенком Пластично, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость Ковкий и вязкий металл Ярко выражены магнитные свойства Тугоплавко (относится к металлам средней активности) Температура плавления железа 1539 °C Температура кипения — 2862 °C
Физические свойства • • Серебристо-белый цвет с сероватым оттенком Пластично, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость Ковкий и вязкий металл Ярко выражены магнитные свойства Тугоплавко (относится к металлам средней активности) Температура плавления железа 1539 °C Температура кипения — 2862 °C

 Химические свойства: • 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (феррит железа) • 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3 • 2 Fe + 3 Cl 2 =(t) 2 Fe. Cl 3 • Fe + S = Fe. S • Fe + Cu. SO 4 = Fe. SO 4 + Cu • Fe + 2 HCl = Fe. Cl 2 + H 2 • 2 Fe+6 H 2 SO 4(конц. ) =(t) Fe 2(SO 4)3+3 SO 2+6 H 2 O • Fe+4 HNO 3(конц. ) =(t) Fe(NO 3)3+NO+2 H 2 O • 3 Fe+8 HNO 3(разб. ) =(t) 3 Fe(NO 3)2+2 NO+4 H 2 O
Химические свойства: • 3 Fe + 2 O 2 = Fe 2 O 3 • Fe. O (феррит железа) • 4 Fe + 3 О 2 + 6 Н 2 О = 4 Fe(ОН)3 • 2 Fe + 3 Cl 2 =(t) 2 Fe. Cl 3 • Fe + S = Fe. S • Fe + Cu. SO 4 = Fe. SO 4 + Cu • Fe + 2 HCl = Fe. Cl 2 + H 2 • 2 Fe+6 H 2 SO 4(конц. ) =(t) Fe 2(SO 4)3+3 SO 2+6 H 2 O • Fe+4 HNO 3(конц. ) =(t) Fe(NO 3)3+NO+2 H 2 O • 3 Fe+8 HNO 3(разб. ) =(t) 3 Fe(NO 3)2+2 NO+4 H 2 O
 Применение • • • Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Применение • • • Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
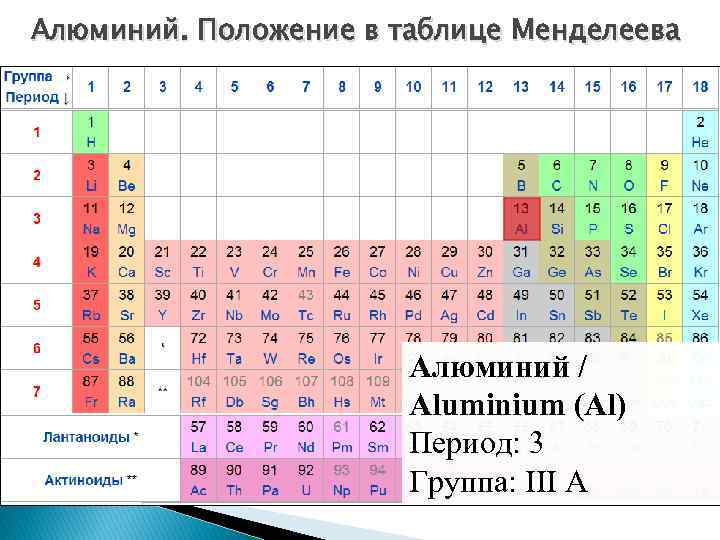 Алюминий. Положение в таблице Менделеева Алюминий / Aluminium (Al) Период: 3 Группа: III A
Алюминий. Положение в таблице Менделеева Алюминий / Aluminium (Al) Период: 3 Группа: III A
 Алюминий. Строение атома Молярная масса: 26, 981539 г/моль Электронная конфигурация: 1 s 2|2 s 22 p 6|3 s 23 p 1 Степень окисления: +3 Валентность: III
Алюминий. Строение атома Молярная масса: 26, 981539 г/моль Электронная конфигурация: 1 s 2|2 s 22 p 6|3 s 23 p 1 Степень окисления: +3 Валентность: III
 Нахождение в природе. Соединения • Бокситы — Al 2 O 3 · H 2 O (с примесями Si. O 2, Fe 2 O 3, Ca. CO 3) • Нефелины — Na 2 O · Al 2 O 3 · 2 Si. O 2 • Корунд (сапфир, рубин, наждак) — Al 2 O 3 • Полевые шпаты — K 2 O·Al 2 O 3· 6 Si. O 2 • Берилл (изумруд, аквамарин) — 3 Ве. О · Al 2 О 3 · 6 Si. O 2 • Каолинит — Al 2 O 3· 2 Si. O 2 · 2 H 2 O –см. рис. В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия
Нахождение в природе. Соединения • Бокситы — Al 2 O 3 · H 2 O (с примесями Si. O 2, Fe 2 O 3, Ca. CO 3) • Нефелины — Na 2 O · Al 2 O 3 · 2 Si. O 2 • Корунд (сапфир, рубин, наждак) — Al 2 O 3 • Полевые шпаты — K 2 O·Al 2 O 3· 6 Si. O 2 • Берилл (изумруд, аквамарин) — 3 Ве. О · Al 2 О 3 · 6 Si. O 2 • Каолинит — Al 2 O 3· 2 Si. O 2 · 2 H 2 O –см. рис. В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия
 Получение • Нагревание хлорида алюминия со щелочным металлом: Al. Cl 3 + 3 K =(t) 3 KCl + Al • Электролиз расплава хлорида аллюминия: 2 Al. Cl 3 = 3 Cl 2 +2 Al
Получение • Нагревание хлорида алюминия со щелочным металлом: Al. Cl 3 + 3 K =(t) 3 KCl + Al • Электролиз расплава хлорида аллюминия: 2 Al. Cl 3 = 3 Cl 2 +2 Al
 Физические свойства • • • Металл серебристо-белого цвета, лёгкий Плотность — 2, 7 г/см³ Температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C Удельная теплота плавления — 390 к. Дж/кг Температура кипения — 2500 °C Удельная теплота испарения — 10, 53 МДж/кг высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу Алюминий обладает высокой электропроводностью (0, 0265 мк. Ом·м) и теплопроводностью (203, 5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью. Слабый парамагнетик. Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием
Физические свойства • • • Металл серебристо-белого цвета, лёгкий Плотность — 2, 7 г/см³ Температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C Удельная теплота плавления — 390 к. Дж/кг Температура кипения — 2500 °C Удельная теплота испарения — 10, 53 МДж/кг высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу Алюминий обладает высокой электропроводностью (0, 0265 мк. Ом·м) и теплопроводностью (203, 5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью. Слабый парамагнетик. Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием
 Кодовый символ указывающий что алюминий может быть вторично переработан Микроструктура алюминия на протравленной поверхности слитка, чистотой 99, 9998 %, размер видимого сектора около 55× 37 мм
Кодовый символ указывающий что алюминий может быть вторично переработан Микроструктура алюминия на протравленной поверхности слитка, чистотой 99, 9998 %, размер видимого сектора около 55× 37 мм
 Химические свойства 4 Al + 3 O 2 = 2 Al 2 O 3 • 2 Al + 3 Hal 2 = 2 Al. Hal 3 • 2 Al + 3 S = Al 2 S 3 • 2 Al + N 2 = 2 Al. N • 4 Al + 3 С = Al 4 С 3 • 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 • 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 • 2 Al + 6 H 2 SO 4(конц) = Al 2(SO 4)3 + 3 SO 2 + 6 H 2 O • Al + 6 HNO 3(конц) = Al(NO 3)3 + 3 NO 2 + 3 H 2 O • 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe В окислительном пламени: Жёлто-бурый В восстановительном пламени: Зелёный •
Химические свойства 4 Al + 3 O 2 = 2 Al 2 O 3 • 2 Al + 3 Hal 2 = 2 Al. Hal 3 • 2 Al + 3 S = Al 2 S 3 • 2 Al + N 2 = 2 Al. N • 4 Al + 3 С = Al 4 С 3 • 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 • 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 • 2 Al + 6 H 2 SO 4(конц) = Al 2(SO 4)3 + 3 SO 2 + 6 H 2 O • Al + 6 HNO 3(конц) = Al(NO 3)3 + 3 NO 2 + 3 H 2 O • 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe В окислительном пламени: Жёлто-бурый В восстановительном пламени: Зелёный •
 Применение Благодаря комплексу свойств широко распространён в тепловом оборудовании. Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике. Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал. В производстве строительных материалов как газообразующий агент. Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например клапанам поршневых ДВС, лопаткам турбин, нефтяным платформам, теплообменной аппаратуре, а также заменяют цинкование. Сульфид алюминия используется для производства сероводорода. Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала. В качестве восстановителя: Как компонент термита, смесей для алюмотермии Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
Применение Благодаря комплексу свойств широко распространён в тепловом оборудовании. Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике. Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал. В производстве строительных материалов как газообразующий агент. Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например клапанам поршневых ДВС, лопаткам турбин, нефтяным платформам, теплообменной аппаратуре, а также заменяют цинкование. Сульфид алюминия используется для производства сероводорода. Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала. В качестве восстановителя: Как компонент термита, смесей для алюмотермии Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
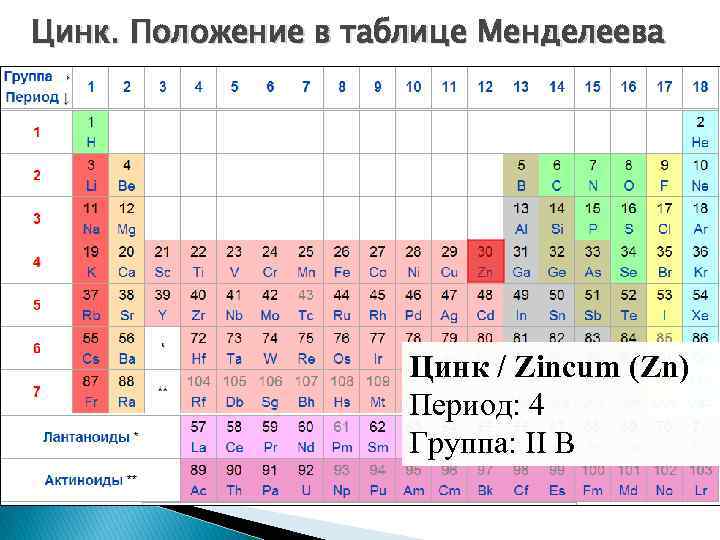 Цинк. Положение в таблице Менделеева Цинк / Zincum (Zn) Период: 4 Группа: II B
Цинк. Положение в таблице Менделеева Цинк / Zincum (Zn) Период: 4 Группа: II B
 Цинк. Строение атома Молярная масса: 65, 39 г/моль Электронная конфигурация: 1 s 2|2 s 22 p 6|3 s 23 p 63 d 10|4 s 2 Степени окисления: +2 Валентность: II
Цинк. Строение атома Молярная масса: 65, 39 г/моль Электронная конфигурация: 1 s 2|2 s 22 p 6|3 s 23 p 63 d 10|4 s 2 Степени окисления: +2 Валентность: II
 Нахождение в природе. Соединения: Сфалерит (сульфид цинка Zn. S) Смитсонит Zn. CO 3 Цинкит Zn. O – рис. 2 Каламин 2 Zn. O · Si. O 2 · Н 2 O
Нахождение в природе. Соединения: Сфалерит (сульфид цинка Zn. S) Смитсонит Zn. CO 3 Цинкит Zn. O – рис. 2 Каламин 2 Zn. O · Si. O 2 · Н 2 O
 Получение Пирометаллургический способ Zn. O + С = Zn + CO Электролиз расплава хлорида цинка: Zn. Cl 2 = Cl 2 +Zn
Получение Пирометаллургический способ Zn. O + С = Zn + CO Электролиз расплава хлорида цинка: Zn. Cl 2 = Cl 2 +Zn
 Физические свойства В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0, 26649 нм, с = 0, 49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова» ). При 100— 150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13, 1· 1028 м− 3
Физические свойства В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0, 26649 нм, с = 0, 49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова» ). При 100— 150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13, 1· 1028 м− 3
 Химические свойства • • 2 Zn + O 2 =(t) 2 Zn. O Zn + 2 HCl = Zn. Cl 2 + H 2↑ Zn + Hal = (t) Zn. Hal 2 Zn + S = Zn. S Zn + H 2, N 2, C, Si, B ⇏ При t=500° С цинк горит бело-голубым пламенем, а на поверхность возле пламени выпадает в виде порошка оксид цинка. В холодном состоянии он белого цвета, а в горячем — жёлтого. Соли цинка – красный цвет пламени.
Химические свойства • • 2 Zn + O 2 =(t) 2 Zn. O Zn + 2 HCl = Zn. Cl 2 + H 2↑ Zn + Hal = (t) Zn. Hal 2 Zn + S = Zn. S Zn + H 2, N 2, C, Si, B ⇏ При t=500° С цинк горит бело-голубым пламенем, а на поверхность возле пламени выпадает в виде порошка оксид цинка. В холодном состоянии он белого цвета, а в горячем — жёлтого. Соли цинка – красный цвет пламени.
 Применение Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Цинк используется в качестве материала для отрицательного электрода в батарейках и аккумуляторах. Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателейи для электромобилей (пробег до 900 км). Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил. Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья приемлемой прочности. Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры. Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Применение Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Цинк используется в качестве материала для отрицательного электрода в батарейках и аккумуляторах. Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателейи для электромобилей (пробег до 900 км). Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил. Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья приемлемой прочности. Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры. Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.


