Металлы – самая представительная группа элементов 87


























- Размер: 24.9 Mегабайта
- Количество слайдов: 39
Описание презентации Металлы – самая представительная группа элементов 87 по слайдам
 Металлы – самая представительная группа элементов 87 из 110 элементов – металлы
Металлы – самая представительная группа элементов 87 из 110 элементов – металлы

 Общность свойств металлов • 1) как правило, атомы металлов имеют небольшое число электронов на внешнем уровне электронной оболочки; • 2) практически для всех металлов характерна слабая связь валентных электронов с ядрами атомов.
Общность свойств металлов • 1) как правило, атомы металлов имеют небольшое число электронов на внешнем уровне электронной оболочки; • 2) практически для всех металлов характерна слабая связь валентных электронов с ядрами атомов.
 • Отличает металлическую связь от ковалентной отсутствие направленности связи и меньшая прочность. • Энергия металлической связи в 3 4 раза меньше энергии ковалентной связи.
• Отличает металлическую связь от ковалентной отсутствие направленности связи и меньшая прочность. • Энергия металлической связи в 3 4 раза меньше энергии ковалентной связи.
 Мерой энергии связи – является величина энергии атомизации металла • Энергия атомизации ( Еатом. ) – это та энергия, которую необходимо затратить для распада 1 моля вещества на свободные атомы: Ме (тв. ) Ме(г).
Мерой энергии связи – является величина энергии атомизации металла • Энергия атомизации ( Еатом. ) – это та энергия, которую необходимо затратить для распада 1 моля вещества на свободные атомы: Ме (тв. ) Ме(г).
 Температура плавления – мера прочности связи в кристаллической решетке металла Металл T пл , о С E атомизации , к. Дж/моль Hg -61, 2 61, 1 W
Температура плавления – мера прочности связи в кристаллической решетке металла Металл T пл , о С E атомизации , к. Дж/моль Hg -61, 2 61, 1 W
 Металлы – понятие химическое и физическое одновременно. • В химическом аспекте металл это донор электронов (восстановитель) : e. ZMe. Me zo
Металлы – понятие химическое и физическое одновременно. • В химическом аспекте металл это донор электронов (восстановитель) : e. ZMe. Me zo
 а) высокая тепло-электропроводность; б) пластичность; в) металлический блеск (связанный с высокой отражательной способностью и непрозрачностью). В физическом аспекте – металлы это вещества, обладающие рядом специфических свойств :
а) высокая тепло-электропроводность; б) пластичность; в) металлический блеск (связанный с высокой отражательной способностью и непрозрачностью). В физическом аспекте – металлы это вещества, обладающие рядом специфических свойств :
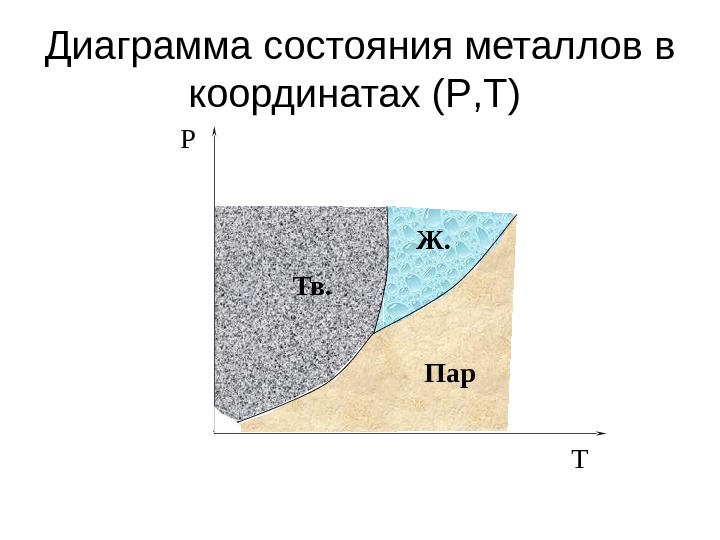
 Диаграмма состояния металлов в координатах ( P , T ) TP Тв. Пар. Ж.
Диаграмма состояния металлов в координатах ( P , T ) TP Тв. Пар. Ж.
 Физические характеристики некоторых металлов : Металл Удельное электросопротивление, Ом·см -1 Коэффициент теплопроводности, к. Дж/(см· c · K ) Cu 1, 61 · 10 -6 3, 9 Al 2, 66 · 10 -6 2, 3 Fe 9, 71 · 10 -6 0, 73 Pb 20, 6 · 10 -6 0, 035 SS
Физические характеристики некоторых металлов : Металл Удельное электросопротивление, Ом·см -1 Коэффициент теплопроводности, к. Дж/(см· c · K ) Cu 1, 61 · 10 -6 3, 9 Al 2, 66 · 10 -6 2, 3 Fe 9, 71 · 10 -6 0, 73 Pb 20, 6 · 10 -6 0, 035 SS
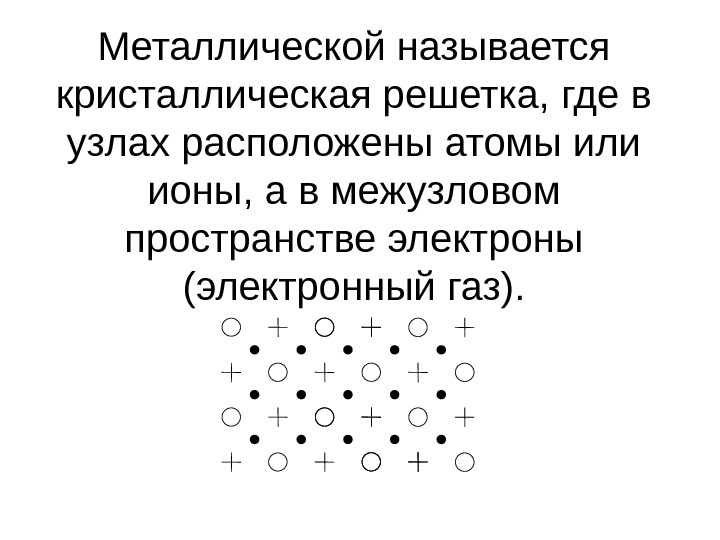
 Металлической называется кристаллическая решетка, где в узлах расположены атомы или ионы, а в межузловом пространстве электроны (электронный газ).
Металлической называется кристаллическая решетка, где в узлах расположены атомы или ионы, а в межузловом пространстве электроны (электронный газ).
 О свободе электронов: • электроны выбиваются с поверхности металла: а) при облучении металлов ультрафиолетом – фотоэффект Столетова; б) при нагревании – термоэлектронная эмиссия; в) при сообщении металлу высокого электрического потенциала (напряжения) – автоэлектронная эмиссия.
О свободе электронов: • электроны выбиваются с поверхности металла: а) при облучении металлов ультрафиолетом – фотоэффект Столетова; б) при нагревании – термоэлектронная эмиссия; в) при сообщении металлу высокого электрического потенциала (напряжения) – автоэлектронная эмиссия.
 Характерные физические характеристики Металл Энергия отрыва электрона, э. В Na 2, 28 Mg 3, 67 K 2, 25 Cu 4, 20 Al 4, 20 Ni 5,
Характерные физические характеристики Металл Энергия отрыва электрона, э. В Na 2, 28 Mg 3, 67 K 2, 25 Cu 4, 20 Al 4, 20 Ni 5,
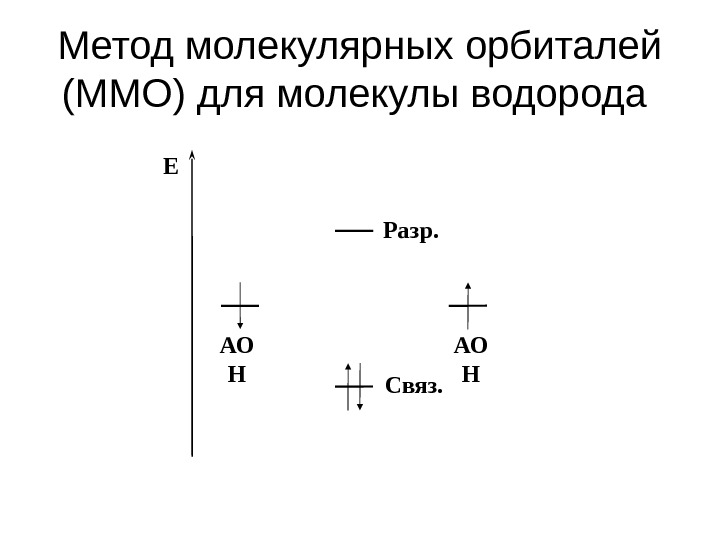
 Метод молекулярных орбиталей (ММО) для молекулы водорода E Разр. Связ. АО H
Метод молекулярных орбиталей (ММО) для молекулы водорода E Разр. Связ. АО H
 При взаимодействии n – атомов зона разрешенных состояний расширяется, уменьшается разность между дискретными уровнями. E 1 2 4 Зона разрешенных состояний 8 n
При взаимодействии n – атомов зона разрешенных состояний расширяется, уменьшается разность между дискретными уровнями. E 1 2 4 Зона разрешенных состояний 8 n
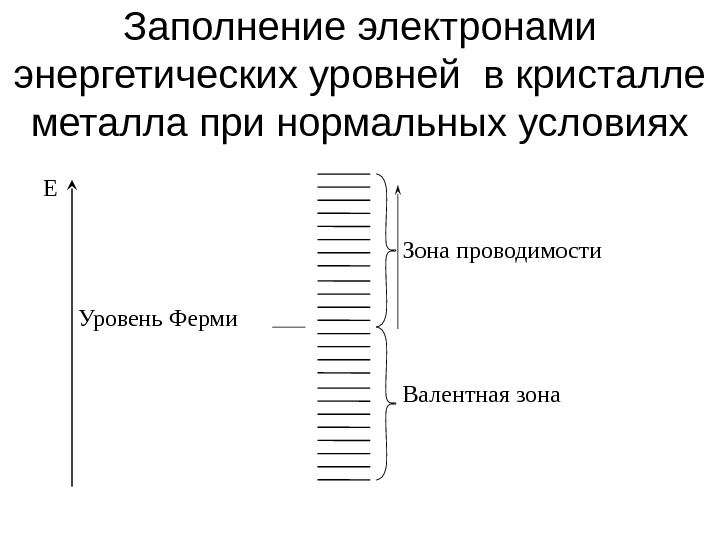
 Заполнение электронами энергетических уровней в кристалле металла при нормальных условиях Зона проводимости Валентная зона. Уровень Ферми. Е
Заполнение электронами энергетических уровней в кристалле металла при нормальных условиях Зона проводимости Валентная зона. Уровень Ферми. Е
 Две схемы трактовки структуры металла Схема 1 Связ. орб. Разр. орб. Схема
Две схемы трактовки структуры металла Схема 1 Связ. орб. Разр. орб. Схема
 Электронная проводимость Кристаллов простых веществ ρ, Ом·см Проводники (металлы) 10 -6 — 10 -4 Полупроводники ( Se, J 2 ) 10 -3 — 10 10 Изоляторы (диэлектрики) более 10 10 Ионные проводники ( Na. Cl электролит) 10 2 —
Электронная проводимость Кристаллов простых веществ ρ, Ом·см Проводники (металлы) 10 -6 — 10 -4 Полупроводники ( Se, J 2 ) 10 -3 — 10 10 Изоляторы (диэлектрики) более 10 10 Ионные проводники ( Na. Cl электролит) 10 2 —
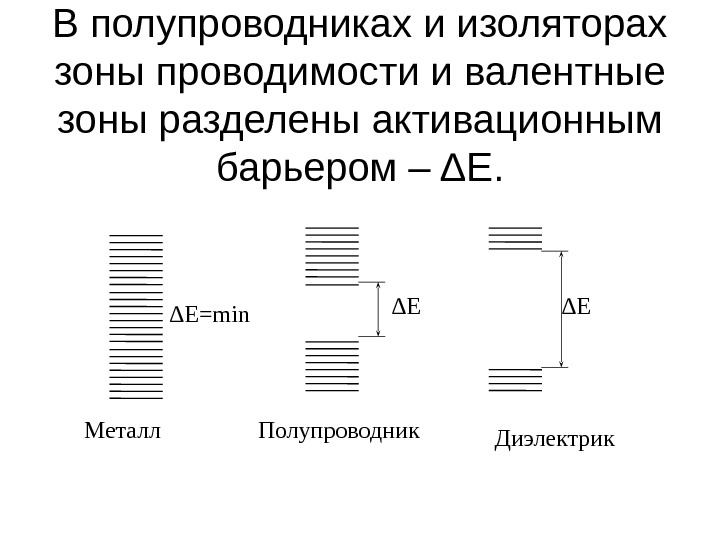
 В полупроводниках и изоляторах зоны проводимости и валентные зоны разделены активационным барьером – Δ E. ΔE ДиэлектрикΔE Полупроводник. Металл ΔE = min
В полупроводниках и изоляторах зоны проводимости и валентные зоны разделены активационным барьером – Δ E. ΔE ДиэлектрикΔE Полупроводник. Металл ΔE = min
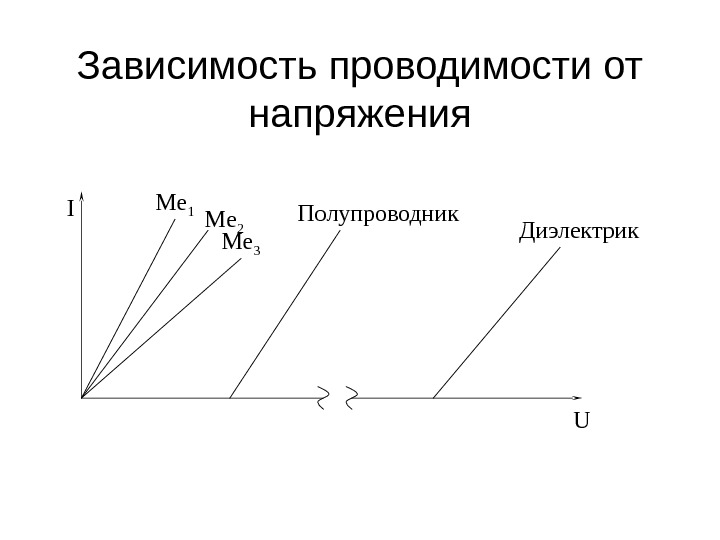
 Зависимость проводимости от напряжения I Me 2 UMe 1 Me 3 Полупроводник Диэлектрик
Зависимость проводимости от напряжения I Me 2 UMe 1 Me 3 Полупроводник Диэлектрик
 Получение металлов из руд. Различают : • самородные металлы ( Au , Ag , Hg , Cu , Pt ); • металлы в связанном состоянии (основная масса: оксиды, соли и т. д. ). Самородные металлы получают механической обработкой руды (промывка золота с помощью драг — двух ярусный комбайн).
Получение металлов из руд. Различают : • самородные металлы ( Au , Ag , Hg , Cu , Pt ); • металлы в связанном состоянии (основная масса: оксиды, соли и т. д. ). Самородные металлы получают механической обработкой руды (промывка золота с помощью драг — двух ярусный комбайн).
 Остальные металлы получают химической переработкой руд следующими методами: • Пирометаллургия – получение металлов при высокой температуре с помощью восстановителя (кокс – чугун, сталь). • Гидрометаллургия – обработка руды водными растворами реагентов и последующим извлечением металлов из растворов. • Электрометаллургия – электролиз растворов и расплавов.
Остальные металлы получают химической переработкой руд следующими методами: • Пирометаллургия – получение металлов при высокой температуре с помощью восстановителя (кокс – чугун, сталь). • Гидрометаллургия – обработка руды водными растворами реагентов и последующим извлечением металлов из растворов. • Электрометаллургия – электролиз растворов и расплавов.
 Пирометаллургический способ: В начале металл в руде переводят в оксиды (обжиг): 2 Zn. S 3 O 2 t 2 Zn. O 2 SO 2 , 2 Mo. S 2 7 O 2 t 2 Mo. O 3 4 SO 2 , затем восстанавливают Zn. O CO Zn CO 2 , Mo. O 3 3 H 2 Mo 3 H 2 O. В качестве восстановителей используют активные металлы: магниотермия: Ti. Cl 4 2 Mg t Ti 2 Mg. Cl 2 ; натриотермия: Ti. Cl 4 4 Na t Ti 4 Na. Cl ; алюмотермия : Fe 2 O 3 2 Al 2 Fe Al 2 O 3.
Пирометаллургический способ: В начале металл в руде переводят в оксиды (обжиг): 2 Zn. S 3 O 2 t 2 Zn. O 2 SO 2 , 2 Mo. S 2 7 O 2 t 2 Mo. O 3 4 SO 2 , затем восстанавливают Zn. O CO Zn CO 2 , Mo. O 3 3 H 2 Mo 3 H 2 O. В качестве восстановителей используют активные металлы: магниотермия: Ti. Cl 4 2 Mg t Ti 2 Mg. Cl 2 ; натриотермия: Ti. Cl 4 4 Na t Ti 4 Na. Cl ; алюмотермия : Fe 2 O 3 2 Al 2 Fe Al 2 O 3.
 Гидрометаллургический способ включает две стадии: металл, входящий в руду, переводят в растворимую соль. Затем извлекают металл химическим или электрохимическим путем. Например: Cu. O H 2 SO 4( разб. ) Cu. SO 4 H 2 O, Cu. SO 4 Fe Cu Fe. SO 4. Из низко-концентрированных руд серебро, платину, золото извлекают с помощью комплексометрического метода. Для этого руду заливают раствором цианида калия или гидрооксида аммония. При этом металл из руды переходит в раствор в виде комплексного соединения: OHSONHAg. OHNHSOAg 24234424 Далее идет восстановление соли до металла.
Гидрометаллургический способ включает две стадии: металл, входящий в руду, переводят в растворимую соль. Затем извлекают металл химическим или электрохимическим путем. Например: Cu. O H 2 SO 4( разб. ) Cu. SO 4 H 2 O, Cu. SO 4 Fe Cu Fe. SO 4. Из низко-концентрированных руд серебро, платину, золото извлекают с помощью комплексометрического метода. Для этого руду заливают раствором цианида калия или гидрооксида аммония. При этом металл из руды переходит в раствор в виде комплексного соединения: OHSONHAg. OHNHSOAg 24234424 Далее идет восстановление соли до металла.
 Применение металлов. • Металлы применяют как конструкционные материалы и в виде комбинированных материалов (железобетон, металлокерамика, металлопластика и др. )
Применение металлов. • Металлы применяют как конструкционные материалы и в виде комбинированных материалов (железобетон, металлокерамика, металлопластика и др. )
 Влияние чистоты металла на применение • металлы высокой чистоты (для каждого металла своя степень чистоты) используются в полупроводниковой технике ( Ge ), в атомной энергетике ( Sr ), в космической технике ( Ti ). • металлы средней чистоты в технике • сплавы – применение этих материалов весьма разнообразно.
Влияние чистоты металла на применение • металлы высокой чистоты (для каждого металла своя степень чистоты) используются в полупроводниковой технике ( Ge ), в атомной энергетике ( Sr ), в космической технике ( Ti ). • металлы средней чистоты в технике • сплавы – применение этих материалов весьма разнообразно.
 Сплавы. Выделяют сплавы трех модификаций: • сплав – механическая смесь кристаллитов (простая эвтектика); • твердые растворы; • сплавы с интерметаллическим соединением.
Сплавы. Выделяют сплавы трех модификаций: • сплав – механическая смесь кристаллитов (простая эвтектика); • твердые растворы; • сплавы с интерметаллическим соединением.
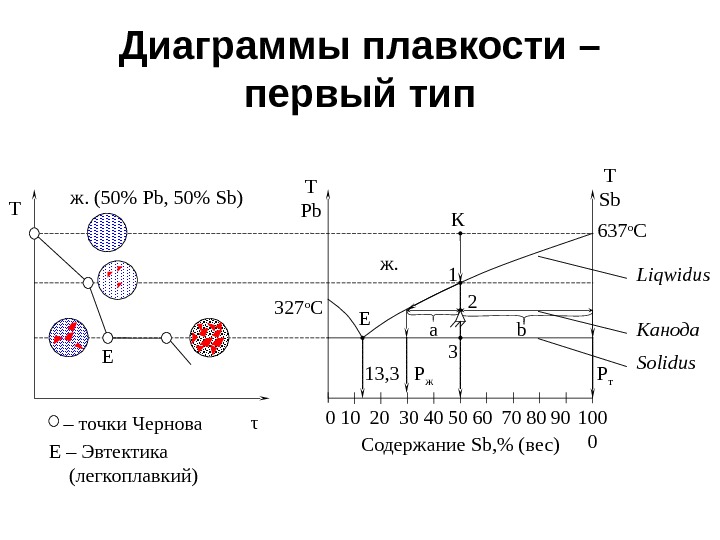
 Диаграммы плавкости – первый тип 2010 30 40 60 70 80 90 100 0500 a bж. T Pb T Sb К 637 о С 327 о С 1 2 3 E P ж P т Содержание Sb, % ( вес)13, 3 Liqwidus Solidus. Канода τT Eж. (50% Pb, 50% Sb) E – Эвтектика ( легкоплавкий)– точки Чернова
Диаграммы плавкости – первый тип 2010 30 40 60 70 80 90 100 0500 a bж. T Pb T Sb К 637 о С 327 о С 1 2 3 E P ж P т Содержание Sb, % ( вес)13, 3 Liqwidus Solidus. Канода τT Eж. (50% Pb, 50% Sb) E – Эвтектика ( легкоплавкий)– точки Чернова
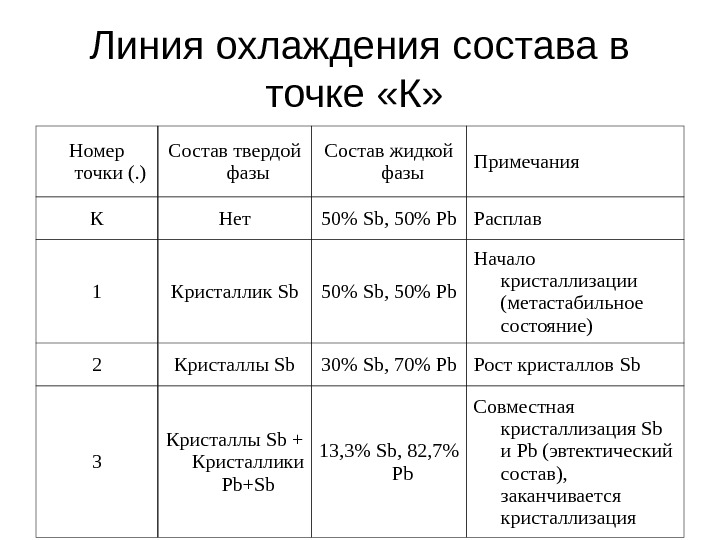
 Линия охлаждения состава в точке «К» Номер точки (. ) Состав твердой фазы Состав жидкой фазы Примечания К Нет 50% Sb , 50% Pb Расплав 1 Кристаллик Sb 50% Sb, 50% Pb Начало кристаллизации (метастабильное состояние) 2 Кристаллы Sb 3 0% Sb, 70% Pb Рост кристаллов Sb 3 Кристаллы Sb + Кристаллики Pb + Sb 13, 3 % Sb, 82, 7% Pb Совместная кристаллизация Sb и Pb (эвтектический состав), заканчивается кристаллизация
Линия охлаждения состава в точке «К» Номер точки (. ) Состав твердой фазы Состав жидкой фазы Примечания К Нет 50% Sb , 50% Pb Расплав 1 Кристаллик Sb 50% Sb, 50% Pb Начало кристаллизации (метастабильное состояние) 2 Кристаллы Sb 3 0% Sb, 70% Pb Рост кристаллов Sb 3 Кристаллы Sb + Кристаллики Pb + Sb 13, 3 % Sb, 82, 7% Pb Совместная кристаллизация Sb и Pb (эвтектический состав), заканчивается кристаллизация
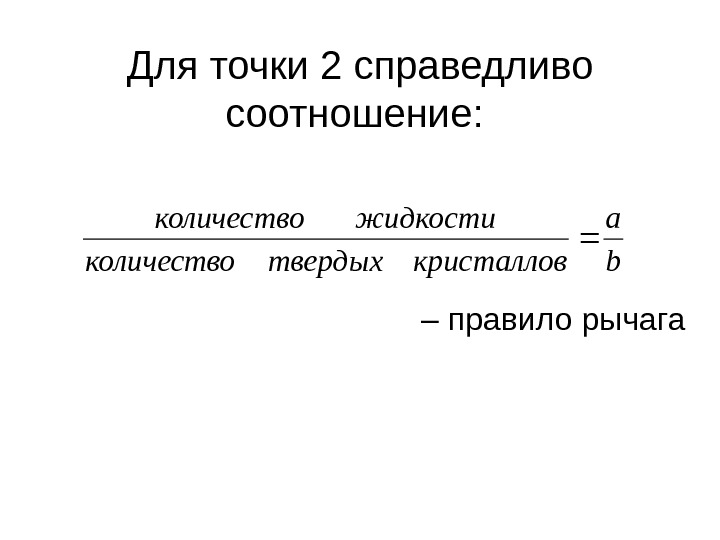
 Для точки 2 справедливо соотношение: – правило рычага b a кристалловтвердыхколичество жидкостиколичество
Для точки 2 справедливо соотношение: – правило рычага b a кристалловтвердыхколичество жидкостиколичество
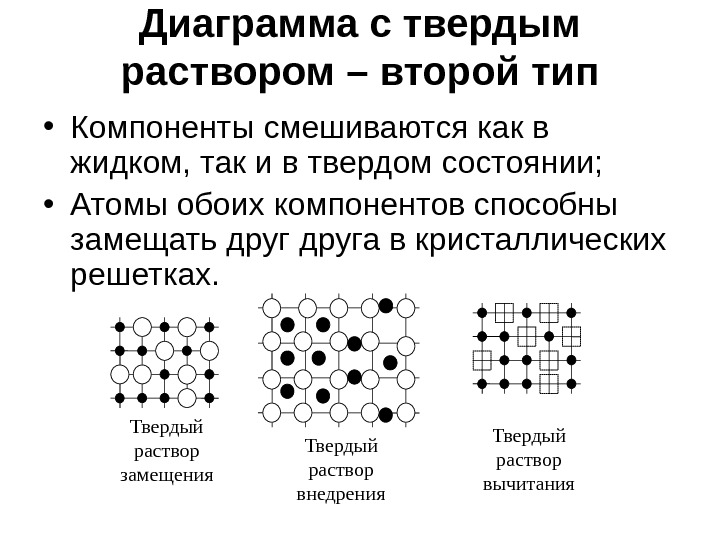
 Диаграмма с твердым раствором – второй тип • Компоненты смешиваются как в жидком, так и в твердом состоянии; • Атомы обоих компонентов способны замещать друга в кристаллических решетках. Твердый раствор замещения Твердый раствор внедрения Твердый раствор вычитания
Диаграмма с твердым раствором – второй тип • Компоненты смешиваются как в жидком, так и в твердом состоянии; • Атомы обоих компонентов способны замещать друга в кристаллических решетках. Твердый раствор замещения Твердый раствор внедрения Твердый раствор вычитания
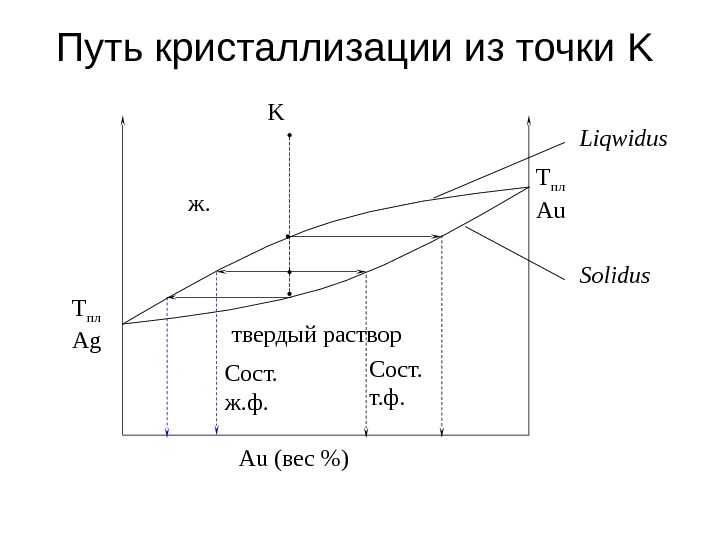
 Путь кристаллизации из точки K Liqwidus Solidus Сост. ж. ф. Сост. т. ф. T пл Au T пл Ag K ж. Au ( вес %)твердый раствор
Путь кристаллизации из точки K Liqwidus Solidus Сост. ж. ф. Сост. т. ф. T пл Au T пл Ag K ж. Au ( вес %)твердый раствор
 Условие образования твердых растворов: • компоненты должны иметь одинаковые по типу кристаллические решетки; • различие в атомных размерах компонентов должно быть в пределах (8 -15%); • компоненты должны обладать близким строением валентной оболочки.
Условие образования твердых растворов: • компоненты должны иметь одинаковые по типу кристаллические решетки; • различие в атомных размерах компонентов должно быть в пределах (8 -15%); • компоненты должны обладать близким строением валентной оболочки.
 Диаграмма с образованием интерметаллического соединения – третий тип Liqwidus Solidus. T пл Sb T пл Mg K ж. Sb 2 Mg
Диаграмма с образованием интерметаллического соединения – третий тип Liqwidus Solidus. T пл Sb T пл Mg K ж. Sb 2 Mg
 Характерные особенности интерметаллического соединения • атомы в решетке располагаются, упорядочено, т. е. атомы одного элемента закономерно и в определенном количестве расположены среди атомов другого элемента; • в соединениях всегда сохраняется кратное весовое отношение элементов и это позволяет выразить их состав простой формулой, например, Sb 2 Mg 3 ; • резко отличаются свойства от свойств составляющих металлов (температура плавления).
Характерные особенности интерметаллического соединения • атомы в решетке располагаются, упорядочено, т. е. атомы одного элемента закономерно и в определенном количестве расположены среди атомов другого элемента; • в соединениях всегда сохраняется кратное весовое отношение элементов и это позволяет выразить их состав простой формулой, например, Sb 2 Mg 3 ; • резко отличаются свойства от свойств составляющих металлов (температура плавления).
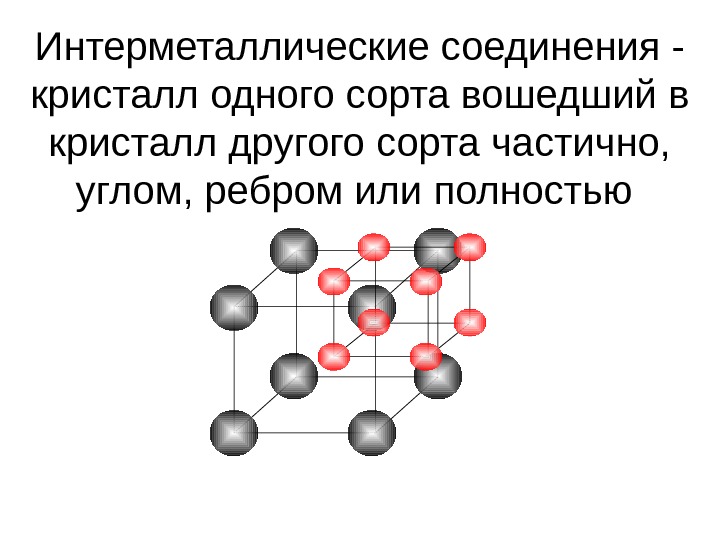
 Интерметаллические соединения — кристалл одного сорта вошедший в кристалл другого сорта частично, углом, ребром или полностью
Интерметаллические соединения — кристалл одного сорта вошедший в кристалл другого сорта частично, углом, ребром или полностью
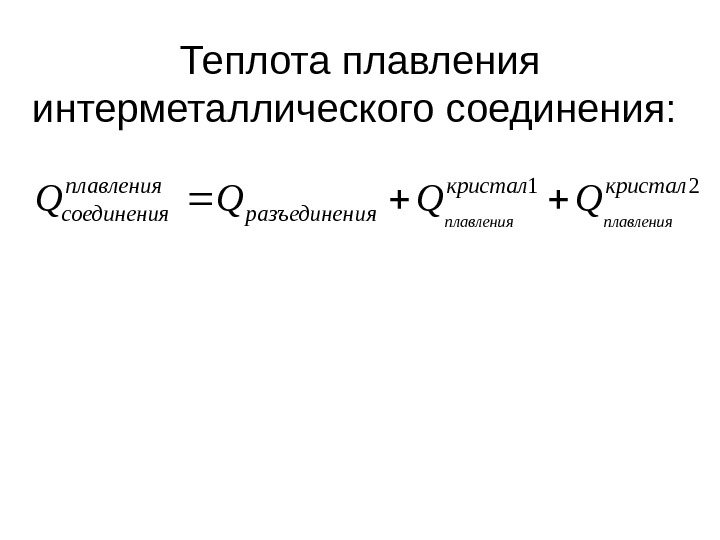
 Теплота плавления интерметаллического соединения: 21 кристал ияразъединен плавления соединенияплавления QQQQ
Теплота плавления интерметаллического соединения: 21 кристал ияразъединен плавления соединенияплавления QQQQ
 Химические свойства металлов s -, p -, d — элементов • Для получения металлов использовался ряд активности металлов Бекетова: 322222322 , , , Au. Ag. Cu. HPb. Sn. Fe. Zn. Al. Mg. Na. Ca. K Легкость разряда катиона в водном растворе возрастает
Химические свойства металлов s -, p -, d — элементов • Для получения металлов использовался ряд активности металлов Бекетова: 322222322 , , , Au. Ag. Cu. HPb. Sn. Fe. Zn. Al. Mg. Na. Ca. K Легкость разряда катиона в водном растворе возрастает
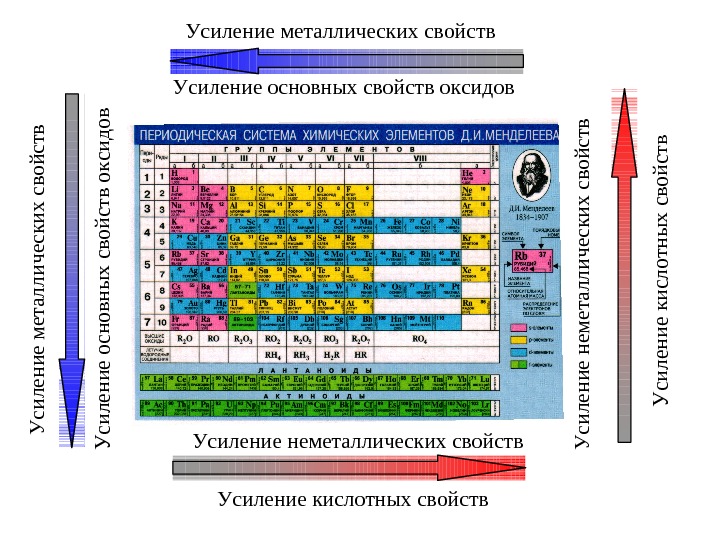
 Усиление кислотных свойств Усиление неметаллических свойств Усиление основных свойств оксидов Усиление металлических свойств У си л ен и е к и сл о тн ы х св о й ств У си л ен и е н ем етал л и ч еск и х св о й ств У си л ен и е о сн о в н ы х св о й ств о к си д о в У си л ен и е м етал л и ч еск и х св о й ств
Усиление кислотных свойств Усиление неметаллических свойств Усиление основных свойств оксидов Усиление металлических свойств У си л ен и е к и сл о тн ы х св о й ств У си л ен и е н ем етал л и ч еск и х св о й ств У си л ен и е о сн о в н ы х св о й ств о к си д о в У си л ен и е м етал л и ч еск и х св о й ств

