
МЕТАЛЛЫ ПОБОЧНЫХ ПОДГРУПП Cu Ag Zn Hg Cr Mn

Халькопирит Cu. S Медь Характерны степени окисления +1, +2, +3. При реакции с кислородом медь образует два оксида, аналогично идёт реакция с серой 2 Cu + O 2 = 2 Cu. O (5000 C) 42 Cu + O 2 = 2 Cu 2 O ( более 10000 C) Со всеми галогенами образуются соли с валентностью II, а с иодом с валентностью I. Cu + Cl 2 = Cu. Cl 2 2 Cu + I 2 = Cu 2 I 2 Растворяется только в азотной и концентрированной серной кислотах. Оксид меди (I) твёрдое вещество оранжевого цвета. Гидроксид меди(I) неустойчив. 2 Cu. OH = Cu 2 O + H 2 O У них преобладают основные свойства. Оксид меди (II) твёрдое вещество чёрного цвета. Гидроксид меди(II) – осадок синего цвета, разлагается при нагревании. Проявляют основные свойства и окислительные свойства. Оксид меди (I) Оксид меди (II) Гидроксид меди(II) Сульфат меди(II) медный купорос

Серебро Самый электро- и теплопроводный металл. Может иметь степени окисления +1, +2, +3, но реально встречаются соединения только +1. Не реагирует с кислородом, водой и кислотами, кроме азотной и концентрированной серной кислот. Вступает в реакцию с серой и с сероводородом на воздухе. 2 Ag + S = Ag 2 S 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O Оксид серебра(I) тёмно-коричневый порошок, обладает основными свойствами. Большинство солей серебра нерастворимы, многие разлагаются. Разложение галогенидов серебра лежит в основе фотографии. серебро оксид серебра(I) галогениды серебра

Цинк Только степень окисления +2. Встречается в природе в основном в виде цинковой обманки Zn. S. Руду обжигают и восстанавливают углём. Довольно активный металл, на воздухе покрывается оксидной плёнкой, реагирует с кислородом, серой, галогенами, фосфором, водородом. Хорошо растворим в кислотах и щелочах, реагирует с солями. Zn + 2 KOH + 2 H 2 O = K 2[Zn(OH)4] + H 2 Оксид цинка – порошок белого цвета, гидроксид цинка – студенистый осадок. Проявляют амфотерные свойства. оксид гидроксид

Ртуть Степени окисления +1 и +2. Встречается в самородном виде и в виде киновари Hg. S. Получают обжигом Hg. S + O 2 = Hg + SO 2 Единственный жидкий металл, очень ядовит. Со многими металлами образует жидкие сплавы - амальгамы. С кислородом реагирует при нагревании, с серой и хлором при обычных условиях, не реагирует с водой и щелочами, из кислот – только с азотной и концентрированной серной кислотами. Сулема – хлорид ртути(I) – восстанавливается металлической ртутью в каломель – хлорид ртути(II). Hg + Hg. Cl 2 = Hg 2 Cl 2 Оксид ртути(II) твёрдое вещество жёлтого или красного цвета, разлагается при нагревании, проявляет основные свойства. Гидроксид ртути(II) неустойчив. Многие соединения меди, ртути, серебра и цинка реагируют с аммиаком с образованием комплексных соединений. Оксид ртути(II)

Хром Наиболее известны степени окисления +2, +3, +6. Основной минерал хромистый железняк - Fe. O Cr 2 O 3. Получают восстановлением углём или алюминотермией. Очень твёрдый металл, покрыт оксидной плёнкой, которая сильно затрудняет реакции. С неметаллами и щелочами даёт соединения +3, а с кислотами +2. Оксид хрома(II) твёрдое ярко-красное вещество, гидроксид хрома(II) твёрдое вещество жёлтого цвета, оба проявляют основные свойства. Соединения хрома(II) на воздухе легко превращаются в соединения хрома(III). Оксид хрома(III) твёрдое тёмно-зелёное вещество, гидроксид хрома(III) – осадок серозелёного цвета. Оба нерастворимы в воде и проявляют амфотерные свойства. Но если гидроксид хрома(III) легко вступает в реакции с кислотами и щелочами, то оксид хрома(III) реагирует только при сплавлении или с концентрированными растворами при нагревании. хромистый железняк Оксид хрома(III)

Оксид хрома(VI) – тёмно-красное кристаллическое вещество, хорошо растворимое в воде. Типичный кислотный оксид, ему соответствуют две кислоты. Cr 2 O 3 + H 2 O = H 2 Cr. O 4 хромовая соли – хроматы, устойчивы в щелочной среде 2 Cr 2 O 3 + H 2 O = H 2 Cr 2 O 7 двухромовая соли - дихроматы, устойчивы в кислой среде. Все соединения хрома(VI) – сильные окислители, переходят в основном в соединения хрома(III). Оксид хрома(VI)

Марганец Степени окисления +2, +4, +6, +7. В реакциях с неметаллами и кислотами проявляет степень окисления +2. Оксид марганца(II) –порошок серо-зелёного цвета, нерастворим, проявляет основные свойства. Гидроксид марганца(II) – белый осадок, имеет основные свойства. Соли окрашены в розовый цвет. Соединения марганца(II) под действием окислителей переходят в соединения +4 и +7. Оксид марганца(IV) –тёмно-коричневый порошок, наиболее устойчив из всех соединений марганца, проявляет амфотерные свойства, сильный окислитель. Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O Оксид марганца (VI) Хлорид марганца (II)
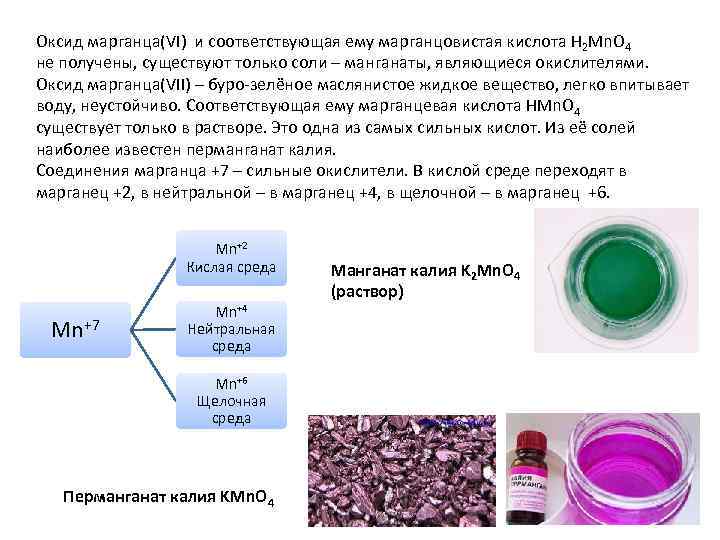
Оксид марганца(VI) и соответствующая ему марганцовистая кислота H 2 Mn. O 4 не получены, существуют только соли – манганаты, являющиеся окислителями. Оксид марганца(VII) – буро-зелёное маслянистое жидкое вещество, легко впитывает воду, неустойчиво. Соответствующая ему марганцевая кислота HMn. O 4 существует только в растворе. Это одна из самых сильных кислот. Из её солей наиболее известен перманганат калия. Соединения марганца +7 – сильные окислители. В кислой среде переходят в марганец +2, в нейтральной – в марганец +4, в щелочной – в марганец +6. Mn+2 Кислая среда Mn+7 Mn+4 Нейтральная среда Mn+6 Щелочная среда Перманганат калия KMn. O 4 Манганат калия K 2 Mn. O 4 (раствор)