Металлы платиновой подгруппы.ppt
- Количество слайдов: 21
 Металлы платиновой подгруппы. .
Металлы платиновой подгруппы. .
 • Металлы платиновой группы (МПГ, Платиновая группа, Платиновые металлы, Платиноиды) — коллективное обозначение шести переходных металлических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. В связи с этим, имеют схожую историю открытия и изучения, добычу, производство и применение. Металлы платиновой группы являются благородными и драгоценными металлами. В природе, чаще всего встречаются, в полиметаллических (медно-никелевых) рудах, а также в месторождениях золота и платины. Иногда, металлы платиновой группы подразделяют на две триады: рутений, родий и палладий — лёгкие платиновые металлы, а платина, иридий и осмий — тяжёлые платиновые металлы.
• Металлы платиновой группы (МПГ, Платиновая группа, Платиновые металлы, Платиноиды) — коллективное обозначение шести переходных металлических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. В связи с этим, имеют схожую историю открытия и изучения, добычу, производство и применение. Металлы платиновой группы являются благородными и драгоценными металлами. В природе, чаще всего встречаются, в полиметаллических (медно-никелевых) рудах, а также в месторождениях золота и платины. Иногда, металлы платиновой группы подразделяют на две триады: рутений, родий и палладий — лёгкие платиновые металлы, а платина, иридий и осмий — тяжёлые платиновые металлы.
 История открытия • В Старом Свете платина не была известна, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. • В 1803 году английский учёный Уильям Хайд Волластон открыл палладий и родий. • В 1804 году английский учёный С. Теннант открыл иридий и осмий. • В 1808 году русский учёный А. Снядицкий, исследуя платиновую руду, привезённую из Южной Америки, извлёк новый химический элемент, названный им вестием. В 1844 году профессор Казанского университета К. К. Клаус всесторонне изучил этот элемент и назвал его в честь России рутением.
История открытия • В Старом Свете платина не была известна, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. • В 1803 году английский учёный Уильям Хайд Волластон открыл палладий и родий. • В 1804 году английский учёный С. Теннант открыл иридий и осмий. • В 1808 году русский учёный А. Снядицкий, исследуя платиновую руду, привезённую из Южной Америки, извлёк новый химический элемент, названный им вестием. В 1844 году профессор Казанского университета К. К. Клаус всесторонне изучил этот элемент и назвал его в честь России рутением.
 Нахождение в природе • • Платина и металлы её группы встречаются в природе в весьма рассеянном состоянии. Геохимически все эти элементы связаны с ультраосновными и основными породами. Известно около полусотни минералов платиновой группы. Платина, иридий, палладий в горных породах и месторождениях развиты как в самородном виде, так и в виде твёрдых растворов и интерметаллических соединений с Fe, Ni, Cu, Sn, реже Au, Os, Pb, Zn, Ag. Наиболее распространёнными являются поликсен (Pt, Fe) где Pt 80 — 88 %, Fe 9 — 11 %, ферроплатина (Pt, Fe) (Fe 16 — 19 %), палладистая платина (Pt, Pd) (Pd 7 — 40 %), станнопалладинит Pd 3 Sn 2 Cu (Pd 40 — 45, Pt 15 — 20, Sn 28 — 33 %), гиверсит Pt. Sb 2 (Pt 45, Sb 51, 5 %), звягинцевит (Pd, Pt)3(Pb, Sn). Осмий, рутений и родий образуют твёрдые растворы. К ним относятся такие минералы как невьянскит (Ir, Os) (Ir 46, 8 — 77, 2 % Os 21 — 49, 3 %), сысертскит (Os, Ir) (Os 67, 9 %, Ir 17 %, Ru 8, 9 %, Rh 4, 5 %), родиевый невьянскит (Ir, Os, Rh) (Ir 69, 9 — 70, 4 %, Os 17, 2 %, Rh 11, 3 %). Кроме того, в природе известны арсениды, сульфоарсениды и сульфиды платины, рутения и палладия, а именно сперрилит Pt. As 2 (Pt 56, 2 %), куперит Pt. S (Pt 79, 2 — 85, 9 %), высоцкит (Pd, Ni)5 S (Pd 59, 5 %, Ni 14, 2 %, Pt 4, 8 %), холлингвортит (Rh, Pt)As. S (Rh 25 %).
Нахождение в природе • • Платина и металлы её группы встречаются в природе в весьма рассеянном состоянии. Геохимически все эти элементы связаны с ультраосновными и основными породами. Известно около полусотни минералов платиновой группы. Платина, иридий, палладий в горных породах и месторождениях развиты как в самородном виде, так и в виде твёрдых растворов и интерметаллических соединений с Fe, Ni, Cu, Sn, реже Au, Os, Pb, Zn, Ag. Наиболее распространёнными являются поликсен (Pt, Fe) где Pt 80 — 88 %, Fe 9 — 11 %, ферроплатина (Pt, Fe) (Fe 16 — 19 %), палладистая платина (Pt, Pd) (Pd 7 — 40 %), станнопалладинит Pd 3 Sn 2 Cu (Pd 40 — 45, Pt 15 — 20, Sn 28 — 33 %), гиверсит Pt. Sb 2 (Pt 45, Sb 51, 5 %), звягинцевит (Pd, Pt)3(Pb, Sn). Осмий, рутений и родий образуют твёрдые растворы. К ним относятся такие минералы как невьянскит (Ir, Os) (Ir 46, 8 — 77, 2 % Os 21 — 49, 3 %), сысертскит (Os, Ir) (Os 67, 9 %, Ir 17 %, Ru 8, 9 %, Rh 4, 5 %), родиевый невьянскит (Ir, Os, Rh) (Ir 69, 9 — 70, 4 %, Os 17, 2 %, Rh 11, 3 %). Кроме того, в природе известны арсениды, сульфоарсениды и сульфиды платины, рутения и палладия, а именно сперрилит Pt. As 2 (Pt 56, 2 %), куперит Pt. S (Pt 79, 2 — 85, 9 %), высоцкит (Pd, Ni)5 S (Pd 59, 5 %, Ni 14, 2 %, Pt 4, 8 %), холлингвортит (Rh, Pt)As. S (Rh 25 %).
 Генетические группы и промышленные типы месторождений • 1. Магматические • а. хромит-платиновые месторождения (уральский тип) • б. месторождения комплексных платина-хромитмедно-никелевых руд (бушвельдский тип) • в. ликвационные медь-никель-платиновые месторождения (норильский тип) • г. благороднометальные медно-титаномагнетитовые месторождения в интрузиях габбро (волковский тип) • 2. Россыпи
Генетические группы и промышленные типы месторождений • 1. Магматические • а. хромит-платиновые месторождения (уральский тип) • б. месторождения комплексных платина-хромитмедно-никелевых руд (бушвельдский тип) • в. ликвационные медь-никель-платиновые месторождения (норильский тип) • г. благороднометальные медно-титаномагнетитовые месторождения в интрузиях габбро (волковский тип) • 2. Россыпи
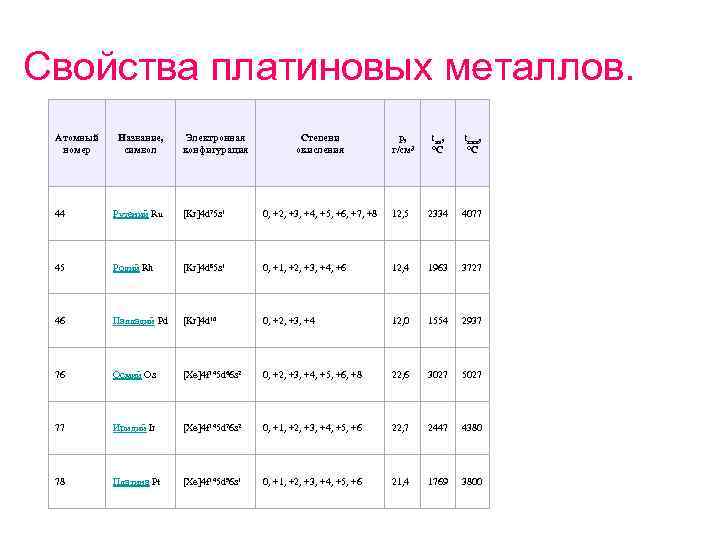 Свойства платиновых металлов. Атомный номер Название, символ Электронная конфигурация Степени окисления p, г/см³ tпл, °C tкип, °C 44 Рутений Ru [Kr]4 d 75 s 1 0, +2, +3, +4, +5, +6, +7, +8 12, 5 2334 4077 45 Родий Rh [Kr]4 d 85 s 1 0, +1, +2, +3, +4, +6 12, 4 1963 3727 46 Палладий Pd [Kr]4 d 10 0, +2, +3, +4 12, 0 1554 2937 76 Осмий Os [Xe]4 f 145 d 66 s 2 0, +2, +3, +4, +5, +6, +8 22, 6 3027 5027 77 Иридий Ir [Xe]4 f 145 d 76 s 2 0, +1, +2, +3, +4, +5, +6 22, 7 2447 4380 78 Платина Pt [Xe]4 f 145 d 96 s 1 0, +1, +2, +3, +4, +5, +6 21, 4 1769 3800
Свойства платиновых металлов. Атомный номер Название, символ Электронная конфигурация Степени окисления p, г/см³ tпл, °C tкип, °C 44 Рутений Ru [Kr]4 d 75 s 1 0, +2, +3, +4, +5, +6, +7, +8 12, 5 2334 4077 45 Родий Rh [Kr]4 d 85 s 1 0, +1, +2, +3, +4, +6 12, 4 1963 3727 46 Палладий Pd [Kr]4 d 10 0, +2, +3, +4 12, 0 1554 2937 76 Осмий Os [Xe]4 f 145 d 66 s 2 0, +2, +3, +4, +5, +6, +8 22, 6 3027 5027 77 Иридий Ir [Xe]4 f 145 d 76 s 2 0, +1, +2, +3, +4, +5, +6 22, 7 2447 4380 78 Платина Pt [Xe]4 f 145 d 96 s 1 0, +1, +2, +3, +4, +5, +6 21, 4 1769 3800
 Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью. Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода. Палладий способен растворить до 800 — 900 объёмов водорода, платина — до 100. Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов:
Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью. Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода. Палладий способен растворить до 800 — 900 объёмов водорода, платина — до 100. Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов:
 При окислении металлов кислородом воздуха образуются оксиды различн ого состава: При нагревании все платиновые металлы реагируют с хлором и фтором: В растворах платиновые металлы существуют только в виде комплексных соединений. Соединения платины используют в медицине в качестве препаратов, обладающих противоопухолевой активностью.
При окислении металлов кислородом воздуха образуются оксиды различн ого состава: При нагревании все платиновые металлы реагируют с хлором и фтором: В растворах платиновые металлы существуют только в виде комплексных соединений. Соединения платины используют в медицине в качестве препаратов, обладающих противоопухолевой активностью.
 Производство • Промышленное производство платины первоначально велось в Америке. Лишь в 1819 году платиновые россыпи были впервые обнаружены на Урале близ Екатеринбурга. С тех пор Россия становится ведущим производителем платины, а, с момента открытия, и платиноидов. • В настоящее время, почти 90 % всего объема производства металлов платиновой группы разделено между платиной и палладием, остальные добываются и продаются в небольших количествах. 95 % запасов и 90 % производства МПГ сосредоточены в двух крупных месторождениях — Бушвельдском комплексе, находящемся на территории Южно. Африканской Республики, и в Норильском рудном районе, расположенном в России. В рудах Бушвельда содержание платины втрое выше, чем палладия, в то время как в Норильске наблюдается обратное соотношение. Поэтому, ЮАР является крупнейшим мировым производителем платины, а Россия — палладия.
Производство • Промышленное производство платины первоначально велось в Америке. Лишь в 1819 году платиновые россыпи были впервые обнаружены на Урале близ Екатеринбурга. С тех пор Россия становится ведущим производителем платины, а, с момента открытия, и платиноидов. • В настоящее время, почти 90 % всего объема производства металлов платиновой группы разделено между платиной и палладием, остальные добываются и продаются в небольших количествах. 95 % запасов и 90 % производства МПГ сосредоточены в двух крупных месторождениях — Бушвельдском комплексе, находящемся на территории Южно. Африканской Республики, и в Норильском рудном районе, расположенном в России. В рудах Бушвельда содержание платины втрое выше, чем палладия, в то время как в Норильске наблюдается обратное соотношение. Поэтому, ЮАР является крупнейшим мировым производителем платины, а Россия — палладия.
 Запасы • • • Содержание платиновых металлов в земной коре (кларк) оценивается, как 10− 8 % для платины, 10− 9 % для палладия и 10− 11 % для остальных платиновых металлов. Общие запасы металлов платиновой группы на начало 2009 года оцениваются в 100 млн кг. Причем распределены они, также неравномерно: ЮАР (63, 00 млн кг разведанных запасов при 70, 00 млн кг общих), Россия (6, 20/6, 60), США (0, 90/2, 00), Канада (0, 31/0, 39). В России почти вся добыча металлов платиновой группы сосредоточена в разработке лицензионных участков «Норильским никелем» (15 % мирового производства платины и 55 % производства палладия). На металлы платиновой группы в окрестностях Норильска разрабатываются Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые месторождения (более 99% разведанных и более 94% оцененных российских запасов). Кроме того, крупными являются: сульфидно-медно-никелевое месторождение Фёдорова Тундра (участок Большой Ихтегипахк) в Мурманская области, а также россыпи Кондёр в Хабаровском крае, Левтыринываям в Камчатский крае, реки Лобва и Выйско-Исовское в Свердловской области.
Запасы • • • Содержание платиновых металлов в земной коре (кларк) оценивается, как 10− 8 % для платины, 10− 9 % для палладия и 10− 11 % для остальных платиновых металлов. Общие запасы металлов платиновой группы на начало 2009 года оцениваются в 100 млн кг. Причем распределены они, также неравномерно: ЮАР (63, 00 млн кг разведанных запасов при 70, 00 млн кг общих), Россия (6, 20/6, 60), США (0, 90/2, 00), Канада (0, 31/0, 39). В России почти вся добыча металлов платиновой группы сосредоточена в разработке лицензионных участков «Норильским никелем» (15 % мирового производства платины и 55 % производства палладия). На металлы платиновой группы в окрестностях Норильска разрабатываются Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые месторождения (более 99% разведанных и более 94% оцененных российских запасов). Кроме того, крупными являются: сульфидно-медно-никелевое месторождение Фёдорова Тундра (участок Большой Ихтегипахк) в Мурманская области, а также россыпи Кондёр в Хабаровском крае, Левтыринываям в Камчатский крае, реки Лобва и Выйско-Исовское в Свердловской области.
 Применение • • • Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше чем у золота, то незначительные добавки золота позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Однако, после отмены этого закона в 1778 году, платина постепенно завоёвывала популярность в ювелирной промышленности. В настоящее время практически все металлы платиновой группы тем или иным образом применяются при изготовлении ювелирных украшений. Металлы платиновой группы иногда используют для изготовления монет. Например в России с 1828 по 1845 выпускались платиновые монеты номиналом 3, 6 и 12 рублей. Платина и другие металлы платиновой группы используются частными лицами и компаниями в качестве накоплений.
Применение • • • Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше чем у золота, то незначительные добавки золота позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Однако, после отмены этого закона в 1778 году, платина постепенно завоёвывала популярность в ювелирной промышленности. В настоящее время практически все металлы платиновой группы тем или иным образом применяются при изготовлении ювелирных украшений. Металлы платиновой группы иногда используют для изготовления монет. Например в России с 1828 по 1845 выпускались платиновые монеты номиналом 3, 6 и 12 рублей. Платина и другие металлы платиновой группы используются частными лицами и компаниями в качестве накоплений.
 • • Фьючерсы и опционы на металлы платиновой группы используются спекулянтами. С середины 1970−х годов главной сферой применения платины и палладия стала автомобильная промышленность[4]. В электротехнической промышленности из металлов платиновой группы изготовляют контакты с большой степенью надёжности (стойкость противкоррозии, устойчивость к действию образующейся на контактах кратковременной электрической дуги). В технике слабых токов при малых напряжениях в цепях используются контакты из сплавов золота с платиной, золота с серебром и платиной. Для слаботочной и средненагруженной аппаратуры связи широко применяют сплавы палладия с серебром (от 60 до 5 % палладия). Магнитные сплавы металлов платиновой группы с высокой коэрцитивной силой употребляют при изготовлении малогабаритных электроприборов. Сопротивления (потенциометры) для автоматических приборов и тензометров делают из сплавов металлов платиновой группы (главным образом палладия с серебром, реже с другими металлами). У них малый температурный коэффициент электрического сопротивления, малая термоэлектродвижущая сила в паре с медью, высокое сопротивление износу, высокая температура плавления, они не окисляются. Металлы платиновой группы идут на изготовление деталей, работающих в агрессивных средах — технологические аппараты, реакторы, электрические нагреватели, высокотемпературные печи, аппаратуру для производства оптического стекла и стекловолокна, термопары, эталоны сопротивления и др.
• • Фьючерсы и опционы на металлы платиновой группы используются спекулянтами. С середины 1970−х годов главной сферой применения платины и палладия стала автомобильная промышленность[4]. В электротехнической промышленности из металлов платиновой группы изготовляют контакты с большой степенью надёжности (стойкость противкоррозии, устойчивость к действию образующейся на контактах кратковременной электрической дуги). В технике слабых токов при малых напряжениях в цепях используются контакты из сплавов золота с платиной, золота с серебром и платиной. Для слаботочной и средненагруженной аппаратуры связи широко применяют сплавы палладия с серебром (от 60 до 5 % палладия). Магнитные сплавы металлов платиновой группы с высокой коэрцитивной силой употребляют при изготовлении малогабаритных электроприборов. Сопротивления (потенциометры) для автоматических приборов и тензометров делают из сплавов металлов платиновой группы (главным образом палладия с серебром, реже с другими металлами). У них малый температурный коэффициент электрического сопротивления, малая термоэлектродвижущая сила в паре с медью, высокое сопротивление износу, высокая температура плавления, они не окисляются. Металлы платиновой группы идут на изготовление деталей, работающих в агрессивных средах — технологические аппараты, реакторы, электрические нагреватели, высокотемпературные печи, аппаратуру для производства оптического стекла и стекловолокна, термопары, эталоны сопротивления и др.
 • • • При изготовлении инструментов металлы платиновой группы позволяют получить уникальные свойства по прочности, корозостойкости и долговечности. Металлы платиновой группы используются в чистом виде, как биметалл и в сплавах (см. Платиновые сплавы). Химические реакторы и их части делают целиком или только покрывают фольгой из металлов платиновой группы. Покрытые платиной аппараты применяют при изготовлении чистых химических препаратов и в пищевой промышленности. Когда химической стойкости и тугоплавкости платины или палладия недостаточно, их заменяют сплавами платины с металлами, повышающими эти свойства: иридием (5 -25 %), родием (3 -10 %) и рутением (2 -10 %). Примером использования металлов платиновой группы в этих областях техники является изготовление котлов и чаш для плавки щелочей или работы с соляной, уксусной и бензойной кислотами; автоклавов, дистилляторов, колб, мешалок и др. Сплавы иридия с осмием, а также золота с платиной и палладием используют для изготовления компасных игл, напаек «вечных» перьев. Высокие каталитические свойства некоторых металлов платиновой группы позволяют применять их в качестве катализаторов, например, платину применяют при производстве серной и азотной кислот. В некоторых странах металлы платиновой группы используются в медицине, в том числе и в качестве небольших добавок к лекарственным препаратам.
• • • При изготовлении инструментов металлы платиновой группы позволяют получить уникальные свойства по прочности, корозостойкости и долговечности. Металлы платиновой группы используются в чистом виде, как биметалл и в сплавах (см. Платиновые сплавы). Химические реакторы и их части делают целиком или только покрывают фольгой из металлов платиновой группы. Покрытые платиной аппараты применяют при изготовлении чистых химических препаратов и в пищевой промышленности. Когда химической стойкости и тугоплавкости платины или палладия недостаточно, их заменяют сплавами платины с металлами, повышающими эти свойства: иридием (5 -25 %), родием (3 -10 %) и рутением (2 -10 %). Примером использования металлов платиновой группы в этих областях техники является изготовление котлов и чаш для плавки щелочей или работы с соляной, уксусной и бензойной кислотами; автоклавов, дистилляторов, колб, мешалок и др. Сплавы иридия с осмием, а также золота с платиной и палладием используют для изготовления компасных игл, напаек «вечных» перьев. Высокие каталитические свойства некоторых металлов платиновой группы позволяют применять их в качестве катализаторов, например, платину применяют при производстве серной и азотной кислот. В некоторых странах металлы платиновой группы используются в медицине, в том числе и в качестве небольших добавок к лекарственным препаратам.
 Получение • • Способ извлечения и разделения платиновых металлов существенно зависит от типа исходного сырья. Переработка россыпей сводится к добыче песка и его обогащению гравитационными методами. Переработка медно-никелевых сульфидных руд обычно включает операции мех. и флотац. обогащения, пирометаллургич. переработки концентратов и гидрометаллургич. рафинирования (аффинаж). При переработке медно-никелевых сульфидных руд платиновые металлы концентрируются в разл. полупродуктах произ-ва; большая часть, особенно Pd и Pt, концентрируется в анодных шламах (после электролитич. рафинирования Cu и Ni); из них получают концентраты платиновые металлы, которые направляют на аффинажные заводы. Схемы аффинажа платиновые металлы включают после-доват. операции обработки концентрата хим. реагентами. Напр. , для выделения Pd и Pt концентраты платиновых металлов обрабатывают царской водкой. К фильтрату, содержащему Pt, Pd и Au, добавляют Fe. SO 4 и осаждают Au. Из раствора, содержащего Pd и Pt в виде [Pt. Cl 6]2 - и [Pd. Cl 4]2 -, добавлением NH 4 Cl осаждают (NH 4)2[Pt. Cl 6], который прокаливают до платиновой губки, затем повторяют растворение в царской водке, осаждение и прокаливание. Р-р, содержащий Pd, обрабатывают водным NH 3 и соляной кислотой, при этом осаждается Pd(NH 3)2 Cl 2; переосаждение повторяют до получения чистого вещества, которое прокаливают до палладиевой губки. Из оставшегося после обработки царской водкой концентрата, используя последоват. операции сплавления, растворения и осаждения, получают чистые (NH 4)3[Rh. Cl 6], (NH 4)3[Ru. Cl 6], (NH 4)2[Ir. Cl 6], которые прокаливают в атмосфере H 2 до Rh, Ru, Ir. В ряде схем аффинажа используют экстракц. методы. Высокочистые платиновые металлы получают методом зонной плавки, вытягиванием монокристаллов из расплава.
Получение • • Способ извлечения и разделения платиновых металлов существенно зависит от типа исходного сырья. Переработка россыпей сводится к добыче песка и его обогащению гравитационными методами. Переработка медно-никелевых сульфидных руд обычно включает операции мех. и флотац. обогащения, пирометаллургич. переработки концентратов и гидрометаллургич. рафинирования (аффинаж). При переработке медно-никелевых сульфидных руд платиновые металлы концентрируются в разл. полупродуктах произ-ва; большая часть, особенно Pd и Pt, концентрируется в анодных шламах (после электролитич. рафинирования Cu и Ni); из них получают концентраты платиновые металлы, которые направляют на аффинажные заводы. Схемы аффинажа платиновые металлы включают после-доват. операции обработки концентрата хим. реагентами. Напр. , для выделения Pd и Pt концентраты платиновых металлов обрабатывают царской водкой. К фильтрату, содержащему Pt, Pd и Au, добавляют Fe. SO 4 и осаждают Au. Из раствора, содержащего Pd и Pt в виде [Pt. Cl 6]2 - и [Pd. Cl 4]2 -, добавлением NH 4 Cl осаждают (NH 4)2[Pt. Cl 6], который прокаливают до платиновой губки, затем повторяют растворение в царской водке, осаждение и прокаливание. Р-р, содержащий Pd, обрабатывают водным NH 3 и соляной кислотой, при этом осаждается Pd(NH 3)2 Cl 2; переосаждение повторяют до получения чистого вещества, которое прокаливают до палладиевой губки. Из оставшегося после обработки царской водкой концентрата, используя последоват. операции сплавления, растворения и осаждения, получают чистые (NH 4)3[Rh. Cl 6], (NH 4)3[Ru. Cl 6], (NH 4)2[Ir. Cl 6], которые прокаливают в атмосфере H 2 до Rh, Ru, Ir. В ряде схем аффинажа используют экстракц. методы. Высокочистые платиновые металлы получают методом зонной плавки, вытягиванием монокристаллов из расплава.
 Химические свойства платины • • • По химическим свойствам платина похожа на палладий, но проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов): Pt + 2 Cl 2 + 2 Na. Cl = Na 2[Pt. Cl 6]. При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объем поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше. При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: черный Pt. O, коричневый Pt. O 2, красновато-коричневый Pt. O 3, а также Pt 2 O 3 и Pt 3 O 4. Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлорплатинатов, например: Na 2 Pt. Cl 4 + 2 Na. OH = 4 Na. Cl + Pt(OH)2, Na 2 Pt. Cl 6 + 4 Na. OH = 6 Na. Cl + Pt(OH)4. Эти гидроксиды проявляют амфотерные свойства: Pt(OH)2 + 2 Na. OH = Na 2[Pt(OH)4], Pt(OH)2 +4 HCl = H 2[Pt. Cl 4] + 2 H 2 O, Pt(OH)4 + 6 HCl = H 2[Pt. Cl 6] + 4 H 2 O, Pt(OH)4+ 2 Na. OH = Na 2[Pt(OH)6]. Гексафторид платины Pt. F 6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода, ксенона или NO: O 2 + Pt. F 6= O 2+[Pt. F 6]−. С помощью него, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона Xe. Pt. F 6. C обнаруженного Н. Бартлеттом взаимодействия между Хе и Pt. F 6, приводящего к образованию Xe. Pt. F 6, началась химия инертных газов. Pt. F 6 получают фторированием платины при 1000 °C под давлением. Фторирование платины при нормальным давлении и температуре 350— 400 °C даёт фторид Pt(IV): Pt + 2 F 2 = Pt. F 4 Фториды платины гигроскопичны и разлагаются водой. Тетрахлорид платины (IV) с водой образует гидраты Pt. Cl 4·n. H 2 O, где n = 1, 4, 5 и 7. Растворением Pt. Cl 4 в соляной кислоте получают платинохлористоводородные кислоты H[Pt. Cl 5] и H 2[Pt. Cl 6]. Синтезированы такие галогениды платины как Pt. Br 4, Pt. Cl 2· 2 Pt. Cl 3, Pt. Br 2 и Pt. I 2. Для платины характерно образование комплексных соединений состава [Pt. X 4]2 - и [Pt. X 6]2 -. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Химические свойства платины • • • По химическим свойствам платина похожа на палладий, но проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов): Pt + 2 Cl 2 + 2 Na. Cl = Na 2[Pt. Cl 6]. При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объем поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше. При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: черный Pt. O, коричневый Pt. O 2, красновато-коричневый Pt. O 3, а также Pt 2 O 3 и Pt 3 O 4. Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлорплатинатов, например: Na 2 Pt. Cl 4 + 2 Na. OH = 4 Na. Cl + Pt(OH)2, Na 2 Pt. Cl 6 + 4 Na. OH = 6 Na. Cl + Pt(OH)4. Эти гидроксиды проявляют амфотерные свойства: Pt(OH)2 + 2 Na. OH = Na 2[Pt(OH)4], Pt(OH)2 +4 HCl = H 2[Pt. Cl 4] + 2 H 2 O, Pt(OH)4 + 6 HCl = H 2[Pt. Cl 6] + 4 H 2 O, Pt(OH)4+ 2 Na. OH = Na 2[Pt(OH)6]. Гексафторид платины Pt. F 6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода, ксенона или NO: O 2 + Pt. F 6= O 2+[Pt. F 6]−. С помощью него, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона Xe. Pt. F 6. C обнаруженного Н. Бартлеттом взаимодействия между Хе и Pt. F 6, приводящего к образованию Xe. Pt. F 6, началась химия инертных газов. Pt. F 6 получают фторированием платины при 1000 °C под давлением. Фторирование платины при нормальным давлении и температуре 350— 400 °C даёт фторид Pt(IV): Pt + 2 F 2 = Pt. F 4 Фториды платины гигроскопичны и разлагаются водой. Тетрахлорид платины (IV) с водой образует гидраты Pt. Cl 4·n. H 2 O, где n = 1, 4, 5 и 7. Растворением Pt. Cl 4 в соляной кислоте получают платинохлористоводородные кислоты H[Pt. Cl 5] и H 2[Pt. Cl 6]. Синтезированы такие галогениды платины как Pt. Br 4, Pt. Cl 2· 2 Pt. Cl 3, Pt. Br 2 и Pt. I 2. Для платины характерно образование комплексных соединений состава [Pt. X 4]2 - и [Pt. X 6]2 -. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
 Химические свойства палладия • Палладий не реагирует с водой, разбавленными кислотами, щелочами, раствором аммиака. Реагирует с концентрированными серной и азотной кислотами, «царской водкой» , галогенами, серой. Окисляется при сплавлении с гидросульфатом калия KHSO 4: • Pd + 2 HCl(к)+ 2 Cl 2= H 2[Pd. Cl 6] • Pd + 2 KCl + Cl 2 = K 2[Pd. Cl 4]; • Pd + 4 HNO 3(к)= Pd(NO 3)2+ 2 NO 2↑ + 2 H 2 O
Химические свойства палладия • Палладий не реагирует с водой, разбавленными кислотами, щелочами, раствором аммиака. Реагирует с концентрированными серной и азотной кислотами, «царской водкой» , галогенами, серой. Окисляется при сплавлении с гидросульфатом калия KHSO 4: • Pd + 2 HCl(к)+ 2 Cl 2= H 2[Pd. Cl 6] • Pd + 2 KCl + Cl 2 = K 2[Pd. Cl 4]; • Pd + 4 HNO 3(к)= Pd(NO 3)2+ 2 NO 2↑ + 2 H 2 O
 Химические свойства иридия • Иридий устойчив на воздухе при обычной температуре и нагревании, при прокаливании порошка в токе кислорода при 600— 1000 °C образует в незначительном количестве Ir. O 2. Выше 1200 °C частично испаряется в виде Ir. O 3. Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями. Свежеосажденная иридиевая чернь частично растворяется в царской водке с образованием смеси соединений Ir(III) и Ir(IV). Порошок иридия может быть растворён хлорированием в присутствии хлоридов щелочных металловпри 600— 900 °C или спеканием с Na 2 O 2 или Ba. O 2 с последующим растворением в кислотах. Иридий взаимодействует с F 2 при 400— 450 °C, а c Cl 2 и S при температуре красного каления.
Химические свойства иридия • Иридий устойчив на воздухе при обычной температуре и нагревании, при прокаливании порошка в токе кислорода при 600— 1000 °C образует в незначительном количестве Ir. O 2. Выше 1200 °C частично испаряется в виде Ir. O 3. Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями. Свежеосажденная иридиевая чернь частично растворяется в царской водке с образованием смеси соединений Ir(III) и Ir(IV). Порошок иридия может быть растворён хлорированием в присутствии хлоридов щелочных металловпри 600— 900 °C или спеканием с Na 2 O 2 или Ba. O 2 с последующим растворением в кислотах. Иридий взаимодействует с F 2 при 400— 450 °C, а c Cl 2 и S при температуре красного каления.
 • • Соединения двухвалентного иридия Ir. Cl 2 — блестящие тёмно-зелёные кристаллы. Плохо растворяется в кислотах и щёлочах. При нагревании до 773 °C разлагается на Ir. Cl и хлор, а выше 798 °C — на составные элементы. Получают нагреванием металлического иридия или Ir. Cl 3 в токе хлора при 763 °C. Ir. S — блестящее тёмно-синее твёрдое вещество. Мало растворим в воде и кислотах. Растворяется в сульфиде калия. Получают нагреванием металлического иридия в парах серы. Соединения трёхвалентного иридия Ir 2 O 3 — твёрдое тёмно-синее вещество. Малорастворим в воде и этаноле. Растворяется в серной кислоте. Получают при лёгком прокаливании сульфида иридия (III). Ir. Cl 3 — летучее соединение оливково-зелёного цвета. Плотность — 5, 30 г/см³. Малорастворим в воде, щелочах и кислотах. При 765 °C разлагается на Ir. Cl 2 и хлор, при 773 °C на Ir. Cl и хлор, а выше 798 °C — на составные элементы. Получают действием хлора на нагретый до 600 °C иридий. Ir. Br 3 — оливково-зелёные кристаллы. Растворяется в воде, мало растворим в спирте. Дегидратируется при нагревании до 105— 120 °C. При сильном нагревании разлагается на элементы. Получают взаимодействием Ir. O 2 с бромоводородной кислотой. Ir 2 S 3 — твёрдое коричневое вещество. Разлагается на элементы при нагревании выше 1050 °C. Мало растворим в воде. Растворяется в азотной кислоте и растворе сульфида калия. Получают действием сероводорода на хлорид иридия (III) или нагреванием порошкообразного металлического иридия с серой при температуре не выше 1050 °C в вакууме.
• • Соединения двухвалентного иридия Ir. Cl 2 — блестящие тёмно-зелёные кристаллы. Плохо растворяется в кислотах и щёлочах. При нагревании до 773 °C разлагается на Ir. Cl и хлор, а выше 798 °C — на составные элементы. Получают нагреванием металлического иридия или Ir. Cl 3 в токе хлора при 763 °C. Ir. S — блестящее тёмно-синее твёрдое вещество. Мало растворим в воде и кислотах. Растворяется в сульфиде калия. Получают нагреванием металлического иридия в парах серы. Соединения трёхвалентного иридия Ir 2 O 3 — твёрдое тёмно-синее вещество. Малорастворим в воде и этаноле. Растворяется в серной кислоте. Получают при лёгком прокаливании сульфида иридия (III). Ir. Cl 3 — летучее соединение оливково-зелёного цвета. Плотность — 5, 30 г/см³. Малорастворим в воде, щелочах и кислотах. При 765 °C разлагается на Ir. Cl 2 и хлор, при 773 °C на Ir. Cl и хлор, а выше 798 °C — на составные элементы. Получают действием хлора на нагретый до 600 °C иридий. Ir. Br 3 — оливково-зелёные кристаллы. Растворяется в воде, мало растворим в спирте. Дегидратируется при нагревании до 105— 120 °C. При сильном нагревании разлагается на элементы. Получают взаимодействием Ir. O 2 с бромоводородной кислотой. Ir 2 S 3 — твёрдое коричневое вещество. Разлагается на элементы при нагревании выше 1050 °C. Мало растворим в воде. Растворяется в азотной кислоте и растворе сульфида калия. Получают действием сероводорода на хлорид иридия (III) или нагреванием порошкообразного металлического иридия с серой при температуре не выше 1050 °C в вакууме.
 • • • Соединения четырёхвалентного иридия Ir. O 2 — чёрные тетрагональные кристаллы с решёткой типа рутила. Плотность — 3, 15 г/см³. Малорастворим в воде, этаноле и кислотах. Восстанавливается до металла водородом. Термически диссоциирует на элементы при нагревании. Получают нагреванием порошкообразного иридия на воздухе или в кислороде при 700 °C, нагреванием Ir. O 2*n. Н 2 О. Ir. F 4 — жёлтая маслянистая жидкость, разлагающаяся на воздухе и гидролизующаяся водой. tпл 106 °C. Получают нагреванием Ir. F 6 с порошком иридия при 150 °C. Ir. Cl 4 - гигроскопичное коричневое твёрдое вещество. Растворяется в холодной воде и разлагается тёплой (водой). Получают нагреванием (600— 700 °C) металлического иридия с хлором при повышенном давлении. Ir. Br 4 — расплывающееся на воздухе синее вещество. Растворяется в этаноле; в воде (с разложением), диссоциирует при нагревании на элементы. Получают взаимодействием Ir. O 2 с бромоводородной кислотой при низкой температуре. Ir. S 2 — твёрдое коричневое вещество. Малорастворим в воде. Получают пропусканием сероводорода через растворы солей иридия (IV) или нагреванием порошкообразного металлического иридия с серой без доступа воздуха в вакууме. Соединения шестивалентного иридия Ir. F 6 — жёлтые тетрагональные кристаллы. tпл 44 °C, tкип 53 °C, плотность — 6, 0 г/см³. Под действием металлического иридия превращается в Ir. F 4, восстанавливается водородом до металлического иридия. Получают нагреванием иридия в атмосфере фтора в трубке из флюорита. Очень сильный окислитель, способный окислить даже воду: 2 Ir. F 6 + 10 H 2 O = 2 Ir(OH)4 + 12 HF + O 2, или NO: NO + Ir. F 6 = NO+[Ir. F 6]− Ir. S 3 — серый, малорастворимый в воде порошок. Получают нагреванием порошкообразного металлического иридия с избытком серы в вакууме. Строго говоря. не является соединением шестивалетного иридия, так как содержит связь S-S. Ir(OH)4 (Ir. O 2*2 H 2 O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir 2 O 3*n. Н 2 О выпадает при нейтрализации щёлочью хлороиридатов (III) и легко окисляется на воздухе до Ir. O 2. Практически нерастворим в воде
• • • Соединения четырёхвалентного иридия Ir. O 2 — чёрные тетрагональные кристаллы с решёткой типа рутила. Плотность — 3, 15 г/см³. Малорастворим в воде, этаноле и кислотах. Восстанавливается до металла водородом. Термически диссоциирует на элементы при нагревании. Получают нагреванием порошкообразного иридия на воздухе или в кислороде при 700 °C, нагреванием Ir. O 2*n. Н 2 О. Ir. F 4 — жёлтая маслянистая жидкость, разлагающаяся на воздухе и гидролизующаяся водой. tпл 106 °C. Получают нагреванием Ir. F 6 с порошком иридия при 150 °C. Ir. Cl 4 - гигроскопичное коричневое твёрдое вещество. Растворяется в холодной воде и разлагается тёплой (водой). Получают нагреванием (600— 700 °C) металлического иридия с хлором при повышенном давлении. Ir. Br 4 — расплывающееся на воздухе синее вещество. Растворяется в этаноле; в воде (с разложением), диссоциирует при нагревании на элементы. Получают взаимодействием Ir. O 2 с бромоводородной кислотой при низкой температуре. Ir. S 2 — твёрдое коричневое вещество. Малорастворим в воде. Получают пропусканием сероводорода через растворы солей иридия (IV) или нагреванием порошкообразного металлического иридия с серой без доступа воздуха в вакууме. Соединения шестивалентного иридия Ir. F 6 — жёлтые тетрагональные кристаллы. tпл 44 °C, tкип 53 °C, плотность — 6, 0 г/см³. Под действием металлического иридия превращается в Ir. F 4, восстанавливается водородом до металлического иридия. Получают нагреванием иридия в атмосфере фтора в трубке из флюорита. Очень сильный окислитель, способный окислить даже воду: 2 Ir. F 6 + 10 H 2 O = 2 Ir(OH)4 + 12 HF + O 2, или NO: NO + Ir. F 6 = NO+[Ir. F 6]− Ir. S 3 — серый, малорастворимый в воде порошок. Получают нагреванием порошкообразного металлического иридия с избытком серы в вакууме. Строго говоря. не является соединением шестивалетного иридия, так как содержит связь S-S. Ir(OH)4 (Ir. O 2*2 H 2 O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir 2 O 3*n. Н 2 О выпадает при нейтрализации щёлочью хлороиридатов (III) и легко окисляется на воздухе до Ir. O 2. Практически нерастворим в воде
 Химические свойства родия • • • • Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты. Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C: 4 Rh + 3 O 2 = 2 Rh 2 O 3. При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита натрия и бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO 4, пероксида натрия Na 2 O 2 и пероксида бария Ba. O 2: 2 Rh + 6 KHSO 4 = 2 K 3 Rh(SO 4)3 + 3 H 2↑, 2 Rh + 3 Ba. O 2 = Rh 2 O 3 + 3 Ba. O. В присутствии хлоридов щелочных металлов, когда есть возможность образовывать комплексы [Rh. X 3]3−, родий взаимодействует с хлором, например: 2 Rh + 6 Na. Cl + Cl 2 = 2 Na 3[Rh. Cl 6]. При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3: Na 3[Rh. Cl 6] + 3 Na. OH = Rh(OH)3↓ + 6 Na. Cl. Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh (III): Rh 2 O 3 + 12 HCl = 2 H 3 Rh. Cl 6 + 3 H 2 O, Rh(OH)3 + 6 HCl = H 3 Rh. Cl 6 + 3 H 2 O. Высшую степень окисления +6 родий проявляет в гексафториде Rh. F 6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или оксид азота (II) NO: 2 Rh. F 6 + 3 Cl 2 = 2 Rh. F 3 + 6 Cl. F. В низших степенях окисления +1 и +2 родий образует комплексные соединения.
Химические свойства родия • • • • Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты. Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C: 4 Rh + 3 O 2 = 2 Rh 2 O 3. При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита натрия и бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO 4, пероксида натрия Na 2 O 2 и пероксида бария Ba. O 2: 2 Rh + 6 KHSO 4 = 2 K 3 Rh(SO 4)3 + 3 H 2↑, 2 Rh + 3 Ba. O 2 = Rh 2 O 3 + 3 Ba. O. В присутствии хлоридов щелочных металлов, когда есть возможность образовывать комплексы [Rh. X 3]3−, родий взаимодействует с хлором, например: 2 Rh + 6 Na. Cl + Cl 2 = 2 Na 3[Rh. Cl 6]. При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3: Na 3[Rh. Cl 6] + 3 Na. OH = Rh(OH)3↓ + 6 Na. Cl. Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh (III): Rh 2 O 3 + 12 HCl = 2 H 3 Rh. Cl 6 + 3 H 2 O, Rh(OH)3 + 6 HCl = H 3 Rh. Cl 6 + 3 H 2 O. Высшую степень окисления +6 родий проявляет в гексафториде Rh. F 6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или оксид азота (II) NO: 2 Rh. F 6 + 3 Cl 2 = 2 Rh. F 3 + 6 Cl. F. В низших степенях окисления +1 и +2 родий образует комплексные соединения.
 Химические свойства осмия • • Порошок осмия при нагревании реагирует с кислородом, галогенами, парами серы, селеном, теллуром, фосфором, азотной и серной кислотами. Компактный осмий не взаимодействует ни с кислотами, ни со щелочами, но с расплавами щелочей образует водорастворимые осматы. Медленно реагирует с азотной кислотой и царской водкой, реагирует с расплавленными щелочами в присутствии окислителей (нитрата или хлората калия), с расплавленной перекисью натрия. В соединениях проявляет степени окисления от − 2 до +8, из которых самыми распространенными являются +2, +3, +4 и +8. Осмий — один из немногих металлов, образующих полиядерные (или кластерные) соединения. Полиядерный карбонил осмия Os 3(CO)12 используется для моделирования и исследования химических реакций углеводородов на металлических центрах. Карбонильные группы в Os 3(CO)12 могут замещаться на другие лиганды, в том числе и содержащие кластерные ядра других переходных металлов.
Химические свойства осмия • • Порошок осмия при нагревании реагирует с кислородом, галогенами, парами серы, селеном, теллуром, фосфором, азотной и серной кислотами. Компактный осмий не взаимодействует ни с кислотами, ни со щелочами, но с расплавами щелочей образует водорастворимые осматы. Медленно реагирует с азотной кислотой и царской водкой, реагирует с расплавленными щелочами в присутствии окислителей (нитрата или хлората калия), с расплавленной перекисью натрия. В соединениях проявляет степени окисления от − 2 до +8, из которых самыми распространенными являются +2, +3, +4 и +8. Осмий — один из немногих металлов, образующих полиядерные (или кластерные) соединения. Полиядерный карбонил осмия Os 3(CO)12 используется для моделирования и исследования химических реакций углеводородов на металлических центрах. Карбонильные группы в Os 3(CO)12 могут замещаться на другие лиганды, в том числе и содержащие кластерные ядра других переходных металлов.


