1 Общ св Ме.ppt
- Количество слайдов: 23

Металлы. Особенности металлического состояния. Физические и химические свойства металлов

Особенности металлического состояния О металлах Строение металлов Металлическая связь

О металлах… «Металлом называется светлое тело, которое ковать можно» М. В. Ломоносов Большинство элементов ПС – металлы Нет резкой границы между металлами и неметаллами Бóльшие, по сравнению с неметаллами, размеры атомов

Строение металлов Малое число электронов на внешнем уровне (1 А, 2 А, 3 А) Внешние электроны удалены от ядра (4 А-7 А) Имеются экранирующие оболочки (группы В) Кристаллическое состояние: 1. Число атомов велико 2. Молекулярные орбитали делокализованы -общее число энергетических уровней равно числу атомов 3. Непрерывная энергетическая зона – переход электронов на более высокие уровни сопровождается ничтожными затратами энергии 4. Электроны «свободны» – перемещаются с незначительными затратами энергии по всему кристаллу

Металлическая связь Валентные электроны принадлежат всему кристаллу Электроны способны перемещаться во всем объеме кристалла Совокупность свободных электронов – электронный газ Следствие- специфические свойства металлов

Физические свойства металлов Агрегатное состояние Температуры плавления и кипения Блеск Пластичность и ковкость Тепло – и электропроводность Магнитные свойства

Агрегатное состояние Твердые вещества, исключение – ртуть; Различаются по степени твердости; Плотность изменяется в широких интервалах: литий – 590 кг/м 3, осмий – 22480 кг/м 3 Непрозрачны- электронный газ отражает падающие световые лучи

Температуры плавления и кипения Изменяются в широких интервалах: ртуть – Тпл = -38, 870 С, вольфрам - +33700 С При изменении температуры последовательно изменяются структуры кристаллов; Интервал между температурой плавления и температурой кипения обусловлен характером внутренней перестройки: железо – 1535 и 3000, вольфрам – 3370 и 5900, ртуть – -38, 87 и +356, 9

Металлический блеск Свободные электроны отражают падающие лучи в компактной массе Наиболее «блестящие» - серебро и индий Магний и алюминий сохраняют блеск в порошкообразном состоянии Если отражаются все световые лучи в одинаковой степени – серебристо-белые Алюминий и магний отражают радиоволны

Пластичность и ковкость Деформация без разрушения Отдельные слои кристаллической решетки смещаются: - атомные-разрыв ковалентных связей - ионные-возникают силы электростатического отталкивания - металлы – перераспределение электронного газа Самый пластичный - золото

Теплопроводность и электропроводность Параллелизм между величинами Наилучшие проводники тепла и электричества – серебро, медь алюминий Обратно пропорциональная зависимость от температуры Причина – наличие в кристалле металла двух зон – валентной и зоны проводимости: валентная зона – совокупность занятых электронами орбиталей зона проводимости – совокупность незаполненных уровней
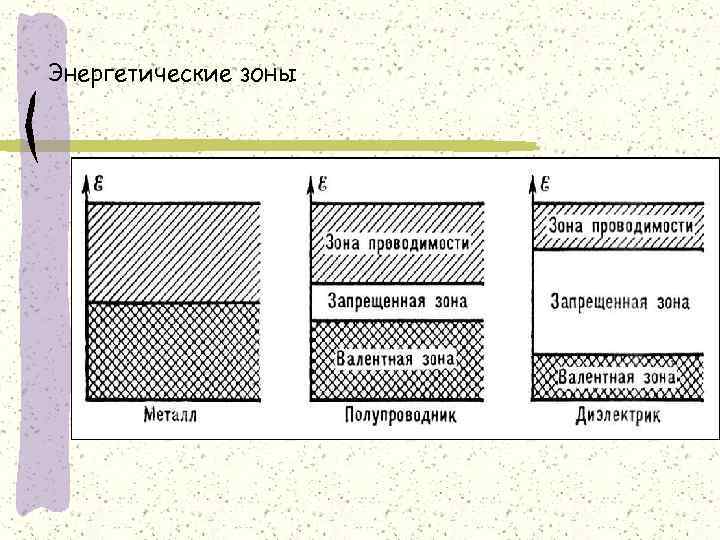
Энергетические зоны

Кристаллические решетки металлов а) гранецентрированная α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др. б) объемноцентрированная Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др в) гексагональная Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.

Магнитные свойства 1. Ферромагнитные металлы – намагничиваются и сохраняют магнитные свойства 2. Парамагнитные металлы – намагничиваются слабо 3. Диамагнитные металлы – не намагничиваются, иногда отталкиваются от магнита Причина – структура кристалла

Химические свойства металлов Энергия ионизации атомов металлов Восстановительные свойства металлов Ряд активности металлов Основные химические реакции металлов Сплавы металлов Коррозия металлов и сплавов

Энергия ионизации Значения небольшие Изменяется в периодах и группах (? ) Легко отдают внешние электроны Образуют положительно заряженные ионы - +, 2+, 3+, реже – больше Чем меньше электронов, тем легче отдают их атомы

Восстановительные свойства металлов Электроположительные элементы – восстановители Атомы металлов только отдают электроны, ионы – могут принимать и отдавать Способность к восстановлению особенно ярко проявляется в реакциях взаимного вытеснения из растворов
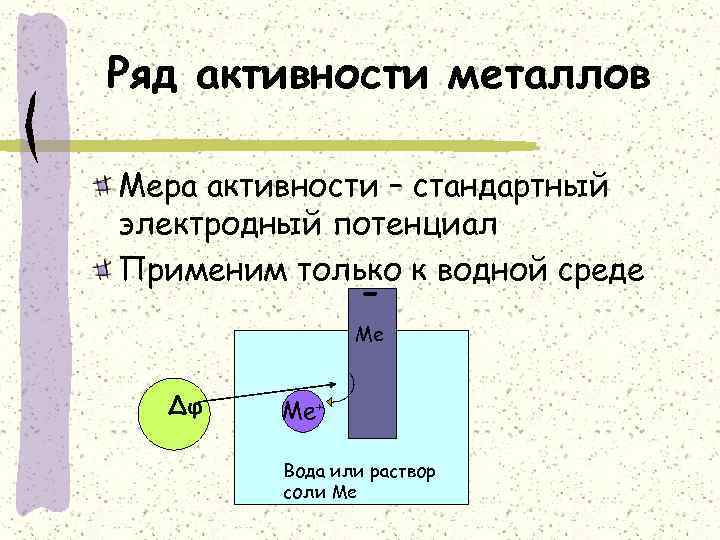
Ряд активности металлов Мера активности – стандартный электродный потенциал Применим только к водной среде - Ме Δφ Ме+ Вода или раствор соли Ме

Основные химические реакции металлов Взаимодействуют с неметаллами Взаимодействуют с кислородом Взаимодействуют с водой Взаимодействуют с кислотами Взаимодействуют друг с другом, образуя сплавы и соединения Ме – nē = Men+

Сплавы металлов Твердые растворы замещения: Ag-Cu, Cu-Ni, Ag-Au, Pt-Au, Mn-Fe Твердые растворы внедрения: Pb-Sn, Bi-Cd, Ag-Pb Интерметаллические соединения: Cu 3 Sn, Zn 3 Hg, Ag 2 Zn 5

Коррозия металлов и сплавов Самопроизвольно протекающий необратимый процесс разрушения металлов и сплавов вследствие их взаимодействия с окружающей средой называется коррозией Различают химическую и электрохимическую коррозию (окислительно-восстановительный процесс)

Коррозия Химическая коррозия 1. Газовая коррозия. агрессивные газы 2. Атмосферная коррозия газы атмосферы 3. Коррозия в неэлектролитах нефть, нефтепродукты, растворители Электрохимическая коррозия Red-Ox-процесс в электролитах Электрохимическая пара: менее активный металлболее активный металл гальванический элемент < ē >

Спасибо за внимание!
1 Общ св Ме.ppt