металлы.pptx
- Количество слайдов: 12
 Металлы.
Металлы.
 Металлы – простые вещества Какие физические свойства характерны для простых веществ-металлов? кроме ртути твёрдые вещества ковкие, пластичные, тягучие вещества имеют металлический блеск тепло- и электропроводны В чем причина этих свойств металлов?
Металлы – простые вещества Какие физические свойства характерны для простых веществ-металлов? кроме ртути твёрдые вещества ковкие, пластичные, тягучие вещества имеют металлический блеск тепло- и электропроводны В чем причина этих свойств металлов?
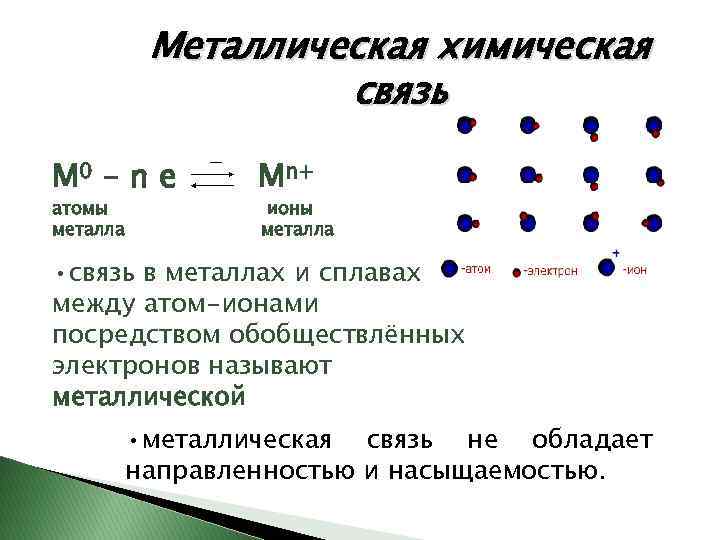 Металлическая химическая связь М 0 – n е атомы металла Мn+ ионы металла • связь в металлах и сплавах между атом-ионами посредством обобществлённых электронов называют металлической • металлическая связь не обладает направленностью и насыщаемостью.
Металлическая химическая связь М 0 – n е атомы металла Мn+ ионы металла • связь в металлах и сплавах между атом-ионами посредством обобществлённых электронов называют металлической • металлическая связь не обладает направленностью и насыщаемостью.
 Металлический блеск металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло.
Металлический блеск металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло.
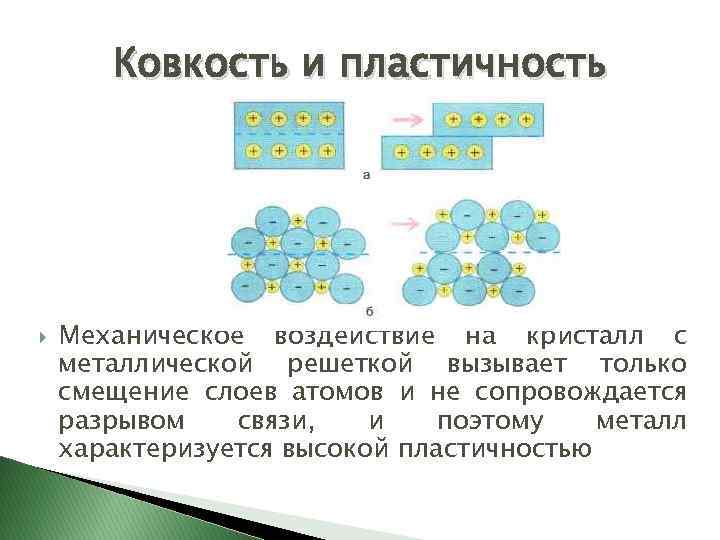 Ковкость и пластичность Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью
Ковкость и пластичность Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью
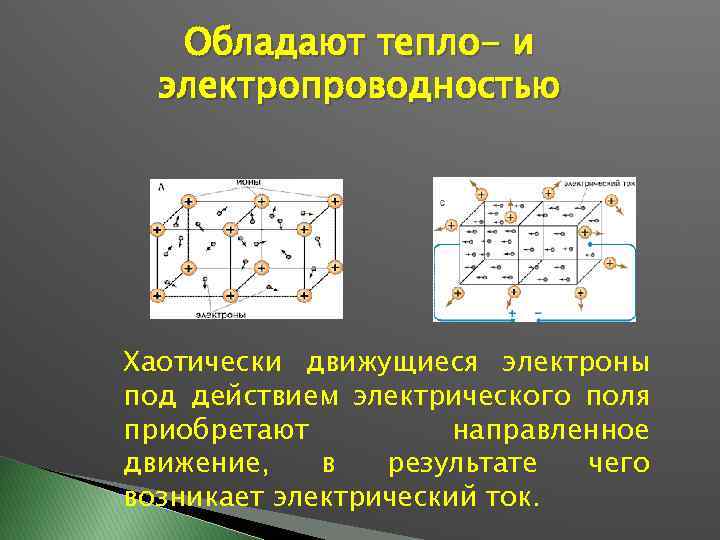 Обладают тепло- и электропроводностью Хаотически движущиеся электроны под действием электрического поля приобретают направленное движение, в результате чего возникает электрический ток.
Обладают тепло- и электропроводностью Хаотически движущиеся электроны под действием электрического поля приобретают направленное движение, в результате чего возникает электрический ток.
 Магнитные свойства металлов Ферромагнетики – металлы способные сильно намагничиваться и долго сохранять это свойство (Fe, Co, Ni). Парамагнетики – слабо намагничиваются и не сохраняют это состояние вне магнитного поля (щелочные, щелочно-земельные и большая часть переходных металлов). Диамагнетики – металлы, выталкиваемые магнитным полем (Cu, Аg, Au, Bi).
Магнитные свойства металлов Ферромагнетики – металлы способные сильно намагничиваться и долго сохранять это свойство (Fe, Co, Ni). Парамагнетики – слабо намагничиваются и не сохраняют это состояние вне магнитного поля (щелочные, щелочно-земельные и большая часть переходных металлов). Диамагнетики – металлы, выталкиваемые магнитным полем (Cu, Аg, Au, Bi).
 Химические свойства металлов: 1) С Не. Ме (простыми веществами): Fe + S → Fe. S (баланс) 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 (баланс) 2 Mg + O 2 → 2 Mg. O (баланс) 2 Na + O 2 → Na 2 O 2 (баланс) 2) Cо сложными веществами: А) с водой (щелочные и щелочноземельные металлы): Ca + 2 H 2 O → Ca(OH)2 + H 2↑ (баланс) 2 K + H 2 O → 2 KOH + H 2↑ (баланс)
Химические свойства металлов: 1) С Не. Ме (простыми веществами): Fe + S → Fe. S (баланс) 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 (баланс) 2 Mg + O 2 → 2 Mg. O (баланс) 2 Na + O 2 → Na 2 O 2 (баланс) 2) Cо сложными веществами: А) с водой (щелочные и щелочноземельные металлы): Ca + 2 H 2 O → Ca(OH)2 + H 2↑ (баланс) 2 K + H 2 O → 2 KOH + H 2↑ (баланс)
 Б) с кислотами (если металл стоит в ряду напряжений левее водорода. Щелочные и щелочноземельные металлы для этой реакции не подходят, почему? ): Zn + H 2 SO 4 → Zn. SO 4 + H 2↑(баланс) Zn + СН 3 СООН → Zn(СН 3 СОО)2 + H 2↑(баланс) В) с солями (если металл стоит в ряду напряжений левее того металла, который образует соль): Fe + Cu. SO 4 → Fe. SO 4 + Cu (баланс)
Б) с кислотами (если металл стоит в ряду напряжений левее водорода. Щелочные и щелочноземельные металлы для этой реакции не подходят, почему? ): Zn + H 2 SO 4 → Zn. SO 4 + H 2↑(баланс) Zn + СН 3 СООН → Zn(СН 3 СОО)2 + H 2↑(баланс) В) с солями (если металл стоит в ряду напряжений левее того металла, который образует соль): Fe + Cu. SO 4 → Fe. SO 4 + Cu (баланс)
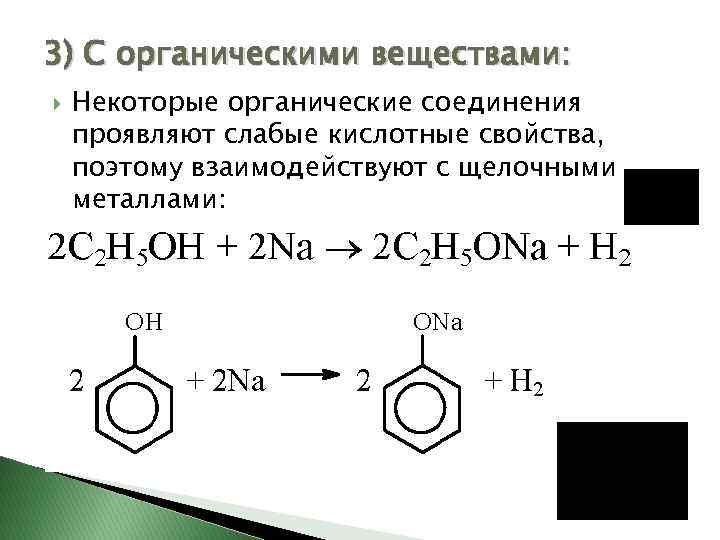 3) С органическими веществами: Некоторые органические соединения проявляют слабые кислотные свойства, поэтому взаимодействуют с щелочными металлами:
3) С органическими веществами: Некоторые органические соединения проявляют слабые кислотные свойства, поэтому взаимодействуют с щелочными металлами:
 1) Электронная формула кальция. а) 1 S² 2 P 3 S¹ в) 1 S² 2 P 3 S² 3 P 4 S¹ б) 1 S² 2 P 3 S² г) 1 S² 2 P 3 S ² 3 P 4 S² 2) Электронную формулу 1 S² 2 P 3 S² 3 P 4 S² имеет атом: а)Na б)Са в)Cu г)Zn 3) Электронная формула наиболее активного металла: а) 1 S² 2 S² в) 1 S² 2 P 3 S² 3 P 3 d 4 S² б) 1 S² 2 P 3 S² г) 1 S² 2 P 3 S² 3 P 4 S² 4)Металлы при взаимодействий с неметаллами проявляют свойства: 5) а) окислительные; б) восстановительные; в) и окислительные, и восстановительные; г) не участвуют в окислительно-восстановительных реакциях. 5) В периодической системе типичные металлы расположены : а) верхней части б) нижней части в) правом верхнем углу г) левом нижнем углу
1) Электронная формула кальция. а) 1 S² 2 P 3 S¹ в) 1 S² 2 P 3 S² 3 P 4 S¹ б) 1 S² 2 P 3 S² г) 1 S² 2 P 3 S ² 3 P 4 S² 2) Электронную формулу 1 S² 2 P 3 S² 3 P 4 S² имеет атом: а)Na б)Са в)Cu г)Zn 3) Электронная формула наиболее активного металла: а) 1 S² 2 S² в) 1 S² 2 P 3 S² 3 P 3 d 4 S² б) 1 S² 2 P 3 S² г) 1 S² 2 P 3 S² 3 P 4 S² 4)Металлы при взаимодействий с неметаллами проявляют свойства: 5) а) окислительные; б) восстановительные; в) и окислительные, и восстановительные; г) не участвуют в окислительно-восстановительных реакциях. 5) В периодической системе типичные металлы расположены : а) верхней части б) нижней части в) правом верхнем углу г) левом нижнем углу
 Домашнее задание: § 20, дописать все электронные балансы, № 5 (а, б), с. 173
Домашнее задание: § 20, дописать все электронные балансы, № 5 (а, б), с. 173


